На этой странице вы узнаете
- Чем атом похож на Солнечную систему?
- Один водород, но три лучше: что такое изотопы?
- Как умеет скакать электрон?
Атом можно представить как конструктор «Лего», который можно собрать из более простых “элементарных” частиц. У каждого атома число “деталек” может быть различным. Об этом и о других особенностях строения атома поговорим в статье.
Строение атома
Великие ученые и философы древности упорно бились над вопросом, из чего же состоят вещества, которые их окружают. Впервые идею о том, что все тела живой и неживой природы состоят из мельчайших частиц — атомов — высказал древнегреческий ученый Демокрит целых 2500 лет назад!
Что же из себя представляет атом?
Атом — это мельчайшая химически неделимая частица вещества.
Атомы могут соединяться друг с другом с помощью химических связей в различной последовательности, образуя более сложные частицы — молекулы. Можно провести аналогию:
- атом — отдельный человек,
- молекулы — группы людей, объединенные общим признаком (семья, одноклассники, коллеги, любители кошек, любители собак).
Молекула — это мельчайшие частицы, которые состоят из атомов. Они являются химически делимыми.
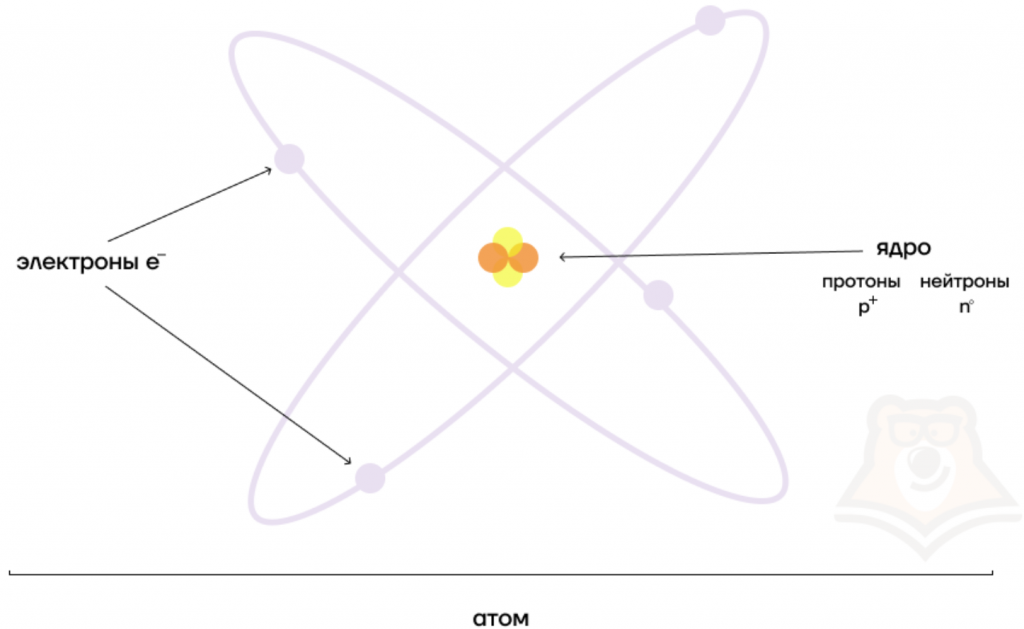
Долгое время считалось, что атом нельзя разделить далее на составляющие. Но с развитием науки учёные-физики выяснили, что атом состоит из более мелких, или элементарных частиц — протонов (p), нейтронов (n) и электронов (ē).
В центре атома располагается ядро, которое состоит из протонов и нейтронов (их общее название нуклоны), а вокруг ядра вращаются электроны.
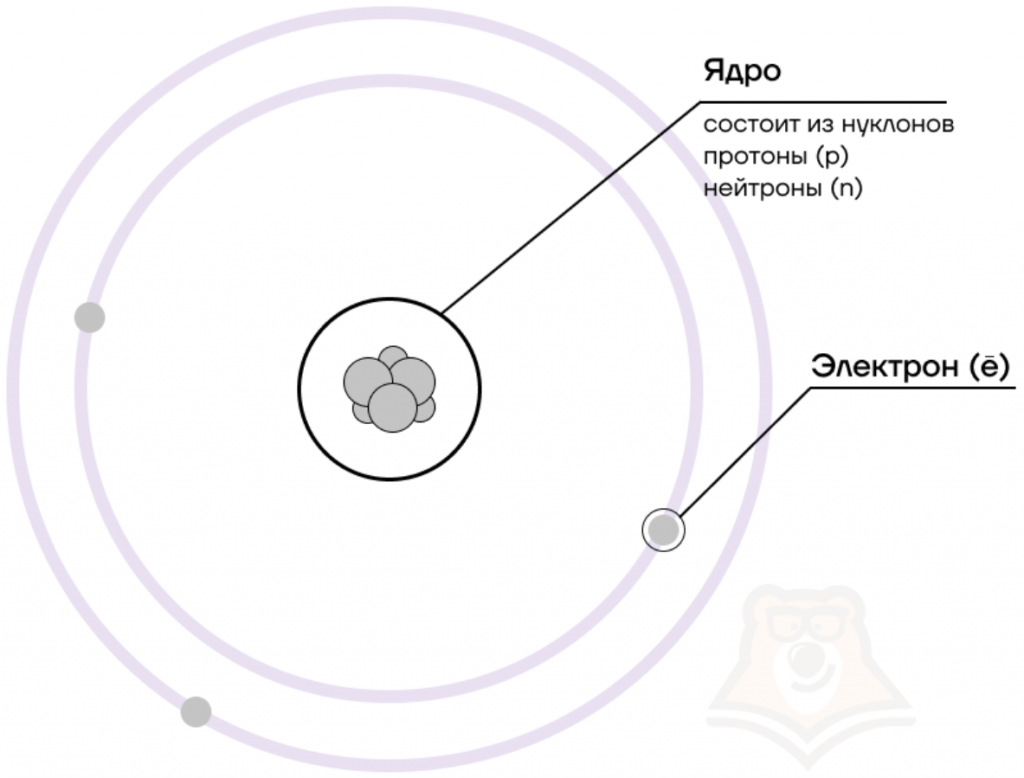
Чем атом похож на Солнечную систему?
Можно представить атом как Солнечную систему, где вокруг ядра (Солнца) по орбитам вращаются электроны (планеты). Это так называемая планетарная модель атома. В реальности атом намного сложнее, но для запоминания нам удобнее пользоваться этими представлениями.
Тогда более точно определение атома будет звучать так:
Атом — электронейтральная химически неделимая частица, которая состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.
Каждая из элементарных частиц в атоме имеет свой заряд и массу:

Характеристика элементарных частиц
Из таблички видно, что вся масса атома сосредоточена в протонах и нейтронах, то есть в ядре. При этом само ядро положительно заряжено, а вокруг ядра вращаются отрицательно заряженные электроны.
В разновидностях одного и того же химического элемента может быть различное число элементарных частиц. Давай рассмотрим это на примере атома водорода.

Первый случай: ядро атома водорода состоит из одного протона (масса ядра = 1 а.е.м.). Такой атом называется протием, именно он указан в периодической системе Д.И. Менделеева.
Добавим к этому ядру один нейтрон, тогда масса ядра будет равна 2 а.е.м.. Мы получили вторую разновидность атома водорода — дейтерий.
Если добавить второй нейтрон к такому ядру, то мы получим тритий. Так вот, разновидности одного и того же химического элемента, которые различаются числом нейтронов в ядре, называются изотопами.
Изотопы — атомы одного химического элемента с разным числом нейтронов: равные заряды ядра, равное число e и p, но разное число n!
Как определить количество элементарных частиц
Сейчас мы научимся определять количество протонов, нейтронов и электронов в атоме любого химического элемента. В этом нам поможет периодическая система Д.И. Менделеева.
Давай рассмотрим ячейку в периодической системе с углеродом:

В верхней части ячейки располагается порядковый номер элемента (это целое число), под ним располагается относительная атомная масса. Она является нецелым числом, поэтому её легко определять. Относительная атомная масса, округленная до целого числа, называется массовым числом.
Эти характеристики связаны с количеством элементарных частиц в атоме следующим образом:
(№ элемента = p = Z = ē)
Число нейтронов = массовое число – порядковый номер
(n = Ar — № элемента)
Давай рассмотрим основные определения и положения, связанные с характеристикой элемента и числовыми операциями:
- Орбиты, на которых располагаются электроны, называются электронными слоями (или энергетическими уровнями). Нумерация слоев начинается с ближайшего к ядру электронного слоя.
- На каждом электронном слое может находиться не более 2N2 электронов (где N — номер слоя).
- Число занятых электронами слоев в атоме элемента совпадает с номером периода, в котором он находится.
- Последний энергетический уровень называют внешним (максимальное число ē на внешнем уровне = 8). Обычно на нем находятся валентные электроны, то есть электроны на внешней (валентной) оболочке атома.
- Число валентных электронов, как правило, совпадает с номером группы, в котором находится элемент.

На примере атома углерода определим количество элементарных частиц в его атоме.
Порядковый номер углерода равен 6, значит, заряд его атома + 6, число протонов и число электронов совпадает и тоже равно 6.
Относительная атомная масса равна 12,01, а число нейтронов равно 12 – 6 = 6.
Углерод находится во втором периоде, IV группе. Это показывает нам, что занято лишь 2 электронных слоя, при этом на внешнем электронном уровне располагаются 4 электрона.
“Грустный” и “веселый” атом
При заполнении электронами ячеек мы описываем так называемое основное состояние. Это такое состояние атома, при котором энергия системы минимальна. Его состояние можно определить как “веселое”: в атоме всё спокойно и в порядке.
Но может быть и другая ситуация, когда на электроны оказывается какое-то воздействие. Тогда происходит процесс, похожий на развод пары в человеческом мире. В результате воздействия те электроны, которые находились на орбитали вдвоем и были спаренными, могут друг с другом “поссориться” и “разъехаться” по разным орбиталям.
Тогда атом можно определить как “грустный”: электроны ссорятся, атома грустит. В химии это состояние и называется возбужденным. Такой “развод” возможен только в пределах одного энергетического уровня.

Атомные подуровни заполняются электронами в порядке увеличения их энергии. Этот порядок выглядит следующим образом:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → …
Проскок электрона
Иногда при заполнении энергетических подуровней мы нарушаем порядок заполнения подуровней. В первую очередь, это связано с заполнением s- и d-подуровней . Электрон перемещается с внешнего s- на предвнешний d-подуровень. Так образуется более устойчивая заполненная или полузаполненная конфигурация.
Такое явление называется проскоком электрона: электрон как бы нарушает общую очередь элементов в оболочке и обходит их.
Это явление характерно для элементов IB и VIB групп, например, Cr, Cu, Ag.
Например, у меди электронная оболочка должна выглядеть как ..3d94s2. Но так как для заполнения d-подуровня не хватает одного электрона, то более выгодной становится ситуация, когда с s-подуровня электрон “перепрыгивает” на внутренний d-подуровень. В результате, конфигурация меди выглядит как 3d104s11

Итог: иметь конфигурации nd5 и nd10 более энергетически выгодно, чем nd4 и nd9. Поэтому у таких элементов, как Cu, Cr, Ag, Au, Nb, Mo, Ru, Pt, Pd происходит проскок (провал) электрона: электрон с верхнего “этажа” как будто проваливается на нижний.
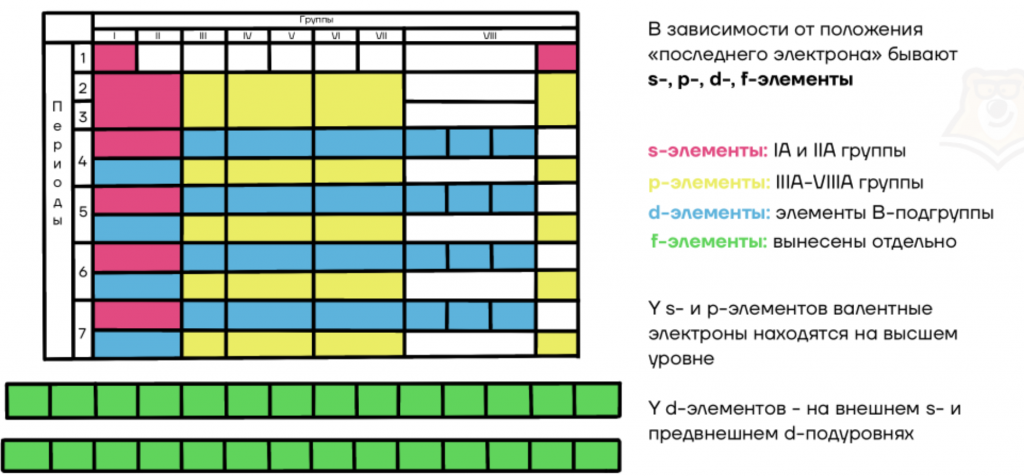
Классификация химических элементов: s-,p-,d-,f-элементы
В зависимости от положения “последнего электрона” бывают s-, p-, d-, f-элементы:
- s-элементы: IA и IIA группы;
- p-элементы: IIIA-VIIIA группы;
- d-элементы: элементы побочных подгрупп;
- f-элементы: вынесены в отдельную группу лантаноидов и актиноидов.
У s- и p-элементов валентные электроны находятся на внешнем уровне.
У d-элементов — на внешнем s- и на предвнешнем d-подуровнях.
Далее приведены электронные формулы атомов элементов первых четырех периодов. Благодаря этой шпаргалке всегда можно сверить свой вариант электронной конфигурации и проверить себя.

Продолжение темы читайте в статье «Строение атома и электронные конфигурации 2.0».
Фактчек
- Атом — электронейтральная частица, состоящая из ядра и вращающихся вокруг него электронов.
- Электроны располагаются на электронных подуровнях, причем их число определяется порядковым номером элемента.
- Существует группа атомов одного и того же химического элемента, у которых имеется разное число нейтронов. Такие элементы называют изотопами.
- Электроны располагаются по ячейкам так, чтобы энергия системы была минимальна.
- Иногда для достижения минимума энергии некоторые правила нарушаются — таковым является проскок электрона.
Проверь себя
Задание 1.
Ядро атома состоит из:
- Протонов и нейтронов
- Протонов и электронов
- Нейтронов и электронов
- Протонов, нейтронов и электронов
Задание 2.
У изотопов различается число:
- Протонов
- Нейтронов
- Электронов
- Нейтронов и электронов
Задание 3.
Проскок электрона характерен для элемента:
- Натрия
- Алюминия
- Ксенона
- Меди
Задание 4.
На третьем электронном слое может находиться максимально:
- 8 электронов
- 18 электронов
- 2 электрона
- 32 электрона
Ответы: 1. — 1; 2. — 2; 3. — 4; 4. — 2.
Физика 9 класс
Тема: Строение атома и атомного ядра. Использование энергии атомных ядер
Урок 56. Состав атомного ядра. Массовое число. Зарядовое
число. Ядерные силы
Ерюткин Евгений Сергеевич
учитель физики высшей категории ГОУ СОШ №1360
Москва
2011
Здравствуйте! Сегодняшний урок будет посвящен вопросу, связанному с обсуждением строения ядра атома, зарядовому числу, массовому числу, поговорим также о том, что такое ядерные силы. Наш урок – это подведение некоторого промежуточного итога по всем ранее изученным вопросам. Мне бы хотелось сказать то, что мы изучали вопросы, связанные со строением атома и строением ядра. Поэтому сегодня мы поговорим именно об этом. Некоторый итог предыдущим темам, предыдущим вопросам. Прежде чем мы перейдем к тому вопросу, который обозначен первым, мы поговорим вот о чем. На предыдущем уроке мы говорили, что Резерфорд в своих экспериментах установил, что существует такая частица, как протон. Через некоторое время в 1932 году Чедвик установил, что существует еще одна частица, которая называется нейтрон. После этого открытия независимо друг от друга два человека, русский ученый Иваненко и немецкий ученый Гейзенберг, предложили протонно-нейтронную модель строения ядра атома. По этой теории Иваненко – Гейзенберга, ядро любого атома содержит протоны и нейтроны. Эти протоны и нейтроны вместе, те, которые находятся в ядре атома, было решено называть нуклонами. Таким образом, «нуклон» (от лат. «ядро») – общее название для протонов и нейтронов. Те частицы, которые имеют заряд, и те частицы, которые заряд не имеют, нейтроны, эти все частицы вместе называются нуклонами. Давайте еще вот о чем поговорим. Идея о заряде ядра была впервые выдвинута в 1913 году английским ученым Генри Мозли. Он предложил, что, раз атом электронейтрален, порядковый номер элемента, умноженный на элементарный электрический заряд, это и есть заряд ядра. Каким образом Мозли пришел к такому заключению? Дело в том, что количество электронов в атоме соответствует порядковому номеру. Значит, заряд всех электронов – это произведение порядкового номера на заряд одного электрона. Поскольку в ядре сосредоточен положительный заряд, значит, то же самое можно говорить и о ядре. Давайте посмотрим на то, как пришел Мозли именно к тому, что мы называем зарядовым числом. Посмотрите:
qЯ = Z. |e|
qЯ – заряд ядра
е – заряд электрона
Z – число протонов в ядре, зарядовое число
Заряд числа, по такому утверждению, определяется как произведение порядкового номера на элементарный электрический заряд. В данном случае е – это заряд электрона, элементарный электрический заряд его называют, и взят он по модулю, потому что понятно, что заряд ядра у нас положительный. В этом случае порядковый номер стали называть зарядовым числом, порядковый номер – это число, соответствующее числу протонов в ядре. Таким образом, мы, говоря о порядковом номере, можем говорить о количестве протонов в ядре. Следующее число, о котором необходимо сказать, – это число массы. Оно, это число, обозначено буквой А, и это самое число берут то же из таблицы Менделеева и округляют его до целых. Дальше мы можем говорить о том уравнении, которое называется во всем мире уравнением Иваненко – Гейзенберга. Это уравнение состоит из трех чисел: массового числа, зарядового числа и числа нейтронов. Давайте посмотрим, как оно записывается и как обозначаются данные величины.
Уравнение Иваненко – Гейзенберга
А = Z + N
А – массовое число,
Z – порядковый номер элемента,
N – число нейтронов в ядре
Посмотрите: массовое число А говорит о том, какое количество нуклонов входит в ядро. Оказалось, что, по таблице Менделеева определяя массовое число химического элемента, мы определяем число нуклонов в ядре атома.
Z, как мы говорили, будет порядковый номер и число протонов в ядре. N в данном случае – это число нейтронов. Таким образом, мы можем из этого уравнения определить число нейтронов, число протонов, зная массовое число и порядковый номер. Здесь необходимо отметить важный момент. Дело в том, что в 1913 году еще один ученый Содди (вы помните, что этот человек работал вместе с Резерфордом) установил интересную вещь. Выяснено было, что существуют химические элементы с абсолютно одинаковыми химическими свойствами, но разным массовым числом. Такие элементы, у которых одинаковые химические свойства, но разное массовое число, стали называть изотопами. Изотопы – это химические элементы с одинаковыми химическими свойствами, но с различной массой атомных ядер.
Еще надо добавить, что у изотопов разная радиоактивность. Все это вместе привело к изучению этого вопроса. Здесь показаны изотопы легких и тяжелых элементов химических. Давайте посмотрим. Мы выбрали специально разные области таблицы Менделеева, чтобы показать, что практически все элементы химические имеют изотопы.
Изотопы:
 Н – протий
Н – протий  U
U
 H – дейтерий
H – дейтерий ![]() U
U
 Н – тритий
Н – тритий
У водорода этих изотопов три. Первый изотоп  Н называется протий. Обратите внимание, что порядковый номер ставится внизу, вот это число Z, а сверху пишется массовое число – это число А. Сверху А, внизу Z, и если мы понимаем, что
Н называется протий. Обратите внимание, что порядковый номер ставится внизу, вот это число Z, а сверху пишется массовое число – это число А. Сверху А, внизу Z, и если мы понимаем, что  это обозначает, что в ядре атома протия самый простой химический элемент, самый распространенный во вселенной. Там всего лишь 1 протон, а нейтронов в этом ядре совсем нет. Есть второй вид водорода – это дейтерий. Наверное, многие слышали такое слово. Обратите внимание: порядковый номер 1, а массовое число равно 2. Так что ядро дейтерия состоит уже из 1 протона и из одного нейтрона. И есть еще один изотоп водорода. Называется тритий. Тритий как раз (порядковый номер первый), а массовое число говорит о том, что в ядре этого изотопа находятся 2 нейтрона. И еще один элемент – это уран. Совсем другая сторона таблицы Менделеева. Это уже тяжелые элементы. У урана 2 изотопа распространенных. Это уран 235. Порядковый номер 92, а массовое число 235. Сразу можно говорить о том, чем отличается ядро одного элемента от другого. Второй изотоп: тоже порядковый номер 92, а массовое число 238. Очень часто, когда идет речь об изотопах, в частности урана, никогда не говорят порядкового номера. Просто говорят «уран», называют химический элемент и говорят его массовое число – 238. Или уран 235. Мы обсуждаем этот вопрос по той простой причине, что знаем, как сегодня этот химический элемент важен для энергетики нашей страны и вообще мировой энергетики в целом.
это обозначает, что в ядре атома протия самый простой химический элемент, самый распространенный во вселенной. Там всего лишь 1 протон, а нейтронов в этом ядре совсем нет. Есть второй вид водорода – это дейтерий. Наверное, многие слышали такое слово. Обратите внимание: порядковый номер 1, а массовое число равно 2. Так что ядро дейтерия состоит уже из 1 протона и из одного нейтрона. И есть еще один изотоп водорода. Называется тритий. Тритий как раз (порядковый номер первый), а массовое число говорит о том, что в ядре этого изотопа находятся 2 нейтрона. И еще один элемент – это уран. Совсем другая сторона таблицы Менделеева. Это уже тяжелые элементы. У урана 2 изотопа распространенных. Это уран 235. Порядковый номер 92, а массовое число 235. Сразу можно говорить о том, чем отличается ядро одного элемента от другого. Второй изотоп: тоже порядковый номер 92, а массовое число 238. Очень часто, когда идет речь об изотопах, в частности урана, никогда не говорят порядкового номера. Просто говорят «уран», называют химический элемент и говорят его массовое число – 238. Или уран 235. Мы обсуждаем этот вопрос по той простой причине, что знаем, как сегодня этот химический элемент важен для энергетики нашей страны и вообще мировой энергетики в целом.
Следующий вопрос, который мы должны затронуть, вытекает из сказанного. Как эти частицы, эти нуклоны удерживаются внутри ядра? Мы назвали различные химические элементы, изотопы различные, особенно у тяжелых элементов, там, где нуклонов, т.е. протонов и нейтронов, много. Как, каким образом они удерживаются внутри ядра? Мы знаем, что в маленьком ядре расстояния, размеры ядра очень и очень малы, бывает собрано большое количество частиц нуклонов. Как эти нуклоны там так плотно, тесно удерживаются, какими силами? Ведь за счет электростатического отталкивания эти частицы должны очень быстро распадаться, разлетаться. Мы знаем, что разноименные только заряды притягиваются, частицы, заряженные разноименными зарядами. Если частицы заряжены одноименно, понятно, что они должны отталкиваться. Внутри ядра находятся протоны. Они положительно заряжены. Размер ядра очень мал. В этом же ядре находятся еще и нейтроны, значит, должны быть силы, которые удерживают вместе те и другие частицы. Эти самые силы называют ядерными силами. Ядерные силы – это силы притяжения, действующие между нуклонами. Можно сказать, что у этих сил существуют свои особые свойства.
Первое свойство, о котором мы должны сказать, – это то, что ядерные силы должны превосходить силы электростатического отталкивания. И это так, когда удалось их определить, то выяснилось, что они в 100 раз превосходят силы электростатического отталкивания. Еще одно очень важное замечание, что действуют ядерные силы на малом расстоянии. Например, 10-15м – это и есть диаметр ядра, эти силы действуют. Но стоит только увеличиться размеру ядра до 10-14, казалось, совсем немного, то это приводит к тому, что ядро обязательно распадется. На этом расстоянии уже ядерные силы не действуют. А силы электростатического отталкивания продолжают действовать и именно они отвечают за то, что ядро распадается.
Еще можно сказать о ядерных силах то, что они не центральны, т.е. они не действуют вдоль прямой, соединяющей эти частицы. И то, что ядерные силы не зависят от того, обладает частица зарядом или не обладает, потому что в ядро входят и протоны, и нейтроны. Вместе эти частицы находятся. Таким образом, вывод: эти частицы, нуклоны, удерживаются в ядре за счет ядерных сил, и эти силы действуют только в ядре. Еще можно отметить, что ядерные силы имеют важное значение в плане стабильности ядра. Отвечают за долговременность существования этого элемента. В заключение мы можем отметить еще одно: когда мы будем говорить об энергетике, вот здесь именно ядерные силы будут играть основную роль. Об этом мы поговорим на следующих уроках. До свидания.
Задание к уроку.
1. Определите нуклонный состав ядер железа  (количество нуклонов, протонов, нейтронов).
(количество нуклонов, протонов, нейтронов).
2. В ядре атома химического элемента 22 протона и 26 нейтронов. Назовите этот химический элемент.
3. Оцените силу гравитационного взаимодействия между двумя нейтронами в ядре. Масса нейтрона примерно равна 1,7*10-27 кг, расстояние между нейтронами примите равным 10-15 м, значение гравитационной постоянной 6,67*10-11 (Н*м2)/кг2.
Когда Резерфорд опровергнул модель Томсона о строении атома, возник другой вопрос: из чего состоит ядро? Ответ на этот вопрос был получен спустя пару десятков лет. До этого в качестве элементарного ядра принимали протон — положительную частицу, которая имеет заряд, по модулю равный заряду электрона: е = 1,6*10-19 Кл. Масса же частицы равна 1,6726 · 10−27 кг.
Изотопы
В результате наблюдения огромного числа радиоактивных превращений было обнаружено, что существуют вещества, идентичные по химическим свойствам, но имеющие совершенно различные радиоактивные свойства — в одних и тех же условиях их распад происходил по-разному. Эти вещества не удавалось разделить ни одним из известных химических способов. Поэтому английский радиохимик Содди в 1911 г. высказал предположение о возможности существования элементов с одинаковыми химическими свойствами, но разной радиоактивностью. Эти элементы, по его мнению, нужно было помещать в одну и ту же клетку периодической системы Д. И. Менделеева. Содди назвал такие элементами изотопами (т. е. занимающими одинаковые места).
Предположение Содди о существовании веществ с разной радиоактивностью, но одинаковыми химическими свойствами, было подтверждено экспериментально. Когда английский физик Томсон проводил точные измерения массы ионов неона методом отклонения их в электрическом и магнитном полях, он установил, что неон есть смесь двух видов атомов. Большая часть атомов имела относительную массу 20, но некоторая часть атомов имела массу, равную 22 а. е. м. В результате относительная атомная масса смеси атомов неона была принята равной 20,2. Причем атомы обладали одинаковыми химическими свойствами, но масса их была различна.
С тех пор изотопы были обнаружены у разных химических элементов. Так, они есть у самого тяжелого из существующих в природе элементов — урана (относительные атомные массы 238, 235 и др.) и у самого легкого — водорода (относительные атомные массы 1, 2, 3).
Было установлено, что:
- Изотопы имеют разную массу.
- Заряды ядер изотопов одинаковы;
- Количество электронов у атомов изотопов одинаково.
- Химические свойства изотопов тоже одинаковые.
- Радиоактивность у изотопов разная — ядра одних атомов радиоактивны, в то время как другие могли быть стабильными или менее радиоактивными.
Эти обобщения помогли сделать вывод, что свойства радиоактивности изотопов зависят от их массы. Причем некоторые элементы могут иметь только нестабильные, или радиоактивные изотопы.
Особый интерес для физиков того времени представлял атом водорода, изотопы которого могли отличаться по массе в 2 и 3 раза:
- Дейтерий — изотоп водорода с атомной массой 2. Это стабильный химический элемент, который можно обнаружить в качестве примеси в обычном водороде. На 4500 атомов обычного водорода приходится 1 атом дейтерия. Совместно с кислородом дейтерий образует тяжелую воду. Ее свойства несколько отличаются от обычной воды. Так, при нормальном атмосферном давлении ее температура кипения составляет 101,2 °С, а температура кристаллизации — 3,8 °С.
- Тритий — изотоп водорода с атомной массой 3. Это нестабильный химический элемент. Он претерпевает β-распад. Период полураспада этого вещества составляет 12 лет.
Существование изотопов доказывает, что заряд атомного ядра определяет не все свойства атома, а лишь его химические свойства и те физические свойства, которые зависят от периферии электронной оболочки, например размеры атома. Масса же атома и его радиоактивные свойства не определяются порядковым номером в таблице Д. И. Менделеева.
Открытие нейтрона
При бомбардировке бериллия α-частицами, испускаемыми нестабильным полонием, возникает сильное проникающее излучение, которое легко преодолевает преграду в виде слоя свинца толщиной до 10–20 см. Это излучение изучали английский физик Чедвик и супруги Жолио-Кюри Ирен и Фредерик из Франции независимо друг от друга примерно в одно и то же время. Ученые предположили, что это излучение создано γ-лучами большой энергии. Но затем выяснилось, что если на пути излучения бериллия поставить пластинку из парафина, то ионизирующая способность излучения резко возрастает.
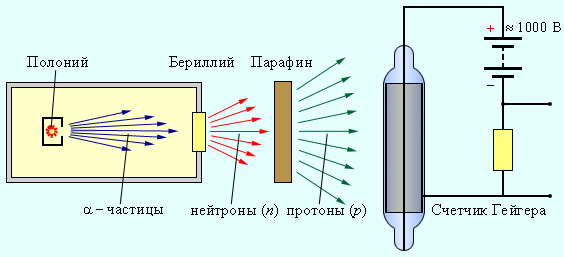
Было установлено, что излучение бериллия выбивает из парафиновой пластинки протоны, которые в большом количестве имеются в этом веществе. Ученые рассчитали длину свободного пробега протонов в воздухе они оценили энергию γ-квантов, которые сообщают при столкновении с протонами необходимую скорость. Расчеты показали слишком большое значение — 50 МэВ. протонам необходимую скорость. Она оказалась огромной – порядка 50 МэВ. Из-за малой массы γ-кванты не могли обладать такой энергией. Поэтому Чедвик сделал вывод, что из бериллия под действием α-частиц вылетают не безмассовые γ-кванты, а довольно тяжелые частицы. Эти частицы обладали большой проникающей способностью и не ионизировали газ в счетчике Гейгера. Это значит, что такие частицы были электрически нейтральными. Этой частице дали название — нейтрон.
Нуклонная модель атома
Сразу после открытия нейтрона несколько физиков одновременно высказали идею протонно-нейтронной, или нуклонной, модели ядра. Согласно этой модели ядро состоит из протонов и нейтронов. Будучи «кирпичиками», из которых строится ядро, протоны и нейтроны получили общее название — нуклоны.
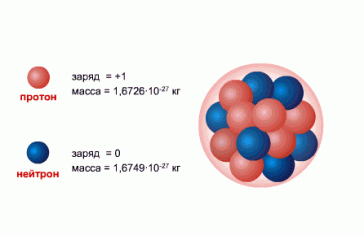
Нуклоны — общее название для составляющих атомное ядро протонов и нейтронов.
В рамках нуклонной теории о строении ядра атома ему было дано следующее определение:
Атомное ядро — центральная часть атома, состоящая из протонов и нейтронов.
Виды нуклонов:
- Протон (от protos — первый, обозначается как p или p+) — стабильная элементарная частица, ядро атома водорода. Заряд протона положительный, по модулю он равен заряду электрона: ep = 1.6∙10−19 Кл. Масса протона: mp = 1.6726231∙10−27 кг = 1.007276470 а. е. м. При расчетах часто используют округленное до целых значение: 1 а. е. м.
- Нейтрон (от лат. neuter — ни тот, ни другой, обозначается как n) — элементарная частица, не имеющая заряда, т. е. нейтральная. Масса нейтрона почти равна (незначительно больше) массе протона: mn = 1.6749286∙10−27 кг=1.0008664902 а. е. м. При расчетах также используют округленное до целых значение: 1 а. е. м.
Массовое число — общее число нуклонов в ядре. Обозначается как A.
Зарядовое число — число протонов в ядре. Обозначается как Z. Зарядовое число всегда соответствует порядковому номеру элемента в периодической таблице Менделеева.
Ядро любого химического в общем виде обозначается так:
AZX
где X — символ химического элемента, Z — число протонов в ядре (порядковый номер элемента в периодической таблице Менделеева), A — массовое число.
Массовое число определяется как сумму протонов и нейтронов, содержащихся в ядре атома:
A=Z+N
N – число нейтронов в ядре.
Пример №1. Пользуясь периодической системой элементов Д.И. Менделеева, определите число протонов и число нейтронов в ядрах атомов серы.
Взглянем на периодическую систему Менделеева и найдем серу:

Порядковый номер серы — 16. Следовательно, зарядовое число, или количество протонов в ядре атома серы — 16. Массовое число составляет 32,066 а. е. м. Округлим до целых и получим 32. Количество нейтронов найдем как разность массового и зарядового чисел:
N=A−Z=32−16=16
Ядерные силы
Ядра атомов обладают устойчивостью, несмотря на то, что между протонами действуют колоссальные силы кулоновского отталкивания. Чем же объясняется это явление? Видимо, между ними существует и другая сила, которая не дает протонам отталкиваться друг от друга. Такие силы назвали ядерными.
Ядерные силы — силы, действующие между протонами и нейтронами.
Ученые установили, что ядерные силы обладают следующими свойствами:
- Ядерные силы заметно проявляются только на расстояниях, сравнимых с размером атомных ядер (10–12–10–13 см). То есть, эти силы являются короткодействующими.
- Ядерные силы примерно в 100 раз превосходят силы электрического взаимодействия. На сегодня это самые мощные силы из всех сил, известных в природе. Именно благодаря им ядра атомов химических элементов сохраняются в устойчивом состоянии.
Энергия связи атомных ядер
Нуклоны в ядре прочно удерживаются ядерными силами. Если совершить работу по их преодолению, придется совершить некоторую работу. Энергию, которую нужно затратить для совершения работы по разделению на отдельные нуклоны, называют энергией связи ядра.
Энергия связи ядра атома — энергия, которая необходима для полного расщепления ядра на отдельные протоны и нейтроны.
На основании закона сохранения энергии можно сделать вывод, что энергия связи равна той энергии, которая выделяется при образовании ядра из отдельных частиц.
В настоящее время рассчитать энергию связи теоретически, подобно тому, как это можно сделать для электронов в атоме, не удается. Выполнить соответствующие расчеты можно, лишь применяя соотношение Эйнштейна между массой и энергией:
Е = mс2
Измерения масс ядер показали, что масса покоя ядра всегда меньше суммы масс входящих в его состав протонов и нейтронов:
Mя< Zmp + Nmn
Mя — масса покоя ядра, Z — число протонов, N — число нейтронов, mp — масса протона, mn — масса нейтрона.
На основании этого был сделан вывод о существовании дефекта (разности масс). Дефект масс определяется разностью суммы масс протонов и нейтронов, входящих в состав ядра, и массы покоя ядра атома:
ΔM=Zmp + Nmn−Mя
ΔM — дефект масс.
Это интересно! Масса ядра атома гелия на 0,75% меньше суммы масс двух протонов и двух нейтронов. Соответственно для гелия в количестве вещества один моль ΔM = 0,03 г.
Уменьшение массы при образовании ядра из нуклонов означает, что при этом уменьшается энергия этой системы нуклонов на значение энергии связи Есв.
Энергия связи — это энергия, которая выделяется при образовании ядра из отдельных частиц, и соответственно это та энергия, которая необходима для расщепления ядра на составляющие его частицы.
Энергия связи определяется формулой:
Eсв=ΔMс2=(Zmp + Nmn−Mя)с2
Это интересно! Энергия связи настолько велика, что образование 4 г гелия сопровождается выделением такой же энергии, что и при сгорании 1,5—2 вагонов каменного угля.
Важную информацию о свойствах ядер содержит зависимость удельной энергии связи от массового числа А.
Удельная энергия связи — энергия связи, приходящаяся на один нуклон ядра.
Удельную энергию связи устанавливают опытным путем. Из рисунка ниже видно, что, не считая самых легких ядер, удельная энергия связи примерно постоянна и равна 8 МэВ/нуклон. Примечательно, что энергия связи электрона и ядра в атоме водорода, равная энергии ионизации, почти в миллион раз меньше этого значения. Кривая на имеет слабо выраженный максимум. Максимальную удельную энергию связи (8,6 МэВ/нуклон) имеют элементы с массовыми числами от 50 до 60, т. е. железо и близкие к нему по порядковому номеру элементы. Ядра этих элементов наиболее устойчивы.
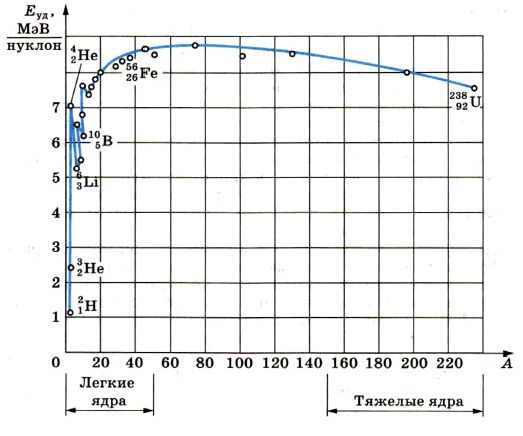
У тяжелых ядер удельная энергия связи уменьшается за счет возрастающей с увеличением Z кулоновской энергии отталкивания протонов. Кулоновские силы стремятся разорвать ядро.
Пример №2. Чему равна энергия связи ядра тяжелого водорода — дейтрона? Атомная масса ядра дейтрона mD = 2,01355 а. е. м, протона mр = 1,00728 а. е. м, нейтрона mn = 1,00866 а. е. м; масса атома углерода mс = 1,995 ∙ 10-26 кг.
Eсв=(Zmp + Nmn−Mя)с2
Зарядовое число водорода — 1. Количество нейтронов — 1. Чтобы найти суммарную массу всех частиц и ядра, нужно их массу в а. е. м. умножить на массу атома углерода в кг и поделить на 12. Это необходимо потому, что 1 а. е. м. равна 1/12 массы атома углерода. Получим:
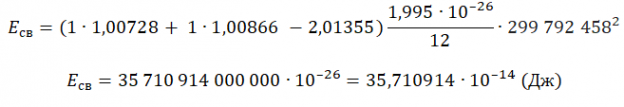
Переведем в МэВ, учитывая, что 1 МэВ = 1,6∙10–13 Дж:
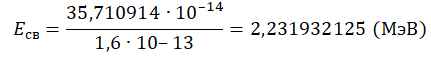
Задание EF17709
Какая из строчек таблицы правильно отражает структуру ядра 49115 In?

Алгоритм решения
- Установить, чем определяются количество протонов и нейтронов.
- Определить, сколько содержится в атоме протонов.
- Определить, сколько содержится в атоме нейтронов.
Решение
Протоны и нейтроны — нуклоны. Общее их количество является массовым числом A, которое указывается слева от обозначения химического элемента в верхнем индексе. В данном случае A = 115.
Зарядовое число — порядковый номер химического элемента в периодической системе Менделеева. Оно обозначается Z и равно количеству протонов в ядре. В нашем случае Z = 49. Значит, протонов 49.
Чтобы посчитать количество нейтронов, нужно из массового числа вычесть зарядовое число: 115 – 49 = 66. Значит, нейтронов 66. Строка 1 подходит.
Ответ: 1
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17974
Связанная система элементарных частиц содержит 14 нейтронов, 13 протонов и 10 электронов. Эта система частиц является
Ответ:
а) ионом алюминия 1327Al
б) нейтральным атомом кремния 1427Si
в) ионом кремния 1427Si
г) нейтральным атомом алюминия 1327Al
Алгоритм решения
- Определить, перед нами ион или нейтральный атом.
- Установить зарядовое число.
- Установить массовое число.
- Выбрать подходящий ответ.
Решение
Согласно условию задачи, в связанной системе элементарных частиц содержится 14 нейтронов, 13 протонов и 10 электронов. В нейтральном атоме количество электронов равно количеству протонов. В нашем случае электронов на 3 меньше. Значит, перед нами ион.
Зарядовое число соответствует количеству протонов. Их 13.
Массовое число равно сумме количества протонов и электронов: 14 + 13 = 27.
Выходит, перед нами ион алюминия.
Ответ: а
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18942
На рисунке представлен фрагмент Периодической системы элементов Д.И. Менделеева. Под названием каждого элемента приведены массовые числа его основных стабильных изотопов. При этом нижний индекс около массового числа указывает (в процентах) распространённость изотопа в природе.
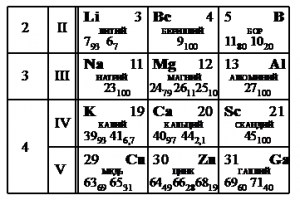
Укажите число протонов и число нейтронов в ядре наименее распространённого из указанных стабильных изотопов меди.

Алгоритм решения
- Найти наименее распространенный изотоп меди.
- Выписать для него массовые и зарядовые числа.
- Найти число протонов и нейтронов.
Решения
Наименее распространен изотоп меди Cu-65, поскольку возле его массового числа стоит меньший индекс — 31.
Массовое число этого изотопа — 65. Зарядовое число соответствует порядковому номеру — 29.
Количество протонов соответствует зарядовому числу. Их 29.
Количество нейтронов есть разность массового и зарядовых чисел: 65 – 29 = 36.
Эти числа запишем последовательно: 2936.
Ответ: 2936
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 1.8k
В ПОМОЩЬ МОЛОДОМУ
УЧИТЕЛЮ
Первоначальные представления
о строении атома и химических
элементах
Цель настоящей статьи – изложение
сложных вопросов общей химии, а именно
первоначальных представлений о строении атомов
химических элементов, в доступной форме. Этот
материал может предварять изучение темы на более
сложном уровне. Такой подход многократно
использовался мной на уроках химии.
Как известно, химия – это наука о веществах.
Разные вещества имеют различное строение. Бывают
вещества атомного строения, они состоят из
атомов. Пример вещества атомного строения –
алмаз. Вещества молекулярного строения
образованы молекулами. Например, вода состоит из
молекул H2O. Любая молекула состоит из
атомов. Известны вещества ионного строения.
Например, поваренная соль NaCl состоит из ионов
натрия и ионов хлора. Ионы – это тоже атомы или
группы атомов, только заряженные. Вот и
получается, какое вещество ни возьми, в основе
его строения лежит атом. Чтобы изучить вещества,
нам вначале следует понять, что такое атом.
Еще 150 лет назад некоторые ученые подвергали
сомнению факт существования атомов. Однако
несколько десятилетий спустя, в конце XIX – начале
XX в., была не только подтверждена реальность
атомов, но и доказано их сложное строение. Было
установлено, что в центре атома находится ядро.
Размеры самого атома во много раз превышают
размеры ядра. Представьте себе футбольное поле с
теннисным мячиком посередине. Если увеличить
атом до размеров футбольного поля, то размеры его
ядра будут сопоставимы с теннисным мячиком.
Атом состоит из элементарных частиц –
протонов, нейтронов и электронов. Элементарными
эти частицы назвали потому, что в отличие от
атома они неделимы. Два вида элементарных частиц
– протоны и нейтроны – образуют ядро. Электроны
образуют электронную оболочку вокруг ядра.
Электроны в отличие от ядер находятся в
постоянном движении. Говоря о движении
электрона, я избегаю употребления слов «вокруг»
и «вращается» и заменяю их словами «около» и
«движется». Если бы я сказала: «Электрон
вращается вокруг ядра», вы могли бы подумать, что
у него (электрона) есть постоянная орбита,
подобно тому как у планет Солнечной системы есть
свои орбиты вокруг Солнца. Кстати, на заре
исследований атома некоторое время ученые так и
думали. Была выдвинута так называемая
«планетарная теория строения атома». Однако
позже было установлено, что движение электрона
гораздо сложнее и что скорость этого движения
очень велика. Именно благодаря быстрому движению
электронов возникает электронное облако.
(Возможно, в детстве вы играли с пуговицей и
ниткой. К середине нитки привязывается пуговица
и много раз один ее конец вращается по часовой
стрелке или против нее, а потом концы нитки
натягиваются и пуговица на большой скорости
начинает двигаться в противоположном
направлении. Возникает иллюзия веретена.
Проделайте с пуговицей и ниткой все, как здесь
описано, наблюдайте веретено, и, может быть, тогда
вы лучше себе представите, что такое электронное
облако.)
В табл. 1 представлены характеристики
элементарных частиц, составляющих атомы.
Таблица 1
Сведения о частицах, составляющих
атомы
| Части атома | Элементарные частицы |
Условное обозначение |
Заряд | Масса |
|---|---|---|---|---|
| Ядро | Протон | р | +1 | 1 а.е.м. |
| Нейтрон | n | 0 | 1 а.е.м. | |
| Электронная оболочка |
Электрон | е | –1 | Можно пренебречь |
Из табл. 1 видно, что нейтрон –
электронейтральная частица, ее заряд равен нулю,
а протон и электрон – это заряженные частицы.
Заряды протона и электрона одинаковы по
величине, но отличаются по знаку заряда. Как
всякая материальная частица, электрон имеет
массу. Однако эта масса так мала (масса электрона
в 1840 раз меньше массы одного протона или
нейтрона), что ее вкладом в общую массу атома
можно пренебречь. Отсюда следует важный вывод: масса
атома сосредоточена в ядре.
Масса протона почти такая же, как масса
нейтрона, и равна атомной единице массы (а.е.м). За
атомную единицу массы принята 1/12 часть массы
изотопа углерода 12С.
Для выражения массы атомов чаще используют
относительную атомную массу (безразмерная
величина), которая обозначается Ar.
Например, для кислорода и серы: Ar(О) = 16 и Ar(S)
= 32.
В состав атома входят заряженные частицы,
однако атом – это электронейтральная
частица.
Заряд свободного атома или
атомов простого вещества равен нулю.Число
протонов в атоме равно числу электронов.
В природе существуют разновидности атомов,
различающихся размерами, массой и другими
характеристиками. Совокупность атомов одного
вида называется химическим элементом. Можно
сказать по-другому: химический элемент – это вид
атомов. Известно более ста химических элементов.
Чем же отличаются атомы различных химических
элементов? Во-первых, размерами, во-вторых,
массой, в-третьих, строением.
Рассмотрим более подробно строение атомов
различных химических элементов. Возьмите
периодическую систему химических элементов
Д.И.Менделеева и найдите химический элемент
водород.
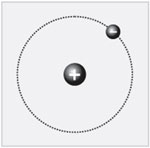
Атомы водорода имеют самое простое строение.
Ядро состоит всего из одного протона. Заряд ядра
равен +1. Поскольку масса атома сосредоточена в
ядре, его масса равна 1 а.е.м. Атом – это
электронейтральная частица, около ядра
находится один электрон.
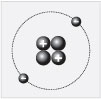
Более сложный элемент – гелий. В периодической
системе он числится под номером 2. Найдите этот
элемент и его порядковый номер в таблице
Менделеева (цифру 2). На рисунке показано, как
условно выглядит строение атома гелия. Как видим,
ядро образовано двумя протонами и двумя
нейтронами. Заряд ядра +2. Около ядра в атоме – два
электрона. Массовое число (оно характеризует
массу атома) равно четырем.
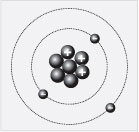
Найдите в периодической системе химический
элемент, порядковый номер которого равен трем.
Это – литий. В атоме лития ядро образовано тремя
протонами и четырьмя нейтронами. Заряд ядра
равен +3, около него находятся три электрона,
массовое число равно семи. Внимательно
рассмотрите клетку периодической системы, в
которой расположен литий, и найдите число 6,94.
Если его округлить, то получится 7. Это массовое
число лития.
Запомните, что меньшее из чисел, расположенных
в клетке периодической системы, – это порядковый
номер элемента. Другое число характеризует массу
атома, при округлении его до целых чисел получают
массовое число. Если хотят указать порядковый
номер и массовое число элемента, например гелия,
это делают так: ![]() .
.
А эта запись относится к литию: ![]() . Здесь 7 – массовое число, равное
. Здесь 7 – массовое число, равное
сумме протонов и нейтронов. Число электронов в
атоме равно числу протонов (заряд ядра) и такое
же, как порядковый номер элемента (3).
Следующее положение необходимо хорошо
запомнить:
порядковый номер элемента
указывает на число электронов, число протонов и
заряд ядра атома.
Найдите в периодической системе элемент
серебро. Чему равны его порядковый номер и
массовое число? Оказывается, порядковый номер 47,
а массовое число 108. Какие выводы можно сделать из
этого? Число электронов в атоме серебра 47, число
протонов также 47, заряд ядра +47. Масса атома (масса
ядра) равна 108 а.е.м. Напомним, что ядро образовано
протонами и нейтронами. Чтобы найти число
нейтронов, необходимо из 108 вычесть 47. В атоме
серебра 61 нейтрон.
Если бы все 47 электронов атома серебра
двигались на одинаковом расстоянии от ядра,
«аварий» (столкновений электронов) нельзя было
бы избежать. Чтобы этого не произошло, природа
распорядилась таким образом, что электроны
располагаются на различных расстояниях от ядра.
Так, в атоме лития два электрона находятся ближе
к ядру, а третий – дальше от него. Располагаясь
на различных расстояниях от ядра, электроны
образуют энергетические уровни. Электроны,
находящиеся на различных энергетических
уровнях, обладают различным запасом энергии. Чем
дальше электрон от ядра, тем больше его энергия.
Чтобы легче запомнить это утверждение, приведу
шуточную аналогию. Представьте, что ваши
родители – это ядро, а вы – электрон. Когда ваша
энергия (активность, независимость) больше: когда
вы близко от родителей (например, в одной с ними
квартире) или далеко от них? Конечно же, во втором
случае. Моим ученикам нравится этот пример, и они
легко запоминают сложное утверждение об энергии.
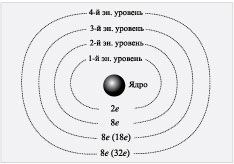
Сколько же электронов может находиться на
различных энергетических уровнях? На ближайшем к
ядру (первом) энергетическом уровне может
находиться не более двух электронов. Вместимость
других электронных слоев показана на схеме.
Схема
В некоторых учебниках вы найдете буквенное
обозначение энергетических уровней:
1-й – уровень К, 2-й – уровень L, 3-й – уровень М, 4-й
– уровень N.
На 2-м энергетическом уровне может находиться 8
электронов. Но что означают цифры 8 (18), 8 (32)?
Установлено, что если 3-й или более дальний
энергетический уровень является внешним, то на
нем может находиться не более восьми электронов.
Если же за 3-м энергетическим уровнем есть другие
энергетические уровни, то на нем может
накапливаться до 18 электронов. Аналогично
обстоит дело с 4-м энергетическим уровнем. Если он
внешний, то может содержать максимально 8
электронов, если же за ним есть другие
энергетические уровни, то на 4-м энергетическом
уровне может накапливаться до 32 электронов.
Важное заключение:
на внешнем энергетическом
уровне не может быть более 8 электронов.
Для нас будет очень важной информация о внешнем
энергетическом уровне, поэтому воспользуемся
сокращением этого словосочетания – ВЭУ.
В дальнейшем, показывая схему атома, мы не будем
обозначать все его протоны и нейтроны, а лишь
укажем в центре заряд его ядра. Заряду ядра атома
мы всегда будем уделять большое внимание, и скоро
вы поймете почему.
Рассмотрим последовательность заполнения
электронами энергетических уровней у атомов
первых 20 элементов периодической системы (табл.
2).
Таблица 2
| Название элемента |
Порядковый номер |
Число электронов на энергетических уровнях |
|||
|---|---|---|---|---|---|
| 1-й | 2-й | 3-й | 4-й | ||
| Водород | 1 | 1 | c | c | c |
| Гелий | 2 | 2 | c | c | c |
| Литий | 3 | 2 | 1 | c | c |
| Бериллий | 4 | 2 | 2 | c | c |
| Бор | 5 | 2 | 3 | c | c |
| Углерод | 6 | 2 | 4 | c | c |
| Азот | 7 | 2 | 5 | c | c |
| Kислород | 8 | 2 | 6 | c | c |
| Фтор | 9 | 2 | 7 | c | c |
| Неон | 10 | 2 | 8 | c | c |
| Натрий | 11 | 2 | 8 | 1 | c |
| Магний | 12 | 2 | 8 | 2 | c |
| Алюминий | 13 | 2 | 8 | 3 | c |
| Kремний | 14 | 2 | 8 | 4 | c |
| Фосфор | 15 | 2 | 8 | 5 | c |
| Сера | 16 | 2 | 8 | 6 | c |
| Хлор | 17 | 2 | 8 | 7 | c |
| Аргон | 18 | 2 | 8 | 8 | c |
| Kалий | 19 | 2 | 8 | 8 | 1 |
| Kальций | 20 | 2 | 8 | 8 | 2 |
Следующий за литием элемент –
бериллий. Его порядковый номер 4, а значит, около
ядра 4 электрона, 2 – на 1-м уровне и 2 – на 2-м. Далее
по мере увеличения порядкового номера идет
накопление электронов на 2-м энергетическом
уровне, и у элемента под номером 10 (неона) на 2-м
(внешнем) энергетическом уровне уже 8 электронов.
Поскольку на внешнем энергетическом уровне не
может быть более 8 электронов, у следующего
элемента с порядковым номером 11 (натрия)
одиннадцатый электрон образует 3-й
энергетический уровень. С увеличением
порядкового номера идет накопление электронов,
но уже на 3-м энергетическом уровне. У аргона, как
и у неона, на ВЭУ максимальное число электронов –
8. Следующий за аргоном элемент – калий.
Размещение электронов на его четырех
энергетических уровнях – 2, 8, 8, 1.
Будем одновременно анализировать табл. 2 и
периодическую систему элементов Д.И.Менделеева.
Обратите внимание, что первые два элемента в
нашей таблице отделены от остальных чертой. Что
объединяет их? И у водорода, и у гелия в атоме
всего лишь один энергетический уровень. В
периодической системе эти элементы расположены
в первой строчке. За гелием следуют 8 элементов:
литий, бериллий, бор, углерод, азот, кислород, фтор
и неон. В табл. 2 эти элементы отделены от других
также чертой. Почему? В атомах этих элементов
электроны распределены по двум энергетическим
уровням. В периодической системе Д.И.Менделеева
элементы от Li по Ne размещены во второй строчке.
Оставшуюся часть табл. 2 проанализируйте сами и
найдите эти элементы в периодической системе.
Напомним, что горизонтальная строчка в
периодической системе элементов Д.И.Менделеева
называется периодом. Такое определение периода
упрощено, и пользоваться им можно лишь на
начальном этапе изучения химии. Обратите
внимание, что четвертый, пятый и шестой периоды
включают в себя не одну, а две строчки (это
большие периоды).
Проанализировав обе таблицы, вы, наверное, сами
смогли сделать вывод:
номер периода указывает на
число энергетических уровней в атоме.
Например, элемент 47Ag (серебро) расположен
в пятом периоде, следовательно, 47 его электронов
распределены на пяти энергетических уровнях.
Обобщим знания и дадим характеристику строения
атомов натрия и калия.
Атом натрия имеет порядковый номер 11,
массовое число 23. Ядро содержит 11 протонов и
12 нейтронов. Заряд ядра +11. Около ядра движется 11
электронов. Натрий находится в третьем периоде,
поэтому 11 его электронов распределены на трех
энергетических уровнях (2е, 8е, 1е).
Атом калия – порядковый номер 19, массовое
число 39. В ядре – 19 протонов и 20 нейтронов. Заряд
ядра +19. Около ядра движется 19 электронов. Калий
находится в четвертом периоде, поэтому 19 его
электронов распределены на четырех
энергетических уровнях (2е, 8е, 8е, 1е).
Сравним распределение электронов в атомах так
называемых сходных элементов, сначала – в атомах
лития, натрия и калия (табл. 3).
Таблица 3
| Элемент | Число электронов на энергетических уровнях |
|||
|---|---|---|---|---|
| 1-й | 2-й | 3-й | 4-й | |
| Литий | 2 | 1 | ||
| Натрий | 2 | 8 | 1 | |
| Kалий | 2 | 8 | 8 | 1 |
Из табл. 3 видно, что на ВЭУ у атомов этих
элементов по одному электрону. Найдем в
периодической системе элементы литий, натрий,
калий. Все они расположены в первом столбце
периодической системы.
Рассмотрим распределение электронов в атомах
бериллия, магния и кальция (табл. 4).
Таблица 4
| Элемент | Число электронов на энергетических уровнях |
|||
|---|---|---|---|---|
| 1-й | 2-й | 3-й | 4-й | |
| Бериллий | 2 | 2 | ||
| Магний | 2 | 8 | 2 | |
| Kальций | 2 | 8 | 8 | 2 |
Оказывается, на ВЭУ у атомов этих
элементов по два электрона. В периодической
системе они расположены во втором столбце.
Рассмотрим распределение электронов в атомах
фтора, хлора и брома (табл. 5).
Таблица 5
| Элемент | Число электронов на энергетических уровнях |
|||
|---|---|---|---|---|
| 1-й | 2-й | 3-й | 4-й | |
| Фтор | 2 | 7 | ||
| Хлор | 2 | 8 | 7 | |
| Бром | 2 | 8 | 18 | 7 |
Из схемы видно, что на ВЭУ у атомов этих
элементов по семь электронов. Они расположены в
седьмом столбце периодической системы.
Вертикальный столбец периодической системы
называется группой. Это определение группы, как и
определение периода, упрощено, и пользоваться им
можно лишь на начальном этапе изучения химии.
Групп в периодической системе – восемь. Как вы
думаете, почему именно восемь, а не семь или
девять? Чтобы ответить на этот вопрос, вспомним,
каково максимальное число электронов на внешнем
энергетическом уровне. Восемь! А теперь очень
важный вывод:
номер группы указывает число
электронов на внешнем энергетическом уровне
атома.
Сколько электронов на ВЭУ у атома серебра?
Чтобы ответить на этот вопрос, уточните
положение серебра в периодической системе.
Серебро находится в первой группе, значит, на
внешнем энергетическом уровне его атомов – один
электрон.
Может быть, кто-то из вас скажет: «Для первых 20
элементов мы знаем распределение электронов в
атоме. А как узнать распределение электронов в
атомах других элементов? Например, как узнать,
что у атома брома на третьем энергетическом
уровне 18 электронов?» На первых порах эту
информацию можно получать из периодической
системы. Найдите в таблице Д.И.Менделеева элемент
№ 35. В его клетке имеется столбик мелких цифр,
если считать снизу, – 2, 8, 18, 7. Значит, на 1-м
энергетическом уровне атома Br – 2e, на 2-м – 8e,
на 3-м – 18e и на 4-м – 7e.
Найдите в периодической системе распределение
электронов в атоме серебра. Как много сведений
можно извлечь из периодической системы! На
экзамене по химии разрешено пользоваться
периодической системой Д.И.Менделеева. Поэтому в
ваших интересах как можно лучше в ней
разобраться. Это не только увлекательно и
интересно, но и может вам пригодиться.
Найдите в периодической системе элементы
гелий, неон, аргон, криптон, ксенон и радон.
Напишите самостоятельно распределение
электронов в атомах этих элементов, а потом
сравните с приведенной ниже табл. 6.
Таблица 6
| Элемент | Число электронов на энергетических уровнях |
|||||
|---|---|---|---|---|---|---|
| 1-й | 2-й | 3-й | 4-й | 5-й | 6-й | |
| Гелий | 2 | |||||
| Неон | 2 | 8 | ||||
| Аргон | 2 | 8 | 8 | |||
| Kриптон | 2 | 8 | 18 | 8 | ||
| Kсенон | 2 | 8 | 18 | 18 | 8 | |
| Радон | 2 | 8 | 18 | 32 | 18 | 8 |
Из табл. 6 видно, что на ВЭУ у атомов этих
элементов максимальное число электронов – по 8.
Перечисленные элементы объединены в группу
инертных газов. Синонимами слова «инертный»
являются слова «неактивный», «пассивный». И
действительно, атомы этих элементов отличаются
чрезвычайно низкой химической активностью.
Правильней было бы сказать, что они отличаются
особой химической неактивностью. Эти газы при
обычных условиях не взаимодействуют ни с какими
веществами, а при особых условиях
взаимодействуют с очень немногими веществами.
Может быть, поэтому другое их название –
благородные газы.
Т.А.ЖУРАВЛЕВА,
учитель химии гимназии № 272
(Санкт-Петербург)
 В статье рассмотрена расшифровка таблицы Менделеева, с помощью которой можно быстро в ней разобраться. Из таблицы Менделеева можно почерпнуть огромное количество информации о каждом химическом элементе. Ее можно использовать на ЕГЭ, если уметь грамотно ей пользоваться.
В статье рассмотрена расшифровка таблицы Менделеева, с помощью которой можно быстро в ней разобраться. Из таблицы Менделеева можно почерпнуть огромное количество информации о каждом химическом элементе. Ее можно использовать на ЕГЭ, если уметь грамотно ей пользоваться.
- Периодическая система Менделеева систематизирует элементы и их свойства. В ней все элементы упорядочены с учетом их атомного числа и повторяющихся химических свойств.
- Периодический закон: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Расшифровка обозначений элементов
Каждому химическому элементу в таблице отведена одна клеточка, в которой указаны символ и название элемента, порядковый номер и относительная атомная масса.
Расшифровка обозначений элементов таблицы Менделеева:
- Обозначение: одной или двумя латинскими буквами.
- Порядковый номер элемента или атомный номер равен числу протонов в его ядре. Обычно пишется в левом верхнем углу.
- Относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учетом их содержания в природе. Поэтому обычно она является дробным числом.
- Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число.
- Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
- Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
- Электронная конфигурация — формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы.
-
Чтобы узнать количество нейтронов в ядре элемента, необходимо из относительной атомной массы (массового числа) вычесть порядковый номер.
Элементы периодической таблицы Менделеева
Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
- Металлы обладают хорошей электро- и теплопроводностью, способны отражать яркий свет, имеют высокую температуру плавления (остаются твердыми при нормальных значениях окружающей среды, исключение — ртуть).
- Неметаллы встречаются в природе в трех состояниях: газ (например, водород), жидкость (например, бром) и твердые вещества (например, фосфор). Он не способны проводить тепло и электричество. Имеют более низкую температуру плавления в сравнении с металлами, более хрупкие и ломкие. Могут иметь разнообразный внешний вид (элементы с низкой плотностью и яркостью).
- Металлоиды имеют смешанные свойства металлов и неметаллов (например, кремний). Они имеют среднюю тепло- и электропроводность. Различаются между собой по температуре плавления, плотности, цвету и форме. Внешний вид может быть схож с металлами или неметаллами.
Расшифровка групп и периодов таблицы Менделеева
В таблице химические вещества расположены в специальном порядке: слева направо по мере роста их атомных масс. Все они в периодической системе объединены в периоды и группы.
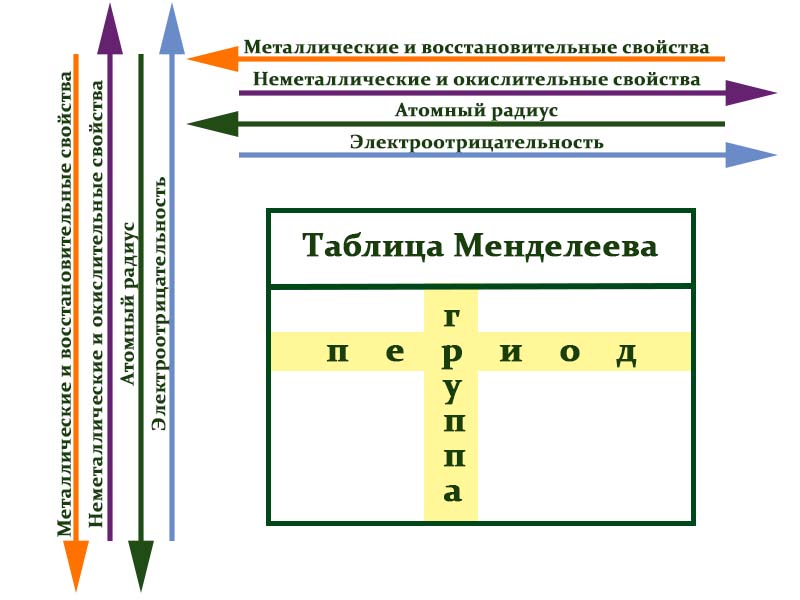
Периоды — это горизонтальные ряды в таблице. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Номер периода, в котором находится элемент, совпадает с номером его валентной оболочки. Эта валентная оболочка постепенно заполняется от начала к концу периода.
Закономерности периодов:
- Металлические свойства убывают, неметаллические и окислительные -возрастают. Каждый период начинается активным металлом и заканчивается инертным газом.
- Уменьшается атомный радиус.
- Увеличивается электроотрицательность.
Группы — это столбцы. Элементы во всех группах имеют одинаковое электронное строение внешних электронных оболочек. В каждой группе на внешнем энергетическом атома одинаковое число электронов, то есть номер группы совпадает с числом валентных электронов, которые могут участвовать в образовании химических связей. Поэтому номер группы часто совпадает с валентностью элементов. Например, номер группы совпадает с валентностью s-элементов и с наибольшей возможной валентностью p-элементов.
Закономерности групп:
- Металлические свойства увеличиваются, неметаллические и окислительные- убывают.
- Увеличивается радиус атома элементов в рамках одной группы.
- Уменьшается электроотрицательность.
Атомное число показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Валетность — это свойство элементов образовывать химические связи. То есть это количество химических связей, которые образует атом или число атомов, которое может присоединить или заместить атом данного элемента. Валентность бывает: постоянная и переменная (зависит от состава вещества, в которое входит элемент).
Определить валентность:
— Постоянная валентность идентична номеру группы главной подгруппы. Номера групп в таблице изображаются римскими цифрами.
— Переменная валентность (часто бывает у неметаллов) определяется по формуле: 8 вычесть № группы, в которой находится вещество.
Расшифровка периодов и групп периодической таблицы Менделеева
Каждый элемент имеет свой порядковый (атомный) номер, располагается в определённом периоде и определённой группе.
Периоды
- Малые периоды: первый, второй и третий периоды. В них содержится соответственно 2, 8 и 8 элементов;
- Большие периоды: остальные элементы. В четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент.
В таблице 7 периодов. В каждом содержится определённое число элементов:
1-й период — 2 элемента (малый период),
2-й период — 8 элементов (малый период),
3-й период — 8 элементов (малый период),
4-й период — 18 элементов (большой период),
5-й период — 18 элементов (большой период),
6-й период — 32 элемента (18+14) (большой период),
7-й период — 32 элемента (18+14) (большой период).
Группы и подгруппы
- Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов.
- Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
В Периодической таблице может использоваться разное обозначение групп. Поэтому согласно такому обозначению бывает разная расшифровка групп таблицы менделеева:
- 18 групп, пронумерованных арабскими цифрами.
- 8 групп, пронумерованных цифрами с добавлением букв A или B.
Группы A — это главные подгруппы.
Группы B — это побочные подгруппы в больших периодов. Это только металлы.
IA, VIIIA — по 7 элементов;
IIA — VIIA — по 6 элементов;
IIIB — 32 элемента (4+14 лантаноидов +14 актиноидов);
VIIIB — 12 элементов;
IB, IIB, IVB — VIIB — по 4 элемента.
Римский номер группы, как правило, показывает высшую валентность в оксидах (но для некоторых элементов не выполняется).
Элементы с порядковыми номерами 58–71 (лантаноиды) и 90–103 (актиноиды) вынесены из таблицы и располагаются под ней. Это элементы IIIB группы. Лантаноиды относятся к шестому периоду, а актиноиды — к седьмому.
Элементы главной подгруппы
1 группа главная подгруппа элементов (IA) — щелочные металлы.
Это мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним электроном на внешней оболочке и прекрасно вступают в реакцию.
Литий Li (3), Натрий Na (11), Калий K (19), Рубидий Rb (37), Цезий Cs (55), Франций Fr (87).
2 группа главная подгруппа (IIА) -щелочноземельными металлами.
Имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Кальций Ca (20), Стронций Sr (38), Барий Ba (56), Радий Ra (88).
3 группа главная подгруппа (IIIА).
Все элементы данной подгруппы, за исключением бора, металлы. Главную подгруппу составляют составляют бор, алюминий, галлий, индий и таллий. На внешнем электронном уровне элементов по три электрона. Они легко отдают эти электроны или образуют три неспаренных электрона.
4 группа главная подгруппа (IVА) .
Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы).
5 группа главная подгруппа (VA).
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
6 группа главной подгруппы (VIA) .
Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства.
7 группа главная подгруппа (VIIA) — галогены .
(F, Cl, Br, I, At). Имеют семь электронов на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
8 группа главная подгруппа (VIIIA) — инертные (благородные) газы.
(He, Ne, Ar, Kr, Xe, Rn, Og). У них полностью заполнен внешний электронный уровень. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными». У инертных газов есть способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Элементы побочной подгруппы
Элементы побочных подгрупп кроме лантаноидов и актиноидов — переходные металлы.
Твёрдые (исключение жидкая ртуть), плотные, обладают характерным блеском, хорошо проводят тепло и электричество.
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
3 группа побочная подгруппа (IIIB) шестого и седьмого периодов — лантаноиды и актиноиды.
Для удобства их помещают под основной таблицей.
- Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
- Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Неметаллы
Правый верхний угол таблицы до инертных газов -неметаллы.
Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе.
Кислородные и водородные соединения
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения.
Существует 8 форм кислородных соединений: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4,
где R — элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют 4 формы водородных соединений: RH4, RH3, RH2, RH.
Характер соединений: RH — сильнокислый; RH2 — слабокислый; RH3 — слабоосновный; RH4 — нейтральный.
