If you have a given mass of a compound, you can calculate the number of moles. Conversely, if you know how many moles of the compound you have, you can calculate its mass. For either calculation, you need to know two things: the chemical formula of the compound and the mass numbers of the elements that comprise it. An element’s mass number is unique to that element, and it’s listed right underneath the element’s symbol in the periodic table. The mass number of an element is not the same as its atomic number.
TL;DR (Too Long; Didn’t Read)
The atomic mass number of each element appears under its symbol in the periodic table. It’s listed in atomic mass units, which is equivalent to grams/mole.
Atomic Number and Atomic Mass Number
Every element is characterized by a unique number of positively charged protons in its nucleus. For example, hydrogen has one proton, and oxygen has eight. The periodic table is an arrangement of the elements according to increasing atomic number. The first entry is hydrogen, the eighth is oxygen and so on. The place an element occupies in the periodic table is an immediate indication of its atomic number, or the number of protons in its nucleus.
Besides protons, the nuclei of most elements also contains neutrons. These fundamental particles don’t have a charge, but they have roughly the same mass as protons, so they must be included in the atomic mass. The atomic mass number is the sum of all protons and neutrons in the nucleus. The hydrogen atom may contain a neutron, but it usually doesn’t, so the mass number of hydrogen is 1. Oxygen, on the other hand, has an equal number of proteins and neutrons, which raises its mass number to 16. Subtracting an element’s mass number from its atomic mass tells you the number of protons in its nucleus.
Finding the Mass Number
The best place to look for an element’s atomic mass number is in the periodic table. It’s displayed under the symbol for the element. You might be mystified by the fact that in many versions of the periodic table, this number contains a decimal fraction, which you wouldn’t expect if it was derived simply by adding protons and neutrons.
The reason for this is that the number displayed is the relative atomic weight, which is derived from all the naturally occurring isotopes of the element weighted by the percentage of each that occurs. Isotopes are formed when the number of neutrons in an element is more or less than the number of protons. Some of these isotopes, such as carbon-13, are stable, but some are unstable and decay over time to a more stable state. Such isotopes, such as carbon-14, are radioactive.
Virtually all elements have more than one isotope, so each has an atomic mass that contains a decimal fraction. For example, the atomic mass of hydrogen listed in the periodic table is 1.008, that for carbon is 12.011 and that for oxygen is 15.99. Uranium, with an atomic number of 92, has three naturally occurring isotopes. Its atomic mass is 238.029. In practice, scientists usually round mass number to the nearest integer.
Units for Mass
The units for atomic mass have been refined over the years, and today scientists use the unified atomic mass unit (amu, or simply u). It is defined to be equal to exactly one-twelfth the mass of an unbound carbon-12 atom. By definition, the mass of one mole of an element, or Avogadro’s number (6.02 x 1023) of atoms, is equal to its atomic mass in grams. In other words, 1 amu = 1 gram/mole. So if the mass of one hydrogen atom is 1 amu, the mass of one mole of hydrogen is 1 gram. The mass of one mole of carbon is therefore 12 grams, and that of uranium is 238 grams.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 ноября 2019 года; проверки требуют 4 правки.
Ма́ссовое число́ атомного ядра — суммарное количество протонов и нейтронов (называемых общим термином «нуклоны») в ядре. Обычно обозначается буквой A. Массовое число близко к атомной массе изотопа, выраженной в атомных единицах массы, но совпадает с ней только для углерода-12, поскольку атомная единица массы (а. е. м.) определяется сейчас как 1⁄12 массы атома 12С. Во всех остальных случаях атомная масса не является целым числом, в отличие от массового числа. Так, массовое число изотопа хлора 35Cl равно 35, а его атомная масса составляет 34,96885 а.е.м.
Массовое число в обозначении конкретного нуклида (вида атомных ядер) пишется верхним левым индексом, например 232Th. Нуклиды с одинаковым массовым числом называются изобарами (например, изобарами являются нуклиды 14C и 14N).
Знание массового числа позволяет оценить массу ядра и атома. Если известно массовое число, то масса М атома и его ядра оценивается из следующего соотношения М ≈ А·mN, где mN ≈ 1,67·10−27 кг — масса нуклона, то есть протона или нейтрона. Например, в состав атома алюминия-27 и его ядра входит 27 нуклонов (13 протонов и 14 нейтронов). Его масса примерно равна 27·1,67·10−27 кг ≈ 4,5·10−26 кг. Если необходимо получить массу ядра с большей точностью, то нужно учесть, что нуклоны в ядре связаны силами ядерного притяжения, и поэтому в соответствии с соотношением E = mc2 масса ядра уменьшается. В массу атома также следует добавить суммарную массу электронов на орбитах вокруг ядра. Однако все эти поправки не превышают 1 %[1].
Массовое число совпадает с барионным числом ядра. Барионное число сохраняется во всех известных процессах, поэтому любые радиоактивные распады и ядерные реакции не приводят к изменению суммы массовых чисел ядер в левой и правой части реакции. Например, при альфа-распаде урана-238
в левой части массовое число начального ядра равно 238, в правой части реакции — два ядра с массовыми числами 234 и 4, что в сумме даёт 238. С учётом того, что массовое число альфа-частицы (ядра гелия-4) равно 4, альфа-распад снижает массовое число распадающегося ядра на 4 единицы. Любые типы бета-распада (бета-минус-распад, позитронный распад, электронный захват, все типы двойного бета-распада) не изменяют массовое число, поскольку в этом процессе происходит лишь превращение некоторых нуклонов ядра из одного вида в другой (протонов в нейтроны или обратно). Изомерный переход также не изменяет массовое число ядра.
Примечания[править | править код]
- ↑ «Ишханов Б. С., Капитонов И. М., Кэбин Э. И., Частицы и атомные ядра. Основные понятия, Изд. МГУ, Москва, 2009, 271 с., тираж 100 экз.» Дата обращения: 15 февраля 2011. Архивировано 25 ноября 2012 года.
Согласно протонно-нейтронной модели строения атомного ядра, заряд ядра должен быть равен сумме зарядов всех протонов, которые входят в его состав. Так как заряд протона равен элементарному заряду, то можно считать, что:
(q) — заряд ядра,
(e) — элементарный заряд,
()
Z
() — количество протонов в ядре.
Количество протонов в ядре
Z
называется зарядовым числом атомного ядра.
Экспериментально было доказано, что число Z совпадает с порядковым номером химического элемента в Периодической системе Менделеева.
Обрати внимание!
Количество протонов в ядре атома совпадает с номером химического элемента в Периодической системе химических элементов и называется зарядовым числом (
Z
).
Массовое число
Количество нейтронов в ядре атома принято обозначать N. Тогда количество протонов и нейтронов в ядре атома можно вычислить как:
A=Z+N.
— количество нуклонов в атоме называется массовым числом.
Изотопы
Химические свойства атома определяются зарядовым числом, так как это число указывает на номер атома в периодической системе, т. е. определяет, какой именно это химический элемент. Физические свойства атома могут быть разными в зависимости от массового числа. Действительно, экспериментально было доказано, что ядра одного и того же химического элемента могут обладать разными массами. Например, в природе существует несколько видов атомов водорода: водород, дейтерий и тритий. Масса дейтерия приблизительно в два, а трития — в три раза больше массы водорода.
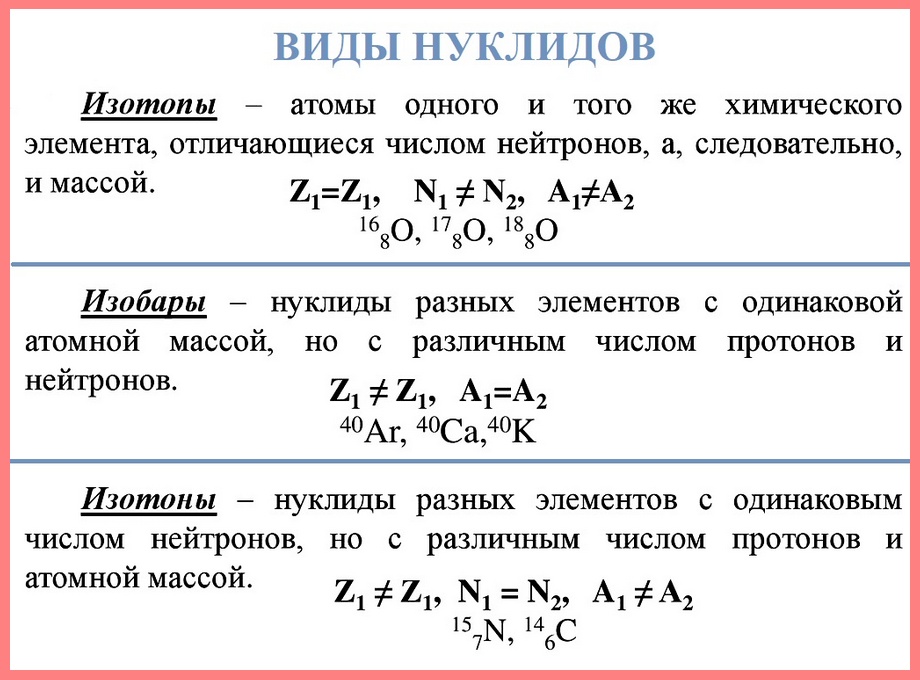
Атомы одного и того же химического элемента, но с разными массами, называются изотопами.
Так как изотопы — это атомы одного и того же химического элемента, то зарядовое число у изотопов одинаковое, а массовые числа различные. Это означает, что ядра изотопов содержат одинаковое число протонов и разное количество нейтронов.
Изотопы принято обозначать:
XZA, где
XZA — химический элемент,
A — массовое число,
Z — зарядовое число.
Пример:
— водород,
H12
— дейтерий,
H13
— тритий.
Содержание
- Примеры массовых чисел
- Водород
- Кислород
- Углерод
- Уран
- Как получить массовое число?
- Обозначения для атомов
- Изотопы
- Изотопы углерода
- Таблица природных изотопов углерода
- Примеры работы
- – Пример 1
- Ответить
- – Пример 2
- Ответить
- Ссылки
В массовое число Массовое число атома – это сумма количества протонов и количества нейтронов в ядре. Эти частицы взаимозаменяемо обозначаются именем нуклоны, поэтому массовое число представляет их количество.
Пусть N – количество присутствующих нейтронов, а Z – количество протонов, если мы назовем A массовым числом, тогда:
А = N + Z
Примеры массовых чисел
Вот несколько примеров массовых чисел для хорошо известных элементов:
Водород
Самый стабильный и многочисленный атом водорода также самый простой: 1 протон и один электрон. Поскольку ядро водорода не имеет нейтронов, верно, что A = Z = 1.
Кислород
В ядре кислорода 8 нейтронов и 8 протонов, поэтому A = 16.
Углерод
Жизнь на Земле основана на химии углерода, легкого атома с 6 протонами в ядре плюс 6 нейтронов, поэтому A = 6 + 6 = 12.
Уран
Этот элемент, намного тяжелее предыдущих, хорошо известен своими радиоактивными свойствами. В ядре урана 92 протона и 146 нейтронов. Тогда его массовое число A = 92 + 146 = 238.
Как получить массовое число?
Как упоминалось ранее, массовое число A элемента всегда соответствует сумме числа протонов и числа нейтронов, содержащихся в его ядре. Это тоже целое число, но … есть ли какое-нибудь правило относительно соотношения между двумя величинами?
Посмотрим: все перечисленные элементы легкие, кроме урана. Атом водорода, как мы уже сказали, самый простой. В нем нет нейтронов, по крайней мере, в его наиболее распространенной версии, а в кислороде и углероде есть равное количество протонов и нейтронов.
То же самое происходит и с другими легкими элементами, такими как азот, еще один очень важный для жизни газ, который имеет 7 протонов и 7 нейтронов. Однако по мере того, как ядро становится более сложным, а атомы становятся тяжелее, количество нейтронов увеличивается с другой скоростью.
В отличие от легких элементов, уран с 92 протонами имеет примерно в 1 ½ раза больше нейтронов: 1 ½ x 92 = 1,5 x 92 = 138.
Как видите, это довольно близко к 146 – количеству нейтронов, которое он имеет.
Все это становится очевидным на кривой на рисунке 2. Это график зависимости N от Z, известный каккривая ядерной устойчивости. Там вы можете увидеть, как легкие атомы имеют такое же количество протонов, что и нейтроны, и как с Z = 20 количество нейтронов увеличивается.
Таким образом, большой атом становится более стабильным, так как избыток нейтронов уменьшает электростатическое отталкивание между протонами.
Обозначения для атомов
Очень полезная запись, которая быстро описывает тип атома, следующая: символ элемента и соответствующие атомные и массовые числа записываются, как показано ниже на этой диаграмме:
В этих обозначениях атомы в предыдущих примерах будут:
Иногда используются другие более удобные обозначения, в которых для обозначения атома используются только символ элемента и массовое число, без атомного номера. Таким образом, 12 6C просто записывается как углерод-12, 16 8Или кислород – 16 и так далее для любого элемента.
Изотопы
Число протонов в ядре определяет природу элемента. Например, каждый атом, ядро которого содержит 29 протонов, является атомом меди, несмотря ни на что.
Предположим, атом меди по какой-то причине теряет электрон, это все равно медь. Однако теперь это ионизированный атом.
Атомному ядру сложнее получить или потерять протон, но в природе это может происходить. Например, внутри звезд более тяжелые элементы непрерывно образуются из легких элементов, поскольку звездное ядро ведет себя как термоядерный реактор.
И прямо здесь, на Земле, есть феномен радиоактивный распад, в котором некоторые нестабильные атомы изгоняют нуклоны и излучают энергию, превращаясь в другие элементы.
Наконец, существует вероятность того, что атом определенного элемента имеет другое массовое число, в данном случае это изотоп.
Хороший пример – всем известный углерод-14 или радиоуглерод, который используется для датировки археологических объектов и как биохимический индикатор. Это тот же углерод с идентичными химическими свойствами, но с двумя дополнительными нейтронами.
Углерод-14 менее распространен, чем углерод-12, стабильный изотоп, а также радиоактивен. Это означает, что со временем он распадается, выделяя энергию и частицы, пока не станет стабильным элементом, которым в его случае является азот.
Изотопы углерода
Углерод существует в природе как смесь нескольких изотопов, наиболее распространенными из которых являются уже упомянутые 126С или углерод-12. А кроме углерода-14 есть 136C с дополнительным нейтроном.
Это обычное явление в природе, например, известно 10 стабильных изотопов олова. С другой стороны, из бериллия и натрия известен только один изотоп.
Каждый изотоп, природный или искусственный, имеет разную скорость превращения. Таким же образом можно создавать искусственные изотопы в лаборатории, которые, как правило, нестабильны и радиоактивно распадаются за очень короткий период долей секунды, в то время как для других требуется гораздо больше времени, равное возрасту Земли или больше.
Таблица природных изотопов углерода
| Изотопы углерода | Атомный номер Z | Массовое число A | Изобилие% |
|---|---|---|---|
| 12 6 C | 6 | 12 | 98.89 |
| 13 6 C | 6 | 13 | 1.11 |
| 14 6 C | 6 | 14 | Следы |
Примеры работы
– Пример 1
В чем разница между137 N и 147 N?
Ответить
Оба являются атомами азота, так как их атомный номер равен 7. Однако один из изотопов с A = 13 имеет на один нейтрон меньше, а 147 N – самый распространенный изотоп.
– Пример 2
Сколько нейтронов находится в ядре атома ртути, обозначаемого как 20180 Hg?
Ответить
Поскольку A = 201 и Z = 80, а также зная, что:
А = Z + N
N = А – Я = 201 – 80 = 121
И делается вывод, что в атоме ртути 121 нейтрон.
Ссылки
- Коннор, Н. Что такое нуклон – Структура атомного ядра – Определение. Получено с: period-table.org.
- Найт, р. 2017. Физика для ученых и инженерии: стратегический подход. Пирсон.
- Сирс, Земанский. 2016. Университетская физика с современной физикой. 14-го. Ред. Том 2.
- Типпенс, П. 2011. Физика: концепции и приложения. 7-е издание. Макгроу Хилл.
- Википедия. Массовое число. Получено с: en.wikipedia.org.
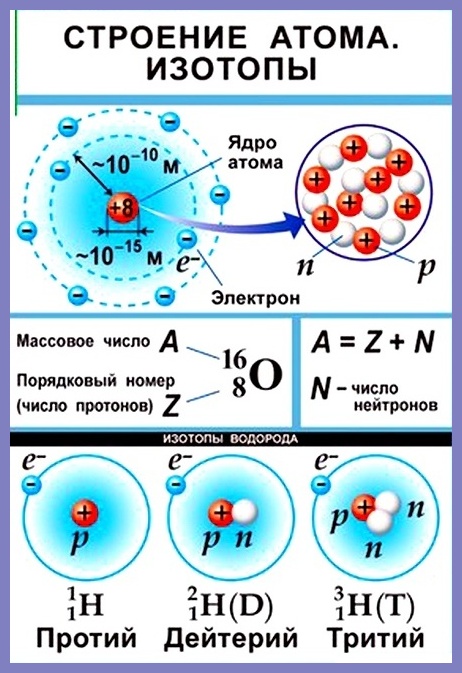
«Строение атома. Массовое число»
Ключевые слова конспекта: строение атома, элементарные частицы, протоны и электроны в атомах, атомный номер, массовой число, число нейтронов, нуклид, изотопы, ионы, катионы, заряд иона.
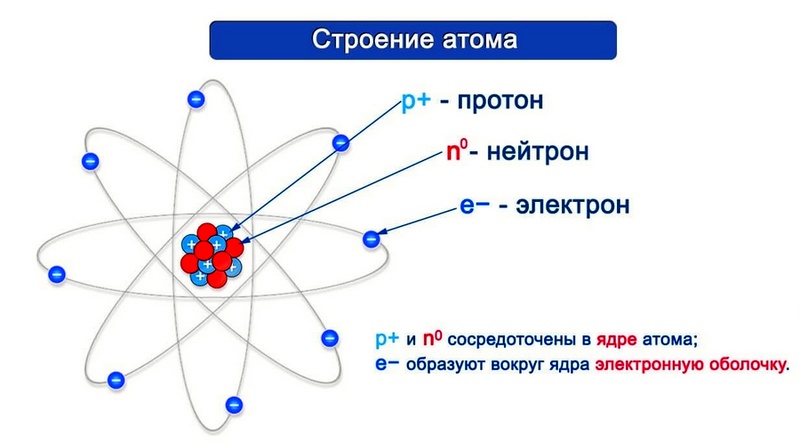
Согласно модели Резерфорда каждый атом состоит из находящегося в его центре ядра и электронной оболочки. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре. Электроны движутся вокруг ядра. Число электронов атома равно положительному заряду ядра.
Диаметр атома 10-10 м, диаметр ядра 10-14 – 10-15 м. Масса атома водорода равна 1,67 • 10-24 г, атома углерода — 1,99 • 10-23 г, атома железа — 9,29 • 10-23 г.
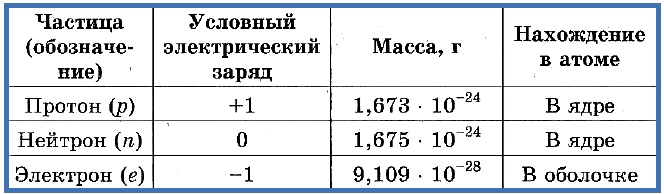
Элементарные частицы — это протоны, электроны и нейтроны, из них состоят все атомы.
Таблица 1. «Элементарные частицы атома»
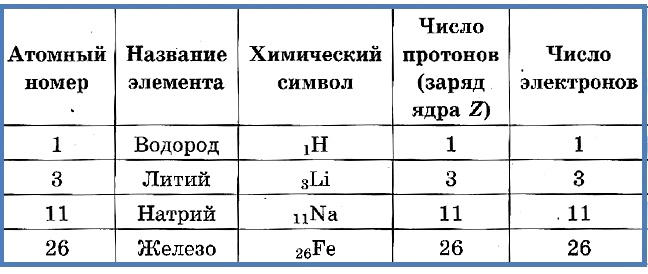
Число протонов разное у атомов различных видов, оно определяет заряд ядра атома и равно атомному номеру элемента в таблице Менделеева. Поскольку атом — электро-нейтральная частица, число электронов в нем равно числу протонов.
Таблица 2. «Протоны и электроны в атомах»
Атомный номер указывают слева внизу от символа элемента, например: 1Н, 26Fe. Обозначение атомного номера — прописная латинская буква Z.
Массовое число атома А — это сумма чисел его протонов и нейтронов в ядре. Массовое число указывают слева вверху от символа элемента или добавляют к названию элемента через дефис, например: 23Na или натрий-23.
Массовое число кислорода, А(16О) = 16 = (8р + 8n).
Число нейтронов N в ядре атома определяют по формуле: N = A — Z. Например, для атома натрия с массовым числом 23, 23Na: А = 23, Z = 11, N = А – Z = 23 — 11 = 12.
Нуклид — это вид атомов с определенным числом протонов и нейтронов в ядре. Например, в природе встречается три вида нуклидов кислорода: 16О, 17О и 18О.
Изотопы — это атомы одного вида с одинаковым числом протонов, но разным числом нейтронов. Так, атомы 16О, 17О и 18О — это изотопы. Природные изотопы урана — 234U, 235U и 238U.
Ионы — заряженные частицы, образующиеся при отщеплении от нейтральных атомов или присоединении к ним электронов. Ионы образуются также из молекул в результате присоединения протона Н+ (NH3 → NH4+) или отщепления Н+ (HNO3 -> NO3–).
Таблица 3. «Обозначение и название ионов»
Катионы — это положительно заряженные ионы (Na+, Аl3+), анионы — отрицательно заряженные ионы (Cl–, NO3–).
Заряд иона указывают в виде индекса справа вверху от символа химического элемента: Li+ , Са2+. На первом месте пишут цифру, на втором — знак заряда. Цифру 1 не пишут.
Конспект урока по химии «Строение атома».