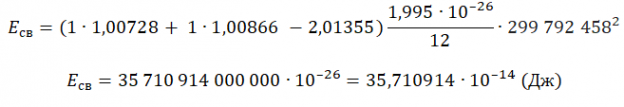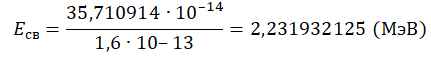Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 ноября 2019 года; проверки требуют 4 правки.
Ма́ссовое число́ атомного ядра — суммарное количество протонов и нейтронов (называемых общим термином «нуклоны») в ядре. Обычно обозначается буквой A. Массовое число близко к атомной массе изотопа, выраженной в атомных единицах массы, но совпадает с ней только для углерода-12, поскольку атомная единица массы (а. е. м.) определяется сейчас как 1⁄12 массы атома 12С. Во всех остальных случаях атомная масса не является целым числом, в отличие от массового числа. Так, массовое число изотопа хлора 35Cl равно 35, а его атомная масса составляет 34,96885 а.е.м.
Массовое число в обозначении конкретного нуклида (вида атомных ядер) пишется верхним левым индексом, например 232Th. Нуклиды с одинаковым массовым числом называются изобарами (например, изобарами являются нуклиды 14C и 14N).
Знание массового числа позволяет оценить массу ядра и атома. Если известно массовое число, то масса М атома и его ядра оценивается из следующего соотношения М ≈ А·mN, где mN ≈ 1,67·10−27 кг — масса нуклона, то есть протона или нейтрона. Например, в состав атома алюминия-27 и его ядра входит 27 нуклонов (13 протонов и 14 нейтронов). Его масса примерно равна 27·1,67·10−27 кг ≈ 4,5·10−26 кг. Если необходимо получить массу ядра с большей точностью, то нужно учесть, что нуклоны в ядре связаны силами ядерного притяжения, и поэтому в соответствии с соотношением E = mc2 масса ядра уменьшается. В массу атома также следует добавить суммарную массу электронов на орбитах вокруг ядра. Однако все эти поправки не превышают 1 %[1].
Массовое число совпадает с барионным числом ядра. Барионное число сохраняется во всех известных процессах, поэтому любые радиоактивные распады и ядерные реакции не приводят к изменению суммы массовых чисел ядер в левой и правой части реакции. Например, при альфа-распаде урана-238
в левой части массовое число начального ядра равно 238, в правой части реакции — два ядра с массовыми числами 234 и 4, что в сумме даёт 238. С учётом того, что массовое число альфа-частицы (ядра гелия-4) равно 4, альфа-распад снижает массовое число распадающегося ядра на 4 единицы. Любые типы бета-распада (бета-минус-распад, позитронный распад, электронный захват, все типы двойного бета-распада) не изменяют массовое число, поскольку в этом процессе происходит лишь превращение некоторых нуклонов ядра из одного вида в другой (протонов в нейтроны или обратно). Изомерный переход также не изменяет массовое число ядра.
Примечания[править | править код]
- ↑ «Ишханов Б. С., Капитонов И. М., Кэбин Э. И., Частицы и атомные ядра. Основные понятия, Изд. МГУ, Москва, 2009, 271 с., тираж 100 экз.» Дата обращения: 15 февраля 2011. Архивировано 25 ноября 2012 года.
Согласно протонно-нейтронной модели строения атомного ядра, заряд ядра должен быть равен сумме зарядов всех протонов, которые входят в его состав. Так как заряд протона равен элементарному заряду, то можно считать, что:
(q) — заряд ядра,
(e) — элементарный заряд,
()
Z
() — количество протонов в ядре.
Количество протонов в ядре
Z
называется зарядовым числом атомного ядра.
Экспериментально было доказано, что число Z совпадает с порядковым номером химического элемента в Периодической системе Менделеева.
Обрати внимание!
Количество протонов в ядре атома совпадает с номером химического элемента в Периодической системе химических элементов и называется зарядовым числом (
Z
).
Массовое число
Количество нейтронов в ядре атома принято обозначать N. Тогда количество протонов и нейтронов в ядре атома можно вычислить как:
A=Z+N.
— количество нуклонов в атоме называется массовым числом.
Изотопы
Химические свойства атома определяются зарядовым числом, так как это число указывает на номер атома в периодической системе, т. е. определяет, какой именно это химический элемент. Физические свойства атома могут быть разными в зависимости от массового числа. Действительно, экспериментально было доказано, что ядра одного и того же химического элемента могут обладать разными массами. Например, в природе существует несколько видов атомов водорода: водород, дейтерий и тритий. Масса дейтерия приблизительно в два, а трития — в три раза больше массы водорода.
Атомы одного и того же химического элемента, но с разными массами, называются изотопами.
Так как изотопы — это атомы одного и того же химического элемента, то зарядовое число у изотопов одинаковое, а массовые числа различные. Это означает, что ядра изотопов содержат одинаковое число протонов и разное количество нейтронов.
Изотопы принято обозначать:
XZA, где
XZA — химический элемент,
A — массовое число,
Z — зарядовое число.
Пример:
— водород,
H12
— дейтерий,
H13
— тритий.
Содержание
- Примеры массовых чисел
- Водород
- Кислород
- Углерод
- Уран
- Как получить массовое число?
- Обозначения для атомов
- Изотопы
- Изотопы углерода
- Таблица природных изотопов углерода
- Примеры работы
- – Пример 1
- Ответить
- – Пример 2
- Ответить
- Ссылки
В массовое число Массовое число атома – это сумма количества протонов и количества нейтронов в ядре. Эти частицы взаимозаменяемо обозначаются именем нуклоны, поэтому массовое число представляет их количество.
Пусть N – количество присутствующих нейтронов, а Z – количество протонов, если мы назовем A массовым числом, тогда:
А = N + Z
Примеры массовых чисел
Вот несколько примеров массовых чисел для хорошо известных элементов:
Водород
Самый стабильный и многочисленный атом водорода также самый простой: 1 протон и один электрон. Поскольку ядро водорода не имеет нейтронов, верно, что A = Z = 1.
Кислород
В ядре кислорода 8 нейтронов и 8 протонов, поэтому A = 16.
Углерод
Жизнь на Земле основана на химии углерода, легкого атома с 6 протонами в ядре плюс 6 нейтронов, поэтому A = 6 + 6 = 12.
Уран
Этот элемент, намного тяжелее предыдущих, хорошо известен своими радиоактивными свойствами. В ядре урана 92 протона и 146 нейтронов. Тогда его массовое число A = 92 + 146 = 238.
Как получить массовое число?
Как упоминалось ранее, массовое число A элемента всегда соответствует сумме числа протонов и числа нейтронов, содержащихся в его ядре. Это тоже целое число, но … есть ли какое-нибудь правило относительно соотношения между двумя величинами?
Посмотрим: все перечисленные элементы легкие, кроме урана. Атом водорода, как мы уже сказали, самый простой. В нем нет нейтронов, по крайней мере, в его наиболее распространенной версии, а в кислороде и углероде есть равное количество протонов и нейтронов.
То же самое происходит и с другими легкими элементами, такими как азот, еще один очень важный для жизни газ, который имеет 7 протонов и 7 нейтронов. Однако по мере того, как ядро становится более сложным, а атомы становятся тяжелее, количество нейтронов увеличивается с другой скоростью.
В отличие от легких элементов, уран с 92 протонами имеет примерно в 1 ½ раза больше нейтронов: 1 ½ x 92 = 1,5 x 92 = 138.
Как видите, это довольно близко к 146 – количеству нейтронов, которое он имеет.
Все это становится очевидным на кривой на рисунке 2. Это график зависимости N от Z, известный каккривая ядерной устойчивости. Там вы можете увидеть, как легкие атомы имеют такое же количество протонов, что и нейтроны, и как с Z = 20 количество нейтронов увеличивается.
Таким образом, большой атом становится более стабильным, так как избыток нейтронов уменьшает электростатическое отталкивание между протонами.
Обозначения для атомов
Очень полезная запись, которая быстро описывает тип атома, следующая: символ элемента и соответствующие атомные и массовые числа записываются, как показано ниже на этой диаграмме:
В этих обозначениях атомы в предыдущих примерах будут:
Иногда используются другие более удобные обозначения, в которых для обозначения атома используются только символ элемента и массовое число, без атомного номера. Таким образом, 12 6C просто записывается как углерод-12, 16 8Или кислород – 16 и так далее для любого элемента.
Изотопы
Число протонов в ядре определяет природу элемента. Например, каждый атом, ядро которого содержит 29 протонов, является атомом меди, несмотря ни на что.
Предположим, атом меди по какой-то причине теряет электрон, это все равно медь. Однако теперь это ионизированный атом.
Атомному ядру сложнее получить или потерять протон, но в природе это может происходить. Например, внутри звезд более тяжелые элементы непрерывно образуются из легких элементов, поскольку звездное ядро ведет себя как термоядерный реактор.
И прямо здесь, на Земле, есть феномен радиоактивный распад, в котором некоторые нестабильные атомы изгоняют нуклоны и излучают энергию, превращаясь в другие элементы.
Наконец, существует вероятность того, что атом определенного элемента имеет другое массовое число, в данном случае это изотоп.
Хороший пример – всем известный углерод-14 или радиоуглерод, который используется для датировки археологических объектов и как биохимический индикатор. Это тот же углерод с идентичными химическими свойствами, но с двумя дополнительными нейтронами.
Углерод-14 менее распространен, чем углерод-12, стабильный изотоп, а также радиоактивен. Это означает, что со временем он распадается, выделяя энергию и частицы, пока не станет стабильным элементом, которым в его случае является азот.
Изотопы углерода
Углерод существует в природе как смесь нескольких изотопов, наиболее распространенными из которых являются уже упомянутые 126С или углерод-12. А кроме углерода-14 есть 136C с дополнительным нейтроном.
Это обычное явление в природе, например, известно 10 стабильных изотопов олова. С другой стороны, из бериллия и натрия известен только один изотоп.
Каждый изотоп, природный или искусственный, имеет разную скорость превращения. Таким же образом можно создавать искусственные изотопы в лаборатории, которые, как правило, нестабильны и радиоактивно распадаются за очень короткий период долей секунды, в то время как для других требуется гораздо больше времени, равное возрасту Земли или больше.
Таблица природных изотопов углерода
| Изотопы углерода | Атомный номер Z | Массовое число A | Изобилие% |
|---|---|---|---|
| 12 6 C | 6 | 12 | 98.89 |
| 13 6 C | 6 | 13 | 1.11 |
| 14 6 C | 6 | 14 | Следы |
Примеры работы
– Пример 1
В чем разница между137 N и 147 N?
Ответить
Оба являются атомами азота, так как их атомный номер равен 7. Однако один из изотопов с A = 13 имеет на один нейтрон меньше, а 147 N – самый распространенный изотоп.
– Пример 2
Сколько нейтронов находится в ядре атома ртути, обозначаемого как 20180 Hg?
Ответить
Поскольку A = 201 и Z = 80, а также зная, что:
А = Z + N
N = А – Я = 201 – 80 = 121
И делается вывод, что в атоме ртути 121 нейтрон.
Ссылки
- Коннор, Н. Что такое нуклон – Структура атомного ядра – Определение. Получено с: period-table.org.
- Найт, р. 2017. Физика для ученых и инженерии: стратегический подход. Пирсон.
- Сирс, Земанский. 2016. Университетская физика с современной физикой. 14-го. Ред. Том 2.
- Типпенс, П. 2011. Физика: концепции и приложения. 7-е издание. Макгроу Хилл.
- Википедия. Массовое число. Получено с: en.wikipedia.org.
Когда Резерфорд опровергнул модель Томсона о строении атома, возник другой вопрос: из чего состоит ядро? Ответ на этот вопрос был получен спустя пару десятков лет. До этого в качестве элементарного ядра принимали протон — положительную частицу, которая имеет заряд, по модулю равный заряду электрона: е = 1,6*10-19 Кл. Масса же частицы равна 1,6726 · 10−27 кг.
Изотопы
В результате наблюдения огромного числа радиоактивных превращений было обнаружено, что существуют вещества, идентичные по химическим свойствам, но имеющие совершенно различные радиоактивные свойства — в одних и тех же условиях их распад происходил по-разному. Эти вещества не удавалось разделить ни одним из известных химических способов. Поэтому английский радиохимик Содди в 1911 г. высказал предположение о возможности существования элементов с одинаковыми химическими свойствами, но разной радиоактивностью. Эти элементы, по его мнению, нужно было помещать в одну и ту же клетку периодической системы Д. И. Менделеева. Содди назвал такие элементами изотопами (т. е. занимающими одинаковые места).
Предположение Содди о существовании веществ с разной радиоактивностью, но одинаковыми химическими свойствами, было подтверждено экспериментально. Когда английский физик Томсон проводил точные измерения массы ионов неона методом отклонения их в электрическом и магнитном полях, он установил, что неон есть смесь двух видов атомов. Большая часть атомов имела относительную массу 20, но некоторая часть атомов имела массу, равную 22 а. е. м. В результате относительная атомная масса смеси атомов неона была принята равной 20,2. Причем атомы обладали одинаковыми химическими свойствами, но масса их была различна.
С тех пор изотопы были обнаружены у разных химических элементов. Так, они есть у самого тяжелого из существующих в природе элементов — урана (относительные атомные массы 238, 235 и др.) и у самого легкого — водорода (относительные атомные массы 1, 2, 3).
Было установлено, что:
- Изотопы имеют разную массу.
- Заряды ядер изотопов одинаковы;
- Количество электронов у атомов изотопов одинаково.
- Химические свойства изотопов тоже одинаковые.
- Радиоактивность у изотопов разная — ядра одних атомов радиоактивны, в то время как другие могли быть стабильными или менее радиоактивными.
Эти обобщения помогли сделать вывод, что свойства радиоактивности изотопов зависят от их массы. Причем некоторые элементы могут иметь только нестабильные, или радиоактивные изотопы.
Особый интерес для физиков того времени представлял атом водорода, изотопы которого могли отличаться по массе в 2 и 3 раза:
- Дейтерий — изотоп водорода с атомной массой 2. Это стабильный химический элемент, который можно обнаружить в качестве примеси в обычном водороде. На 4500 атомов обычного водорода приходится 1 атом дейтерия. Совместно с кислородом дейтерий образует тяжелую воду. Ее свойства несколько отличаются от обычной воды. Так, при нормальном атмосферном давлении ее температура кипения составляет 101,2 °С, а температура кристаллизации — 3,8 °С.
- Тритий — изотоп водорода с атомной массой 3. Это нестабильный химический элемент. Он претерпевает β-распад. Период полураспада этого вещества составляет 12 лет.
Существование изотопов доказывает, что заряд атомного ядра определяет не все свойства атома, а лишь его химические свойства и те физические свойства, которые зависят от периферии электронной оболочки, например размеры атома. Масса же атома и его радиоактивные свойства не определяются порядковым номером в таблице Д. И. Менделеева.
Открытие нейтрона
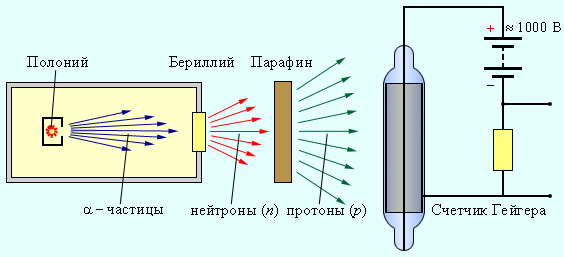
При бомбардировке бериллия α-частицами, испускаемыми нестабильным полонием, возникает сильное проникающее излучение, которое легко преодолевает преграду в виде слоя свинца толщиной до 10–20 см. Это излучение изучали английский физик Чедвик и супруги Жолио-Кюри Ирен и Фредерик из Франции независимо друг от друга примерно в одно и то же время. Ученые предположили, что это излучение создано γ-лучами большой энергии. Но затем выяснилось, что если на пути излучения бериллия поставить пластинку из парафина, то ионизирующая способность излучения резко возрастает.
Было установлено, что излучение бериллия выбивает из парафиновой пластинки протоны, которые в большом количестве имеются в этом веществе. Ученые рассчитали длину свободного пробега протонов в воздухе они оценили энергию γ-квантов, которые сообщают при столкновении с протонами необходимую скорость. Расчеты показали слишком большое значение — 50 МэВ. протонам необходимую скорость. Она оказалась огромной – порядка 50 МэВ. Из-за малой массы γ-кванты не могли обладать такой энергией. Поэтому Чедвик сделал вывод, что из бериллия под действием α-частиц вылетают не безмассовые γ-кванты, а довольно тяжелые частицы. Эти частицы обладали большой проникающей способностью и не ионизировали газ в счетчике Гейгера. Это значит, что такие частицы были электрически нейтральными. Этой частице дали название — нейтрон.
Нуклонная модель атома
Сразу после открытия нейтрона несколько физиков одновременно высказали идею протонно-нейтронной, или нуклонной, модели ядра. Согласно этой модели ядро состоит из протонов и нейтронов. Будучи «кирпичиками», из которых строится ядро, протоны и нейтроны получили общее название — нуклоны.
Нуклоны — общее название для составляющих атомное ядро протонов и нейтронов.
В рамках нуклонной теории о строении ядра атома ему было дано следующее определение:
Атомное ядро — центральная часть атома, состоящая из протонов и нейтронов.
Виды нуклонов:
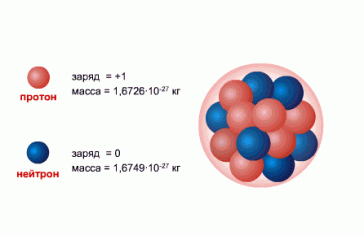
- Протон (от protos — первый, обозначается как p или p+) — стабильная элементарная частица, ядро атома водорода. Заряд протона положительный, по модулю он равен заряду электрона: ep = 1.6∙10−19 Кл. Масса протона: mp = 1.6726231∙10−27 кг = 1.007276470 а. е. м. При расчетах часто используют округленное до целых значение: 1 а. е. м.
- Нейтрон (от лат. neuter — ни тот, ни другой, обозначается как n) — элементарная частица, не имеющая заряда, т. е. нейтральная. Масса нейтрона почти равна (незначительно больше) массе протона: mn = 1.6749286∙10−27 кг=1.0008664902 а. е. м. При расчетах также используют округленное до целых значение: 1 а. е. м.
Массовое число — общее число нуклонов в ядре. Обозначается как A.
Зарядовое число — число протонов в ядре. Обозначается как Z. Зарядовое число всегда соответствует порядковому номеру элемента в периодической таблице Менделеева.
Ядро любого химического в общем виде обозначается так:
AZX
где X — символ химического элемента, Z — число протонов в ядре (порядковый номер элемента в периодической таблице Менделеева), A — массовое число.
Массовое число определяется как сумму протонов и нейтронов, содержащихся в ядре атома:
A=Z+N
N – число нейтронов в ядре.
Пример №1. Пользуясь периодической системой элементов Д.И. Менделеева, определите число протонов и число нейтронов в ядрах атомов серы.
Взглянем на периодическую систему Менделеева и найдем серу:
Порядковый номер серы — 16. Следовательно, зарядовое число, или количество протонов в ядре атома серы — 16. Массовое число составляет 32,066 а. е. м. Округлим до целых и получим 32. Количество нейтронов найдем как разность массового и зарядового чисел:
N=A−Z=32−16=16
Ядерные силы
Ядра атомов обладают устойчивостью, несмотря на то, что между протонами действуют колоссальные силы кулоновского отталкивания. Чем же объясняется это явление? Видимо, между ними существует и другая сила, которая не дает протонам отталкиваться друг от друга. Такие силы назвали ядерными.
Ядерные силы — силы, действующие между протонами и нейтронами.
Ученые установили, что ядерные силы обладают следующими свойствами:
- Ядерные силы заметно проявляются только на расстояниях, сравнимых с размером атомных ядер (10–12–10–13 см). То есть, эти силы являются короткодействующими.
- Ядерные силы примерно в 100 раз превосходят силы электрического взаимодействия. На сегодня это самые мощные силы из всех сил, известных в природе. Именно благодаря им ядра атомов химических элементов сохраняются в устойчивом состоянии.
Энергия связи атомных ядер
Нуклоны в ядре прочно удерживаются ядерными силами. Если совершить работу по их преодолению, придется совершить некоторую работу. Энергию, которую нужно затратить для совершения работы по разделению на отдельные нуклоны, называют энергией связи ядра.
Энергия связи ядра атома — энергия, которая необходима для полного расщепления ядра на отдельные протоны и нейтроны.
На основании закона сохранения энергии можно сделать вывод, что энергия связи равна той энергии, которая выделяется при образовании ядра из отдельных частиц.
В настоящее время рассчитать энергию связи теоретически, подобно тому, как это можно сделать для электронов в атоме, не удается. Выполнить соответствующие расчеты можно, лишь применяя соотношение Эйнштейна между массой и энергией:
Е = mс2
Измерения масс ядер показали, что масса покоя ядра всегда меньше суммы масс входящих в его состав протонов и нейтронов:
Mя< Zmp + Nmn
Mя — масса покоя ядра, Z — число протонов, N — число нейтронов, mp — масса протона, mn — масса нейтрона.
На основании этого был сделан вывод о существовании дефекта (разности масс). Дефект масс определяется разностью суммы масс протонов и нейтронов, входящих в состав ядра, и массы покоя ядра атома:
ΔM=Zmp + Nmn−Mя
ΔM — дефект масс.
Это интересно! Масса ядра атома гелия на 0,75% меньше суммы масс двух протонов и двух нейтронов. Соответственно для гелия в количестве вещества один моль ΔM = 0,03 г.
Уменьшение массы при образовании ядра из нуклонов означает, что при этом уменьшается энергия этой системы нуклонов на значение энергии связи Есв.
Энергия связи — это энергия, которая выделяется при образовании ядра из отдельных частиц, и соответственно это та энергия, которая необходима для расщепления ядра на составляющие его частицы.
Энергия связи определяется формулой:
Eсв=ΔMс2=(Zmp + Nmn−Mя)с2
Это интересно! Энергия связи настолько велика, что образование 4 г гелия сопровождается выделением такой же энергии, что и при сгорании 1,5—2 вагонов каменного угля.
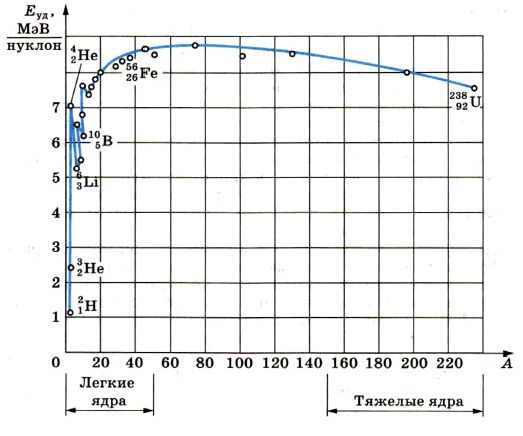
Важную информацию о свойствах ядер содержит зависимость удельной энергии связи от массового числа А.
Удельная энергия связи — энергия связи, приходящаяся на один нуклон ядра.
Удельную энергию связи устанавливают опытным путем. Из рисунка ниже видно, что, не считая самых легких ядер, удельная энергия связи примерно постоянна и равна 8 МэВ/нуклон. Примечательно, что энергия связи электрона и ядра в атоме водорода, равная энергии ионизации, почти в миллион раз меньше этого значения. Кривая на имеет слабо выраженный максимум. Максимальную удельную энергию связи (8,6 МэВ/нуклон) имеют элементы с массовыми числами от 50 до 60, т. е. железо и близкие к нему по порядковому номеру элементы. Ядра этих элементов наиболее устойчивы.
У тяжелых ядер удельная энергия связи уменьшается за счет возрастающей с увеличением Z кулоновской энергии отталкивания протонов. Кулоновские силы стремятся разорвать ядро.
Пример №2. Чему равна энергия связи ядра тяжелого водорода — дейтрона? Атомная масса ядра дейтрона mD = 2,01355 а. е. м, протона mр = 1,00728 а. е. м, нейтрона mn = 1,00866 а. е. м; масса атома углерода mс = 1,995 ∙ 10-26 кг.
Eсв=(Zmp + Nmn−Mя)с2
Зарядовое число водорода — 1. Количество нейтронов — 1. Чтобы найти суммарную массу всех частиц и ядра, нужно их массу в а. е. м. умножить на массу атома углерода в кг и поделить на 12. Это необходимо потому, что 1 а. е. м. равна 1/12 массы атома углерода. Получим:
Переведем в МэВ, учитывая, что 1 МэВ = 1,6∙10–13 Дж:
Задание EF17709
Какая из строчек таблицы правильно отражает структуру ядра 49115 In?
Алгоритм решения
- Установить, чем определяются количество протонов и нейтронов.
- Определить, сколько содержится в атоме протонов.
- Определить, сколько содержится в атоме нейтронов.
Решение
Протоны и нейтроны — нуклоны. Общее их количество является массовым числом A, которое указывается слева от обозначения химического элемента в верхнем индексе. В данном случае A = 115.
Зарядовое число — порядковый номер химического элемента в периодической системе Менделеева. Оно обозначается Z и равно количеству протонов в ядре. В нашем случае Z = 49. Значит, протонов 49.
Чтобы посчитать количество нейтронов, нужно из массового числа вычесть зарядовое число: 115 – 49 = 66. Значит, нейтронов 66. Строка 1 подходит.
Ответ: 1
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17974
Связанная система элементарных частиц содержит 14 нейтронов, 13 протонов и 10 электронов. Эта система частиц является
Ответ:
а) ионом алюминия 1327Al
б) нейтральным атомом кремния 1427Si
в) ионом кремния 1427Si
г) нейтральным атомом алюминия 1327Al
Алгоритм решения
- Определить, перед нами ион или нейтральный атом.
- Установить зарядовое число.
- Установить массовое число.
- Выбрать подходящий ответ.
Решение
Согласно условию задачи, в связанной системе элементарных частиц содержится 14 нейтронов, 13 протонов и 10 электронов. В нейтральном атоме количество электронов равно количеству протонов. В нашем случае электронов на 3 меньше. Значит, перед нами ион.
Зарядовое число соответствует количеству протонов. Их 13.
Массовое число равно сумме количества протонов и электронов: 14 + 13 = 27.
Выходит, перед нами ион алюминия.
Ответ: а
pазбирался: Алиса Никитина | обсудить разбор
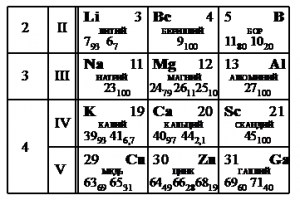
Задание EF18942
На рисунке представлен фрагмент Периодической системы элементов Д.И. Менделеева. Под названием каждого элемента приведены массовые числа его основных стабильных изотопов. При этом нижний индекс около массового числа указывает (в процентах) распространённость изотопа в природе.
Укажите число протонов и число нейтронов в ядре наименее распространённого из указанных стабильных изотопов меди.
Алгоритм решения
- Найти наименее распространенный изотоп меди.
- Выписать для него массовые и зарядовые числа.
- Найти число протонов и нейтронов.
Решения
Наименее распространен изотоп меди Cu-65, поскольку возле его массового числа стоит меньший индекс — 31.
Массовое число этого изотопа — 65. Зарядовое число соответствует порядковому номеру — 29.
Количество протонов соответствует зарядовому числу. Их 29.
Количество нейтронов есть разность массового и зарядовых чисел: 65 – 29 = 36.
Эти числа запишем последовательно: 2936.
Ответ: 2936
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 1.8k
Практически сразу после
открытия нейтрона советским физиком Дмитрием Иваненко и немецким учёным
Вернером Гейзенбергом была предложена протонно-нейтронная модель атомного ядра.
Согласно ей, ядра всех химических элементов (за исключением водорода) состоят
из двух видов частиц: протонов и нейтронов. Протоны и нейтроны называют
нуклонами (от латинского «нуклеус» — ядро), а ядра атомов — нуклидами.
Общее число нуклонов в ядре
называют массовым числом и обозначают
буквой А. Оно ставится вверху перед буквенным обозначением химического
элемента.
Например, массовое число
кислорода равно 16, а углерода — 12.
Мы уже говорили о том, что массовое
число принято выражать в атомных единицах массы (сокращённо, а. е. м.) и
округлять до целых чисел. Напомним также, что атомную единицу массы
выражают через массу атома углерода; она равна 1/12 части массы атома углерода:
Число протонов в ядре
соответствует порядковому или атомному номеру элемента в таблице Менделеева и
называется зарядовым числом,
поскольку оно определяет заряд ядра. Обозначается зарядовое число буквой Z.
В наших примерах, зарядовое
число кислорода равно восьми, а углерода — 6.
Как видно из приведённых
примеров, зарядовое число ставится внизу перед буквенным обозначением элемента.
Напомним, что заряд протона положителен
и равен элементарному электрическому заряду. Следовательно, зарядовое число
численно равно заряду ядра, выраженному в элементарных электрических зарядах.
Так как атом в целом
электрически нейтрален, то зарядовое число определяет одновременно и число
электронов в атоме.
Число нейтронов в ядре обозначают большой буквой N. Нетрудно
догадаться, что оно равно разнице между массовым и зарядовым числом:
Таким образом, ядро любого
атома обозначается буквенным символом элемента. Вверху указывается значение его
массового числа, а внизу — зарядового.
В общем случае любой
химический элемент периодической таблицы Дмитрия Ивановича Менделеева можно
представить в виде:
где под X
подразумевается символ химического элемента.
Ещё раз уточним, каким образом
определяется число протонов, электронов и нейтронов в ядре атома любого
химического элемента. Во-первых, необходимо посмотреть в таблице Менделеева
порядковый номер интересующего нас химического элемента. Таким образом мы
найдём зарядовое число, то есть количество протонов и электронов в ядре. Затем,
всё в той же таблице, необходимо посмотреть атомную массу этого элемента и
округлить её до целых. Тем самым мы найдём массовое число, то есть общее
количество нуклонов в ядре. И наконец, чтобы определить количество нейтронов в
ядре атома, мы должны будем вычесть из массового числа зарядовое.
На основе новой,
протонно-нейтронной модели строения атомных ядер, было дано объяснение многим
экспериментальным фактам. Так, например, ещё в 1906—1907 годах учёными было
выявлено, что продукт радиоактивного распада урана — ионий и продукт
радиоактивного распада тория — радиоторий имеют те же химические свойства, что
и торий, но отличаются от него атомной массой и характеристиками радиоактивного
распада. При этом атомы обладали одинаковыми химическими свойствами, а отделить
их друг от друга было невозможно никакими химическими методами. Впервые, на
существование таких атомов обратил внимание Фредерик Содди в 1910 году. Он
предложил называть такие разновидности атомов одного и того же химического
элемента изотопами (что по-гречески означает «равноместные»), так как по
своим химическим свойствам они должны быть помещены в одну и ту же клетку
таблицы Менделеева.
На основании многих
экспериментов, было установлено, что изотопы одинаково вступают в химические
реакции и образуют одинаковые соединения. Это говорило о том, что число
электронов в электронных оболочках, а, значит, и заряд ядра у изотопов
одинаковы. Следовательно, ядра изотопов различаются только числом нейтронов.
Иными словами, химические свойства элементов определяются не атомной массой, а
зарядовым числом ядра. Действительно, например, нуклиды водорода-три и гелия-три
имеют близкие по величине атомные массы, но принципиально разные химические
свойства.
Из всех известных на
сегодняшний день изотопов (а они есть у всех химических элементов) только изотопы
водорода имеют названия:
Протий является самым
распространённым изотопом в природе, а его ядро содержит только один протон.
Изотоп дейтерия (его ещё называют тяжёлой водой), содержит в своём ядре один
протон и один нейтрон. Соответственно, у трития — один протон и два нейтрона. В
настоящее время в лабораториях получены изотопы водорода и с большим числом
нейтронов: тремя, четырьмя, пятью и даже шестью.
Следует отметить, что у разных
атомов существует разное количество изотопов. Например, у урана их 26, но
самыми распространёнными в природе являются два — это уран-235 (около 0,7 %), и
уран-238 (чуть более 99 %). Вы, наверное, обратили внимание на то, что мы не
называли зарядового числа изотопов урана. Дело в том, что обычно изотопы
называют по их массовым числам, так как зарядовые числа у них одинаковые.
Отметим, что изотопы бывают
устойчивые (или стабильные) и неустойчивые (то есть радиоактивные). Стабильные
изотопы сохраняются сколь угодно долго.
А нестабильные изотопы со
временем превращаются в другие химические элементы в результате радиоактивных
превращений.
В настоящее время известно
около 280 стабильных изотопов химических элементов и более 2 тыс. радиоактивных
изотопов.
Как правило, природные
элементы представляют собой смесь нескольких изотопов, поэтому возникает
задача их разделения. Как мы уже знаем, магнитное поле искривляет траекторию
движения заряженных частиц. На этом свойстве магнитного поля основано действие
устройства, называемого масс-спектрографом, который используется для
разделения изотопов по массовому числу.
Закрепления материала.
В заключении отметим, что предложенная
Иваненко и Гейзенбергом протонно-нейтронная модель строения ядра впоследствии
полностью была подтверждена экспериментально. Однако оставался нерешённым ещё
один вопрос: почему ядра атомов не распадаются на отдельные нуклоны?
Действительно, ведь мы знаем, что ядра атомов являются весьма устойчивыми
образованиями, хотя в их состав входят одинаково заряженные частицы — протоны.
А поскольку размеры ядер очень малы, то между протонами должны существовать
огромные силы электрического отталкивания — порядка 230 ньютонов, что для
частиц с массой порядка 10–27 степени килограмм является очень
большой силой. Поэтому возникает вопрос: какое взаимодействие препятствует
взаимному отталкиванию между одноимённо заряженными частицами?
Мы знаем, что, кроме
электромагнитных сил, в природе существуют также гравитационные силы. Может
быть, стабилизирующую роль в ядрах играет именно гравитационное взаимодействие
между нуклонами?
Нет, так как расчёты
показывают, что сила гравитационного притяжения между двумя протонами в ядре
пренебрежимо мала по сравнению с силой электростатического отталкивания. Этот
результат позволяет сделать вывод о том, что между ядерными частицами,
по-видимому, действуют силы особой природы, радикально отличающиеся от
гравитационных и электромагнитных сил. Эти силы принято называть ядерными
силами. А так как ядерное взаимодействие во много раз превосходит
электромагнитное, то его ещё называют сильным взаимодействием.
Другой особенностью ядерных
сил является то, что они очень быстро убывают с увеличением расстояния между
ядерными частицами. Проще говоря, они действуют на расстояниях, сравнимыми с
размерами самих ядер.