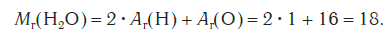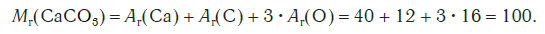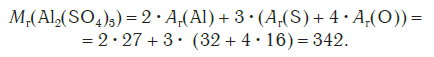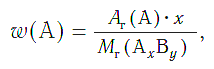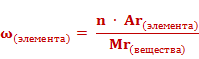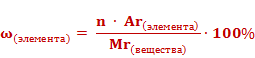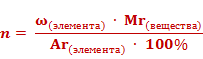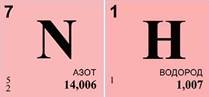За окном – дождь и пронизывающий ветер. Холодно. В такую погоду музы особенно активны. Они слетаются в гости и садятся ко мне на плечо. На правое. Сразу все. И, свесив ноги, начинают болтать друг с другом. Я им уже не нужна. Ребята, о чем это вы? Мне, как и вам, тоже хочется чая с имбирем. И шоколада. И венских вафель. Но я обещала написать статью (и не одну) о массовой доле элемента. Такие расчеты очень важны для развития логических основ алгоритмики. Умение определять массовую долю (или компоненты системы по известной массовой доле) пригодится и во время учебы в медицинском, и во врачебной практике. Поэтому, берем тетрадку, ручку, карандаш и ластик, читаем статью и записываем вместе со мной решение задач. Вначале, как всегда, теория практики. Разберемся с основными понятиями.
Доля – часть чего-нибудь (толковый словарь С.И. Ожегова)
Массовая доля – число, показывающее отношение массы части к общей массе целого или по-другому, отношение массы компонента системы к массе всей системы. Эта величина обозначается греческой буквой “омега” и может выражаться в долях единицы или в процентах.
Например, мы купили у бабули на рынке ведро яблок и груш общей массой 10 кг. Дома разделили фрукты на две кучки. Масса груш составила 3 кг. Значит, массовая доля груш 3/10 = 0,3 (30%). Вспомнили, как рассчитать массовую долю? Отлично! Поехали дальше.
Массовая доля элемента в соединении – число, показывающее, какую часть составляет масса всех атомов данного элемента в молекуле вещества от общей массы молекулы, определяется отношением массы атомов к массе молекулы. Разберемся на примере конкретной задачи
Задача 1
Определите массовую долю железа в оксиде железа (III)
Записываем формулу массовой доли в общем виде, затем конкретизируем ее. Читаем внимательно и следим за моими руками. Массовая доля элемента в соединении определяется отношением массы атомов (числитель) к массе молекулы (знаменатель), то есть:
1) в числителе мы работаем с атомами того элемента, чью массовую долю определяем, для этого умножаем атомную массу элемента (молярная масса атомов) на число атомов этого элемента
2) в знаменателе мы записываем молярную массу вещества
Это очень легкая прямая задача. Попробуем решить обратные задачи – по известной массовой доле определяем неизвестный элемент (вернее, его атомную массу), либо неизвестное число атомов углерода в общей формуле класса органических веществ.
Задача 2
Соединение элемента имеет формулу Э2О3, массовая доля элемента в нем 68,42%. Установите элемент.
Для определения неизвестного элемента необходимо рассчитать его атомную массу (молярную массу атомов), а затем по Периодической системе химических элементов Д.И. Менделеева по атомной массе определяем химический элемент.
Алгоритм решения задачи строим на основании алгебраической формулы определения массовой доли элемента в соединении. Атомную массу элемента обозначаем как неизвестное Х. В числителе записываем массу атомов того элемента, чья массовая доля представлена в условии, в знаменателе – молярную массу вещества в общем виде. Решаем уравнение. По рассчитанной атомной массе определяем элемент. Это хром. Записываем формулу и называем вещество.
Задача 3
Оксид неизвестного пятивалентного элемента содержит 56,34% кислорода. Определите этот элемент.
Задача 4
Массовая доля водорода в алкине CnH2n-2 составляет 12,2 %. Определите число атомов углерода
Алгоритм решения задачи строим на основании алгебраической формулы определения массовой доли элемента в соединении. В числителе записываем массу атомов того элемента, чья массовая доля представлена в условии, в знаменателе – молярную массу вещества в общем виде. Решаем уравнение, определяем неизвестное n, записываем формулу, называем вещество. Это гексин.
Задача 5
Массовая доля водорода в молекуле алкина CnH2n-2 равна 11,11 %. Определите число атомов углерода
Если вы думаете, что все так просто, вы очень и очень ошибаетесь. То ли еще будет! Гораздо более веселые задачи вас ожидают в следующей статье – “Массовая доля элемента в соединении”. Но это будет завтра. Сегодня музы устали от пустой болтовни и улетели в теплые края. А я, довольная проделанной работой, иду пить чай с имбирем, лимоном и медом! Чего и вам желаю.
Приходите ко мне на занятия, и вы будете поражены тем, что всего за ТРИ ЧАСА сможете усвоить объем знаний, намного превышающий тот, который вам вкладывали в голову на протяжении ТРЕХ ЛЕТ! Занятие будет проходить динамично, интересно, весело, но главное, РЕЗУЛЬТАТИВНО! Вы блестяще сдадите ЕГЭ по химии и станете студентом престижного медицинского ВУЗа!
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы “Решение задач по химии” – и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте, или на Facebook. Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
найди число атомов каждого элемента в молекуле оксида углерода, если массовая доля углерода в нём равна (42,86) %, а массовая доля кислорода — (57,14) %.
1. Примем массу оксида равной (100) г. Масса углерода в такой порции равна (42,86) г, а масса кислорода — (57,14) г.
2. Находим относительные атомные массы элементов в Периодической таблице:
3. Обозначаем число атомов углерода как (x), а число атомов кислорода — (y), и записываем отношение масс:
.
4. Получаем выражение:
5. Находим отношение (x : y):
.
В молекуле оксида углерода на (1) атом углерода приходится (1) атом кислорода.
В уроке 7 «Относительная молекулярная и относительная формульная массы» из курса «Химия для чайников» научимся вычислять относительную молекулярную массу, а также относительную формульную массу веществ; кроме того, выясним что такое массовая доля и приведем формулу для ее вычисления. Напоминаю, что в прошлом уроке «Валентность» мы дадим определение валентности, научились ее определять; рассмотрели элементы с постоянной и переменной валентностью, кроме того научились составлять химические формулы по валентности.
Каждый химический элемент характеризуется определенным значением относительной атомной массы. Состав любого вещества выражается молекулярной или простейшей формулой его структурной единицы. Такая структурная единица состоит из определенного числа атомов химических элементов. Поэтому масса структурной единицы может быть выражена в атомных единицах массы.
Содержание
- Относительная молекулярная масса
- Относительная формульная масса
- Вычисление массовой доли химического элемента по формуле вещества
Относительная молекулярная масса
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Mr.
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды H2O:
Относительная молекулярная масса серной кислоты H2SO4:
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными. Значение Мr показывает, во сколько раз масса молекулы данного вещества больше атомной единицы массы u. Например, если Mr(H2O) = 18, это значит, что масса молекулы H2O в 18 раз больше 1/12 части массы атома углерода, т. е. в 18 раз больше атомной единицы массы. Соответственно, масса молекулы H2SO4 в 98 раз больше 1/12 части массы атома углерода.
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr. При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:
Относительная формульная масса вещества Al2(SO4)3 равна:
Относительная формульная масса показывает, во сколько раз масса формульной единицы данного вещества больше 1/12 части массы атома углерода, или атомной единицы массы u.
Вычисление массовой доли химического элемента по формуле вещества
По формуле вещества можно рассчитать массовую долю атомов каждого химического элемента, который входит в состав этого вещества, т. е. определить, какую часть от общей массы вещества составляет масса атомов данного элемента.
Массовая доля (w) атомов химического элемента в веществе показывает, какая часть относительной молекулярной (формульной) массы вещества приходится на атомы данного элемента.
Массовая доля атомов элемента А в сложном веществе АxBy рассчитывается по формуле:
где w («дубль-вэ») — массовая доля элемента А;
Ar(А) — относительная атомная масса элемента А;
х, у — числа атомов элементов А и В в формуле вещества;
Mr(АхBy) — относительная молекулярная (формульная) масса вещества АхBy.
Массовые доли выражаются в долях единицы или в процентах.
Пример. Определите массовые доли элементов в фосфорной кислоте H3PO4
Спойлер
[свернуть]
Краткие выводы урока:
- Относительная молекулярная (формульная) масса вещества — это физическая величина, равная отношению массы молекулы (формульной единицы) вещества к 1/12 части массы атома углерода.
- Эта величина равна сумме относительных атомных масс химических элементов, входящих в состав молекулы (формульной единицы) данного вещества, с учетом числа атомов каждого элемента.
Надеюсь урок 7 «Относительная молекулярная и относительная формульная массы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Содержание:
- § 1 Массовая доля химического элемента
- § 2 Практическое применение расчетов массовой доли элемента
- § 3 Определение формулы исследуемых веществ
§ 1 Массовая доля химического элемента
Относительную молекулярную массу веществ рассчитывают по химическим формулам, выражающим количественный состав веществ. Используя химические формулы можно также вычислить массовую долю каждого элемента в химическом соединении.
Массовая доля элемента (обозначается латинской буквой ω) показывает, какую часть составляет масса всех атомов данного элемента, содержащихся в одной молекуле вещества,
от общей массы молекулы.
Массовые доли элементов могут быть выражены в долях единицы или в процентах. Формула для расчета массовой доли элемента в веществе выглядит так: массовая доля элемента в веществе (ω) элемента равна отношению произведения числа атомов(n) и относительной атомной массы (Ar) данного элемента к относительной молекулярной массе (Mr) вещества.
Если массовую долю рассчитывать в процентах, то формула приобретет следующий вид.
Используя данную формулу, можно рассчитать массовую долю каждого химического элемента в составе сложного вещества.
Например, попробуем рассчитать массовую долю алюминия в оксиде алюминия (Al2O3).
Для расчетов пользуемся данными периодической системы химических элементов. Определим относительную молекулярную массу оксида алюминия. Она будет равна 102 (сумма двух относительных атомных масс алюминия и трех относительных атомных масс кислорода). Массовая доля алюминия в процентном отношении по формуле составит 53%.
§ 2 Практическое применение расчетов массовой доли элемента
Для чего же нужны такие расчеты? Иногда требуется сравнить содержание элементов в веществах.
Например, геологи открыли два месторождения железа. Первое содержит железо в виде оксида железа FeO, второе – в виде сульфида железа FeS. Какое месторождение богаче железом при прочих одинаковых условиях?
Дано:
Формула оксида железа FeO;
формула сульфида железа – FeS.
Найти:
Массовую долю железа в первом месторождении ω1(Fe) и массовую долю железа во втором месторождении ω2(Fe).
Решение:
1. Записываем формулу для расчета массовой доли железа в первом месторождении: ω1(Fe) в оксиде железа равна отношению произведения числа атомов железа n и относительной атомной массы (Ar) железа к относительной молекулярной массе (Mr) оксида железа, умноженное на 100%.
2. Записываем формулу для расчета массовой доли железа во втором месторождении: ω2(Fe)в сульфиде железа равна отношению произведения числа атомов железа n и относительной атомной массы (Ar) железа к относительной молекулярной массе (Mr) сульфида железа, все умноженное на 100%.
Для расчетов пользуемся данными периодической системы химических элементов.
Число атомов железа, кислорода и серы в обоих соединениях равны 1.
3. Рассчитываем относительную молекулярную массу оксида железа. Она равняется 72.
4. Находим относительную молекулярную массу сульфида железа. Она равняется 88.
5. Массовая доля железа в первом месторождении ω1(Fe) = 78%.
6. Массовая доля железа во втором месторождении ω2(Fe)= 64%.
7. Сравниваем значения массовых долей железа. Массовая доля железа в первом месторождении ω1(Fe) больше, чем массовая доля железа во втором месторождении ω2(Fe).
Ответ: Первое месторождение богаче железом.
§ 3 Определение формулы исследуемых веществ
В химических лабораториях на основе результатов анализа химических соединений определяют формулы исследуемых веществ. При этом решают задачи, обратные предыдущей. Например, можно вывести формулу вещества, зная массовые доли его элементов. Для этого преобразуем формулу массовой доли.
Число атомов элемента (n) равно отношению произведения массовой доли элемента в веществе (ω)элемента и относительной молекулярной массы (Mr) вещества к относительной атомной массе (Ar) данного элемента, умноженной на 100%.
Решим задачу. Экспериментально установлено, что вещество содержит 83% азота и 17% водорода. Какова формула этого вещества, если в результате эксперимента получено значение его относительной атомной массы, равное 17?
Дано:
Массовая доля азота ω(N)=83%, массовая доля водорода ω(Н)=17%, относительная молекулярная масса вещества Mr(NxHy)=17.
Найти:
Формулу вещества NxHy, где «x» – число атомов азота, а «у» – число атомов водорода.
Решение:
1. Найдем число атомов азота – х. Оно равняется отношению произведения массовой доли азота ω(N) и относительной молекулярной массы (Mr) вещества к относительной атомной массе (Ar) азота, умноженной на 100%. Получаем единицу.
2. Найдем число атомов водорода – у. Оно равняется отношению произведения массовой доли водорода ω(Н) и относительной молекулярной массы (Mr) вещества к относительной атомной массе (Ar) водорода, умноженной на 100%. Получаем число 3.
3. Так как х=1, а у=3, то формула вещества – NH3 (индекс 1 не пишется).
Для расчетов пользуемся данными периодической системы химических элементов.
4. Произведем проверку, вычислим относительную молекулярную массу полученного вещества. Она равна сумме относительной атомной массы азота и трех относительных атомных масс водорода. Задача решена правильно.
Ответ:формула вещества – NH3.
Список использованной литературы:
- Н.Е. Кузнецова. Химия. 8 класс. Учебник для общеобразовательных учреждений. – М. Вентана-Граф, 2012.