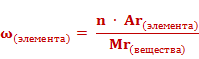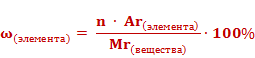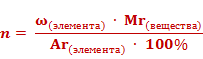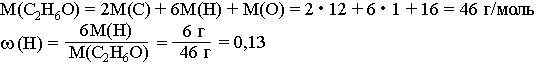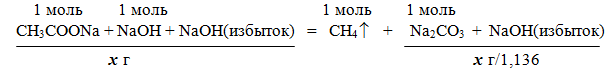Химическая формула соединения рассказывает нам не только о том, из каких элементов состоит вещества, но и о соотношении элементов в веществе. Давайте, например, посмотрим на серную кислоту Н2SO4 и сернистую кислоту H2SO3. Это два разных вещества, хотя оба состоят из водорода Н, серы S и кислорода О. Но из-за того, что соотношения элементов в них разное (в серной кислоте 4 атома кислорода, а в сернистой – 3), свойства у них тоже разные.
Используя химическую формулу, можно узнать и массовую доля элемента в соединении.
Массовая доля элемента в соединении показывает, какую часть составляет масса конкретного элемента от массы вещества.
Чтобы понять это сложное (на первый взгляд сложное, на самом деле оно простое) определения, представьте, что вы принесли из магазина пакет с покупками. В нём батон хлеба, пачка масла, два эскимо и упаковка чипсов. Весит пакет 1 килограмм. Какой вклад в это вносят чипсы? Пусть чипсы весят 50 граммов. Значит, от 1 килограмма (всей массы пакета с покупками) на чипсы приходится всего 50 граммов. Значит, можно посчитать, что чипсы – всего лишь 0,05 часть от всей массы пакета с покупками (50/1000=0,05).
Более удобно вычислять массовую долю в процентах, поэтому можно записать простую пропорцию:
1 килограмм (весь пакет с покупками) – 100%
50 граммов (упаковка чипсов) – Х%
Отсюда Х=50 г*100%/1000 г=5%. То есть массовая доля чипсов в пакете с покупками – 5%.
Теперь перейдём от покупок в супермаркете к химическим формулам.
Пример 1.
Определите массовую долю водорода и хлора в хлориде водорода.
Решение:
Формула хлорида водорода HCl. Чтобы определить массовые доли, нужно посчитать по таблице Менделеева молекулярную массу хлорида водорода. Она составляет 36,5 (1+35,5).
Из формулы мы видим, что в составе молекулы 1 атом водорода и 1 атом хлора. Обязательно обращайте на это внимание! Из примеров ниже будет видно, что это очень важно. Итак, составим пропорцию для определения массовой доли водорода:
36,5 (молекулярная масса соединения) – 100%
1 (атомная масса 1 атома водорода, входящего в соединение) – Х%
Отсюда Х=1*100/36,5=2,7%
Аналогично для хлора:
36,5 (молекулярная масса соединения) – 100%
35,5 (атомная масса 1 атома водорода, входящего в соединение) – Y%
Y=35,5*100/36,5=97,3%.
Таким образом, ответ: в хлориде водорода массовая доля водорода 2,7%, массовая доля хлора 97,3%.
Не лишним будет себя проверить, сложив все массовые доли. В сумме они должны давать 100 процентов. В нашем случае массовая доля водорода 2,7%+массовая доля хлора 97,3%=100%. Значит, мы всё сделали верно.
Пример 2.
Определите массовые доли углерода и кислорода в углекислом газе.
Решение:
Формула углекислого газа СО2. Обратите внимание, что здесь 2 атома кислорода. Это очень важно!
Теперь посчитаем молекулярную массу СО2, используя периодическую таблицу. Она будет равна 44: 12 (атомная масса углерода)+2*16 (атомная масса кислорода, умноженная на 2, потому что в формуле 2 атома кислорода).
Переходим к расчёту массовых долей с помощью пропорций.
Для углерода:
44 (молекулярная масса СО2) – 100%
12 (атомная масса 1 атома углерода) – Х%
Х=12*100/44=27,3%
Для кислорода:
44 (молекулярная масса СО2) – 100%
32 (масса 2 атомов кислорода, входящих в формулу) – Y%
Y=32*100/44=72,7%
Здесь мы взяли не 16 (атомная масса кислорода), а 32 потому, что в формуле СО2 2 атома кислорода. Помните, что выше я обращала на это внимание? Не упускайте это из виду, иначе будут ошибки.
Но ответ мы уже получили: в углекислом газе массовая доля углерода 27,3%, массовая доля кислорода 72,7%. (Проверим себя, сложив массовые доли: 27,3+72,7=100. Значит, всё верно).
Пример 3.
Этот пример от строгого репетитора по химии, который готовит к огэ по химии. Итак, найдите массовые доли алюминия и кислорода в оксиде алюминия.
Решение:
Формула оксида алюминия Al2O3. Не забудьте учесть число атомов алюминия и кислорода (как в примере выше)!
Сначала найдём молекулярную массу оксида алюминия, пользуясь таблицей Менделеева. Атомная масса алюминия 27, атомная масса кислорода 16. Молекулярная масса Al2O3 2*27+3*16 (потому что у нас 2 атома алюминия и 3 атома кислорода)=102.
Рассчитываем массовые доли.
Для алюминия:
102 (молекулярная масса Al2O3) – 100%
54 (масса 2 атомов алюминия, входящих в формулу) – Х%
Х=54*100/102=52,9%
Для кислорода:
102 (молекулярная масса Al2O3) – 100%
48 (масса 3 атомов кислорода, входящих в формулу) – Y%
Y=48*100/102=47,1%
Ответ: в оксиде алюминия массовая доля алюминия 52,9%, массовая доля кислорода 47,1% (проверка: 52,9+47,1=100).
А можно узнать формулу соединения, если известны массовые доли? И сделать это очень просто.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
1. Массовую долю элемента в веществе рассчитывают по формуле:
.
2. Если имеется (1) моль вещества, то его масса равна
.
3. (1) моль вещества содержит (x) моль элемента. Поэтому масса элемента, содержащегося в веществе, равна
m(эл.)=n(эл.)⋅M(эл.)=xмоль⋅Mг/моль
.
4. Подставив массу элемента и массу вещества в формулу ((1)), получим формулу ((2)), которой и воспользуемся для вычисления:
w(эл.)=xмоль(эл.)⋅Mг/моль(эл.)1моль⋅M г/моль(вещества)⋅100
.
Пример:
таким образом, например, расчёт массовой доли углерода в оксиде углерода((IV)) должен выглядеть так:
1. по формуле вещества видно, что (1) моль
CO2
содержит (1) моль химического элемента (C).
2. Если имеется (1) моль
CO2
, то его масса равна
.
3. А (1) моль элемента (C) имеет массу
.
4. Таким образом, массовая доля элемента (C) в
CO2
равна
27,3
%
.
Загрузить PDF
Загрузить PDF
Состав молекулы в массовых процентах – это доля каждого элемента в общей массе молекулы. Массовый процент какого-либо элемента в соединении определяется как отношение массы данного элемента к полной молекулярной массе соединения, умноженное на 100%. Хоть это определение и звучит замысловато, на самом деле определить массовую долю довольно легко!
-
1
Атомы. Материя состоит из атомов, а те, в свою очередь, состоят из протонов, нейтронов и электронов. Атомы – элементарные кирпичики, из которых сложено все, что окружает нас.
-
2
Молекулы. Молекулы – это электрически нейтральные химические соединения двух или большего количества атомов, скрепленных друг с другом химическими связями.
- Например, вода состоит из молекул H2O. Каждая молекула воды включает в себя два атома водорода, соединенных химическими связями с одним атомом кислорода.
-
3
Моли. Моль – это единица измерения количества вещества. Один моль определяется как количество вещества, содержащее 6,02 x10^ 23 элементарных составляющих, и повсеместно используется для выражения количества химических веществ.
- Величина 6,02 x 10^23 примерно равна числу атомов в 12 граммах чистого углерода и называется “числом Авогадро”.
-
4
Химические соединения. Это чистые химические вещества, состоящие из двух или более химических элементов.
- Вода, состоящая из молекул H2O, является химическим веществом.
-
5
Атомная масса. Это масса отдельного атома либо молекулы. Атомная масса выражается в граммах на моль (г/моль).
- Учтите, что атомная масса отличается от атомного веса; она соответствует полной массе частицы (атома или молекулы) в состоянии покоя.
-
6
Молекулярная масса. Это масса отдельной молекулы. Другими словами, это сумма масс всех атомов, входящих в данную молекулу.
- Как и в случае с атомной массой, молекулярная масса отлична от веса молекулы.
Реклама
-
1
Выпишите элементы, входящие в химическое соединение.
- Например, вам необходимо вычислить массовые проценты в лимонной кислоте, имеющей химическую формулу C6H8O7, как показано на рисунке. Молекула кислоты содержит следующие элементы: углерод (C), водород (H) и кислород (O).
-
2
Выпишите атомную массу каждого элемента. Для определения атомных масс используйте периодическую таблицу элементов (таблицу Менделеева). Как правило, атомная масса приведена в этой таблице сразу под символом соответствующего элемента, и выражена в единицах г/моль.
- Для приведенного выше примера находим: атомная масса углерода равна 12,01 г/моль, водорода – 1,00 г/моль, кислорода – 15,99 г/моль.
-
3
Найдите массовый вклад каждого элемента, входящего в соединение. Массовый вклад отдельного соединения равен атомной массе данного элемента, умноженной на количество его атомов в молекуле соединения. Количество атомов каждого элемента в молекуле обозначается числом в подписи, стоящим после символа соответствующего элемента.
- В нашем примере отметим, что молекула лимонной кислоты состоит из 6 атомов углерода, 8 атомов водорода и 7 атомов кислорода. Таким образом, мы можем вычислить массовый вклад каждого элемента, см. рисунок.
Массовый вклад углерода: 6 x 12,01 г/моль = 72,06 г/моль
Массовый вклад водорода: 8 x 1,00 г/моль = 8,00 г/моль
Массовый вклад кислорода: 7 x 15,99 г/моль = 111,93 г/моль
- В нашем примере отметим, что молекула лимонной кислоты состоит из 6 атомов углерода, 8 атомов водорода и 7 атомов кислорода. Таким образом, мы можем вычислить массовый вклад каждого элемента, см. рисунок.
-
4
Вычислите общую молекулярную массу вашего соединения. Общая молекулярная масса равна сумме массовых вкладов каждого элемента, и соответствует массе одной молекулы соединения.
- В нашем примере молекулярная масса рассчитывается так:
Молекулярная масса C6H8O7 = 72,06 г/моль + 8,00 г/моль + 111,93 г/моль = 191,99 г/моль
- В нашем примере молекулярная масса рассчитывается так:
-
5
Найдите массовый состав в процентах. Массовая доля элемента в процентах вычисляется как отношение массового вклада данного элемента к общей молекулярной массе соединения, умноженное на 100%.
- В нашем примере массовые проценты каждого элемента рассчитываются так, как показано на рисунке. Таким образом, C6H8O7 состоит из 37,53% углерода, 4,16% водорода и 58,29% кислорода.
Реклама
Советы
- Вы можете проверить правильность своих вычислений, сложив массовые проценты всех элементов – в сумме должно получиться 100%. Однако помните, что вы не всегда можете получить точно 100%, поскольку массовый вклад каждого элемента был округлен до второго знака после запятой.
Реклама
Об этой статье
Эту страницу просматривали 12 927 раз.
Была ли эта статья полезной?
Содержание:
- § 1 Массовая доля химического элемента
- § 2 Практическое применение расчетов массовой доли элемента
- § 3 Определение формулы исследуемых веществ
§ 1 Массовая доля химического элемента
Относительную молекулярную массу веществ рассчитывают по химическим формулам, выражающим количественный состав веществ. Используя химические формулы можно также вычислить массовую долю каждого элемента в химическом соединении.
Массовая доля элемента (обозначается латинской буквой ω) показывает, какую часть составляет масса всех атомов данного элемента, содержащихся в одной молекуле вещества,
от общей массы молекулы.
Массовые доли элементов могут быть выражены в долях единицы или в процентах. Формула для расчета массовой доли элемента в веществе выглядит так: массовая доля элемента в веществе (ω) элемента равна отношению произведения числа атомов(n) и относительной атомной массы (Ar) данного элемента к относительной молекулярной массе (Mr) вещества.
Если массовую долю рассчитывать в процентах, то формула приобретет следующий вид.
Используя данную формулу, можно рассчитать массовую долю каждого химического элемента в составе сложного вещества.
Например, попробуем рассчитать массовую долю алюминия в оксиде алюминия (Al2O3).
Для расчетов пользуемся данными периодической системы химических элементов. Определим относительную молекулярную массу оксида алюминия. Она будет равна 102 (сумма двух относительных атомных масс алюминия и трех относительных атомных масс кислорода). Массовая доля алюминия в процентном отношении по формуле составит 53%.
§ 2 Практическое применение расчетов массовой доли элемента
Для чего же нужны такие расчеты? Иногда требуется сравнить содержание элементов в веществах.
Например, геологи открыли два месторождения железа. Первое содержит железо в виде оксида железа FeO, второе – в виде сульфида железа FeS. Какое месторождение богаче железом при прочих одинаковых условиях?
Дано:
Формула оксида железа FeO;
формула сульфида железа – FeS.
Найти:
Массовую долю железа в первом месторождении ω1(Fe) и массовую долю железа во втором месторождении ω2(Fe).
Решение:
1. Записываем формулу для расчета массовой доли железа в первом месторождении: ω1(Fe) в оксиде железа равна отношению произведения числа атомов железа n и относительной атомной массы (Ar) железа к относительной молекулярной массе (Mr) оксида железа, умноженное на 100%.
2. Записываем формулу для расчета массовой доли железа во втором месторождении: ω2(Fe)в сульфиде железа равна отношению произведения числа атомов железа n и относительной атомной массы (Ar) железа к относительной молекулярной массе (Mr) сульфида железа, все умноженное на 100%.
Для расчетов пользуемся данными периодической системы химических элементов.
Число атомов железа, кислорода и серы в обоих соединениях равны 1.
3. Рассчитываем относительную молекулярную массу оксида железа. Она равняется 72.
4. Находим относительную молекулярную массу сульфида железа. Она равняется 88.
5. Массовая доля железа в первом месторождении ω1(Fe) = 78%.
6. Массовая доля железа во втором месторождении ω2(Fe)= 64%.
7. Сравниваем значения массовых долей железа. Массовая доля железа в первом месторождении ω1(Fe) больше, чем массовая доля железа во втором месторождении ω2(Fe).
Ответ: Первое месторождение богаче железом.
§ 3 Определение формулы исследуемых веществ
В химических лабораториях на основе результатов анализа химических соединений определяют формулы исследуемых веществ. При этом решают задачи, обратные предыдущей. Например, можно вывести формулу вещества, зная массовые доли его элементов. Для этого преобразуем формулу массовой доли.
Число атомов элемента (n) равно отношению произведения массовой доли элемента в веществе (ω)элемента и относительной молекулярной массы (Mr) вещества к относительной атомной массе (Ar) данного элемента, умноженной на 100%.
Решим задачу. Экспериментально установлено, что вещество содержит 83% азота и 17% водорода. Какова формула этого вещества, если в результате эксперимента получено значение его относительной атомной массы, равное 17?
Дано:
Массовая доля азота ω(N)=83%, массовая доля водорода ω(Н)=17%, относительная молекулярная масса вещества Mr(NxHy)=17.
Найти:
Формулу вещества NxHy, где «x» – число атомов азота, а «у» – число атомов водорода.
Решение:
1. Найдем число атомов азота – х. Оно равняется отношению произведения массовой доли азота ω(N) и относительной молекулярной массы (Mr) вещества к относительной атомной массе (Ar) азота, умноженной на 100%. Получаем единицу.
2. Найдем число атомов водорода – у. Оно равняется отношению произведения массовой доли водорода ω(Н) и относительной молекулярной массы (Mr) вещества к относительной атомной массе (Ar) водорода, умноженной на 100%. Получаем число 3.
3. Так как х=1, а у=3, то формула вещества – NH3 (индекс 1 не пишется).
Для расчетов пользуемся данными периодической системы химических элементов.
4. Произведем проверку, вычислим относительную молекулярную массу полученного вещества. Она равна сумме относительной атомной массы азота и трех относительных атомных масс водорода. Задача решена правильно.
Ответ:формула вещества – NH3.
Список использованной литературы:
- Н.Е. Кузнецова. Химия. 8 класс. Учебник для общеобразовательных учреждений. – М. Вентана-Граф, 2012.
Определение массовой доли (ω) вещества
Многие характеристики вещества являются суммой нескольких составляющих, каждая из которых представляет определенную долю от целого.
Математически долю каждой составляющей определяют как частное от деления части на целое (меньшей величины на большую).
Важными характеристиками состава многокомпонентных систем (молекул, смесей веществ, растворов, сополимеровСополимеры – высокомолекулярные соединения, макромолекулы которых содержат два (и более) типа структурных звеньев.) являются массовые, мольные и объёмные доли отдельных компонентов.
Массовая доля компонента (вещества, химического элемента) – содержание компонента в многокомпонентной системе (смеси веществ, растворе, молекуле), определяемое как отношение массы этого компонента к суммарной массе всех компонентов системы.
Таким образом, для нахождения массовой доли вещества в смеси (и решения обратной задачи) служит соотношение:
ω(вещества) = m(вещества) / m(смеси).
Массовую долю элемента в веществе можно определить, используя молярные массы:
ω(элемента) = M(элемента) / M(вещества).
Например, массовая доля водорода ω(H) в этиловом спирте С2Н5ОН вычисляется следующим образом:
Часто долю выражают в процентах. Для этого полученный результат умножают на 100. То есть в данном случае ω(H)=13%. Это означает, что в каждом г (кг, т) С2Н6O содержится 0,13 г (кг, т) водорода или каждые 100 г (кг, т) С2Н6O содержат 13 г (кг, т) водорода.
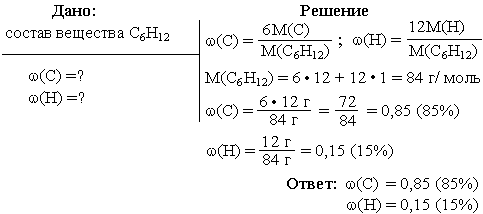
Задача 1. Вычислить массовые доли каждого из элементов, входящих в состав углеводорода, формула которого C6H12.
Задача 2. Из нефти получают бензин (массовая доля его в нефти составляет 25%) и мазут (55%). При дальнейшей переработке мазута получают еще некоторое количество бензина (60% от массы мазута). Рассчитайте массу бензина, который будет получен из нефти массой 200 кг.
Задача 3. Смесь ацетата натрия с избытком гидроксида натрия прокалили. После прокаливания масса сухого остатка оказалась в 1,136 раза меньше массы исходной смеси. Вычислите массовые доли компонентов исходной смеси.
Решение
При сплавлении ацетата натрия CH3COONa с гидроксидом натрия образуется метан CH4 (реакция Дюма).
Уравнение реакции: