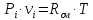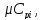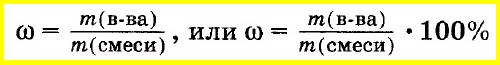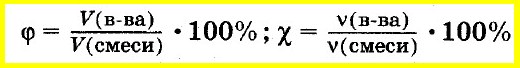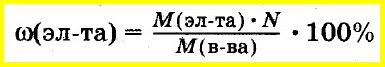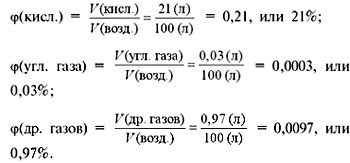В качестве рабочих тел могут использоваться
смеси, состоящие из нескольких газов.
Если смесь состоит из идеальных газов,
то для неё справедливы все соотношения,
полученные для однородного идеального
газа. Например, уравнение состояния
идеального газа для 1кг смеси
P·v=Rсм·T;
для
m>1 кг
P·V=m·Rсм·T,
где Rсм=R0/µсм– газовая постоянная смеси, Дж/(кг·град);
R0=8314 Дж/(кмоль·град) – универсальная
газовая постоянная;
v
– удельный объём смеси, м3/кг;
µсм –
«кажущаяся» молекулярная масса смеси,
кг/кмоль.
Для
определения Rсм иµсм необходимо знать состав
смеси, который может быть задан массовыми
или объёмными долями.
Определение состава газовой смеси в массовых долях
Массовая доля

где
– массаi-го газа
в смеси, кг;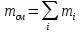
Определение удельной газовой
постоянной смеси Rсм
и состава смеси в объёмных долях
Если смесь задана массовыми долями, то
или

где

Дж/(кг·град);
компонента, кг/кмоль.
Объёмная
доля, выраженная через массовую долю
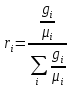
Определение «кажущейся» молекулярной
массы смеси
через массовые и объёмные доли
или

Определение плотности и удельного
объёма смеси
при нормальных физических условиях
Нормальные физические условия:
P0 =760 мм
рт.ст.=101300 Па,t0= 0°C= 273K.
Тогда

м3/кг,

кг/м3.
Определение параметров состояния
смеси P,
v, T
в характерных точках цикла и
показателей политропы
Недостающие (не заданные) параметры
состояния в характерных точках цикла
(1, 2, 3, 4, 5) определяются из уравнения
состояния
и по
известным (заданным) соотношениям для
характерных процессов цикла

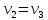

Показатель политропы:
для
процесса 1-2
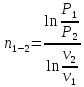
для
процесса 4-5

Определение
процессных теплоёмкостей Cv
и Cp
газовой смеси
и
показателя адиабаты k
Теплоёмкости смеси при постоянном
объёме и давлении в кДж/(кг·град)

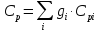
где


составе смеси. Находятся с учётом
количества атомов в молекуле и молекулярной
массы по формулам (руководствуясь
таблицей 8):


Таблица
8. Мольные теплоёмкости газов в соответствии
с
молекулярно-кинетической теорией
строения газов
|
Газы |
|
|
|
Одноатомные |
12,5 |
20,8 |
|
Двухатомные |
20,8 |
29,1 |
|
Трёх- |
29,1 |
37,4 |
Показатель адиабаты
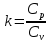
Процессные теплоёмкости для:
процесса 1-2

процесса 2-3

процесса 3-4

процесса 4-5
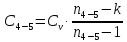
процесса 5-1

Примечание: для изотермических
процессов теплоёмкость равна
∞.
Определение изменения внутренней энергии Δu, энтальпии Δh
и
энтропии Δs
в процессах, составляющих цикл
Изменение внутренней энергии в любом
процессе
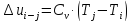
кДж/кг.
Изменение энтальпии в любом процессе

кДж/кг.
Изменение энтропии в любом процессе
(кроме изотермического)
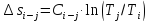
кДж/кг.
Изменение энтропии в изотермическом
процессе

кДж/кг.
Определение
количества работы изменения объёма l,
совершаемой в каждом из процессов,
и теплоты q,
подводимой (отводимой) в каждом из
процессов, составляющих цикл
Для
процесса 1-2:

кДж/кг;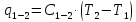
кДж/кг.
Для
процесса 2-3:

кДж/кг;
кДж/кг.
Для
процесса 3-4:

кДж/кг;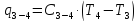
кДж/кг.
Для
процесса 4-5:

кДж/кг;
кДж/кг.
Для
процесса 5-1:

кДж/кг;
кДж/кг.
Примечание: для изотермических
процессов теплота и работа рассчитываются
по формуле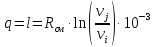
кДж/кг.
Количество теплоты q1,
подводимое в цикле, – это сумма
количеств теплоты тех процессов, в
которых теплота участвует со знаком
«+»;
количество теплоты q2,
отводимое в цикле, – это сумма
количеств теплоты тех процессов, в
которых теплота участвует со знаком
«-»;
полезная работа lц
– это алгебраическая сумма количеств
работы во всех процессах цикла;
термический КПД цикла
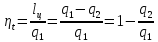
термический КПД цикла Карно

Примечание: при построении цикла
в диаграммеs–Tрекомендуется значение энтропии смеси
в состоянии 1 условно принять равным
нулю (s1=0). Тогда
состояние 2 на диаграмме находится по
значениям температурыT2и величины
Расчёт промежуточных точек в процессе
1-2 производится по произвольно выбранной
температуреTx
в интервале (T1–T2)
и изменению энтропии
Аналогично строятся остальные процессы
цикла.
Соседние файлы в папке ТТ ЭТК-2з
- #
- #
- #
- #
- #
- #
Решение задач с долей вещества в смеси, в соединении
Ключевые слова конспекта: массовая доля вещества в смеси или растворе, молярная доля вещества, объемная доля вещества, массовая доля элемента в соединении, масса элемента, массовая доля элемента.
Массовую долю вещества в смеси или растворе вычисляют как отношение массы вещества, входящего в состав смеси, к массе всей смеси. Массовую долю часто выражают в процентах. Для этого отношение массы вещества к массе смеси умножают на 100%:
Аналогично объемную долю вещества вычисляют как отношение объема вещества к объему смеси, а молярную долю вещества — как отношение количества вещества одного из компонентов смеси к сумме количеств веществ всех компонентов смеси:
Массовую долю элемента в соединении вычисляют как отношение массы элемента, входящего в состав данного соединения, к массе всего соединения:
Зная молекулярную формулу соединения, массу элемента, входящего в его состав, вычисляют как произведение молярной массы элемента на число атомов этого элемента в соединении.
В этом случае массовую долю элемента в соединении рассчитывают как отношение этой величины к молярной массе всего соединения:
Цитаты из пособия «Задачи по химии 8-9 кл.» (авт. О.С. Габриелян и др.) использованы в учебных целях. Ссылка на покупку книги указана в конце конспекта.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
25 г оксида магния смешали с 35 г оксида алюминия. Определите массовую долю оксида магния в данной смеси.
Ответ. ω(MgO) = 0,417, или 41,7%.
Задача № 2.
Вычислите объемную долю азота в смеси газов, содержащей 32 л азота, 48 л углекислого газа, 36 л гелия и 14 л водорода.
Ответ. φ(N2) = 0,246, или 24,6%.
Задача № 3.
Вычислите молярную и массовую долю (в %) оксида углерода (II) в смеси, содержащей 16,8 л (н. у.) оксида углерода (II) и 13,44 л (н. у.) оксида углерода (IV).
Ответ. χ(СО) = 55,56%, ω(СО) = 44,3%.
Задача № 4.
В воде растворили 15 г хлорида натрия. Вычислите массу полученного раствора, если массовая доля соли в нем равна 5%.
Ответ: m(р-ра) = 300 г.
Задача № 5.
Образец сплава меди с цинком имеет массу 75 г. Массовая доля меди в этом сплаве равна 64%. Определите массу цинка в данном образце.
Ответ. m(Zn) = 27 г.
[highlight]Задача № 6.[/highlight] Объемная доля аммиака в смеси с кислородом равна 40%. Вычислите плотность данной смеси по воздуху.
Посмотреть РЕШЕНИЕ
Ответ. Dвозд(смеси) = 0,896.
Задача № 7.
Найдите массовую долю кислорода в фосфате натрия.
Посмотреть РЕШЕНИЕ
Ответ. ω (O) = 39%.
[highlight]Задача № 8.[/highlight] Определите массовую долю фосфора в смеси, содержащей 55 г фосфата натрия и 70 г дигидрофосфата натрия.
Посмотреть РЕШЕНИЕ
Ответ. ω(Р) = 22,77%
[highlight]Задача № 9.[/highlight] Массовая доля серы в техническом сульфате натрия равна 20,48%. Рассчитайте массовую долю примесей в данном продукте (в %).
Посмотреть РЕШЕНИЕ
Ответ. ω (примесей) = 9,12%.
Задача № 10.
Плотность смеси оксида азота (II) и оксида азота (IV) по водороду равна 17,8. Найдите массовую долю оксида азота (IV) в данной смеси.
Посмотреть РЕШЕНИЕ
Ответ. ω(NO2) = 45,2%.
Решение задач с долей вещества в смеси, в соединении. Выберите дальнейшие действия:
- Перейти к следующей теме: Решение задач на вывод формул соединений
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
- Купить книгу Задачи по химии и способы их решения. 8-9 кл. / О.С. Габриелян и др. — М.: Дрофа.
Команда “Газы!” была объявлена еще две недели назад. И что?! Легкие задачи порешали и расслабились?! Или вы думаете, что задачи на газы касаются только 28-х заданий ЕГЭ?! Как бы не так! Если газов пока еще не было в 34-х заданиях, это ничего не значит! Задач на электролиз тоже не было в ЕГЭ до 2018 года. А потом как врезали, мама не горюй! Обязательно прочитайте мою статью “Тайны задач по химии? Тяжело в учении – легко в бою!”. В этой статье очень подробно рассказывается о новых фишках на электролиз. Статья вызвала шквал самых разных эмоций у преподавателей химии. До сих пор мне и пишут, и звонят, и благодарят, и бьются в конвульсиях. Просто цирк с конями, в котором я – зритель в первом ряду.
Однако, вернемся к нашим баранам, вернее, Газам. Я прошла через огонь и воду вступительных экзаменов и знаю точно – хочешь завалить абитуриента, дай ему задачу на Газы. Почитайте на досуге сборник задач И.Ю. Белавина. Я процитирую одну такую “мозгобойню”, чтобы вам жизнь медом не казалась. Попробуйте решить.
И.Ю. Белавин, 2005, задача 229
“Два из трех газов (сероводород, водород и кислород) смешали и получили газовую смесь, плотность которой оказалась равной плотности оставшегося газа. Полученную газовую смесь вместе с равным ей объемом третьего газа под давлением поместили в замкнутый сосуд емкостью 4 л, содержавший азот при н.у. и нагревали при 600 С до окончания химических реакций, затем постепенно охладили. Определите массы веществ, содержавшихся в сосуде после охлаждения, если плотность газовой смеси в сосуде перед нагреванием равнялась 9,25г/л. (Ответ: m(S) = 7,5 г, m(SO2) = 15 г, m(Н2О) = 9 г)”
Ну как, решили? Нет?! А ваши репетиторы?! Извините, это был риторический вопрос. Кстати, мои ученики, абитуриенты 2003-2008 гг. такие задачи щелкали, как семечки, на экзаменах во 2-й медицинский (теперь РНИМУ им. Н.И. Пирогова). Надеюсь, вам понятно, что 34-м задачам ЕГЭ еще есть куда усложняться, perfectio interminatus est (нет предела совершенству), с газами нужно работать, работать и работать. Поэтому команду “Газы!” отменять рано. Итак, поехали!
Сегодня мы поговорим о газовых смесях, затронем понятие плотности газа (абсолютной и относительной), средней молярной массы, решим задачи: определение средней молярной массы и плотности газа по компонентам смеси и наоборот.
• Газовая смесь – смесь отдельных газов НЕ вступающих между собой в химические реакции. К смесям газов относятся: воздух (состоит из азота, кислорода, углекислого газа, водяного пара и др.), природный газ (смесь предельных и непредельных углеводородов, оксида углерода, водорода, сероводорода, азота, кислорода, углекислого газа и др.), дымовые газы (содержат азот, углекислый газ, пары воды, сернистый газ и др.) и др.
• Объемная доля – отношение объема данного газа к общему объему смеси, показывает, какую часть общего объема смеси занимает данный газ, измеряется в долях единицы или в процентах.
• Мольная доля – отношение количества вещества данного газа к общему количеству вещества смеси газов, измеряется в долях единицы или в процентах.
• Плотность газа (абсолютная) – определяется как отношение массы газа к его объему, единица измерения (г/л). Физический смысл абсолютной плотности газа – масса 1 л, поэтому молярный объем газа (22,4 л при н.у. t° = 0°C, P = 1 атм) имеет массу, численно равную молярной массе.
• Относительная плотность газа (плотность одного газа по другому) – это отношение молярной массы данного газа к молярной массе того газа, по которому она находится
• Средняя молярная масса газа – рассчитывается на основе молярных масс составляющих эту смесь газов и их объемных долей
Настоятельно рекомендую запомнить среднюю молярную массу воздуха Мср(в) = 29 г/моль, в заданиях ЕГЭ часто встречается.
Обязательно посетите страницу моего сайта “Изучаем Х-ОбХ-04. Закон Авогадро. Следствия из закона Авогадро. Нормальные условия. Молярный объем газа. Абсолютная и относительная плотность газа. Закон объемных отношений” и сделайте конспекты по теории. Затем возьмите бумагу и ручку и решайте задачи вместе со мной.
ВАНГУЮ: чует мое сердце, что ЕГЭ по химии 2019 года устроит нам газовую атаку, а противогазы не выдаст!
Задача 1
Определить плотность по азоту газовой смеси, состоящей из 30% кислорода, 20% азота и 50% углекислого газа.
Задача 2
Вычислите плотность по водороду газовой смеси, содержащей 0,4 моль СО2, 0,2 моль азота и 1,4 моль кислорода.
Задача 3
5 л смеси азота и водорода имеют относительную плотность по водороду 12. Определить объем каждого газа в смеси.
Несколько задач со страницы моего сайта
Задача 4
Плотность по водороду пропан-бутановой смеси равна 23,5. Определите объемные доли пропана и бутана
Задача 5
Газообразный алкан объемом 8 л (н.у.) имеет массу 14,28 г. Чему равна его плотность по воздуху
Задача 6
Плотность паров альдегида по метану равна 2,75. Определите альдегид
Ну как? Пошло дело? Если туго, вернитесь к задачам и решайте их самостоятельно до тех пор, пока не щелкнет! А для стимуляции – десерт в виде еще одной задачи И.Ю. Белавина на газы. Наслаждайтесь ее решением самостоятельно!
И.Ю. Белавин, 2005, задача 202
“Сосуд емкостью 5,6 л при н.у. заполнили метаном, затем нагрели до высокой температуры, в результате чего произошло частичное разложение метана. Определите массу образовавшейся сажи, если известно, что после приведения к нормальным условиям объем полученной газовой смеси оказался в 1,6 раза больше объема исходного метана, эта газовая смесь обесцвечивает бромную воду и имеет плотность по воздуху 0,2931. (Ответ: m(C) = 0,6 г)”
Задачи И.Ю. Белавина – это крутой драйв! Попробуйте порешать, и вы откажетесь от просмотра любых ужастиков, поскольку запасетесь адреналином надолго! Но нам нужно спуститься на землю к ЕГЭ, простому и надежному, как первый советский трактор. Кстати, у меня в коллекции припасено немало сюрпризов с газовыми фишками, собранными за все годы работы и бережно хранимыми. Думаю, пришло время сказать им: “И снова здравствуйте!”, поскольку ЕГЭ с каждым годом становится “все чудесатее и чудесатее”. Но это уже совсем другая история. Читайте мои статьи – и вы подстелите соломку под свою ЕГЭшную попу.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Позвоните мне +7(903)186-74-55, приходите ко мне на курс, на бесплатные Мастер-классы “Решение задач по химии”. Я с удовольствием вам помогу.
Репетитор по химии и биологии кбн В.Богунова
УЧЕБНИКИ. ПОСОБИЯ
О.С.ГАБРИЕЛЯН,
И.Г.ОСТРОУМОВ,
А.К.АХЛЕБИНИН
СТАРТ В ХИМИЮ
7 класс
Продолжение. Начало см. в № 1, 2, 3, 4, 5, 6, 7/2006
Глава 2. Математика в химии
(окончание)
§ 13. Объемная доля газов в смеси
В состав воздуха входит несколько различных
газов: кислород, азот, углекислый газ,
благородные газы, водяные пары и некоторые
другие вещества. Содержание каждого из этих
газов в чистом воздухе строго определенно.
Для того чтобы выразить состав смеси газов в
цифрах, т.е. количественно, используют особую
величину, которую называют объемной долей газов
в смеси.
Объемную долю газа в смеси обозначают
греческой буквой
– «фи».
Объемной долей газа в смеси называют
отношение объема данного газа к общему объему
смеси:
Что же показывает объемная доля газа в смеси
или, как говорят, какой физический смысл этой
величины? Объемная доля газа показывает, какую
часть общего объема смеси занимает данный газ.
Если бы нам удалось разделить 100 л воздуха на
отдельные газообразные компоненты, мы получили
бы около 78 л азота, 21 л кислорода, 30 мл углекислого
газа, в оставшемся объеме содержались бы так
называемые благородные газы (главным образом
аргон) и некоторые другие (рис. 62).
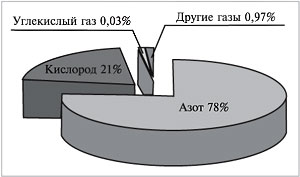 |
Рис. 62.
|
Рассчитаем объемные доли этих газов в
воздухе:
Нетрудно заметить, что сумма объемных долей
всех газов в смеси всегда равна 1, или 100%:
(азота) +
(кисл.) +
(угл. газа) +
(др. газов) = 78% + 21% + 0,03% + 0,97% = 100%.
Тот воздух, который мы выдыхаем, гораздо беднее
кислородом (его объемная доля снижается до 16%),
зато содержание углекислого газа возрастает до
4%. Такой воздух для дыхания уже непригоден. Вот
почему помещение, в котором находится много
людей, надо регулярно проветривать.
В химии на производстве чаще приходится
сталкиваться с обратной задачей: определять
объем газа в смеси по известной объемной доле.
Пример. Вычислите объем кислорода,
содержащегося в 500 л воздуха.
Из определения объемной доли газа в смеси
выразим объем кислорода:
V(кисл.) = V(возд.)•(кисл.).
Подставим в уравнение числа и рассчитаем объем
кислорода:
V(кисл.) = 500 (л)•0,21 = 105 л.
Кстати, для приближенных расчетов объемную
долю кислорода в воздухе можно принять равной 0,2,
или 20%.
При расчете объемных долей газов в смеси можно
воспользоваться маленькой хитростью. Зная, что
сумма объемных долей равна 100%, для «последнего»
газа в смеси эту величину можно рассчитать
по-другому.
Задача. Анализ атмосферы Венеры
показал, что в 50 мл венерианского «воздуха»
содержится 48,5 мл углекислого газа и 1,5 мл азота.
Рассчитайте объемные доли газов в атмосфере
планеты.
Дано:
V(смеси) = 50 мл,
V(угл. газа) = 48,5 мл,
V(азота) = 1,5 мл.
Найти:
(угл. газа),
(азота).
Решение
Рассчитаем объемную долю углекислого газа в
смеси. По определению:
Вычислим объемную долю азота в смеси, зная, что
сумма объемных долей газов в смеси равна 100%:
(угл.
газа) + (азота) = 100%,
(азота) =
100% – (угл. газа) =
100% – 97% = 3%.
Ответ. (угл.
газа) = 97%, (азота) =
3%.
С помощью какой величины измеряют содержание
компонентов в смесях другого типа, например в
растворах? Понятно, что в этом случае
пользоваться объемной долей неудобно. На помощь
приходит новая величина, о которой вы узнаете на
следующем уроке.
1.
Что такое объемная доля компонента в газовой
смеси?2. Объемная доля аргона в воздухе 0,9%. Какой
объем воздуха необходим для получения 5 л аргона?3. При разделении воздуха было получено 224 л
азота. Какие объемы кислорода и углекислого газа
были получены при этом?
4.
Объемная доля метана в природном газе составляет
92%. Какой объем этой газовой смеси будет
содержать 4,6 мл метана?5. Смешали 6 л кислорода и 2 л углекислого
газа. Найдите объемную долю каждого газа в
полученной смеси.
§ 14. Массовая доля вещества в растворе
– Сколько ложечек сахара ты кладешь в чай?
– Дома – две, в гостях – восемь.
Шутка известная, но давайте посмотрим на нее
глазами химика. Вряд ли вам понравится такой «чай
в гостях». Уж очень сладкий он будет из-за
неумеренного содержания сахара! Содержание
растворенного вещества в растворе химики
называют концентрацией.
Концентрацию вещества можно выражать
различными способами. Кстати, число ложечек на
чашку воды – способ вполне приемлемый, но только
для кухни. Трудно представить себе химика,
приготавливающего раствор таким образом.
Один из самых распространенных способов
выражения концентрации раствора – через
массовую долю растворенного вещества.
Массовой долей вещества в растворе называют
отношение массы растворенного вещества к массе
раствора:
Не правда ли, очень похоже на объемную долю? Так
оно и есть, ведь любая доля, как вы уже знаете, –
это отношение какой-то части к целому. Как и
массовая доля элемента в сложном веществе,
массовая доля вещества в растворе обозначается
греческой буквой
(«омега») и может принимать значения от 0 до 1 (или
от 0 до 100%). Она показывает, какая часть массы
раствора приходится на растворенное вещество. И
еще: массовая доля вещества в процентах численно
равна массе растворенного вещества в 100 г
раствора. К примеру, в 100 г 3%-го раствора уксуса
содержится 3 г чистой уксусной кислоты.
Самые простые растворы состоят из двух
компонентов. Один из компонентов раствора –
растворитель. Для нас более привычны жидкие
растворы, значит, растворитель в них – жидкое
вещество. Чаще всего – вода.
Другой компонент раствора – растворенное
вещество. Им может быть и газ, и жидкое, и твердое
вещество.
Масса раствора складывается из массы
растворителя и массы растворенного вещества, т.
е. верно выражение:
m(раствора) = m(растворителя) + m(растворенного
вещества).
Предположим, массовая доля растворенного
вещества равна 0,1, или 10%. Значит, оставшиеся 0,9,
или 90%, – это массовая доля растворителя.
Массовая доля растворенного вещества широко
используется не только в химии, но и в медицине,
биологии, физике, да и в повседневной жизни. В
качестве иллюстрации к сказанному рассмотрим
решение некоторых задач прикладного характера.
Задача 1. Перед посадкой семена
томатов дезинфицируют (протравливают) 1%-м
раствором марганцовки. Какую массу такого
раствора можно приготовить из 0,25 г марганцовки?
Дано:
(марганцовки) =
0,01 г,
m(марганцовки) = 0,25 г.
Найти:
m(раствора).
Решение
Зная массу растворенного вещества и его
массовую долю в растворе, можно вычислить массу
раствора:
Ответ. m(раствора) = 25 г.
Задача 2. В медицине широко применяют
так называемые физиологические растворы, в
частности раствор поваренной соли с массовой
долей соли 0,9%. Рассчитайте массы соли и воды,
необходимые для приготовления 1500 г
физиологического раствора.
Дано:
(соли) = 0,009,
m(раствора) = 1500 г.
Найти:
m(соли),
m(воды).
Решение
Вычислим массу соли, необходимой для
приготовления 1500 г физиологического раствора:
m(соли) = m(раствора)•(соли) = 1500 (г)•0,009 = 13,5 г.
Определим массу воды, необходимой для
приготовления раствора:
m(воды) = m(раствора) – m(соли) =
1500 – 13,5 = 1486,5 г.
Ответ. m(соли) = 13,5 г, m(воды) = 1486,5 г.
Отличаются ли свойства растворов от свойств
компонентов, образующих эти гомогенные смеси?
С помощью домашнего эксперимента (задание 9 к
этому параграфу) вам будет нетрудно убедиться в
том, что раствор замерзает при более низкой
температуре, чем чистый растворитель. Например,
морская вода начинает замерзать при температуре
–1,9 °С, в то время как чистая вода
кристаллизуется при 0 °С.
1.
Что такое массовая доля растворенного вещества?
Сравните понятия «объемная доля» и «массовая
доля» компонентов смеси.2. Массовая доля йода в аптечной йодной
настойке составляет 5%. Какую массу йода и спирта
нужно взять, чтобы приготовить 200 г настойки?3. В 150 г воды растворили 25 г поваренной соли.
Определите массовую долю соли в полученном
растворе.4. В 200 г столового уксуса содержится 6 г
уксусной кислоты. Определите массовую долю
кислоты в столовом уксусе.
5.
Найдите массу воды и лимонной кислоты,
необходимую для приготовления 50 г 5%-го раствора.6. Из 240 г 3%-го раствора питьевой соды
выпарили 80 г воды. Найдите массовую долю соды в
полученном растворе.7. К 150 г 20%-го раствора сахара добавили 30 г
сахара. Найдите массовую долю вещества в
полученном растворе.8. Смешали два раствора серной кислоты: 80 г
40%-го и 160 г 10%-го. Найдите массовую долю кислоты в
полученном растворе.
9.
Пять чайных ложек поваренной соли (с горкой)
растворите в 450 г (450 мл) воды. Учитывая, что масса
соли в каждой ложке примерно 10 г, рассчитайте
массовую долю соли в растворе. В две одинаковые
пластиковые бутылки объемом 0,5 л налейте
полученный раствор и водопроводную воду.
Поместите бутылки в морозильную камеру
холодильника. Загляните в холодильник примерно
через час. Какая жидкость начнет замерзать
раньше? В какой бутылке содержимое раньше
превратится в лед? Сделайте вывод.
ПРАКТИЧЕСКАЯ РАБОТА № 3.
Приготовление раствора с заданной массовой
долей
растворенного вещества
Цель данной работы состоит в приготовлении
раствора с заданной массовой долей путем
растворения рассчитанной массы твердого
вещества в определенном объеме воды.
Рассчитайте массу твердого вещества,
необходимого для приготовления раствора в
соответствии с вашим вариантом задания (табл. 3).
На весах отмерьте рассчитанную массу твердого
вещества и перенесите его в химический стакан.
Таблица 3
Варианты задания к практической
работе № 3
| Вариант | Растворенное вещество |
Масса раствора, г |
Массовая доля растворенного вещества, % |
|---|---|---|---|
| 1 | Поваренная соль | 80 | 10 |
| 2 | Сахар | 150 | 5 |
| 3 | Лимонная кислота | 50 | 2 |
| 4 | Натриевая селитра | 70 | 10 |
Рассчитайте массу воды, необходимой
для приготовления раствора. Поскольку плотность
воды равна 1 г/мл, рассчитанная вами масса
численно равна ее объему. С помощью мерного
цилиндра отмерьте вычисленный объем воды и
прилейте его к веществу в стакане. Перемешивая
содержимое стакана стеклянной палочкой,
добейтесь полного растворения вещества в воде.
Требуемый раствор готов.
§ 15. Массовая доля примесей
На примере замерзания раствора соли вы
убедились, что присутствие посторонних
соединений изменяет свойства вещества. В
некоторых областях техники использование
недостаточно «чистых» материалов недопустимо.
Микросхему компьютера не сделать без особо
чистого кристалла кремния, в атомной энергетике
предъявляются повышенные требования к очистке
ядерного топлива, световой сигнал «погаснет» в
стекловолоконном кабеле, наткнувшись на
посторонние вкрапления.
Если главное (основное) вещество содержит
посторонние загрязнения – это тоже смесь, только
в этом случае все ненужные, а порой и вредные ее
компоненты называют одним словом – примеси. Чем
меньше примесей, тем чище вещество.
Иногда вещество, содержащее примеси, называют
техническим образцом или просто образцом.
Следовательно, любой такой образец включает
основное вещество и примеси.
Степень чистоты вещества принято выражать
массовой долей основного компонента или
массовой долей примесей.
С массовыми долями разного типа вы уже знакомы.
Попробуйте теперь сами сформулировать
определение, что такое массовая доля примесей в
веществе. Получилось? Сравните.
Массовой долей примесей называется отношение
массы примесей к массе образца:
Предположим, вам нужно вычислить массовую долю
основного вещества в образце. Тогда можно
воспользоваться формулой:
Следует не забывать, что сумма массовых долей
основного вещества и примесей всегда равна 1, или
100%:
(осн.
в-ва) + (примесей) =
1, или 100%.
Также справедливо утверждение, что масса
образца складывается из массы основного
вещества и массы примесей:
m(образца) = m(осн. в-ва) + m(примесей).
Разберем несколько задач с использованием
понятия «массовая доля примесей».
Задача 1. Природная самородная
сера содержит 8% примесей. Какая масса чистой серы
содержится в 2 т природного образца?
Дано:
(примесей) = 0,08,
m(образца) = 2 т.
Найти:
m(серы).
Решение
Вычислим массу примесей в 2 т самородной серы:
m(примесей) = m(образца)•(примесей) = 2 (т) •0,08
= 0,16 т.
Рассчитаем массу чистой серы, содержащейся в
природном образце:
m(серы) = m(образца) – m(примесей)
= 2 (т) – 0,16 (т) = 1,84 т.
Ответ. m(серы) = 1,84 т.
Задача 2. В пищевой отрасли
промышленности можно использовать лимонную
кислоту, содержащую не более 1% посторонних
примесей. В аналитической лаборатории
установлено, что в 2,345 г продукта содержится 2,312 г
кислоты. Можно ли использовать продукт в пищевых
целях?
Дано:
m(образца) = 2,345 г,
m(кислоты) = 2,312 г.
Найти:
(примесей).
Решение
Вычислим массовую долю лимонной кислоты в
образце:
Рассчитаем массовую долю примесей в образце:
(примесей)
= 1 – (кислоты) = 1
– 0,986 = 0,014, или 1,4%.
Ответ. Данный образец лимонной кислоты не
может быть использован в пищевой отрасли
промышленности.
1.
Что называется массовой долей примесей? Что
показывает эта величина?2. В промышленности используются вещества с
маркировкой «ч», что означает «чистое вещество».
Содержание примесей в них может составлять,
например, 0,01%. Найдите максимально допустимую
массу примесей в 120 г образца сажи с маркировкой
«ч».3. Массовая доля примесей в известняке
составляет 5%. Рассчитайте массу основного
вещества (карбоната кальция), содержащегося в 300
кг природного известняка.
4.
При очистке медного купороса получилось 150 мг
примесей, что составило 2% от массы образца.
Определите массу технического медного купороса,
который подвергли очистке.
5. Для изготовления полупроводниковых
батарей используется сверхчистый кремний.
Массовая доля примесей в нем не должна превышать
0,000 000 0001%. Годится ли для данных целей
кремний, в 30 кг которого содержится 0,03 мг
примесей?
1.Находим
количество вещества газовой смеси: υ(смеси)= =14/22,4=0,625(моль)
2.Вычисляем среднюю молярную массу смеси: М(смеси) = = 25,5:0,625= 40,8(г/моль)
3.
Находим объемную долю азота в смеси: Пусть x—объемная доля
азота в смеси, φ(N2)=x, тогда
(1-x)—объемная
доля оксида углерода(IV) в
смеси, φ (CO2)= 1-x
по формуле М(смеси)= φ(N2) × М(N2) + φ (CO2) × М(CO2)
40,8= x×28 +
(1-x) ×
44 откуда x=0,2
или x=20%
φ(N2)=20%
φ (CO2)=1-0,2=0,8
или 80%
4.
Определяем мольную долю азота в смеси. По закону Авогадро объемная доля газа
в смеси равна его мольной доле, поэтому φ(N2)= χ(N2)=0,2
или 20%
5.
Вычисляем массовую долю азота в смеси, на основе формулы χ(N2)= υ(N2)/ υ(смеси)
находим
количество вещества азота
υ(N2) = χ(N2) × υ(смеси)=0,2×0,625=0,125
(моль), тогда m(N2)= υ(N2) × M(N2)=
0,125×28=3,5(г)
ω(N2)= = 3,5/25,5=0,137 или 13,7%
Все эти
действия можно объединить одной формулой ω(N2)= = 0,2 × 0,625 × 28/25,5=0,137
или
ω(N2)= = 0,2 × 28/40,8 = 0,137 или 13,7%
Ответ:
φ(N2)=20%
; χ(N2)=20%
ω(N2)=13,7%