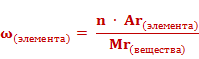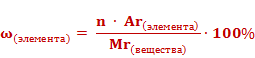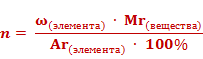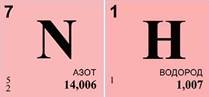1. Массовую долю элемента в веществе рассчитывают по формуле:
.
2. Если имеется (1) моль вещества, то его масса равна
.
3. (1) моль вещества содержит (x) моль элемента. Поэтому масса элемента, содержащегося в веществе, равна
m(эл.)=n(эл.)⋅M(эл.)=xмоль⋅Mг/моль
.
4. Подставив массу элемента и массу вещества в формулу ((1)), получим формулу ((2)), которой и воспользуемся для вычисления:
w(эл.)=xмоль(эл.)⋅Mг/моль(эл.)1моль⋅M г/моль(вещества)⋅100
.
Пример:
таким образом, например, расчёт массовой доли углерода в оксиде углерода((IV)) должен выглядеть так:
1. по формуле вещества видно, что (1) моль
CO2
содержит (1) моль химического элемента (C).
2. Если имеется (1) моль
CO2
, то его масса равна
.
3. А (1) моль элемента (C) имеет массу
.
4. Таким образом, массовая доля элемента (C) в
CO2
равна
27,3
%
.
Химическая формула соединения рассказывает нам не только о том, из каких элементов состоит вещества, но и о соотношении элементов в веществе. Давайте, например, посмотрим на серную кислоту Н2SO4 и сернистую кислоту H2SO3. Это два разных вещества, хотя оба состоят из водорода Н, серы S и кислорода О. Но из-за того, что соотношения элементов в них разное (в серной кислоте 4 атома кислорода, а в сернистой – 3), свойства у них тоже разные.
Используя химическую формулу, можно узнать и массовую доля элемента в соединении.
Массовая доля элемента в соединении показывает, какую часть составляет масса конкретного элемента от массы вещества.
Чтобы понять это сложное (на первый взгляд сложное, на самом деле оно простое) определения, представьте, что вы принесли из магазина пакет с покупками. В нём батон хлеба, пачка масла, два эскимо и упаковка чипсов. Весит пакет 1 килограмм. Какой вклад в это вносят чипсы? Пусть чипсы весят 50 граммов. Значит, от 1 килограмма (всей массы пакета с покупками) на чипсы приходится всего 50 граммов. Значит, можно посчитать, что чипсы – всего лишь 0,05 часть от всей массы пакета с покупками (50/1000=0,05).
Более удобно вычислять массовую долю в процентах, поэтому можно записать простую пропорцию:
1 килограмм (весь пакет с покупками) – 100%
50 граммов (упаковка чипсов) – Х%
Отсюда Х=50 г*100%/1000 г=5%. То есть массовая доля чипсов в пакете с покупками – 5%.
Теперь перейдём от покупок в супермаркете к химическим формулам.
Пример 1.
Определите массовую долю водорода и хлора в хлориде водорода.
Решение:
Формула хлорида водорода HCl. Чтобы определить массовые доли, нужно посчитать по таблице Менделеева молекулярную массу хлорида водорода. Она составляет 36,5 (1+35,5).
Из формулы мы видим, что в составе молекулы 1 атом водорода и 1 атом хлора. Обязательно обращайте на это внимание! Из примеров ниже будет видно, что это очень важно. Итак, составим пропорцию для определения массовой доли водорода:
36,5 (молекулярная масса соединения) – 100%
1 (атомная масса 1 атома водорода, входящего в соединение) – Х%
Отсюда Х=1*100/36,5=2,7%
Аналогично для хлора:
36,5 (молекулярная масса соединения) – 100%
35,5 (атомная масса 1 атома водорода, входящего в соединение) – Y%
Y=35,5*100/36,5=97,3%.
Таким образом, ответ: в хлориде водорода массовая доля водорода 2,7%, массовая доля хлора 97,3%.
Не лишним будет себя проверить, сложив все массовые доли. В сумме они должны давать 100 процентов. В нашем случае массовая доля водорода 2,7%+массовая доля хлора 97,3%=100%. Значит, мы всё сделали верно.
Пример 2.
Определите массовые доли углерода и кислорода в углекислом газе.
Решение:
Формула углекислого газа СО2. Обратите внимание, что здесь 2 атома кислорода. Это очень важно!
Теперь посчитаем молекулярную массу СО2, используя периодическую таблицу. Она будет равна 44: 12 (атомная масса углерода)+2*16 (атомная масса кислорода, умноженная на 2, потому что в формуле 2 атома кислорода).
Переходим к расчёту массовых долей с помощью пропорций.
Для углерода:
44 (молекулярная масса СО2) – 100%
12 (атомная масса 1 атома углерода) – Х%
Х=12*100/44=27,3%
Для кислорода:
44 (молекулярная масса СО2) – 100%
32 (масса 2 атомов кислорода, входящих в формулу) – Y%
Y=32*100/44=72,7%
Здесь мы взяли не 16 (атомная масса кислорода), а 32 потому, что в формуле СО2 2 атома кислорода. Помните, что выше я обращала на это внимание? Не упускайте это из виду, иначе будут ошибки.
Но ответ мы уже получили: в углекислом газе массовая доля углерода 27,3%, массовая доля кислорода 72,7%. (Проверим себя, сложив массовые доли: 27,3+72,7=100. Значит, всё верно).
Пример 3.
Этот пример от строгого репетитора по химии, который готовит к огэ по химии. Итак, найдите массовые доли алюминия и кислорода в оксиде алюминия.
Решение:
Формула оксида алюминия Al2O3. Не забудьте учесть число атомов алюминия и кислорода (как в примере выше)!
Сначала найдём молекулярную массу оксида алюминия, пользуясь таблицей Менделеева. Атомная масса алюминия 27, атомная масса кислорода 16. Молекулярная масса Al2O3 2*27+3*16 (потому что у нас 2 атома алюминия и 3 атома кислорода)=102.
Рассчитываем массовые доли.
Для алюминия:
102 (молекулярная масса Al2O3) – 100%
54 (масса 2 атомов алюминия, входящих в формулу) – Х%
Х=54*100/102=52,9%
Для кислорода:
102 (молекулярная масса Al2O3) – 100%
48 (масса 3 атомов кислорода, входящих в формулу) – Y%
Y=48*100/102=47,1%
Ответ: в оксиде алюминия массовая доля алюминия 52,9%, массовая доля кислорода 47,1% (проверка: 52,9+47,1=100).
А можно узнать формулу соединения, если известны массовые доли? И сделать это очень просто.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Массовая доля – один из важных параметров, который активно используется для расчетов и не только в химии. Приготовление сиропов и рассолов, расчет внесения удобрений на площадь под ту или иную культуру, приготовление и назначение лекарственных препаратов. Для всех этих расчетов нужна массовая доля. Формула для ее нахождения будет дана ниже.
В химии она рассчитывается:
- для компонента смеси, раствора;
- для составной части соединения (химического элемента);
- для примесей к чистым веществам.
Раствор – это тоже смесь, только гомогенная.
Массовая доля – это отношение массы компонента смеси (вещества) ко всей его массе. Выражают в обычных числах или в процентах.
Формула для нахождения такая:
? = (m (сост. части) · m (смеси, в-ва)) / 100% .
Содержание:
- Нахождение массовой доли химического элемента
- Нахождение массовой доли вещества в смесях и растворах
- Массовая доля примесей
- Видео
Нахождение массовой доли химического элемента
Массовая доля химического элемента в веществе находится по отношению атомной массы химического элемента, умноженной на количество его атомов в этом соединении, к молекулярной массе вещества.
Например, для определения w кислорода (оксигена) в молекуле углекислого газа СО2 вначале найдем молекулярную массу всего соединения. Она составляет 44. В молекуле содержится 2 атома кислорода. Значит w кислорода рассчитываем так:
w(O) = (Ar(O) · 2 ) / Mr(СО2)) х 100%,
w(O) = ((16 · 2) / 44) х 100% = 72,73%.
Аналогичным образом в химии определяют, например, w воды в кристаллогидрате – комплексе соединения с водой. В таком виде в природе находятся многие вещества в минералах.
Например, формула медного купороса CuSO4 · 5H2O. Чтобы определить w воды в этом кристаллогидрате, нужно в уже известную формулу подставить, соответственно, Mr воды (в числитель) и общую m кристаллогидрата (в знаменатель). Mr воды 18, а всего кристаллогидрата – 250.
w( H2O ) = ((18 · 5) / 250 ) · 100% = 36%
Нахождение массовой доли вещества в смесях и растворах
Массовая доля химического соединения в смеси или растворе определяется по той же формуле, только в числителе будет масса вещества в растворе (смеси), а в знаменателе – масса всего раствора (смеси):
? = (m (в-ва) · m (р-ра)) / 100% .
Следует обратить внимание, что массовая концентрация – это отношение массы вещества к массе всего раствора, а не только растворителя.
Например, растворили 10 г поваренной соли в 200 г воды. Нужно найти процентную концентрацию соли в полученном растворе.
Для определения концентрации соли нам нужна m раствора. Она составляет:
m (р-ра) = m (соли) + m (воды) = 10 + 200 = 210 (г).
Находим массовую долю соли в растворе:
? = ( 10 · 210) / 100% = 4,76%
Таким образом, концентрация поваренной соли в растворе составит 4,76%.
Если в условии задачи дается не m, а объем раствора, то его нужно перевести в массу. Делается это обычно через формулу для нахождения плотности:
p = m / V,
где m – масса вещества (раствора, смеси), а V – его объем.
Такую концентрацию используют чаще всего. Именно ее имеют в виду (если нет отдельных указаний), когда пишут о процентном содержании веществ в растворах и смесях.
Массовая доля примесей
В задачах часто дается концентрация примесей в веществе или вещества в его минералах. Следует обратить внимание на то, что концентрация (массовая доля) чистого соединения будет определяться путем вычитания из 100% доли примеси.
Например, если говорится, что из минерала получают железо, а процент примесей 80%, то чистого железа в минерале 100 – 80 = 20%.
Соответственно, если написано, что в минерале содержится только 20% железа, то во все химические реакции и в химическом производстве будут участвовать именно эти 20%.
Например, для реакции с соляной кислотой взяли 200 г природного минерала, в котором содержание цинка 5%. Для определения массы взятого цинка пользуемся той же формулой:
? = (m (в-ва) · m (р-ра)) / 100% ,
из которой находим неизвестную m раствора:
m (Zn) = ( w · 100% ) / m (минер.)
m (Zn) = (5 · 100) / 200 = 10 (г)
То есть, в 200 г взятого для реакции минерала содержится 5% цинка.
Задача. Образец медной руды массой 150 г содержит сульфид меди одновалентной и примеси, массовая доля которых составляет 15%. Вычислите массу сульфида меди в образце.
Решение задачи возможно двумя способами. Первый – это найти по известной концентрации массу примесей и вычесть ее из общей m образца руды. Второй способ – это найти массовую долю чистого сульфида и по ней уже рассчитать его массу. Решим обоими способами.
- I способ
Вначале найдем m примесей в образце руды. Для этого воспользуемся уже известной формулой:
? = ( m (примесей) · m (образца)) / 100% ,
m(примес.) = (w · m (образца)) · 100% , (А)
m(примес.) = (15 · 150) / 100% = 22,5 (г).
Теперь по разности найдем количество сульфида в образце:
150 – 22,5 = 127,5 г
- II способ
Вначале находим w соединения:
100 – 15 = 85%
А теперь по ней, воспользовавшись той же формулой, что и в первом способе (формула А), найдем m сульфида меди:
m(Cu2S) = (w · m (образца)) / 100% ,
m(Cu2S) = (85 · 150) / 100% = 127,5 (г).
Ответ: масса сульфида меди одновалентного в образце составляет 127,5 г.
Видео
Из видео вы узнаете, как правильно производить рассчеты по химическим формулам и как найти массовую долю.
Содержание:
- § 1 Массовая доля химического элемента
- § 2 Практическое применение расчетов массовой доли элемента
- § 3 Определение формулы исследуемых веществ
§ 1 Массовая доля химического элемента
Относительную молекулярную массу веществ рассчитывают по химическим формулам, выражающим количественный состав веществ. Используя химические формулы можно также вычислить массовую долю каждого элемента в химическом соединении.
Массовая доля элемента (обозначается латинской буквой ω) показывает, какую часть составляет масса всех атомов данного элемента, содержащихся в одной молекуле вещества,
от общей массы молекулы.
Массовые доли элементов могут быть выражены в долях единицы или в процентах. Формула для расчета массовой доли элемента в веществе выглядит так: массовая доля элемента в веществе (ω) элемента равна отношению произведения числа атомов(n) и относительной атомной массы (Ar) данного элемента к относительной молекулярной массе (Mr) вещества.
Если массовую долю рассчитывать в процентах, то формула приобретет следующий вид.
Используя данную формулу, можно рассчитать массовую долю каждого химического элемента в составе сложного вещества.
Например, попробуем рассчитать массовую долю алюминия в оксиде алюминия (Al2O3).
Для расчетов пользуемся данными периодической системы химических элементов. Определим относительную молекулярную массу оксида алюминия. Она будет равна 102 (сумма двух относительных атомных масс алюминия и трех относительных атомных масс кислорода). Массовая доля алюминия в процентном отношении по формуле составит 53%.
§ 2 Практическое применение расчетов массовой доли элемента
Для чего же нужны такие расчеты? Иногда требуется сравнить содержание элементов в веществах.
Например, геологи открыли два месторождения железа. Первое содержит железо в виде оксида железа FeO, второе – в виде сульфида железа FeS. Какое месторождение богаче железом при прочих одинаковых условиях?
Дано:
Формула оксида железа FeO;
формула сульфида железа – FeS.
Найти:
Массовую долю железа в первом месторождении ω1(Fe) и массовую долю железа во втором месторождении ω2(Fe).
Решение:
1. Записываем формулу для расчета массовой доли железа в первом месторождении: ω1(Fe) в оксиде железа равна отношению произведения числа атомов железа n и относительной атомной массы (Ar) железа к относительной молекулярной массе (Mr) оксида железа, умноженное на 100%.
2. Записываем формулу для расчета массовой доли железа во втором месторождении: ω2(Fe)в сульфиде железа равна отношению произведения числа атомов железа n и относительной атомной массы (Ar) железа к относительной молекулярной массе (Mr) сульфида железа, все умноженное на 100%.
Для расчетов пользуемся данными периодической системы химических элементов.
Число атомов железа, кислорода и серы в обоих соединениях равны 1.
3. Рассчитываем относительную молекулярную массу оксида железа. Она равняется 72.
4. Находим относительную молекулярную массу сульфида железа. Она равняется 88.
5. Массовая доля железа в первом месторождении ω1(Fe) = 78%.
6. Массовая доля железа во втором месторождении ω2(Fe)= 64%.
7. Сравниваем значения массовых долей железа. Массовая доля железа в первом месторождении ω1(Fe) больше, чем массовая доля железа во втором месторождении ω2(Fe).
Ответ: Первое месторождение богаче железом.
§ 3 Определение формулы исследуемых веществ
В химических лабораториях на основе результатов анализа химических соединений определяют формулы исследуемых веществ. При этом решают задачи, обратные предыдущей. Например, можно вывести формулу вещества, зная массовые доли его элементов. Для этого преобразуем формулу массовой доли.
Число атомов элемента (n) равно отношению произведения массовой доли элемента в веществе (ω)элемента и относительной молекулярной массы (Mr) вещества к относительной атомной массе (Ar) данного элемента, умноженной на 100%.
Решим задачу. Экспериментально установлено, что вещество содержит 83% азота и 17% водорода. Какова формула этого вещества, если в результате эксперимента получено значение его относительной атомной массы, равное 17?
Дано:
Массовая доля азота ω(N)=83%, массовая доля водорода ω(Н)=17%, относительная молекулярная масса вещества Mr(NxHy)=17.
Найти:
Формулу вещества NxHy, где «x» – число атомов азота, а «у» – число атомов водорода.
Решение:
1. Найдем число атомов азота – х. Оно равняется отношению произведения массовой доли азота ω(N) и относительной молекулярной массы (Mr) вещества к относительной атомной массе (Ar) азота, умноженной на 100%. Получаем единицу.
2. Найдем число атомов водорода – у. Оно равняется отношению произведения массовой доли водорода ω(Н) и относительной молекулярной массы (Mr) вещества к относительной атомной массе (Ar) водорода, умноженной на 100%. Получаем число 3.
3. Так как х=1, а у=3, то формула вещества – NH3 (индекс 1 не пишется).
Для расчетов пользуемся данными периодической системы химических элементов.
4. Произведем проверку, вычислим относительную молекулярную массу полученного вещества. Она равна сумме относительной атомной массы азота и трех относительных атомных масс водорода. Задача решена правильно.
Ответ:формула вещества – NH3.
Список использованной литературы:
- Н.Е. Кузнецова. Химия. 8 класс. Учебник для общеобразовательных учреждений. – М. Вентана-Граф, 2012.
Статьи
Линия УМК О. С. Габриеляна. Химия (8-9)
Химия
Массовая доля вещества
Ребятам, впервые пришедшим на урок химии, кажется: «Ух, какой отличный предмет. Столько разноцветных баночек и скляночек в лабораторном ящике. Вот сейчас я как нахимичу, друзья ахнут и выпадут в осадок».
Однако, при виде ровных рядков непонятных формул на доске энтузиазм у ребят испаряется быстрее, чем происходит взгонка кристаллов йода. Если подходить к химии, как к науке, которой нет места в реальной жизни, и просто заучивать ряды формул, то интерес может умереть очень быстро.
10 января 2019
Но все становится намного веселее, если поискать примеры химических реакций вокруг нас.
Костер в летнем походе, сквашивание овощей, изменение вкуса любимых блюд с помощью соли или сахара — это все химия.
Сегодня мы разберем одну из базовых тем «Массовая доля вещества в растворе».
Если хорошо изучить тему и научиться быстро решать задачи, можно не только определить, сколько ложек сахара бабушка добавила в свой чай, но и находить ответы на сложные криминалистические задачи.
Но перед тем, как приступить к практической части, стоит разобраться с теорией.
ОСНОВНЫЕ ТЕРМИНЫ
Основными терминами в этой теме будут:
-
Раствор — однородная смесь различных веществ в жидком виде.
-
Компоненты — вещества, которые подлежат смешиванию для получения раствора.
-
Растворитель — жидкий компонент, к которому добавляют субстанции для получения раствора.
-
Растворенное вещество — твердые или жидкие вещества, которые добавляют к растворителю для получения раствора.
-
Массовая доля — отношение массы вещества к массе раствора, в котором оно содержится.
-
Концентрация — отношение количества растворенного вещества к растворителю, выраженное в процентах.
Когда мы смешиваем между собой жидкости, которые идеально растворяются друг в друге, например воду и спирт, то можем любой из этих компонентов считать растворителем. Однако традиционно в водных растворах вода является растворителем, а второй ингредиент — растворенным веществом.
НЕОБХОДИМЫЕ ФОРМУЛЫ
Массовая доля вещества обозначается буквой греческого алфавита ω — омега. Чтобы ее определить, используется формула для вычисления массовой доли вещества.
ω (в-ва)= m (в-ва)/ m (р-ра) (1)
В этом равенстве массовая доля принимает значение от 0 до 1.
Однако в задачах чаще используется процентное соотношение, которое получается по следующей формуле:
ω (в-ва)= m (в-ва)/ m (р-ра)*100% (2)
Масса раствора равна сумме его компонентов.
m (р-ра)=m (в-ва)+m (р-ля) (3)
В случае двухкомпонентного раствора массовая доля растворенного вещества и массовая доля растворителя в сумме дают 100%
ω (в-ва)+ω (р-ля)=100% (4)
Масса раствора находится сложением масс компонентов, входящих в раствор
m (р-ра)=m (в-ва)+m (р-ля)(5)
Для успешного решения задачи на определение массовой доли вещества в растворе следует вспомнить еще одну формулу, которая связывает массу вещества, его объем и плотность.
m (в-ва)=p(в-ва)*V(в-ва) (6)
Напомним, что плотность воды составляет 1 г/мл. Это значит, что 100 мл воды весит ровно 100 гр.
Если возникает недопонимание теоретической части, более подробно теория изложена в учебнике «Химия. 8 класс» под редакцией О. С. Габриеляна, который можно найти на портале электронных учебников LECTA
#ADVERTISING_INSERT#