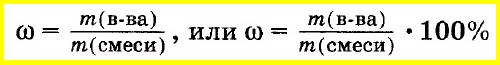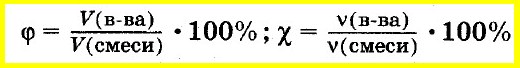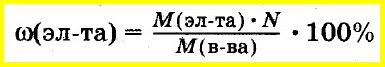Массовая доля кислоты
К 500 миллилитрам 32-процентной кислоты (плотность равна 1,2 г/мл) прибавили 1 литр воды (H2O). Определить массовую долю кислоты полученной в растворе.
Решение задачи
Найдем, массу раствора кислоты по формуле, устанавливающей связь между массой и объемом раствора:
m = 1,2 г/мл ∙ 500 мл = 600 (г).
Найдем, какая масса кислоты (в г) содержится в 600 г 32-процентного раствора. Составим пропорцию:
в 100 г раствора содержится 32 г кислоты
в 600 г раствора содержится х г кислоты
Откуда:
Учитывая, что плотность воды (H2O) равна 1 г/см3, соответственно масса воды (H2O) равна 1000 г, найдем, массу полученного раствора:
m (раствора) = 600 + 1000 = 1600 (г).
Найдем массовую долю кислоты полученной в растворе:
Массовая доля растворенного вещества в растворе – это отношение массы растворенного вещества к массе раствора. Выражается в долях единицы или в %. Следует отметить, что массовая доля растворенного вещества в растворе, выраженная в %, называется процентной концентрацией раствора.
Получаем, что массовая доля кислоты в растворе равна:
w (кислоты) = 192 / 1600 = 0,12 или 12 %.
Ответ:
массовая доля кислоты в растворе равна 0,12 или 12 %.
Задания 34 (2022). Расчет массовой доли химического соединения в смеси.
Задание №1
Смесь меди и оксида меди(II), в которой масса протонов в ядрах всех атомов составляет 46% от общей массы смеси, разделили на две равные части. К первой части добавили избыток разбавленного раствора серной кислоты. При этом образовалось 528 г раствора с массовой долей соли 10%. Ко второй части добавили 700 г разбавленного раствора азотной кислоты, взятого в избытке. Вычислите массовую долю нитрата меди(II) в образовавшемся растворе.
Решение
Ответ: ꞷ(Cu(NO3)2)=12,31 %
Пояснение:
CuO + H2SO4 ⟶ CuSO4 + H2O (I)
3Cu + 8HNO3 ⟶ 3Cu(NO3)2 + 2NO + 4H2O (II)
CuO + 2HNO3 ⟶ Cu(NO3)2 + H2O (III)
1) Исходя из условия, можем сразу найти количество вещества сульфата меди(II):
m(CuSO4) = = 52,8 г
n(CuSO4) = 52,8/160 = 0,33 моль
2) Найдем количество протонов в смеси меди и оксида меди (II), при этом примем количество обоих веществ за 1 моль.
N(p+) в Cu = 29 частиц;
N(p+) в CuO = 29 + 8 = 37 частиц;
3) По условию массовая доля протонов составляет 46% от общей массы. Это значит, что масса протонов составляет 46% (или 0,46) от суммы масс двух веществ. Составим уравнение, зная, что молярная масса одного протона составляет 1 г/моль.
ꞷ(p+) = mp+ / m(Cu) + m(CuO)
4) Пусть n(Cu) = x моль, тогда m(Cu) = 64x г;
m общ.(CuO) = nобщ.(CuO) · M
nобщ.(CuO) = 0,33 · 2 = 0,66 моль – так как смесь разделили на 2 равные части
m общ.(CuO) = 0,66 · 80 = 52,8 г
m(p+) = mCu(p+) + mCuO(p+)
Если в 1 моль меди содержится 29 протонов, то в n(Cu) = x моль, содержится 29x протонов, а значит: m(p+) = (29x моль) · (1 г/моль) = 29x г
Если в 1 моль оксида меди(II) содержится 37 моль протонов, то в n(CuO) = 0,33 моль содержится 0,66 ∙ 37 = 24,42 моль протонов, а значит: m(p+) = 24,42 ∙ 1 = 24,42 г.
5) Подставим под уравнение:
0,46 = (29x + 24,42) / (64x + 52,8)
29,44x + 24,29 = 29x + 24,42
0,44x = 0,13
x = 0,13/0,44 = 0,3 моль – общее количество меди.
0,3/2 = 0,15 моль – количество меди в одной части смеси.
6) По уравнениям реакций найдем m(Cu(NO3)2):
n2(Cu(NO3)2) = n2(Cu) = 0,15 моль
n3(Cu(NO3)2) = n3(CuO) = 0,33 моль
nобщ.(Cu(NO3)2) = 0,15 + 0,33 = 0,48 моль.
mобщ.(Cu(NO3)2) = M·n = 0,48 · 188 = 90,24 г
7) Найдем ꞷ(Cu(NO3)2):
mр—ра(Cu(NO3)2) = m(Cu) + m(CuO) + mр—ра(HNO3) – m(NO)
m(Cu) = M·n = 0,15 · 64 = 9,6 г
m(CuO) = M·n = 0,33 · 80 = 26,4 г
m(NO) = 2/3 · n·M = 2/3 · 0,15 · 30 = 3 г
mр—ра(Cu(NO3)2) = 9,6 + 26,4 + 700 – 3 = 733 г
ꞷ(Cu(NO3)2) = (90,24/733) · 100% = 12,31 %
Задание №2
К 60 г раствора дигидрофосфата натрия, в котором 55% от общей массы раствора составляет масса протонов в ядрах всех атомов, добавили 40 г 15%-ного раствора гидроксида натрия. Затем к образовавшемуся раствору добавили 51 г нитрата серебра. Определите массовую долю нитрата серебра в конечном растворе.
Решение
Ответ: ꞷ(AgNO3) = 13,68 %
Пояснение:
1) Так как при взаимодействии дигидрофосфата натрия со щелочью может образовываться два типа солей: фосфат натрия либо гидрофосфат натрия – необходимо вычислить соотношение реагентов.
m(NaOH) = 0,15 · 40 = 6 г
n(NaOH) = 6/40 = 0,15 моль
2) Известно, что в растворе NaH2PO4 протоны в ядрах всех атомов составляют 55 % от общей массы раствора. Понимая, что раствор состоит из массы самого растворенного вещества и массы воды, примем, что m(NaH2PO4) = x г, а m(H2O) = y г.
Посчитаем массу протонов в каждом из веществ, примем их количество за 1 моль, а молярную массу одного протона за 1 г/моль:
а) mp+(NaH2PO4) = mp+(Na) + 2mp+(H) + mp+(P) + 4mp+(O) = 11+2+15+32 = 60 г
mp+(NaH2PO4) : m(NaH2PO4) = 60 : 120 = 1 : 2
Следовательно, в x г NaH2PO4 содержится 0,5x г протонов.
б) mp+(H2O)=2mp+(H) + mp+(O) = 2+8=10 г — протонов содержится в 1 моль воды (18г).
Следовательно, в y г H2O содержится 10y/18 г протонов.
Найдем общую массу протонов в растворе:
mp+(р-раNaH2PO4) = mр-ра(NaH2PO4) · ꞷp+ = 60 · 0,55 = 33 г
0,5x + 10/18y = 33 (г)
Составим систему уравнений:
Решая которую находим, что:
y = 54
x = 60 – 54 = 6
m(H2O) = 54 г
m(NaH2PO4) = 6 г
3) n(NaH2PO4)= 6/120 = 0,05 моль
Таким образом, мы можем записать, что количества веществ дигидрофосфата натрия и гидроксида натрия относятся друг к другу как:
n(NaH2PO4) : n(NaOH) = 0,05 : 0,15 = 1:3,
следовательно, щелочь в избытке и протекать будут следующие реакции:
NaH2PO4 + 2NaOH ⟶ Na3PO4 + 2H2O (I)
Na3PO4 + 3AgNO3 ⟶ Ag3PO4 + 3NaNO3 (II)
2NaOH + 2AgNO3 ⟶ Ag2O + H2O + 2NaNO3 (III)
Найдем ꞷ(AgNO3) в конечном растворе:
а) nост.(NaOH) = nисх.(NaOH) — n1(NaOH)
n1(NaOH) = 2n(NaH2PO4) = 2 · 0,05 = 0,1 моль
nост.(NaOH) = 0,15 – 0,1 = 0,05 моль
n(Ag3PO4) = n(Na3PO4) = n(NaH2PO4) = 0,05 моль
m(Ag3PO4) = 0,05 · 419 = 20,95 г
n(AgNO3) = 51/170 = 0,3 моль
nост.(NaOH) : n(AgNO3) = 0,05 : 0,3 =1:6 – следовательно, n(AgNO3) в избытке
n(Ag2O) = 0,5nост.(NaOH) = 0,025 моль
m(Ag2O) = 0,025 · 232 = 5,8 г
б) Найдем массу конечного раствора. Помним, что масса раствора – это всё, что смешали, минус образовавшиеся газы и осадки.
mр-ра кон.(AgNO3) = mр-ра(NaH2PO4) + mр-ра(NaOH) + m(AgNO3) – m(Ag3PO4) – m(Ag2O)
mр-ра кон.(AgNO3) = 60 + 40 + 51 – 20,95 – 5,8 = 124,25 г
в) nост.(AgNO3) = 0,3 – n2(AgNO3) – n3(AgNO3) = 0,3 – 3n2(Na3PO4) – n(NaOH) = 0,3 – 0,15 – 0,05 = 0,1 моль
mост. (AgNO3) = 0,1 · 170 = 17 (г)
ꞷ(AgNO3) = 17/124,25 · 100% = 13,68%
Ответ: ꞷ(AgNO3) = 13,68%
Задание №3
Олеум массой 114 г, в котором общее число электронов в 58 раз больше числа Авогадро, растворили в 26 г воды, затем добавили 23,2 г железной окалины и нагрели. Вычислите массовую долю соли в конечном растворе. Возможным образованием кислых солей пренебречь.
Решение
Ответ: ꞷ(Fe2(SO4)3) = 37,5%
Пояснение:
Для решения подобных задач удобнее считать, что олеум – это раствор SO3 в безводной H2SO4, т.е. воды в нем нет.
1) Для начала определим соотношение веществ в олеуме:
а) Пусть n(SO3) = x моль, а n(H2SO4) = y моль, тогда m(SO3) = 80x г, а m(H2SO4) = 98y г. По условию масса олеума составляет 114 г, следовательно: 80x + 98y = 114 г.
б) Найдем количество электронов в обоих веществах. При этом помним, что количество электронов = количеству протонов = порядковому номеру элемента.
n(e) в x моль SO3 равно: 16x + 3·8x = 40x моль;
n(e) в y моль H2SO4 равно: 2·1y + 16y + 4·8y = 50y моль;
По условию известно, что N(e) в 58 раз больше числа Авогадро (NA), вспоминаем формулу:
n(e) = N/NA , где N = 58NA , то есть: n(e) = 58NA/NA = 58 моль ⇒ 40x + 50y = 58 моль
в) Составим систему уравнений:
решая которую, получаем, что:
y = 1, x = 0,2,
n(H2SO4) = 1 моль, n(SO3) = 0,2 моль, следовательно, n(SO3) в недостатке.
Для того чтобы понять какое уравнение следует записать для второй реакции нам следует понять какой концентрации раствор серной кислоты мы получим в результате добавления олеума к воде. Если раствор серной кислоты получится разбавленным — железная окалина растворится в растворе серной кислоты с образованием двух солей (железа (II) и железа (III). Если же раствор серной кислоты окажется концентрированным, реакция железной окалины с серной кислотой приведет к образованию диоксида серы, сульфата железа(III) и воды.
При добавлении олеума к воде протекает следующая реакция:
SO3 + H2O ⟶ H2SO4 (I)
а) nI(H2SO4) = n(SO3) = 0,2 моль;
mI(H2SO4) = 98 + 0,2 = 19,6 г;
б) mр—ра(H2SO4) = m(олеума) + m(H2O);
mр—ра(H2SO4) = 114 + 26 = 140 г;
в) m(H2SO4) = mисх.(H2SO4) + mI(H2SO4);
m(H2SO4) = 98 + 19,6 = 117,6 г;
ꞷ(H2SO4) = 117,6/140 · 100% = 84% — следовательно, образовавшийся раствор кислоты можно считать концентрированным, а значит протекает следующая реакция:
2Fe3O4 + 10H2SO4 = 3Fe2(SO4)3 + SO2 + 10H2O (II)
Определим массовую долю соли в конечном растворе:
а) n(Fe3O4) = 23,2/232 = 0,1 моль;
б) n(Fe2(SO4)3) = 3/2n(Fe3O4) = 3/2 · 0,1 = 0,15 моль;
m(Fe2(SO4)3) = 0,15 · 400 = 60 г;
в) n(SO2) = 1/2n(Fe3O4) = 0,5 · 0,1 = 0,05 моль;
m(SO2) = 0,05 · 64 = 3,2 г;
г) mр—ра(Fe2(SO4)3) = mр—ра(H2SO4) + m(Fe3O4) – m(SO2);
mр—ра(Fe2(SO4)3) = 140 + 23,2 – 3,2 = 160 г;
д) ꞷ(Fe2(SO4)3) = 60/160 · 100% = 37,5%.
Задание №4
Смесь фосфида цинка и нитрида магния общей массой 65,7 г, в которой общее число электронов в 32 раза больше числа Авогадро, растворили в 730 г 30%-ной соляной кислоты. Вычислите массовую долю кислоты в конечном растворе.
Решение
Ответ: ꞷост.(HCl) = 10,18%
Пояснение:
Сразу запишем уравнения реакций:
Zn3P2 + 6HCl = 3ZnCl2 + 2PH3 (I)
Mg3N2 + 8HCl = 3MgCl2 + 2NH4Cl (II)
Для начала можем сразу определить n(HCl), исходя из условия:
а) m(HCl) = 730 · 0,3 = 219 г
n(HCl) = 219/36,5 = 6 моль
2) По условию масса смеси (Zn3P2 и Mg3N2) равна 65,7 г. Составим первое уравнение системы:
Пусть n(Zn3P2) = x моль, тогда m(Zn3P2) = 257x г
Пусть n(Mg3N2) = y моль, тогда m(Mg3N2) = 100y г
Следовательно: 257x + 100y = 65,7 г
3) Далее перейдем к количеству электронов. По условию: общее число электронов в смеси в 32 раза больше числа Авогадро – это можно записать так:
n(e) = N/NA , где N = 32NA , то есть: n(e) = 32NA/NA = 32 моль
Далее найдем количества электронов в веществах смеси отдельно. При этом помним, что количество электронов = количеству протонов = порядковому номеру элемента.
а) Ne(Zn3P2) = 30 ·3 + 15 · 2 = 120 электронов.
Если в 1 моль Zn3P2 содержится 120 · 1 = 120 моль электронов, то в x моль (Zn3P2) содержится 120x моль.
б) Ne(Mg3N2) = 12 · 3 + 7 · 2 = 50 электронов.
Если в 1 моль Mg3N2 содержится 50 · 1 = 50 моль электронов, то в y моль (Zn3P2) содержится 50y моль.
в) Составим второе уравнения системы: 120x + 50y = 32
Решим систему уравнений, найдем x и y:
x = 0,1 (моль) – n(Zn3P2);
y = 0,4 (моль) – n(Mg3N2);
Найдем массу оставшейся в растворе соляной кислоты (логично, что если она осталась, значит была в избытке):
а) n1(HCl) = 6n(Zn3P2) = 0,1 · 6 = 0,6 моль
n2(HCl) = 8n(Mg3N2) = 0,4 · 8 = 3,2 моль
nост.(HCl) = 6 — 3,2 — 0,6 = 2,2 моль
б) mост.(HCl) = 2,2 · 36,5 = 80,3 г
Найдем массу конечного раствора. Помним, что масса раствора – это всё, что смешали, минус образовавшиеся газы и осадки. Из газов у нас только PH3 (никакого NH3 там нет! Он прореагировал с соляной кислотой и перешел в NH4Cl! баллы не теряем).
а) mконечн. р-ра(HCl) = mсмеси + mисх. р-ра (HCl) – m(PH3)
б) n(PH3) = 2n(Zn3P2) = 0,2 моль
m(PH3) = 0,2 · 34 = 6,8 г
в) mконечн. р-ра(HCl) = 65,7 + 730 – 6,8 = 788,9 г
Найдем ꞷост.(HCl):
ꞷост.(HCl) = (80,3/788,9) · 100% = 10,18%
Ответ: ꞷост.(HCl) = 10,18% .
Задание №5
К 125 г раствора аммиака, в котором 56% от общей массы раствора составляет масса протонов в ядрах всех атомов, добавили 40,05 г хлорида алюминия. Через образовавшийся раствор пропустили сернистый газ, при этом прореагировало 2,24 л (н.у.) газа. Вычислите массовые доли солей в конечном растворе. Растворимостью газов в воде пренебречь.
Решение
Ответ: ꞷ(NH4Cl) = 32,5%; ꞷ(NH4HSO3) = 6,69%
Пояснение:
1) Для начала можем сразу записать следующую реакцию:
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl (I)
2) Найдем количества веществ, данных в условии:
а) n(AlCl3) = 40,05/133,5 = 0,3 моль;
б) n(SO2) = 2,24/22,4 = 0,1 моль;
3) Далее мы не можем сразу сделать вывод о том какая реакция протекает:
SO2 + NH3 + H2O = NH4HSO3 либо SO2 + 2NH3 + H2O = (NH4)2SO3
Также возможен случай когда образуются сразу две соли одновременно.
Обратим внимание на соотношение реагентов (SO2 и NH3) в двух реакциях: 1:1 и 1:2 соответственно. Чтобы сделать вывод, какая из двух реакций протекает, необходимо провести дальнейшие расчеты.
4) В условии сказано, что масса раствора аммиака составляет 125 г. Раствор состоит из воды и аммиака.
Пусть n(NH3) = x моль, а n(H2O) = y моль. Тогда m(NH3) = 17x г, а m(H2O) = 18y г.
Составим первое уравнение системы: 17x + 18y = 125 г
5) Также известно, что массовая доля протонов в ядрах всех атомов составляет 56% от массы раствора. Найдем количество и массу протонов. При этом помним, что количество протонов = порядковому номеру элемента, а молярная масса одного протона составляет 1г/моль.
а) Np+(NH3) = 7 + 1 · 3 = 10 протонов;
Если в 1 моль NH3 содержится 10 · 1 = 10 моль протонов, то в x моль NH3 содержится 10x моль.
m p+(NH3) = 10x · 1 = 10x г;
б) Np+(H2O) = 1 · 2 + 8 = 10 протонов;
Если в 1 моль H2O содержится 10 · 1 = 10 моль протонов, то в y моль H2O содержится 10y моль.
mp+( H2O) = 10y · 1 = 10y г;
в) Составим второе уравнение системы:
0,56 = (10x + 10y)/125 ⇒ 10x + 10y = 70
Составим систему уравнений:
Решая которую находим, что:
y = 6
x = 1
Следовательно:
n(H2O) = y моль = 6 моль,
n(NH3) = x моль = 1 моль
7) Вернемся к действию 3) и сравним количества веществ, но для этого нам сначала необходимо найти количество оставшегося аммиака, так как его часть ушла на первую реакцию.
а) n1(NH3) = 3n(AlCl3) = 3 · 0,3 = 0,9 моль
nост.(NH3) = 1 – 0,9 = 0,1 моль;
б) n(SO2) : n(NH3) = 0,1 : 0,1 = 1 : 1 – следовательно, реакция протекает до образования кислой соли.
SO2 + NH3 + H2O = NH4HSO3 (II)
8) Найдем массу образовавшихся солей:
а) n(NH4Cl) = 3n(AlCl3) = 3 · 0,3 = 0,9 моль
m(NH4Cl) = 0,9 · 53,5 = 48,15 г;
б) n(NH4HSO3) = n(SO2) = 0,1 моль,
m(NH4HSO3) = 0,1 · 99 = 9,9 г;
9) Напишем уравнение массы конечного раствора. Помним, что масса раствора – это всё, что смешали, минус образовавшиеся газы и осадки.
mконечн. р-ра = mр-ра(NH3) + m(AlCl3) – m(Al(OH)3) + m(SO2)
Вычислим недостающие данные:
а) n(Al(OH)3) = n(AlCl3) = 0,3 моль
m(Al(OH)3) = 0,3 · 78 = 23,4 г;
б) m(SO2) = 0,1 · 64 = 6,4 г;
в) Найдем массу конечного раствора:
mконечн. р-ра = 125 + 40,05 – 23,4 + 6,4 = 148,05 г
Найдем массовую долей солей в образовавшемся растворе:
ꞷ(NH4Cl) = (48,15/148,05) · 100% = 32,5% ;
ꞷ(NH4HSO3) = (9,9/148,05) · 100% = 6,69%
Ответ: ꞷ(NH4Cl) = 32,5%; ꞷ(NH4HSO3) = 6,69% .
Задание №6
Пластинку, сделанную из сплава цинка со свинцом, в которой общее число электронов в атомах металлов в 56 раз больше числа Авогадро, поместили в 100 г раствора хлорида олова(II). После того как хлорид олова(II) прореагировал полностью, пластинку с выделившимся на ней металлом извлекли из раствора. В результате общее число электронов в атомах трёх металлов пластинки увеличилось на 12,5% по сравнению с числом электронов в атомах металлов исходной пластинки. К оставшемуся раствору добавили 480 г 20%-ного раствора гидроксида натрия. Вычислите массовую долю щёлочи в конечном растворе. Процессом гидролиза солей пренебречь.
Решение
Ответ: ꞷост.(NaOH) = 7,13%
Пояснение:
1) Для начала можно записать уравнение первой реакции (понятно, что реагировать из двух металлов пластинки будет цинк, так как он активнее):
Zn + SnCl2 = ZnCl2 + Sn (I)
Уравнение второй реакции сразу записать нельзя, так как она может протекать по двум направлениям:
ZnCl2 + 4NaOH = Na2[Zn(OH)4] + 2NaCl либо ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
Обратим внимание на соотношение реагентов: 1:4 и 1:2 — и на основании дальнейших расчетов сделаем вывод о том, какая реакция протекает.
По условию, общее число электронов пластинки в 56 раз больше числа Авогадро. Записать это можно следующим образом:
n(e) = N/NA , где N = 56NA , то есть: n(e) = 56NA/NA = 56 моль, то есть общее количество электронов в Zn-Pb пластинке равно 56 моль.
Пусть n(Zn) = x моль, а n(Pb) = y моль. Помним, что количество электронов в атоме химического элемента точно такое же, как и количество протонов и численно равно порядковому номеру элемента.
В таком случае, количество вещества электронов в металлическом цинке будет равно:
ne(Zn) = N(e—)·n(Zn) = 30x моль,
а количество вещества электронов в металлическом свинце будет равно:
ne(Pb) = 82y моль
Тогда, суммарное количество вещества электронов пластинки из цинка и свинца будет равно:
ne(Zn/Pb пластинки) = (30x + 82y) моль,
в то же время мы знаем, что ne(Zn/Pb пластинки) = 56 моль, отсюда следует первое уравнение системы:
30x + 82y = 56
Известно, что общее число электронов в пластинке из трёх металлов на 12,5% по сравнению больше по сравнению с числом электронов в атомах металлов исходной пластинки из двух металлов.
Тогда, изменение количества вещества электронов пластинки после реакции будет равно:
Δne(пластинки) =56 · 0,125 = 7,
а общее количество электронов в пластинке из трех металлов (после реакции):
ne(пластинки Zn-Pb-Sn) = 56 + 7 = 63 – общее количество электронов пластинки после реакции.
Изменение количества электронов пластинки произошло из-за того, что часть цинка с пластинки ушла в раствор, а часть олова из раствора соли выделилась на пластинке.
Количество электронов в исходной пластинке:
Ne исходной пл. = Ne(Pb) + Ne исх.(Zn),
а количество вещества электронов в исходной пластинке:
ne исходной пл. = ne(Pb) + ne исх.(Zn),
Количество электронов в конечной пластинке:
Ne конечной пл. = Ne(Pb) + Ne исх.(Zn) – Ne прореаг.(Zn) + Ne(Sn),
а количество вещества электронов в конечной пластинке:
ne конечной пл. = ne(Pb) + ne исх.(Zn) – ne прореаг.(Zn) + Ne(Sn),
Тогда, разница количества вещества электронов может быть записано как:
Δne(пластинки) = ne конечной пл. — ne исходной пл. = (ne(Pb) + ne исх.(Zn) – ne прореаг.(Zn) + Ne(Sn)) — (ne(Pb) + ne исх.(Zn)) = ne(Pb) + ne исх.(Zn) – ne прореаг.(Zn) + Ne(Sn) — ne(Pb) — ne исх.(Zn) = — ne прореаг.(Zn) + ne(Sn) = ne(Sn) — ne прореаг.(Zn)
т.е. Δne(пластинки) = ne(Sn) — ne прореаг.(Zn)
Из уравнения реакции I можно сделать вывод, что количество вещества осевшего Sn равно количеству прореагировавшего Zn. Пусть n(Sn) = nпрореаг.(Zn) = z моль.
Тогда количество вещества электронов в образовавшемся олове будет равно:
ne(Sn) = 50z моль,
а количество вещества электронов в прореагировавшем цинке будет равно:
ne прореаг.(Zn) = 30z моль.
Таким образом,
Δne(пластинки) = ne(Sn) — ne прореаг.(Zn) = 50z — 30z = 20z моль,
в то же время:
Δne(пластинки) = 7 моль,
следовательно:
7 = 20z
z = 0,35,
а n(Sn) = nпрореаг.(Zn) = n1(ZnCl2) = 0,35 моль,
Перейдем теперь к расчету соотношения щелочи и хлорида цинка.
а) mисх.(NaOH) = 480 · 0,2 = 96 г
nисх.(NaOH) = 96/40 = 2,4 моль;
б) nисх.(NaOH)/n(ZnCl2)= 2,4/0,35 = 6,9
Следовательно, можно сделать вывод, что NaOH находится в избытке, поэтому реакция будет протекать по пути комплексообразования:
ZnCl2 + 4NaOH = Na2[Zn(OH)4] + 2NaCl (II)
Рассчитаем количество вещества и массу непрореагировавшего гидроксида натрия:
а) nпрореаг.(NaOH) = 4n(ZnCl2) = 0,35 · 4 = 1,4 моль
nост.(NaOH) = 2,4 – 1,4 = 1 моль;
б) mост.(NaOH) = 1 · 40 = 40 г
Напишем выражение массы конечного раствора:
mконечн. р-ра = mр-ра(SnCl2) + mушедш.(Zn) – mосевш.(Sn) + mр-ра(NaOH)
mконечн. р-ра = 100 + (65 · 0,35) – (119 · 0,35) + 480 = 561,1 г
Рассчитаем массовую долю щелочи в конечном растворе:
ꞷост.(NaOH)= (40/561,1) · 100% = 7,13%
Ответ: ꞷост.(NaOH) = 7,13%
Задание №7
Смесь фосфида и нитрида лития, в которой масса протонов в ядрах всех атомов составляет 46% от общей массы смеси, растворили в 200 г 36,5%-ной соляной кислоты. При этом выделилось 5,6 л (н.у.) газа. Вычислите массовую долю кислоты в конечном растворе.
Решение
Ответ: ꞷост.(HCl) = 7,766%
Можем сразу записать уравнения реакций:
Li3P + 3HCl = 3LiCl + PH3 (I)
Li3N + 4HCl = 3LiCl + NH4Cl (II)
Найдем количество вещества и массу фосфина:
n(PH3) = 5,6/22,4 = 0,25 моль
m(PH3) = 0,25 · 34 = 8,5 г
По условию, масса протонов в ядрах всех атомов составляет 46%. Напишем уравнение:
ꞷp+ = (mp+(Li3N + Li3P)/ m(Li3N + Li3P)
Найдем недостающие данные.
а) n(Li3P) = n(PH3) = 0,25 моль
m(Li3P) = 0,25 · 52 = 13 г;
б) Пусть n(Li3N) = x моль, тогда m(Li3N) = 35x г
в) Найдем количество и массу протонов в смеси. При этом помним, что количество протонов = порядковому номеру элемента, а молярная масса одного протона составляет 1г/моль.
np+ = Np+ · n(в-ва)
Np+(Li3P) = 3 · 3 + 15 = 24
Np+(Li3N) = 3 · 3 + 7 = 16
np+(Li3P) = 24 · 0,25 = 6 моль, mp+(Li3P) = 6 г;
np+(Li3N) = 16x моль, mp+(Li3N) = 16x г;
Решим уравнение:
0,46 = (6 + 16x)/(35x + 13) ⇒ 16x + 6 = 16,1x + 5,98 ⇒ 0,02 = 0,1x ⇒ x = 0,2 моль — n(Li3N).
Найдем сразу массу нитрида лития: m(Li3N) = 35 · 0,2 = 7 г
Найдем массу и количество оставшейся соляной кислоты:
а) m(HCl) = 200 · 0,365 = 73 г
n(HCl) = 73/36,5 = 2 моль;
б) n1(HCl) = 3n(Li3P) = 3 · 0,25 = 0,75 моль
n2(HCl) = 4n(Li3N) = 4 · 0,2 = 0,8 моль
nобщ.(HCl) = 0,75 + 0,8 = 1,55 моль;
в) nост.(HCl) = 2 – 1,55 = 0,45 моль
mост.(HCl) = 0,45 · 36,5 = 16,425 г
Найдем массу раствора. Помним, что масса раствора – это всё, что смешали, минус образовавшиеся газы и осадки:
mконечн. р-ра = m(Li3N) + m(Li3P) + mр-ра(HCl) – m(PH3)
mконечн. р-ра = 13 + 7 + 200 – 8,5 = 211,5 г
Найдем ꞷост.(HCl):
ꞷост.(HCl) = (16,425/211,5) · 100% = 7,766%
Ответ: ꞷост.(HCl) = 7,766%
Задание №8
В 800 г раствора нитрата серебра, в котором общее число атомов в 110 раз больше числа Авогадро, внесли 16 г порошка меди. К образовавшемуся раствору добавили 200 г 30%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в конечном растворе.
Решение
Ответ: ꞷост.(NaOH) = 2,27%
Пояснение:
Напишем уравнения реакции:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag (I)
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3 (II)
Найдем количества веществ, данных в условии:
а) n(Cu) = 16/64 = 0,25 моль
б) m(NaOH) = 200 · 0,3 = 60 г
n(NaOH) = 60/40 = 1,5 моль
По условию, общее число атомов в 110 раз больше числа Авогадро, это можно записать так:
n(атомов) = N/NA , где N = 110NA , то есть: n(ат.) = 110NA/NA = 110 моль, то есть общее количество атомов равно 110 моль.
Понимаем, что в задаче говорится именно о количестве атомов – это значит, что 1 молекула H2O содержит в сумме 3 атома: 2 атома водорода и 1 атом кислорода.
n(ат.) = n(в-ва) · N
а) Обозначим n(H2O) как x моль, тогда m(H2O) = 18x г.
Если в 1 моль H2O mатомов = (2 ·1 +1) · 1 = 3г, то в x моль H2O mатомов = (2 · 1 + 1) · x = 3x г;
б) Обозначим n(AgNO3) как y моль, тогда m(AgNO3) = 170y г
Если в 1 моль AgNO3 mатомов = (1 + 1 + 3) · 1 = 5г, то в y моль AgNO3 mатомов = (1 + 1 + 3) · y = 5y г.
Составим систему уравнений:
y = 1 моль — n(AgNO3)
x = (110 – 5)/3 = 35 моль – n(H2O)
По реакции I, n(AgNO3) – в избытке, так как n1(AgNO3) = 2n(Cu) = 0,25 · 2 = 0,5 моль
nост.(AgNO3) = 1 – 0,5 = 0,5 моль
Следовательно, будет протекать следующая реакция:
2AgNO3 + 2NaOH = Ag2O + 2NaNO3 + H2O (III)
Найдем количество вещества и массу оставшегося NaOH:
а) n2(NaOH) = 2n(Cu(NO3)2) = 2n1(Cu) = 0,5 моль
n3(NaOH) = n(AgNO3) = 0,5 моль
nост.(NaOH) = 1,5 – 0,5 – 0,5 = 0,5 моль;
б) mост.(NaOH) = 0,5 · 40 = 20 г;
Составим уравнение массы конечного раствора. Помним, что масса раствора – это всё, что смешали, минус образовавшиеся газы и осадки:
mконеч. р-ра = mр-ра(AgNO3) + m(Cu) – m(Ag) + mр-ра(NaOH) – m(Cu(OH)2) – m(Ag2O)
Найдем недостающие данные:
а) n(Ag) = 2n(Cu) = 0,5 моль
m(Ag) = 108 · 0,5 = 54 г;
б) n2(Cu(OH)2) = n(Cu(NO3)2) = 0,25 моль
m(Cu(OH)2) = 0,25 · 98 = 24,5 г;
в) n(Ag2O) = 0,5n3(AgNO3) = 0,5 · 0,5 = 0,25моль
m(Ag2O) = 0,25 · 232 = 58 г;
г) mконеч. р-ра = 800 + 16 – 54 + 200 – 24,5 – 58 = 879,5 г
Найдем ꞷост.(NaOH):
ꞷост.(NaOH) = (20/879,5) · 100% = 2,27%
Ответ: ꞷост.(NaOH) = 2,27%
Задание №9
Смесь нитрата железа(II) и нитрата железа(III), в которой масса протонов в ядрах всех атомов составляет 49,07% от общей массы смеси, прокалили до постоянной массы. Твёрдый остаток растворили в избытке соляной кислоты. При этом образовалось 299 г раствора с массовой долей соли 25%. Вычислите массу исходной смеси нитратов.
Решение
Ответ: mсмеси = 98,92 г
Пояснение:
Запишем уравнения реакций:
4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2 (I)
4Fe(NO3)3 = 2Fe2O3 + 12NO2 + 3O2 (II)
Fe2O3 + 6HCl = 2FeCl3 + 3H2O (III)
Найдем массу и количество FeCl3. Так как смесь прокалили до постоянной массы, разложение полное и твердый остаток составляет только хлорид железа (III).
m(FeCl3) = 299 · 0,25 = 74,75 г
n(FeCl3) = 74,75/162,5 = 0,46 моль
По условию масса протонов составляет 0,4907 от общей массы смеси, по сути, та же массовая доля протонов. Составим для нее уравнение:
0,4907 = (mp+(Fe(NO3)2 + Fe(NO3)3))/m(Fe(NO3)2 + Fe(NO3)3)
а) Помним, что молярная масса одного протона составляет 1г/моль. Найдем массу протонов в ядрах смеси.
а) Обозначим n(Fe(NO3)3) за x моль, тогда m(Fe(NO3)3) = 242x г. А n(Fe(NO3)2) за y моль, тогда m(Fe(NO3)2) = 180y г.
б) np+ = Np+ · n(в-ва)
Np+(Fe(NO3)3) = 26 + 21 + 72 = 119; Np+(Fe(NO3)2) = 26 + 14 + 48 = 88;
mp+(Fe(NO3)3) = 119x г; mp+(Fe(NO3)2) = 88y г;
в) Составим 1ое уравнение системы:
0,4907 = (119x + 88y)/(242x + 180y) ⇒ 0,4907(242x + 180y) = 119x + 88y
Обратим внимание, что FeCl3 образуется из Fe2O3, который образуется после разложения двух нитратов.
n(Fe2O3) = 2/4n(Fe(NO3)3) + 2/4n(Fe(NO3)2) = 0,5(n(Fe(NO3)3) + n(Fe(NO3)2)) = 0,5(x + y) – моль;
n(FeCl3) = 2n(Fe2O3) = 2 · 0,5(x + y) = x + y = 0,46 моль – 2о-е уравнение системы.
Решим систему уравнений:
y = 0,2, т.е. n(Fe(NO3)2) = 0,2 моль,
x = 0,26, т.е. n(Fe(NO3)3) = 0,26 моль
Найдем массу смеси:
m(Fe(NO3)3) + m(Fe(NO3)2) = 242 · 0,26 + 180 · 0,2 = 62,92 + 36 = 98,92 г
Ответ: mсмеси = 98,92 г
Задание №10
Смесь нитрата натрия и нитрата серебра общей массой 42,5 г, в которой масса протонов в ядрах всех атомов составляет 48% от массы смеси, прокалили до постоянной массы. Выделившуюся смесь газов пропустили через 10 мл воды. Вычислите массовую долю растворённого вещества в образовавшемся растворе.
Решение
Ответ: ꞷ(HNO3) = 40,9%
Пояснение:
2NaNO3 = 2NaNO2 + O2 (I)
2AgNO3 = 2Ag + 2NO2 + O2 (II)
4NO2 + O2 + 2H2O = 4HNO3 (III)
1) По условию, масса смеси составляет 42,5 г, составим 1ое уравнение системы:
Пусть n(NaNO3) = x моль, тогда m(NaNO3) = 85x г;
Пусть n(AgNO3) = y моль, тогда m(AgNO3) = 170y г;
Составим первое уравнение системы: 85x + 170y = 42,5 г
2) Найдем количество и массу протонов в ядрах смеси. При этом помним, что для атома химического элемента количество протонов совпадает с порядковым номером элемента, а молярная масса одного протона составляет 1г/моль.
а) np+ = Np+ · n(в-ва)
Np+(NaNO3) = 11 + 7 + 24 = 42
np+(NaNO3) = 42x моль; mp+(NaNO3) = 42x · 1 = 42x г
Np+(AgNO3) = 47 + 7 + 24 = 78
np+(AgNO3) = 78y моль; mp+(AgNO3) = 78y · 1 = 78y г
б) Составим второе уравнение системы:
0,48 = (mp+(NaNO3 + AgNO3))/m(NaNO3 + AgNO3)
0,48 = (42x + 78y)/(85x + 170y) ⇒ 3y = x
3) Составим и решим систему уравнений:
y = 0,1, т.е. n(AgNO3) = 0,1 моль,
x = 0,3, т.е. n(NaNO3) = 0,3 моль
4) Сравним количества NO2 и O2 в реакции (III):
а) nобщ.(O2) = 0,5n(NaNO3) + 0,5 n(AgNO3) = 0,15 + 0,05 = 0,2 моль
n(NO2) = n(AgNO3) = 0,1 моль;
б) n(NO2)/4 < n(O2)/1 , так как 0,025 < 0,2 – следовательно n(NO2) в недостатке, расчет будем вести по нему.
5) Найдем n(O2), которое израсходовалось в реакции.
n(O2) = 1/4n(NO2) = 1/4 ·0,1 = 0,025 моль
m(O2) = 0,025 · 32 = 0,8 г;
6) Найдем количество и массу HNO3:
n(HNO3) = n(NO2) = 0,1 моль
m(HNO3) = 0,1 · 63 = 6,3 г;
7) Найдем массу раствора:
mконеч. р-ра = m(NO2) + mистр.(O2) + m(H2O)
а) Найдем недостающие данные:
m(NO2) = 0,1 · 46 = 4,6 г
m(H2O) = V(H2O) · ρ(H2O) = 10 · 1 = 10г;
б) mконеч. р-ра = 4,6 + 0,8 + 10 = 15,4 г;
8) Найдем ꞷ(HNO3):
ꞷ(HNO3) = (6,3/15,4) · 100% = 40,9%
Ответ: ꞷ(HNO3) = 40,9%
Задание №11
Смесь нитрата магния и нитрата серебра, в которой масса протонов в ядрах всех атомов составляет 48,32% от общей массы смеси, прокалили до постоянной массы. Выделившуюся смесь газов пропустили через 800 мл воды. При этом объём непоглотившегося газа составил 13,44 л (н.у.). Вычислите массовую долю растворённого вещества в образовавшемся растворе.
Решение
Ответ: ꞷ(HNO3) = 48,1 %
Пояснение:
2Mg(NO3)2 = 2MgO + 4NO2 + O2
2AgNO3 = 2Ag + 2NO2 + O2
4NO2 + O2 + 2H2O = 4HNO3
1) По условию, масса протонов в ядрах всех атомов составляет 46%. Напишем уравнение:
ꞷp+ = (mp+(Mg(NO3)2 + AgNO3)/m(Mg(NO3)2 + AgNO3)
Найдем недостающие данные.
Пусть n(Mg(NO3)2) = x моль, тогда m(Mg(NO3)2) = 148x г
Пусть n(AgNO3) = y моль, тогда m(AgNO3) = 170y г;
2) Найдем количество и массу протонов в смеси. При этом помним, что количество протонов = порядковому номеру элемента, а молярная масса одного протона составляет 1г/моль.
а) np+ = Np+ · n(в-ва)
np+(Mg(NO3)2) = (12 + 14 + 48)x = 74x моль
np+(AgNO3) = (47 + 7 + 24)y = 78y моль
б) mp+ = np+ · 1г/моль
mp+(Mg(NO3)2) = 74x г;
mp+(AgNO3) = 78y г
3) Решим уравнение:
0,4832 = (74x + 78y)/(148x + 170y) ⇒ 2,49x = 4,14y ⇒ x = 1,66y
4) Найдем и сравним количества веществ в 3 реакции, при этом примем x = 1,66y:
а) nобщ.(NO2) = 2n(Mg(NO3)2) + n(AgNO3) = 2x + y = 4,32y моль
nобщ.(O2) = 0,5n(Mg(NO3)2) + 0,5n(AgNO3) = 0,5(x+y) = 1,33y моль
б)n(NO2)/4 < n(O2)/1, так как 1,08y < 1,32y – следовательно, n(NO2) в недостатке, расчет будем вести по нему.
P.S. А вообще можно было бы избежать этих всех расчетов и просто оценить избыток/недостаток по соотношению коэффициентов в реакции. Обратим внимание, что в 3й реакции соотношение
n(NO2) : n(O2) = 4 : 1
В 1о-й реакции соотношение n(NO2) : n(O2) такое же (4 : 1) – это значит, что вещества истратились полностью.
Во 2о-й реакции соотношение n(NO2) : n(O2) = 2 : 1 (или 4 : 2) – это значит, что NO2 истратился полностью, а часть O2 нет, соответственно n(O2) – в избытке.
nост.(O2) = 13,44/22,4 = 0,6 моль
Составим уравнение для nобщ.(O2):
nобщ.(O2) = nреаг.(О2) + nост.(О2)
nреаг.(О2) = 1/4n(NO2) = (2x + y)/4 моль
0,5x + 0,5y = (2x + y)/4 + 0,6 ⇒ y = 2,4 моль – n(AgNO3).
x = 1,66 · 2,4 = 3,98 = 4 моль – n(Mg(NO3)2);
Найдем количество и массу HNO3:
n(HNO3) = n(NO2) = 2 · 4 + 2,4 = 10,4 моль
m(HNO3) = 10,4 · 63 = 655,2 г;
Найдем массу раствора:
mконеч. р-ра = m(NO2) + mистр.(O2) + m(H2O)
а) Найдем недостающие данные:
m(NO2) = 10,4 · 46 = 478,4 г
m(H2O) = V(H2O) · ρ(H2O) = 800 · 1 = 800г;
nреаг.(О2) = 1/4n(NO2) = 2,6 моль
mреаг.(О2) = 2,6 · 32 = 83,2 г
б) mконеч. р-ра = 478,4 + 83,2 + 800 = 1361,6 г;
8) Найдем ꞷ(HNO3):
ꞷ(HNO3) = (655,2/1361,6) · 100% = 48,1%
Ответ: ꞷ(HNO3) = 48,1 %
Задание №12
К 112 г 30%-ного раствора гидроксида калия добавили 13 г цинка. После окончания реакции к образовавшемуся раствору прилили 245 г 20%-ного раствора серной кислоты. Известно, что в условиях, при которых была проведена реакция, растворимость сульфата цинка составляет 57,7 г на 100 г воды, растворимость сульфата калия – 12,0 г на 100 г воды. Вычислите массу выпавшего осадка.
Решение
Ответ: m(K2SO4) = 18 г
Пояснение:
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2 (I)
1) Найдем количества веществ, данных в условии.
а) m(KOH) = 112 · 0,3 = 33,6 г
n(KOH) = 33,6 / 56 = 0,6 моль
б) n(Zn) = 13 / 65 = 0,2 моль
2) Сравним количества реагентов:
n(Zn)/1 < n(KOH)/2, следовательно n(KOH) – в избытке.
nост.(KOH) = 0,6 – n1(KOH) = 0,6 – 2n(Zn) = 0,6 – 0,4 = 0,2 моль
Дальше к полученному раствору добавляют серную кислоту. Обратим внимание, что протекать у нас могут 2 реакции (так как в растворе осталась и комплексная соль, и щелочь). Однако в первую очередь будет протекать реакция нейтрализации, так как ее скорость выше.
2KOH + H2SO4 = K2SO4 + 2H2O (II)
3) Найдем n(H2SO4):
m(H2SO4) = 245 · 0,2 = 49 г
n(H2SO4) = 49 / 98 = 0,5 моль
4) Сравним количества веществ в реакции 2:
n(KOH)/2 < n(H2SO4)/1 , следовательно n(H2SO4) – в избытке. Найдем nост.(H2SO4):
nост.(H2SO4) = 0,5 – n2(H2SO4) = 0,5 – 1/2n2(KOH) = 0,5 – 0,1 = 0,4 моль
5) Сравним соотношение n(K2[Zn(OH)4]) и n(H2SO4):
n1(K2[Zn(OH)4]) = n(Zn) = 0,2 моль
n(H2SO4)/ n(K2[Zn(OH)4]) = 0,4/0,2 = 2/1– следовательно, n(K2[Zn(OH)4]) : n(H2SO4) = 1 : 2
Значит будет протекать следующая реакция:
K2[Zn(OH)4] + 2H2SO4 = K2SO4 + ZnSO4 + 4H2O (III)
6) В условии просят найти массу выпавшего осадка. Так как в «привычный» осадок в уравнениях реакций ничего не выпадает, а в условии дана растворимость двух солей, приходим к выводу, что в осадок будет выпадать одна или две соли (нужно проверить). Здесь необходимо вспомнить понятие о насыщенном растворе. После того, как содержание соли в растворе превышает значение её растворимости при данной температуре, часть соли кристаллизуется и выпадает в осадок.
7) Найдем количества и массу двух солей:
а) n(K2SO4) = n2(K2SO4) + n3(K2SO4) = 1/2n2(KOH) + n(K2[Zn(OH)4]) = 0,1 + 0,2 = 0,3 моль
m(K2SO4) = 0,3 · 174 = 52,2 г
б) n(ZnSO4) = n(K2[Zn(OH)4]) = 0,2 моль
m(ZnSO4) = 0,2 · 161 = 32,2 г
8) Так как в условии растворимость дается на 100 г воды, необходимо найти массу воды в конечном растворе.
m(H2O) = mконеч. р—ра – m(K2SO4) –m(ZnSO4)
а) mконеч. р—ра = mр—ра(KOH) + m(Zn) – m(H2) + mр—ра(H2SO4)
Найдем недостающие данные:
n(H2) = n(Zn) = 0,2 моль
m(H2) = 0,2 · 2 = 0,4 г
mконеч. р-ра = 112 + 13 – 0,4 + 245 = 369,6 г
б) m(H2O) = 369,6 – 52,2 – 32,2 = 285,2 г
9) Проанализируем растворимость для двух солей. Составим пропорции:
а) для K2SO4: если в 100 г воды растворяется 12 г соли, то в 285,2 г воды растворяется x г соли:
x = (285,2 · 12)/100 = 34,2 г соли способно раствориться. По расчетам в задаче образовалось 52,2 г соли.
52,2 – 34,2 = 18 г – K2SO4 выпадет в осадок.
б) для ZnSO4: если в 100 г воды растворяется 57,7 г соли, то в 285,2 г воды растворяется y г соли:
y = (285,2 · 57,7)/100 = 164,56 г соли способно раствориться. По расчетам в задаче образовалось 32,2г соли. Масса образовавшейся соли не превышает растворимость, поэтому ZnSO4 в осадок не выпадает.
Ответ: m(K2SO4) = 18 г
Задание №13
Алюминий массой 8,1 г сплавили с 9,6 г серы. Полученную смесь растворили в 96 г насыщенного раствора гидроксида натрия. Вычислите массу выпавшего осадка. Растворимость гидроксида натрия составляет 100 г на 100 г воды, растворимость сульфида натрия в условиях реакции – 20,6 г на 100 г воды.
Решение
Ответ: m(Na2S) = 14,62 г
Пояснение:
1) Для начала сравним количества веществ в 1ой реакции и определим, какое из них находится в избытке.
а) n(Al) = 8,1 / 27 = 0,3 моль
n(S) = 9,6 / 32 = 0,3 моль
б)n(S)/3 < n(Al)/2 , так как 0, 1 < 0,15 – следовательно, n(Al) – избыток, n(S) – недостаток.
Сразу определим nост.(Al) и nобр.(Al2S3)
nост.(Al) = 0,3 – 2/3n(S) = 0,3 – 0,2 = 0,1 моль;
nобр.(Al2S3) = 1/3n(S) = 1/3 · 0,3 = 0,1 моль;
2) Полученную смесь веществ составляют 0,1 моль Al и 0,1 моль Al2S3. Запишем реакции:
Al2S3 + 8NaOH = 2Na[Al(OH)4] + 3Na2S (II)
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2 (III)
3) Найдем количество NaOH. В условии дана его растворимость, а также сказано о том, что раствор насыщенный. По растворимости найдем массу NaOH.
ρ(NaOH) = 100 г на 100 г воды, можно записать это в расчете на массу раствора, то есть 100 г (NaOH) на 200 г раствора NaOH. Составим пропорцию:
Если в 200 г насыщенного раствора растворяется 100 г NaOH, то в 96 г насыщенного раствора растворяется x г NaOH.
x = (100 · 96) / 200 = 48 г – m(NaOH)
n(NaOH) = 48 / 40 = 1,2 моль
4) Найдем nост.(NaOH):
nост.(NaOH) = 1,2 – n2(NaOH) – n3(NaOH) = 1,2 – 8n(Al2S3) – n3(Al) = 1,2 – 0,8 – 0,1 = 0,3 моль
mост.(NaOH) = 40 · 0,3 = 12 г
5) В условии просят найти массу выпавшего осадка. Так как в «привычный» осадок в уравнениях реакций ничего не выпадает, а в условии дана растворимость NaOH и Na2S, приходим к выводу, что в осадок будут выпадать оба вещества или одно из них. Также необходимо вспомнить понятие о насыщенном растворе. После того, как содержание соли в растворе превышает значение её растворимости при данной температуре, часть соли кристаллизуется и выпадает в осадок.
6) Найдем m(Na2S):
n(Na2S) = 3n(Al2S3) = 0,1 · 3 = 0,3 моль
m(Na2S) = 0,3 · 78 = 23,4 г
7) Так как в условии растворимость дается на 100 г воды, необходимо найти массу воды в конечном растворе.
m(H2O) = mконеч. р-ра – m(Na2S) – m(Na[Al(OH)4]) – mост.(NaOH)
а) mконеч. р-ра = m(Al) + m(S) – m(H2) + mр-ра(NaOH)
Найдем недостающие данные:
n(H2) = 3/2n3(Al) = 3/2 · 0,1 = 0,15 моль
m(H2) = 0,15 · 2 = 0,3 г
n(Na[Al(OH)4]) = 2n(Al2S3) + n(A
mконеч. р-ра = 8,1 + 9,6 – 0,3 + 96 = 113,4 г
б) m(H2O) = 113, 4 – 23,4 – 35,4 – 12 = 42,6 г
8) Проанализируем растворимость для Na2S и NaOH. Составим пропорции:
а) для Na2S: если в 100 г воды растворяется 20,6 г соли, то в 42,6 г воды растворяется x г соли:
x = (20,6 · 42,6)/100 = 8,78 г соли способно раствориться. По расчетам в задаче образовалось 23,4 г соли.
23,4 – 8,78 = 14,62 г – K2SO4 выпадет в осадок.
б) для NaOH: если в 100 г воды растворяется 100 г гидроксида , то в 42,6 г воды растворяется y г NaOH:
y = (42,6 ·100 )/100 = 42,6 г соли способно раствориться. По расчетам в задаче образовалось 12 г NaOH. Масса образовавшегося NaOH не превышает растворимость, поэтому NaOH в осадок не выпадает.
Ответ: m(Na2S) = 14,62 г
Задание №14
Кристаллогидрат нитрата железа(II), в котором массовая доля протонов в ядрах всех атомов составляет 52,05%, прокалили до постоянной массы. Твёрдый остаток растворили в 300 г йодоводородной кислоты, взятой в избытке. Через образовавшуюся смесь пропустили сернистый газ, при этом прореагировало 2,24 л (н.у.) газа. Вычислите массовую долю соли йодоводородной кислоты в конечном растворе и массу исходного кристаллогидрата.
Решение
Ответ: m(Fe(NO3)2 ∙ 9H2O) = 68,4 г; ꞷ(FeI2) = 19,23%
Пояснение:
Записать разложение кристаллогидрата сразу мы не можем, так как нам неизвестно соотношение безводной соли и воды в кристаллогидрате, но мы можем записать его в общем виде для начала. Важно(!) в конце всех расчетов не забыть записать правильное уравнение:
4Fe(NO3)2 ∙ nH2O = 2Fe2O3 + 8NO2 + O2 + 4nH2O (I)
Дальше можем записать остальные уравнения:
Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O (II)
SO2 + I2 + 2H2O = H2SO4 + 2HI (III)
Можем сразу найти n(SO2):
n(SO2) = 2,24 / 22,4 = 0,1 моль
Далее найдем n(I2), n(Fe2O3), так как они взаимосвязаны:
n(I2) = n(SO2) = 0,1 моль
n(Fe2O3) = n(I2) = 0,1 моль
По количеству оксида железа (III) найдем количество безводной соли в кристаллогидрате и заодно ее массу:
n(Fe(NO3)2) = 4/2n(Fe2O3) = 2 · 0,1 = 0,2 моль
m(Fe(NO3)2) = 0,2 · 180 = 36 г
Известно, что массовая доля протонов в ядрах всех атомов кристаллогидрата составляет 52,05%. Составим уравнение для неё:
ꞷp+ = mp+(Fe(NO3)2) · mp+(H2O) / m(Fe(NO3)2 ∙ nH2O)
Пусть n(H2O) = x моль, тогда m(H2O) = 18x г
Найдем количество и массу протонов в ядрах кристаллогидрата. При этом помним, что количество протонов = порядковому номеру элемента, а молярная масса одного протона составляет 1г/моль.
а) np+ = Np+ ∙ n(в-ва)
np+(Fe(NO3)2) = (26 + 14 + 48) · 0,2 = 17,6 моль
np+(H2O) = (2 + 8)x = 10x моль
б) mp+ = np+ · 1г/моль
mp+( Fe(NO3)2) = 17,6 г;
mp+(H2O) = 10x г
Решим уравнение:
0, 5205 = (17,6 + 10x) / (36 + 18x)
18,738 + 9,369x = 17,6 + 10x
1,138 = 0,631x
x = 1,8 моль – n(H2O) в кристаллогидрате, m(H2O) = 1,8 · 18 = 32,4 г
Найдем общую массу кристаллогидрата, а затем его молярную массу, так как зная молярную массу можно вывести его формулу. При этом помним, что количество кристаллогидрата равно количеству его безводной соли, так как в 1 формульной единице кристаллогидрата содержится 1 формульная единица безводной соли.
m(Fe(NO3)2∙nH2O) = m(Fe(NO3)2) + m(H2O) = 36 + 32,4 = 68,4 г
M(Fe(NO3)2∙nH2O) = m/n
M(Fe(NO3)2∙nH2O) = 68,4/0,2 = 342 (г/моль).
Учитывая, что M(Fe(NO3)2∙nH2O) = M(Fe(NO3)2) + M(H2O) – найдем молярную массу воды, а из нее и количество молекул воды в кристаллогидрате.
M(H2O) = 342 – 180 = 162 (г/моль), N(H2O) = 162/18 = 9 молекул воды содержит 1 формульная единица кристаллогидрата.
Формула кристаллогидрата: Fe(NO3)2∙9H2O. Не забываем уравнять 1-ую реакцию(!)
4Fe(NO3)2∙9H2O = 2Fe2O3 + 8NO2 + O2 + 36H2O
Найдем количество и массу соли йодоводородной кислоты – FeI2:
n(FeI2) = 2n(Fe2O3) = 2 · 0,1 = 0,2 моль
m(FeI2) = 0,2 · 310 = 62 г
Найдем массу конечного раствора. При этом помним, что для расчета массы раствора необходимо сложить массы всех добавленных субстанций и вычесть из этого массу всех газов и осадков. Обратим внимание, что выпавший йод в реакции (II), израсходовался в реакции (III). Фактически это означает, что массу йода надо сначала вычесть затем прибавить при расчете массы раствора. То есть при расчете массы раствора массу йода можно не использовать.
mконеч. р-ра = m(Fe2O3) + mр-ра(HI) + m(SO2)
Найдем недостающие данные:
m(SO2) = 0,1 · 64 = 6,4 г
m(Fe2O3) = 0,1 · 160 = 16 г
mконеч. р-ра = 16 + 300 + 6,4 = 322,4 г
Найдем массовую долю FeI2:
ꞷ(FeI2) = (62/322,4) · 100% = 19,23% .
Ответ: m(Fe(NO3)2 ∙ 9H2O) = 68,4 г; ꞷ(FeI2) = 19,23%
Задание №15
Через 440 г раствора нитрата меди(II), в котором 52,5% от общей массы раствора составляет масса протонов в ядрах всех атомов, пропускали электрический ток, используя инертные электроды. После того как на аноде выделилось 6,72 л (н.у.) газа электрический ток отключили, а электроды оставили в растворе. Определите массовую долю всех протонов в растворе после окончания всех реакций.
Решение
Ответ: ꞷp+ = 52,78%
Пояснение:
Запишем уравнение реакции электролиза:
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3 (I)
1) По условию, масса протонов в ядрах всех атомов составляет 52,5% от общей массы раствора. Найдем массу протонов:
(440/100) · 52,5 = 231 г
Пусть n(Cu(NO3)2) = x моль, m(Cu(NO3)2) = 188x г.
Пусть n(H2O) = y моль, m(H2O) = 18y г.
Составим первое уравнение системы: 188x + 18y = 440
Найдем количество протонов в ядрах всех атомов. При этом помним, что количество протонов численно равно порядковому номеру элемента в периодической системе, а молярная масса протона составляет 1г/моль.
а) np+ = Np+ ∙ n(в-ва)
np+(Cu(NO3)2) = (29 + 14 + 48) · x = 91x моль
np+(H2O) = (2 + 8)y = 10y моль
б) mp+ = np+ · 1г/моль
mp+(Cu(NO3)2) = 91x г;
mp+(H2O) = 10y г
Составим второе уравнение системы: 91x + 10y = 231
2) Решим систему уравнений:
24,2x = 24,2
x = 1 моль – n(Cu(NO3)2)
y = 14 моль – n(H2O)
3) Дальше необходимо проверить, идет ли далее электролиз воды. Для этого нам необходимо рассчитать количество выделившегося на аноде газа и сравнить его с тем количеством, которое бы выделилось, если бы электролиз соли прошел полностью.
n(газа) = 6,72/22,4 = 0,3 моль
n1(O2) = 0,5n(Cu(NO3)2) = 0,5 · 1 = 0,5 моль
0,3 < 0,5 – из чего делаем вывод, что электролиза воды не было, но электролиз соли прошел не полностью, и часть её осталась в растворе.
4) В условии сказано, что электроды после окончания электролиза оставили в растворе, поэтому кислота из анодного пространства стала растворять медь, образовавшуюся на катоде.
5) Чтобы записать следующую реакцию, необходимо знать концентрацию азотной кислоты, так как реакция может протекать с образованием NO либо NO2.
Обратим внимание, что количество веществ в 1ой реакции дальше нужно считать по количеству выделившегося кислорода, так как он в недостатке.
n(HNO3) = 4n(O2) = 0,3 · 4 = 1,2 моль
m(HNO3) = 1,2 · 63 = 75,6 г
Найдем массу раствора после1ой реакции:
mр—ра 1 = mр—ра(Cu(NO3)2) – m(Cu) – m(O2)
mр-ра 1 = 440 – (2n(O2) ·64) – (0,3 · 32) = 440 – 38,4 – 9,6 = 392 г
Найдем концентрацию HNO3:
ꞷ(HNO3) = (75,6/392) · 100% = 19,28% — следовательно, кислота разбавленная, поэтому растворение меди протекает с образованием NO.
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O (II)
6) Сравним количества меди и азотной кислоты и определим избыток/недостаток.
n(HNO3)/8 < n(Cu)/3 = 1,2/8 < 0,6/3 = 0,15 < 0,2 – следовательно, HNO3 в недостатке.
Найдем количество и массу прореагировавшей меди:
n2(Cu) = 3/8n(HNO3) = 0,45 моль
m2(Cu) = 0,45 · 64 = 28,8 г
7) В задаче просят найти массовую долю протонов в растворе после окончания всех реакций. Для начала нам необходимо определиться с тем, какие вещества остались в растворе. Это: нитрат меди (II) и вода.
а) Найдем общее количество и массу нитрата меди(II):
nобщ.(Cu(NO3)2) = n1 ост.(Cu(NO3)2) + n2 обр.(Cu(NO3)2)
nобщ.(Cu(NO3)2) = (1 – 2n1(O2)) + 3/8n(HNO3) = 1 – 0,6 + 0,45 = 0,85 моль
mобщ.(Cu(NO3)2) = 0,85 · 188 = 159,8 г
б) Найдем общее количество воды:
m(H2O) = mконечн. р-ра – m(Cu(NO3)2)
mконечн. р-ра = mр-ра 1 + mпрореаг.(Cu) – m(NO)
mконечн. р-ра = 392 + 28,8 – (2/8n(HNO3) · 30) = 392 + 28,8 – 9 = 411,8 г
m(H2O) = 411, 8 – 159,8 = 252 г
n(H2O) = 252/18 = 14 моль
8) Найдем количество и массу протонов в конечном растворе. При этом помним, что количество протонов = порядковому номеру элемента, а молярная масса одного протона составляет 1г/моль.
а) np+ = Np+ ∙ n(в-ва)
np+(Cu(NO3)2) = (29 + 14 + 48) · 0,85 = 77,35 моль
np+(H2O) = (2 + 8) · 14 = 140 моль
б) mp+ = np+ · 1г/моль
mp+(Cu(NO3)2) = 77,35 г;
mp+(H2O) = 140 г
9) Найдем ꞷp+:
ꞷp+ = (77,35 + 140)/411,8 · 100% = 52,78% .
Ответ: ꞷp+ = 52,78%
Задание №16
Через 526,5 г раствора хлорида натрия, в котором массовая доля протонов в ядрах всех атомов составляет 54,7%, пропускали электрический ток до тех пор, пока на аноде не выделилось 22,4 л (н.у.) газа. К образовавшемуся в результате электролиза раствору добавили 13 г цинка. Определите массовую долю всех протонов в конечном растворе.
Решение
Ответ: ꞷp+ = 54,8%
Пояснение:
2NaCl + 2H2O = H2 + Cl2 + 2NaOH (I)
1) По условию, масса протонов в ядрах всех атомов составляет 54,7% от общей массы раствора. Найдем массу протонов:
(526,5/100) · 54,7 = 288 г
Пусть n(NaCl) = x моль, тогда m(NaCl) = 58,5x г
Пусть n(H2O) = y моль, тогда m(H2O) = 18y г
Составим 1-е уравнение системы: 58,5x + 18y = 526,5
2) Найдем количество протонов в ядрах всех атомов. При этом помним, что количество протонов = порядковому номеру элемента, а молярная масса одного протона составляет 1г/моль.
а) np+ = Np+ ∙ n(в-ва)
np+(NaCl) = (11 + 17) · x = 28x моль
np+(H2O) = (2 + 8)y = 10y моль
б) mp+ = np+ · 1г/моль
mp+(NaCl) = 28x г;
mp+(H2O) = 10y г
Составим второе уравнение системы: 28x + 10y = 288
3) Решим систему уравнений:
8,1x = 8,1
x = 1, т.е. n(NaCl) = 1 моль
y = 26, т.е. n(H2O) = 26 моль
4) Дальше необходимо проверить, идет ли электролиз воды. Для этого нам необходимо рассчитать количество выделившегося на аноде газа и сравнить его с тем количеством, которое бы выделилось, если бы электролиз соли прошел полностью.
n(газа) = 22,4/22,4 = 1 моль
n1(Cl2) = 0,5n(NaCl) = 0,5 · 1 = 0,5 моль
m1(Cl2) = 0,5 · 71 = 35,5 г – выделилось при электролизе соли.
0,5 < 1 – из чего делаем вывод, что помимо электролиза соли также шел и электролиз воды.
Запишем вторую и третью реакцию.
2H2O = 2H2 + O2 (II)
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2 (III)
Найдем сразу количество цинка: n(Zn) = 13/65 = 0,2 моль
5) Из прошлого пункта мы понимаем, что n(газа) = n(Cl2) + n(O2). Можем найти количество и массу кислорода во второй реакции:
n(O2) = 1 – 0,5 = 0,5 моль;
m(O2) = 0,5 · 32 = 16 г
6) В задаче просят найти массовую долю протонов в растворе после окончания всех реакций. Для начала нам необходимо определиться с тем, какие вещества остались в растворе. Это: NaOH, H2O, Na2[Zn(OH)4].
а) Найдем общее количество и массу NaOH:
nост.(NaOH) = nобр.(NaOH) – nистр.(NaOH)
nост.(NaOH) = 2n1(Cl) – 2n(Zn) = 1 – 0,4 = 0,6 моль
mост.(NaOH) = 0,6 · 40 = 24 г
б) Найдем общее количество и массу Na2[Zn(OH)4]:
n(Na2[Zn(OH)4]) = n(Zn) = 0,2 моль
m(Na2[Zn(OH)4]) = 0,2 · 179 = 35,8 г
в) Сразу найти количество и массу H2O нельзя, так как:
m(H2O) = mконечн. р-ра – m(NaOH) – m(Na2[Zn(OH)4])
Поэтому сначала найдем массу конечного раствора. При этом помним, что масса раствора – это всё, что смешали, минус образовавшиеся газы и осадки.
mконечн. р-ра = mр-ра(NaCl) – m1(H2) – m1(Cl2) – m2(H2) – m2(O2) + m(Zn) – m3(H2)
Найдем недостающие данные:
n1(H2) = n1(Cl2) = 0,5 моль; m1(H2) = 0,5 · 2 = 1 г
n2(H2) = 2n2(O2) = 1 моль; m1(H2) = 1 · 2 = 2 г
n3(H2) = n(Zn) = 0,2 моль; m1(H2) = 0,2 · 2 = 0,4 г
Найдем массу конечного раствора:
mконечн. р-ра = 526,5 – 1 – 35,5 – 2 – 16 + 13 – 0,4 = 484,6 г
Теперь мы можем найти количество и массу воды:
m(H2O) = 484,6 – 24 – 35,8 = 424,8 г; n(H2O) = 424,8/18 = 23,6 моль
7) Найдем количество и массу протонов в конечном растворе. При этом помним, что количество протонов = порядковому номеру элемента, а молярная масса одного протона составляет 1г/моль.
а) np+ = Np+ ∙ n(в-ва)
np+(NaOH) = (11 + 8 + 1) · 0,6 = 12 моль
np+(H2O) = (2 + 8) · 23,6 = 236 моль
np+(Na2[Zn(OH)4]) = (11 · 2 + 30 + 8 ·4 + 4 · 1) · 0,2 = 17,6 моль
б) mp+ = np+ · 1г/моль
mp+(NaOH) = 12 г;
mp+(H2O) = 236 г
mp+( Na2[Zn(OH)4]) = 17,6 г
8) Найдем ꞷp+ :
ꞷp+ = (12 + 236 + 17,6)/484,6 · 100% = 54,8%
Ответ: ꞷp+ = 54,8%
Задание №17
Через 500 г раствора хлорида бария, в котором 53% от общей массы раствора составляет масса протонов в ядрах всех атомов, пропускали электрический ток до тех пор, пока на аноде не выделилось 8,96 л (н.у.) газа. К образовавшемуся в результате электролиза раствору добавили 63,6 г карбоната натрия. Определите массовую долю карбоната натрия в конечном растворе.
Решение
Ответ: ꞷост.(Na2CO3) = 2,43 %
Пояснение:
BaCl2 + 2H2O = H2 + Cl2 + Ba(OH)2 (I)
По условию, масса протонов в ядрах всех атомов составляет 54,7% от общей массы раствора. Найдем массу протонов:
(500/100) · 53 = 265 г
Пусть n(BaCl2) = x моль, тогда m(BaCl2) = 208x г
Пусть n(H2O) = y моль, тогда m(H2O) = 18y г
Составим первое уравнение системы: 208x + 18y = 500
Найдем количество протонов в ядрах всех атомов. При этом помним, что количество протонов равно порядковому номеру элемента, а молярная масса одного протона составляет 1г/моль. Если забыли об этом вспоминаем состав атома водорода — 1 протон и 1 электрон, масса электрона пренебрежимо мала, поэтому можно считать, что масса протона равна массе одного атома водорода.
а) np+ = Np+ ∙ n(в-ва)
np+(BaCl2) = (56 + 17 · 2) · x = 90x моль
np+(H2O) = (2 + 8)y = 10y моль
б) mp+ = np+ · 1г/моль
mp+(BaCl2) = 90x г;
mp+(H2O) = 10y г
Составим 2-е уравнение системы: 90x + 10y = 265 г
Решим систему уравнений:
46x = 23
x = 0,5, т.е. n(BaCl2) = 0,5 моль,
y = 22, т.е. n(H2O) = 22 моль.
Дальше необходимо проверить, идет ли электролиз воды. Для этого нам необходимо рассчитать количество выделившегося на аноде газа и сравнить его с тем количеством, которое бы выделилось, если бы электролиз соли прошел полностью.
n(газа) = 8,96/22,4 = 0,4 моль,
n1(Cl2) = n(BaCl2) = 0,5 моль
0,4 < 0,5 – из чего делаем вывод, что электролиза воды не было и электролиз соли прошел не полностью, и часть её осталась в растворе.
Обратим внимание, что количество веществ в 1ой реакции дальше нужно считать по количеству выделившегося хлора, так как он в недостатке.
Найдем nост.(BaCl2) = 0,5 – n1(BaCl2) = 0,5 – n(Cl2) = 0,5 – 0,4 = 0,1 моль
Запишем следующие реакции:
Ba(OH)2 + Na2CO3 = BaCO3 + 2NaOH (II)
BaCl2 + Na2CO3 = BaCO3 + 2NaCl (III)
Найдем количество добавленного карбоната натрия:
n(Na2CO3) = 63,6 / 106 = 0,6 моль
Далее найдем количество и массу оставшегося карбоната натрия, так как в задаче просят найти его массовую долю:
nост.(Na2CO3) = 0,6 – n2(Na2CO3) – n3(Na2CO3)
n2(Na2CO3) = n(Ba(OH)2) = n(Cl2) = 0,4 моль;
n3(Na2CO3) = nост.(BaCl2) = 0,1 моль;
nост.(Na2CO3) = 0,6 – 0,4 – 0,1 = 0,1 моль
mост.(Na2CO3) = 0,1 · 106 = 10,6 г
Найдем массу конечного раствора. При этом помним, что масса раствора – это всё, что смешали, минус образовавшиеся газы и осадки.
mконечн. р-ра = mр-ра(BaCl2) – m(H2) – m(Cl2) + m(Na2CO3) – mобщ.(BaCO3)
Найдем недостающие данные:
n(H2) = n(Cl2) = 0,4 моль; m(H2) = 0,4 · 2 = 0,8 г
m(Cl2) = 0,4 · 71 = 28,4 г
nобщ.(BaCO3) = n(Ba(OH)2) + nост.(BaCl2) = 0,4 + 0,1 = 0,5 моль;
mобщ.(BaCO3) = 0,5 · 197 = 98,5 г
Теперь мы можем найти массу раствора:
mконечн. р-ра = 500 – 0,8 – 28,4 + 63,6 – 98,5 = 435,9 г
Найдем ꞷост.(Na2CO3):
ꞷост.(Na2CO3) = (10,6/435,9) · 100% = 2,43 %
Ответ: ꞷост.(Na2CO3) = 2,43 %.
Как правильно рассчитать массу и массовую долю вещества в исходной смесии
Определение массы образовавшейся соли
Задача 282.
На нейтрализацию уксусной кислоты массой 120 г затрачено 50 г раствора гидроксида натрия с массовой долей вещества 40%. Определите массу образовавшейся соли.
Решение:
m(p-pa) = 50 г;
m(CH3COOH) = 120 г;
w%(NaOH) = 40% или 0,4;
M(NaOH) = 40 г/моль;
M(CH3COOH) = 60 г/моль;
m(CH3COONa) = 82 г/моль;
m(CH3COONa) = ?
Уравнение реакции имеет вид:
CH3COOH + NaOH = CH3COONa + Н2О.
Из уравнения реакции вытекает, что на образование 1 моль ацетата натрия затрачивается 1 моль гидроксида натрия и 1 моль уксусной кислоты,
т.е. n(CH3COONa) = n(CH3COOH) = n(NaOH).
Рассчитаем количество уксусной кислоты, получим:
n(CH3COOH) = m(CH3COOH)/M(CH3COOH) = 120/60 = 2 моль.
Рассчитаем количество гидроксида натрия, получим:
n(NaOH) = [w%(NaOH) . mp-pa)]/M(NaOH) = (0,4 – 50)/40 = 0,5 моль.
Таким образом, в избытке взята уксусная кислота, а в недостатке – гидроксид натрия (2 моль > 0,5 моль), поэтому расчет массы ацетата натрия будем вести по гидроксиду натрия.
Тогда
n(CH3COONa) = n(NaOH) = 0,5 моль;
m(CH3COONa) = n(CH3COONa) .M(CH3COONa) = 0,5 . 82 = 41 г.
Ответ: m(CH3COONa) = 41 г.
Определение массовой доли нитрата калия в смеси
Задача 283.
Твёрдый нитрат калия массой 50,5 г нагревали до тех пор, пока не выделился кислород, способный полностью окислить гидроксид железа (2), находящийся в водном растворе так, что при растворении продукта в избытке соляной кислоты образовалось 260 г 25 %-го раствора соли. Определите массовую долю нитрата калия в твердой смеси после нагрева.
Решение:
m(смеси) = 50,5 г;
m(p-pa) = 260 г;
w%(FeCl3) = 25%;
M(KNO3) = 101 г/моль;
М(FeCl3) = 162 г/моль;
w%(KNO3) = ?
Уравнения химических процессов:
2KNO3 = 2KNO2 + O2;
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3.
Fe(OH)3 + 3HCl = FeCl3 + 3H2O.
Из уравнений вытекает, что 2 моль KNO3 дают 1 моль О2, 1 моль О2 окисляет 4 моль Fe(OH)2 с образованием 4 моль Fe(OH)3, 1 моль Fe(OH)3 образует 1 моль FeCl3. Можно записать:
2n(KNO3) = n(O2) = 4n[Fe(OH)2] = 4n[Fe(OH)3] = 4n(FeCl3).
После приведения всех членов равенства получим:
2n(FeCl3) = n(KNO3), т.е. n(KNO3) = 1/2n(FeCl3).
1. Рассчитаем количество FeCl3 в растворе, получим:
n(FeCl3) = [m(p-pa) . w%(FeCl3)]/100%/М(FeCl3) = (260 . 25%)/100%/160 = 0,4 моль.
2. Рассчитаем количество KNO3, получим:
(KNO3 = 1/2n(FeCl3) = 0,4/2 = 0,2 моль.
3. Рассчитаем массу KNO3, получим:
m(KNO3) = n(KNO3) . M(KNO3) = 0,2 . 101 = 20,2 г.
4. Рассчитаем массовую долю нитрата калия в смеси, получим:
w%(KNO3) = [m(KNO3)/m(смеси)].100% = (22,2/50,5).100% = 40%.
Ответ: w%(KNO3) = 40%.
Определение состава исходной смеси
Задача 284.
При последовательном окислении смеси изомерных пропиловых спиртов массой 4,2 г оксидом меди (2) и аммиачным раствором оксида серебра получили 10,8 г Ag. Определите состав исходной смеси.
Решение:
m(смеси) = 4,2 г;
М(СН3-СН2-СН2-ОН) = 60 г/моль;
Ar(Ag) = 108 г/моль;
m(СН3-СН2-СН2-ОН) = ?
m[СН3-СН(ОН)-СН3] = ?
При окислении смеси изомерных пропиловых спиртов происходят процессы:
1) Первичные спирт пропанол-1 окисляются оксидом меди (2) при нагревании до альдегида, образуется пропаналь или пропионовый альдегид:
СН3-СН2-СН2-ОН + CuO = СН3-СН2-COH + Cu↓ + H2O.
2) Пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона (пропанон):
2.CH3-CH-CH3 + CuO → CH3-C=O + Cu↓ + H2O.
| |
OH CH3
Далее, при действии на смесь аммиачным раствором оксида серебра будет происходить реаакция с выделением металлического серебра – “реакция серебряного зеркала”:
СН3-СН2-COH + 2[Ag(NH3)2]OH = 2Ag + СН3-СН2-CONH3 + 3NH3 + H2O
Из уравнения реакции вытекает, что из 1 моль СН3-СН2-COH образуется 2 моль Ag,
т.е. nСН3-СН2-COH = 1/2nAg = nСН3-СН2-СН2-ОН.
Рассчитаем количество полученного серебра:
n(Ag) = m(Ag)/Ar(Ag) = 10,8/108 = 0,1 моль.
Тогда
n(СН3-СН2-СН2-ОН) = 1/2nAg = = 0,1/2 = 0,05 моль.
Рассчитаем массу пропанола-1 в смеси:
m(СН3-СН2-СН2-ОН) = n(СН3-СН2-СН2-ОН) . М(СН3-СН2-СН2-ОН) = 0,05 моль . 60 г/моль = 3 г.
Рассчитаем массу пропанола-2 в смеси:
m[СН3-СН(ОН)-СН3] = m(смеси) – m(СН3-СН2-СН2-ОН) = 4,2 – 3 = 1,2 г.
Ответ: m(СН3-СН2-СН2-ОН) = 3 г; m[СН3-СН(ОН)-СН3] = 1,2 г.
Определение массы и массовые доли металлов в смеси.
Задача 285.
При растворении смеси цинка и железа массой 535,2 г в концентрированной серной кислоте, выделился газ (или смесь газов) объемом 120,96 л (при н.у.). Реакция протекает при нагревании. Определите массы цинка и железа и массовые доли (в %) металлов в смеси.
Решение:
Vm = 22,4 л/моль;
Ar(Zn) = 65,38 г/моль;
m(смеси) = 535,2г
V(SO2) = 120,96 л;
m(Zn) = ?
m(Fe) = ?
w%(Zn) = ?
w%(Fe) = ?
Железе концентрированной кислотой пассивируется, реакция не идет.
Уравнение реакции имеет вид:
Zn + 2H2SO4 = ZnSO4 + 2H2O + SO2.
Из уравнения реакции вытекает, что 1 моль Zn требуется для выделения 1 моль SO2, т.е. n(Zn) = n(SO2).
1. Рассчитаем количество выделившегося SO2, получим:
n(SO2) = V(SO2)/Vm = 120,96/22,4 = 5,4 моль.
2. Рассчитаем массу цинка в смеси, получим:
n(Zn) = n(SO2) = 5,4 моль;
m(Zn) = n(Zn) .Ar(Zn) = 5,4 . 65,38 = 353,052 г.
3. Рассчитаем массу железа в смеси, получим:
m(Fe) = m(смеси) – m(Zn) = 535,2 – 353,052 = 182,148 г.
4. Рассчитаем массовые доли (в %) металлов в смеси, получим:
w%(Zn) = m(Zn)/m(смеси) = 353,052/535,2 = 0,66 или 66%
w%(Fe) = m(Fe)/m(смеси) = 182,148/535,2 = 0,34 или 34%.
Ответ: m(Zn) = 353,052 г; m(Fe) = 182,148 г; w%(Zn) = 66%; w%(Fe) = 34%.
Рассчет массовой долю кислоты в растворе,
Задача 286.
Рассчитайте массовую долю кислоты в растворе, полученном при смешении 95 мл воды и 10 г смеси оксида хрома(VI) и песка. Массовая доля песка в смеси 50%. Ответ укажите в процентах и округлите с точностью до десятых. Считайте, что в результате реакции образуется только хромовая кислота H2CrO4.
Решение:
m(H2O) = 95 г;
m(смесь) = 10 г;
w%(CrO3) = w%(SiO2) = 50% или 0,5;
M(H2O) = 18 г/моль;
М(H2CrO4) = 118 г/моль;
М(CrO3) = 100 г/моль;
w%(H2CrO4) = ?
Рассчитаем массу CrO3, получим:
m(CrO3) = m(смесь) . w%(CrO3) = 10 . 0,5 = 5 г.
Рассчитаем количество CrO3, получим:
n(CrO3) = m(CrO3)/М(CrO3) = 5/100 = 0,05 моль.
Уравнение реакции имеет вид:
CrO3 + H2O = H2CrO4.
Из уравнения вытекает, что на образование 1 моль H2CrO4 затрачивается 1 моль CrO3 и 1 моль Н2О,
т.е. n(H2CrO4) = n(CrO3) = n(H2O).
Тогда
n(H2CrO4) = n(CrO3) = 0,05 моль.
Рассчитаем массу H2CrO4, получим:
m(H2CrO4) = n(H2CrO4) . М(H2CrO4) = 0,05 . 118 = 5,9 г.
Так как n(H2CrO4) = n(CrO3) = n(H2O), то масса полученного раствора равна массе воды и массе оксида хрома(VI):
m(р-ра) = m(H2O) + m(CrO3) = 95 + 5 = 100 г.
Тогда
w%(H2CrO4) = [m(H2CrO4) . 100%]/m(р-ра) = (5,9 . 100%)/100 = 5,9%.
Ответ: 5,9%.
Решение задач с долей вещества в смеси, в соединении
Ключевые слова конспекта: массовая доля вещества в смеси или растворе, молярная доля вещества, объемная доля вещества, массовая доля элемента в соединении, масса элемента, массовая доля элемента.
Массовую долю вещества в смеси или растворе вычисляют как отношение массы вещества, входящего в состав смеси, к массе всей смеси. Массовую долю часто выражают в процентах. Для этого отношение массы вещества к массе смеси умножают на 100%:
Аналогично объемную долю вещества вычисляют как отношение объема вещества к объему смеси, а молярную долю вещества — как отношение количества вещества одного из компонентов смеси к сумме количеств веществ всех компонентов смеси:
Массовую долю элемента в соединении вычисляют как отношение массы элемента, входящего в состав данного соединения, к массе всего соединения:
Зная молекулярную формулу соединения, массу элемента, входящего в его состав, вычисляют как произведение молярной массы элемента на число атомов этого элемента в соединении.
В этом случае массовую долю элемента в соединении рассчитывают как отношение этой величины к молярной массе всего соединения:
Цитаты из пособия «Задачи по химии 8-9 кл.» (авт. О.С. Габриелян и др.) использованы в учебных целях. Ссылка на покупку книги указана в конце конспекта.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
25 г оксида магния смешали с 35 г оксида алюминия. Определите массовую долю оксида магния в данной смеси.
Ответ. ω(MgO) = 0,417, или 41,7%.
Задача № 2.
Вычислите объемную долю азота в смеси газов, содержащей 32 л азота, 48 л углекислого газа, 36 л гелия и 14 л водорода.
Ответ. φ(N2) = 0,246, или 24,6%.
Задача № 3.
Вычислите молярную и массовую долю (в %) оксида углерода (II) в смеси, содержащей 16,8 л (н. у.) оксида углерода (II) и 13,44 л (н. у.) оксида углерода (IV).
Ответ. χ(СО) = 55,56%, ω(СО) = 44,3%.
Задача № 4.
В воде растворили 15 г хлорида натрия. Вычислите массу полученного раствора, если массовая доля соли в нем равна 5%.
Ответ: m(р-ра) = 300 г.
Задача № 5.
Образец сплава меди с цинком имеет массу 75 г. Массовая доля меди в этом сплаве равна 64%. Определите массу цинка в данном образце.
Ответ. m(Zn) = 27 г.
[highlight]Задача № 6.[/highlight] Объемная доля аммиака в смеси с кислородом равна 40%. Вычислите плотность данной смеси по воздуху.
Посмотреть РЕШЕНИЕ
Ответ. Dвозд(смеси) = 0,896.
Задача № 7.
Найдите массовую долю кислорода в фосфате натрия.
Посмотреть РЕШЕНИЕ
Ответ. ω (O) = 39%.
[highlight]Задача № 8.[/highlight] Определите массовую долю фосфора в смеси, содержащей 55 г фосфата натрия и 70 г дигидрофосфата натрия.
Посмотреть РЕШЕНИЕ
Ответ. ω(Р) = 22,77%
[highlight]Задача № 9.[/highlight] Массовая доля серы в техническом сульфате натрия равна 20,48%. Рассчитайте массовую долю примесей в данном продукте (в %).
Посмотреть РЕШЕНИЕ
Ответ. ω (примесей) = 9,12%.
Задача № 10.
Плотность смеси оксида азота (II) и оксида азота (IV) по водороду равна 17,8. Найдите массовую долю оксида азота (IV) в данной смеси.
Посмотреть РЕШЕНИЕ
Ответ. ω(NO2) = 45,2%.
Решение задач с долей вещества в смеси, в соединении. Выберите дальнейшие действия:
- Перейти к следующей теме: Решение задач на вывод формул соединений
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
- Купить книгу Задачи по химии и способы их решения. 8-9 кл. / О.С. Габриелян и др. — М.: Дрофа.
План урока:
Важнейшие химические законы
Массовая доля
Решение задач с неизвестным элементом в соединении
Молярная концентрация
Важнейшие химические законы
В химической науке существует несколько законов, которым подчиняются вещества.
Закон сохранения массы
Закон был сформулирован в 1748 году Михаилом Васильевичем Ломоносовым, но его открывателем считается французский ученый Антуан Лоран Лавуазье. Он экспериментальным путем доказал закон в 1756 году.
Формулировка закона: «Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся во время реакции».
Закон подчиняется атомно-молекулярной теории, согласно которому химические реакции представляют собой перегруппировку атомов в молекулы. Новые атомы при этом не образуются. Например, чистый натрий получают путем электролиза расплава хлорида натрия. Исходя из уравнения реакции и атомной массы элементов, можно сделать вывод, что закон сохранения массы существует.
Закон постоянства состава вещества
Закон был открыт в те времена, когда считалось, что все вещества имеют молекулярное строение. Но согласно современным исследованиям только 5 % неорганических веществ состоят из молекул, поэтому закон справедлив для небольшой части химических соединений.
Формулировка закона: «Всякое чистое вещество молекулярного строения независимо от способа получения имеет одинаковый количественный и качественный состав». Состав немолекулярных веществ непостоянен.
Например, вода Н2О имеет молекулярное строение и ее состав одинаков, вне зависимости от способа получения. А углерод имеет различные аллотропные модификации в виде алмаза и графита. Поэтому химический состав данного вещества зависит от метода получения.
Массовая доля
Доля – одна часть чего-то целого. Например, пицца разрезана на восемь частей. Один кусок – 1/8 или 12,5 % от целой пиццы – это массовая доля.
Массовая доля обозначается буквой греческого алфавита («омега») ω и выражается в процентах (от 0 до 100) или цифрой от 0 до 1.
Массовая доля элемента
Массовая доля атома показывает, какая часть молекулярной массы соединения приходится на данный химический элемент.Ее рассчитывают по формуле:
где n – число атомов элемента в химическом соединении,
Ar(Э) – относительная атомная масса элемента,
Mr(в-ва) – относительная молекулярная масса соединения.
Задача. Найти массовую долю калия в перманганате калия KMnO4.
- Найти относительную молекулярную массу соединения.
Mr(KMnO4) = 39 + 55 + 16 * 4 = 158 г/моль
- Рассчитать массовую долю химического элемента в соединении.
ω (К) = 39г/моль /158 г/моль = 24,7 % или 0,247
Ответ: ω (К) = 24,7 % или 0,247
Массовая и объемная доля компонента смеси
Смесь – структура, образующаяся из двух и более веществ. Вещества, входящие в состав смеси, называют компонентами. Например, воздух – смесь азота, кислорода, углекислого газа и других. Если масса одного компонента в десятки раз меньше массы другого компонента смеси, то его называют примесью. Например, воздух может быть загрязнен угарным газом.
Массовая доля в жидких и твердых смесях рассчитывается по формуле:
Массовая доля в смеси газов (φ) рассчитывается по формуле:
Задача. В 10 мл дистиллированной воды растворили 1 г поваренной соли. Найдите массовую долю растворенного вещества.
- Найти массу раствора.
m (р-ра) = m (H2O) + m (NaCl) = 10 г + 1 г = 11 г
- Найти массовую долю соли.
ω (NaCl) = (1 г/11 г) * 100 % = 9,09 %
Ответ: ω (NaCl) = 9,09 %
Задача. В 4 л растворе содержится 100 г соляной кислоты HCl. Рассчитайте массовую долю растворенного вещества, учитывая, что плотность соляной кислоты – 1,098 г/мл.
- Найти массу вещества.
m(р-ра) = V * p = 4000 мл * 1,098 г/мл = 4392 г
- Найти массовую долю кислоты.
ω (НCl) = (100 г/4392 г) * 100 % = 2,277 %
Ответ: ω (НCl) = 2,277 %
Задача. К 700 г 48%-ного раствора добавили 30 г это же соли, которая находится в растворе. Определите массовую долю в полученной смеси?
- Найти массу раствора.
m(р-ра) = 700 г + 30 г = 730 г
- Найти массу растворенного вещества в исходном растворе.
m1(соли) = 700 г * 48 %/ 100 % = 336 г
- Найти массу вещества в полученном растворе.
m2 (соли) = 336 г + 30 г = 366 г
- Найти массовую долю соли в растворе.
ω (соли) = 366 г * 100 %/ 730 г = 50,137 %
Ответ: ω (соли) = 50,137 %
Задача. Смешали 200 г 35%-ного и 300 г 5%-ного раствора серной кислоты H2SO4. Определите массовую долю кислоты.
- Найти массу первой кислоты.
m1 (соли) = 200 г * 35 % / 100 % = 70 г
- Найти массу второй кислоты.
m1 (соли) = 300 г * 5 % / 100 % = 15 г
- Найти массу раствора.
m (р-ра) = 200 г + 300 г = 500 г
- Найти массу вещества.
m(в-ва) = 70 г + 15 г = 85 г
- Найти массовую долю кислоты.
ω (к-ты) = 85 г * 100 % / 500 г = 17 %
Ответ: ω (к-ты) = 17 %
Массовая доля примесей
В природе практически во всех веществах есть примеси. Но в некоторых областях использование «грязных материалов» недопустимо. Например, в микросхеме компьютера используют только чистый кристалл кремния.
Вещество, содержащее примеси, называется образцом.Степень чистоты выражают массовой долей основного компонента, или массовой долей примесей.
Задача. В самородной сере 8 % примесей. Сколько чистой серы в 500 кг природного образца?
- Найти массу примесей в образце.
m(примесей) = 500 кг * 8 % / 100 % = 40 кг
- Найти массу чистой серы в образце.
m(серы) = m(образца) – m (примесей) = 500 кг – 40 кг = 460 кг
Ответ: m (чистой серы) = 460 кг
Массовая доля продукта реакции
Большинство химических реакций обратимы. При необратимых реакциях часть веществ утрачивается, и выход продуктов уменьшается. Т.е. полученная практическая масса отличается от теоретической. В расчетах используют отношение реального количества получаемого вещества к теоретически вычисленному количеству. Это отношение называется выходом продукта химической реакции от теоретически возможного.
Задача. При взаимодействии хлора и метана (объем – 112 л) был получен дихлорметан, масса которого составила 255 г. Какова доля выхода дихлорметана.
- Написать уравнение реакции.
CH4 + 2Cl2 = CH2Cl2 + 2HCl
- Рассчитать количества метана.
n(CH4) = V/Vm = 112 л/22,4л/моль = 5 моль
- Посчитать теоретическое количество дихлорметана.
Исходя из уравнения: n(CH2Cl2) = n(CH4) = 5 моль
mтеор(CH2Cl2) = M *nтеор(CH2Cl2) = 85 г/моль * 5 моль = 425 г
- Найти долю выхода дихлорметана.
η (CH2Cl2) = 255 г * 100 % / 425 г = 60%
Ответ: η (CH2Cl2) = 60%
Решение задач с неизвестным элементом в соединении
Задача. Определите название элемента (Э) в соединении Э2О3, при том, что его массовая доля составляет 68,42%.
- Найти молярную массу.
М (Э2О3) = 2 * х + 3 * 16 = 2х + 48
- Найти массовую долю элемента в химическом соединении.
Пусть О(Э2О3) = 1 моль
ω (Э) =m (Э) / m (Э2О3) =2х / (2х + 48) = 0,684
- Найти атомную массу элемента.
0,684 (2х +48) / 0,684 = 2х / 0,684
2х + 48 = 2,924х
х = 52
- Определить химический элемент.
М (Cr) = 52 г/моль
Ответ: Cr2O3
Задача. Оксид пятивалентного элемента содержит 56,34% кислорода. Какой состав вещества?
- Определить формулу соединения.
Т.к. элемент имеет валентность равную V, то оксид выглядит следующим образом Э2О5
- Вычислить молярную массу элемента.
ω (О) = m (О) / m (Э2О5) = (5 * 16) / (2х + 5 * 16) = 0,684
1,1268х + 45,072 = 80
1,1268х = 34,928
х = 31
- Определить по атомной массе химический элемент.
М (Р) = 31 г/моль
Ответ: Р2О5
Молярная концентрация
Молярная концентрация (молярность)Сm выражает концентрацию вещества в растворе.
где νр.в. – количество растворенного вещества (моль),
Vр-ра– объем раствора (л).
Молярная концентрация измеряется в моль/л или М.
Задача. В 100 мл раствора содержится 1,8 г соляной кислоты.Чему равна молярная концентрация кислоты.
- Найти количество вещества.
ν(HCl) = m (HCl) / M (HCl) = 1,8 г/ 36,5 г/моль = 0,05 моль
- Найти молярную концентрацию раствора.
Сm (HCl) = ν (HCl) /Vр-ра= 0,05 моль / 0,1 л = 0,5 моль/л
Знание химических законов и формул позволяет работникам лабораторий делать растворы нужные растворы. Не на каждом производстве есть растворы всех концентраций, поэтому умение решать подобные задачи позволяет создавать необходимые смеси. На понятиях массовая доля и концентрация строится химия реальных систем.