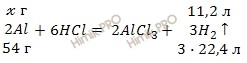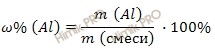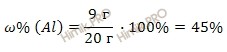Определите массовые доли металлов в смеси.
Смесь медных и алюминиевых опилок массой 12 г обработали концентрированной азотной кислотой. При этом масса нерастворившегося остатка составила 3 г. Определите массовые доли металлов в смеси.
Решение.
Запишем краткое условие задачи:
|
m (смеси Cu и Al) = 12 г m (остатка) = 3 г |
В данной задаче идет речь о взаимодействии металлов с концентрированной азотной кислотой. Медь реагирует с кислотой согласно уравнению: Cu + 4HNO3 = Cu(NO3)2 + 2NO2↑+ 2H2O. |
|
ω (Al) – ? ω (Cu) – ? |
Алюминий же концентрированной азотной кислотой пассивируется и с ней не взаимодействует. Следовательно, масса нерастворившегося остатка равняется массе алюминиевых опилок в смеси.
Таким образом, m (Al) = 4 г.
0,25 (или 25%).
Следовательно, ω (Cu) = 1 – ω (Al), ω (Cu) = 1 – 0,25 = 0,75 (или 75%)
Ответ: ω (Al) = 25%; ω (Cu) = 75%.
2. Смесь состоит из трех веществ, но только два вещества принимают участие в описываемых процессах.
Нахождение массовой доли металлов (медь, алюминий) в смеси
Смесь меди (Cu) и алюминия (Al) массой 20 грамм обработали соляной кислотой (HCl). При этом выделилось 11,2 дм3 (н.у.) водорода (H2). Определить массовую долю (%) каждого металла в смеси.
Решение задачи
Напомню, что соляная кислота (HCl) обладает слабыми окислительными свойствами, следовательно, соляная кислота (HCl) реагирует с металлами стоящими в электрохимическом ряду напряжений левее (до) водорода (H2).
Таким образом, соляная кислота (HCl) будет реагировать с алюминием (Al) и не будет реагировать с медью (Cu).
Запишем уравнение реакции взаимодействия соляной кислоты (HCl) с алюминием (Al):
Учитывая, что молярная масса алюминия (Al) равна 27 г/моль, вычислим массу алюминия (Al) по формуле, устанавливающей связь между массой и химическим количеством вещества:
Учитывая количество моль из уравнения реакции получаем:
m (Al) = 2 моль ∙ 27 г/моль = 54 (г)
По уравнению реакции найдем, сколько алюминия (Al) (в г) взаимодействует с соляной кислотой (HCl):
при взаимодействии г Al с HCl выделяется 11,2 л H2
при взаимодействии 54 г Al с HCl выделяется 67,2 л H2
Откуда:
Найдем массу меди (Cu) по формуле:
m (Cu) = m (смеси) — m (Al)
Получаем:
m (Cu) = 20 г – 9 г = 11 (г).
Найдем массовую долю алюминия (Al) в смеси по формуле:
Получаем:
Рассчитаем массовую долю меди (Cu) в смеси по формуле:
ω% (Cu) = 100% — ω% (Al)
Получаем:
ω% (Cu) = 100% — 45% = 55%
Ответ: массовая доля алюминия равна 45%, массовая доля меди равна 55%.
Напишем уравнения реакций:
Fe + 2HCl = FeCl2 + H2
Mg + 2HCl = MgCl2 + H2
Рассчитаем количество вещества выделившегося водорода:
n = V/Vm = 0,224л/22,4л/моль = 0,01моль
Пусть х моль – количество вещества железа
Пусть y моль- количество вещества магния
По уравнению реакции:
n(H2) = n(Fe) = x моль
n(H2) = n(Mg) = y моль
Составим уравнение:
x + y = 0.01
Так как количество вещества железа х моль, то его масса равна: 56х грамм, масса магния соответственно 24у грамм, составим второе уравенние:
56х + 24у = 0,4
Составим систему уравнений:
56х + 24у = 0,4
х + у = 0,01
Домножим второе уравнение на 24
56х + 24у = 0,4
24х + 24у = 0,24
Вычтем из первого уравнения второе:
32х = 0,16
х = 0,005 моль
Рассчитаем массу железа:
m = n*M = 0,005моль*56г/моль = 0,28г
Рассчитаем массовую долю железа в смеси:
w(Fe) = m(Fe)/m(смеси) = 0,28г/0,4г = 0,7; 70%
Рассчитаем массовую долю магния:
w(Mg) = 100% – w(Fe) = 100% – 70% = 30%
Примеры
решения задач.
Рассмотрим три примера задач, в которых смеси металлов реагируют
с соляной кислотой:
Пример
1. При действии на смесь меди и железа массой 20 г избытком соляной
кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в
смеси.
В первом примере медь не реагирует с соляной кислотой, то есть
водород выделяется при реакции кислоты с железом. Таким образом, зная объём
водорода, мы сразу сможем найти количество и массу железа. И, соответственно,
массовые доли веществ в смеси.
Решение
примера 1.
1.
Находим количество водорода: моль.
2.
По уравнению реакции:
Количество
железа тоже 0,25 моль. Можно найти его массу:
г.
3.
Теперь можно рассчитать массовые доли металлов в смеси:
Ответ: железа,
меди.
Пример
2. При действии на смесь алюминия и железа массой 11 г избытком
соляной кислоты выделилось 8,96 л газа (н.у.). Определить массовые доли
металлов в смеси.
Во втором примере в реакцию вступают оба металла.
Здесь уже водород из кислоты выделяется в обеих реакциях. Поэтому прямым
расчётом здесь нельзя воспользоваться. В таких случаях удобно решать с помощью
очень простой системы уравнений, приняв за —
число моль одного из металлов, а за —
количество вещества второго.
Решение
примера 2.
1.
Находим количество водорода: моль.
2.
Пусть количество алюминия — моль,
а железа моль.
Тогда можно выразить через и
количество
выделившегося водорода:
–
мольное соотношение
3.
Нам известно общее количество водорода: моль.
Значит,(это
первое уравнение в системе).
4.
Для смеси металлов нужно выразить массычерез
количества веществ.Значит,
масса алюминия
масса
железа
а масса
всей смеси
(это
второе уравнение в системе).
5.
Итак, мы имеем систему из двух уравнений:
Решать такие системы гораздо удобнее методом вычитания, домножив первое
уравнение на 18:и
вычитая первое уравнение из второго:
моль
моль
6.
Дальше находим массы металлов и их массовые доли в смеси:
г
г
соответственно,
Ответ: железа,
алюминия.
Пример
3. 16 г смеси цинка, алюминия и меди обработали избытком раствора
соляной кислоты. При этом выделилось 5,6 л газа (н.у.) и не растворилось 5 г
вещества. Определить массовые доли металлов в смеси.
В третьем примере два металла реагируют, а третий металл (медь) не
вступает в реакцию. Поэтому остаток 5 г — это масса меди. Количества остальных
двух металлов — цинка и алюминия (учтите, что их общая масса 16 − 5 = 11 г)
можно найти с помощью системы уравнений, как в примере №2.
Ответ к Примеру 3: 56,25% цинка, 12,5% алюминия, 31,25% меди.
Следующие три примера задач (№4, 5, 6) содержат реакции металлов с
азотной и серной кислотами. Главное в таких задачах — правильно определить,
какой металл будет растворяться в ней, а какой не будет.
Ads by
Browser ShopAd Options
Пример 4. На
смесь железа, алюминия и меди подействовали избытком холодной концентрированной
серной кислоты. При этом часть смеси растворилась, и выделилось 5,6 л газа
(н.у.). Оставшуюся смесь обработали избытком раствора едкого натра. Выделилось
3,36 л газа и осталось 3 г не растворившегося остатка. Определить массу и
состав исходной смеси металлов.
В этом примере надо помнить, что холодная
концентрированная серная кислота не реагирует с железом и алюминием
(пассивация), но реагирует с медью. При этом выделяется оксид серы (IV).
Со щелочью реагирует только
алюминий — амфотерный металл (кроме алюминия, в щелочах растворяются
ещё цинк и олово, в горячей концентрированной щелочи — ещё можно растворить
бериллий).
Решение
примера 4.
1.
С концентрированной серной кислотой реагирует только медь, число
моль газа: моль
(конц.)
(не забудьте, что такие реакции надо обязательно уравнивать с помощью
электронного баланса)
Так как
мольное соотношение меди и сернистого газа ,
то меди тоже моль.
Можно найти массу меди:
г.
2.
В реакцию с раствором щелочи вступает алюминий, при этом
образуется гидроксокомплекс алюминия и водород:
3.
Число моль водорода: моль,мольное
соотношение алюминия и водорода и,
следовательно,
моль.
Масса
алюминия:
г
4.
Остаток — это железо, массой 3 г. Можно найти массу смеси: г.
5.
Массовые доли металлов:
Ответ: меди,
алюминия,
железа.
Пример
5. 21,1 г смеси цинка и алюминия растворили в 565 мл раствора азотной
кислоты, содержащего 20 мас. % НNО3 и
имеющего плотность 1,115 г/мл. Объем выделившегося газа, являющегося простым
веществом и единственным продуктом восстановления азотной кислоты, составил
2,912 л (н.у.). Определите состав полученного раствора в массовых процентах.
(РХТУ)
В тексте этой задачи чётко указан продукт восстановления азота —
«простое вещество». Так как азотная кислота с металлами не даёт водорода, то
это — азот. Оба металла растворились в кислоте.
В задаче спрашивается не состав исходной смеси металлов, а состав
получившегося после реакций раствора. Это делает задачу более сложной.
Решение
примера 5.
1.
Определяем количество вещества газа: моль.
2.
Определяем массу раствора азотной кислоты, массу и количество
вещества растворенной :
г
г
моль
Обратите
внимание, что так как металлы полностью растворились, значит —кислоты точно
хватило (с водой эти металлы не реагируют). Соответственно, надо будет
проверить, не оказалась ли кислота в избытке, и сколько ее осталось
после реакции в полученном растворе.
3.
Составляем уравнения реакций (не забудьте про электронный
баланс) и, для удобства расчетов, принимаем за —
количество цинка, а за —
количество алюминия. Тогда, в соответствии с коэффициентами в уравнениях, азота
в первой реакции получится моль,
а во второй — моль:
4.
Тогда, учитывая, что масса смеси металлов г,
их молярные массы — г/моль
у цинка и г/моль
у алюминия, получим следующую систему уравнений:
–
количество азота
–
масса смеси двух металлов
Решать эту
систему удобно, домножив первое уравнение на 90 и вычитая первое уравнение их
второго.
значит,
моль
значит,
моль
Проверим
массу смеси:
г.
5.
Теперь переходим к составу раствора. Удобно будет переписать
реакции ещё раз и записать над реакциями количества всех прореагировавших и
образовавшихся веществ (кроме воды):
6.
Следующий вопрос: осталась ли в растворе азотная кислота и сколько
её осталось?По уравнениям реакций, количество кислоты, вступившей в реакцию: моль,
т.е.
кислота была в избытке и можно вычислить её остаток в растворе:
моль.
7.
Итак, в итоговом растворесодержатся:
нитрат
цинка в количестве моль:
г
нитрат
алюминия в количестве моль:
г
избыток
азотной кислоты в количестве моль:
г
8.
Какова масса итогового раствора?Вспомним, что масса итогового
раствора складывается из тех компонентов, которые мы смешивали (растворы и
вещества) минус те продукты реакции, которые ушли из раствора (осадки и газы):
|
Масса |
= |
Сумма |
– |
Масса |
– |
Масса |
9.
10. Тогда для
нашей задачи:
11. =
масса раствора кислоты + масса сплава металлов — масса азота
12. г
13. г
14.
Теперь можно рассчитать массовые доли веществ в получившемся
растворе:
Ответ: нитрата
цинка, нитрата
алюминия, азотной
кислоты.
Пример
6. При обработке г
смеси меди, железа и алюминия избытком концентрированной азотной кислоты
выделилось л
газа (н.у.), а при действии на эту смесь такой же массы избытка хлороводородной
кислоты — л
газа (н.у.). Определите состав исходной смеси. (РХТУ)
При решении этой задачи надо вспомнить, во-первых, что
концентрированная азотная кислота с неактивным металлом (медь) даёт ,
а железо и алюминий с ней не реагируют. Соляная кислота, напротив, не реагирует
с медью.
Ответ к примеру 6: меди,
железа,
алюминия.
Задачи
для самостоятельного решения.
1.
Несложные задачи с двумя компонентами смеси.
1-1. Смесь меди и алюминия
массой г
обработали -ным
раствором азотной кислоты, при этом выделилось л
газа (н. у.). Определить массовую долю алюминия в смеси.
1-2. Смесь меди и цинка
массой г
обработали концентрированным раствором щелочи. При этом выделилось л
газа (н.y.). Вычислите массовую долю цинка в исходной смеси.
1-3. Смесь магния и оксида
магния массой г
обработали достаточным количеством разбавленной серной кислоты. При этом выделилось л
газа (н.у.). Найти массовую долю магния в смеси.
1-4. Смесь цинка и оксида
цинка массой г
растворили в разбавленной серной кислоте. Получили сульфат цинка массой г.
Вычислите массовую долю цинка в исходной смеси.
1-5. При действии смеси
порошков железа и цинка массой г
на избыток раствора хлорида меди (II) образовалось г
меди. Определите состав исходной смеси.
1-6. Какая масса -ного
раствора соляной кислоты потребуется для полного растворения г
смеси цинка с оксидом цинка, если при этом выделился водород объемом л
(н.у.)?
1-7. При растворении в
разбавленной азотной кислоте г
смеси железа и меди выделяется оксид азота (II) объемом л
(н.у.). Определите состав исходной смеси.
1-8. При растворении г
смеси железных и алюминиевых опилок в -ном
растворе соляной кислоты ( г/мл)
выделилось л
водорода (н.у.). Найдите массовые доли металлов в смеси и определите объем
израсходованной соляной кислоты.
2.
Задачи более сложные.
2-1. Смесь кальция и
алюминия массой г
прокалили без доступа воздуха с избытком порошка графита. Продукт реакции
обработали разбавленной соляной кислотой, при этом выделилось л
газа (н.у.). Определите массовые доли металлов в смеси.
2-2. Для растворения г
сплава магния с алюминием использовано мл
-ного
раствора серной кислоты ( г/мл).
Избыток кислоты вступил в реакцию с мл
раствора гидрокарбоната калия с концентрацией моль/л.
Определите массовые доли металлов в сплаве и объем газа (н.у.), выделившегося
при растворения сплава.
2-3. При растворении г
смеси железа и оксида железа (II) в серной кислоте и выпаривании раствора
досуха образовалось г
железного купороса — гептагидрата сульфата железа (II). Определите
количественный состав исходной смеси.
2-4. При взаимодействии
железа массой г
с хлором образовалась смесь хлоридов железа (II) и (III) массой г.
Вычислите массу хлорида железа (III) в полученной смеси.
2-5. Чему была равна
массовая доля калия в его смеси с литием, если в результате обработки этой
смеси избытком хлора образовалась смесь, в которой массовая доля хлорида калия
составила ?
2-6. После обработки
избытком брома смеси калия и магния общей массой г
масса полученной смеси твердых веществ оказалась равной г.
Эту смесь обработали избытком раствора гидроксида натрия, после чего осадок
отделили и прокалили до постоянной массы. Вычислите массу полученного при этом
остатка.
2-7. Смесь лития и натрия
общей массой г
окислили избытком кислорода, всего было израсходовано л
(н.у.). Полученную смесь растворили в г
-го
раствора серной кислоты. Вычислите массовые доли веществ в образовавшемся
растворе.
2-8. Сплав алюминия с
серебром обработали избытком концентрированного раствора азотной кислоты,
остаток растворили в уксусной кислоте. Объемы газов, выделившихся в обеих
реакциях измеренные при одинаковых условиях, оказались равными между собой.
Вычислите массовые доли металлов в сплаве.
3.
Три металла и сложные задачи.
3-1. При обработке г
смеси меди, железа и алюминия избытком концентрированной азотной кислоты
выделилось л
газа. Такой же объем газа выделяется и при обработке этой же смеси такой же
массы избытком разбавленной серной кислоты (н.у.). Определите состав исходной
смеси в массовых процентах.
3-2. г
смеси железа, меди и алюминия, взаимодействуя с избытком разбавленной серной
кислоты, выделяет л
водорода (н.у.). Определите состав смеси в массовых процентах, если для
хлорирования такой же навески смеси требуется л
хлора (н.у.).
3-3. Железные, цинковые и
алюминиевые опилки смешаны в мольном отношении (в
порядке перечисления). г
такой смеси обработали избытком хлора. Полученную смесь хлоридов растворили
в мл
воды. Определить концентрации веществ в полученном растворе.
3-4. Сплав меди, железа и
цинка массой г
(массы всех компонентов равны) поместили в раствор
соляной кислоты массой г.
Рассчитайте массовые доли веществ в получившемся растворе.
3-5. г
смеси, состоящей из кремния, алюминия и железа, обработали при нагревании
избытком гидроксида натрия, при этом выделилось л
газа (н.у.). При действии на такую массу смеси избытка соляной кислоты
выделяется л
газа (н.у.). Определите массы веществ в исходной смеси.
3-6. При обработке смеси
цинка, меди и железа избытком концентрированного раствора щелочи выделился газ,
а масса нерастворившегося остатка оказалась в раза
меньше массы исходной смеси. Этот остаток обработали избытком соляной кислоты,
объем выделившегося газа при этом оказался равным объему газа, выделившегося в
первом случае (объемы измерялись при одинаковых условиях). Вычислите массовые
доли металлов в исходной смеси.
3-7. Имеется смесь кальция,
оксида кальция и карбида кальция с молярным соотношением компонентов (в
порядке перечисления). Какой минимальный объем воды может вступить в химическое
взаимодействие с такой смесью массой г?
3-8. Смесь хрома, цинка и
серебра общей массой г
обработали разбавленной соляной кислотой, масса нерастворившегося остатка
оказалась равной г.
Раствор после отделения осадка обработали бромом в щелочной среде, а по
окончании реакции обработали избытком нитрата бария. Масса образовавшегося
осадка оказалась равной г.
Вычислите массовые доли металлов в исходной смеси.
Ответы
и комментарии к задачам для самостоятельного решения.
1-1. (алюминий
не реагирует с концентрированной азотной кислотой);
1-2. (в
щелочи растворяется только амфотерный металл — цинк);
1-3. ;
1-4. ;
1-5. (железо,
вытесняя медь, переходит в степень окисления );
1-6. г;
1-7. (железо
в азотной кислоте переходит в );
1-8. (железо
в реакции с соляной кислотой переходит в );
мл
раствора .
2-1. (кальций
и алюминий с графитом (углеродом) образуют карбиды и
;
при их гидролизе водой или выделяются,
соответственно, ацетилен и
метан );
2-2. ;
2-3. (гептагидрат
сульфата железа — );
2-4. г;
2-5. ;
2-6. г;
2-7. (при
окислении кислородом лития образуется его оксид, а при окислении натрия —
пероксид ,
который в воде гидролизуется до пероксида водорода и щелочи);
2-8. ;
3-1. ;
3-2. ;
3-3. (железо
в реакции с хлором переходит в степень окисления );
3-4. (не
забудьте, что медь не реагирует с соляной кислотой, поэтому её масса не входит
в массу нового раствора);
3-5. г
г
г
(кремний
— неметалл, он реагирует с раствором щелочи, образуя силикат натрия и водород;
с соляной кислотой он не реагирует);
3-6. ;
3-7. мл;
3-8. (хром
при растворении в соляной кислоте переходит в хлорид хрома (II), который при
действии брома в щелочной среде переходит в хромат; при добавлении соли бария
образуется нерастворимый хромат бария)
Как правильно рассчитать массу и массовую долю вещества в исходной смесии
Определение массы образовавшейся соли
Задача 282.
На нейтрализацию уксусной кислоты массой 120 г затрачено 50 г раствора гидроксида натрия с массовой долей вещества 40%. Определите массу образовавшейся соли.
Решение:
m(p-pa) = 50 г;
m(CH3COOH) = 120 г;
w%(NaOH) = 40% или 0,4;
M(NaOH) = 40 г/моль;
M(CH3COOH) = 60 г/моль;
m(CH3COONa) = 82 г/моль;
m(CH3COONa) = ?
Уравнение реакции имеет вид:
CH3COOH + NaOH = CH3COONa + Н2О.
Из уравнения реакции вытекает, что на образование 1 моль ацетата натрия затрачивается 1 моль гидроксида натрия и 1 моль уксусной кислоты,
т.е. n(CH3COONa) = n(CH3COOH) = n(NaOH).
Рассчитаем количество уксусной кислоты, получим:
n(CH3COOH) = m(CH3COOH)/M(CH3COOH) = 120/60 = 2 моль.
Рассчитаем количество гидроксида натрия, получим:
n(NaOH) = [w%(NaOH) . mp-pa)]/M(NaOH) = (0,4 – 50)/40 = 0,5 моль.
Таким образом, в избытке взята уксусная кислота, а в недостатке – гидроксид натрия (2 моль > 0,5 моль), поэтому расчет массы ацетата натрия будем вести по гидроксиду натрия.
Тогда
n(CH3COONa) = n(NaOH) = 0,5 моль;
m(CH3COONa) = n(CH3COONa) .M(CH3COONa) = 0,5 . 82 = 41 г.
Ответ: m(CH3COONa) = 41 г.
Определение массовой доли нитрата калия в смеси
Задача 283.
Твёрдый нитрат калия массой 50,5 г нагревали до тех пор, пока не выделился кислород, способный полностью окислить гидроксид железа (2), находящийся в водном растворе так, что при растворении продукта в избытке соляной кислоты образовалось 260 г 25 %-го раствора соли. Определите массовую долю нитрата калия в твердой смеси после нагрева.
Решение:
m(смеси) = 50,5 г;
m(p-pa) = 260 г;
w%(FeCl3) = 25%;
M(KNO3) = 101 г/моль;
М(FeCl3) = 162 г/моль;
w%(KNO3) = ?
Уравнения химических процессов:
2KNO3 = 2KNO2 + O2;
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3.
Fe(OH)3 + 3HCl = FeCl3 + 3H2O.
Из уравнений вытекает, что 2 моль KNO3 дают 1 моль О2, 1 моль О2 окисляет 4 моль Fe(OH)2 с образованием 4 моль Fe(OH)3, 1 моль Fe(OH)3 образует 1 моль FeCl3. Можно записать:
2n(KNO3) = n(O2) = 4n[Fe(OH)2] = 4n[Fe(OH)3] = 4n(FeCl3).
После приведения всех членов равенства получим:
2n(FeCl3) = n(KNO3), т.е. n(KNO3) = 1/2n(FeCl3).
1. Рассчитаем количество FeCl3 в растворе, получим:
n(FeCl3) = [m(p-pa) . w%(FeCl3)]/100%/М(FeCl3) = (260 . 25%)/100%/160 = 0,4 моль.
2. Рассчитаем количество KNO3, получим:
(KNO3 = 1/2n(FeCl3) = 0,4/2 = 0,2 моль.
3. Рассчитаем массу KNO3, получим:
m(KNO3) = n(KNO3) . M(KNO3) = 0,2 . 101 = 20,2 г.
4. Рассчитаем массовую долю нитрата калия в смеси, получим:
w%(KNO3) = [m(KNO3)/m(смеси)].100% = (22,2/50,5).100% = 40%.
Ответ: w%(KNO3) = 40%.
Определение состава исходной смеси
Задача 284.
При последовательном окислении смеси изомерных пропиловых спиртов массой 4,2 г оксидом меди (2) и аммиачным раствором оксида серебра получили 10,8 г Ag. Определите состав исходной смеси.
Решение:
m(смеси) = 4,2 г;
М(СН3-СН2-СН2-ОН) = 60 г/моль;
Ar(Ag) = 108 г/моль;
m(СН3-СН2-СН2-ОН) = ?
m[СН3-СН(ОН)-СН3] = ?
При окислении смеси изомерных пропиловых спиртов происходят процессы:
1) Первичные спирт пропанол-1 окисляются оксидом меди (2) при нагревании до альдегида, образуется пропаналь или пропионовый альдегид:
СН3-СН2-СН2-ОН + CuO = СН3-СН2-COH + Cu↓ + H2O.
2) Пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона (пропанон):
2.CH3-CH-CH3 + CuO → CH3-C=O + Cu↓ + H2O.
| |
OH CH3
Далее, при действии на смесь аммиачным раствором оксида серебра будет происходить реаакция с выделением металлического серебра – “реакция серебряного зеркала”:
СН3-СН2-COH + 2[Ag(NH3)2]OH = 2Ag + СН3-СН2-CONH3 + 3NH3 + H2O
Из уравнения реакции вытекает, что из 1 моль СН3-СН2-COH образуется 2 моль Ag,
т.е. nСН3-СН2-COH = 1/2nAg = nСН3-СН2-СН2-ОН.
Рассчитаем количество полученного серебра:
n(Ag) = m(Ag)/Ar(Ag) = 10,8/108 = 0,1 моль.
Тогда
n(СН3-СН2-СН2-ОН) = 1/2nAg = = 0,1/2 = 0,05 моль.
Рассчитаем массу пропанола-1 в смеси:
m(СН3-СН2-СН2-ОН) = n(СН3-СН2-СН2-ОН) . М(СН3-СН2-СН2-ОН) = 0,05 моль . 60 г/моль = 3 г.
Рассчитаем массу пропанола-2 в смеси:
m[СН3-СН(ОН)-СН3] = m(смеси) – m(СН3-СН2-СН2-ОН) = 4,2 – 3 = 1,2 г.
Ответ: m(СН3-СН2-СН2-ОН) = 3 г; m[СН3-СН(ОН)-СН3] = 1,2 г.
Определение массы и массовые доли металлов в смеси.
Задача 285.
При растворении смеси цинка и железа массой 535,2 г в концентрированной серной кислоте, выделился газ (или смесь газов) объемом 120,96 л (при н.у.). Реакция протекает при нагревании. Определите массы цинка и железа и массовые доли (в %) металлов в смеси.
Решение:
Vm = 22,4 л/моль;
Ar(Zn) = 65,38 г/моль;
m(смеси) = 535,2г
V(SO2) = 120,96 л;
m(Zn) = ?
m(Fe) = ?
w%(Zn) = ?
w%(Fe) = ?
Железе концентрированной кислотой пассивируется, реакция не идет.
Уравнение реакции имеет вид:
Zn + 2H2SO4 = ZnSO4 + 2H2O + SO2.
Из уравнения реакции вытекает, что 1 моль Zn требуется для выделения 1 моль SO2, т.е. n(Zn) = n(SO2).
1. Рассчитаем количество выделившегося SO2, получим:
n(SO2) = V(SO2)/Vm = 120,96/22,4 = 5,4 моль.
2. Рассчитаем массу цинка в смеси, получим:
n(Zn) = n(SO2) = 5,4 моль;
m(Zn) = n(Zn) .Ar(Zn) = 5,4 . 65,38 = 353,052 г.
3. Рассчитаем массу железа в смеси, получим:
m(Fe) = m(смеси) – m(Zn) = 535,2 – 353,052 = 182,148 г.
4. Рассчитаем массовые доли (в %) металлов в смеси, получим:
w%(Zn) = m(Zn)/m(смеси) = 353,052/535,2 = 0,66 или 66%
w%(Fe) = m(Fe)/m(смеси) = 182,148/535,2 = 0,34 или 34%.
Ответ: m(Zn) = 353,052 г; m(Fe) = 182,148 г; w%(Zn) = 66%; w%(Fe) = 34%.
Рассчет массовой долю кислоты в растворе,
Задача 286.
Рассчитайте массовую долю кислоты в растворе, полученном при смешении 95 мл воды и 10 г смеси оксида хрома(VI) и песка. Массовая доля песка в смеси 50%. Ответ укажите в процентах и округлите с точностью до десятых. Считайте, что в результате реакции образуется только хромовая кислота H2CrO4.
Решение:
m(H2O) = 95 г;
m(смесь) = 10 г;
w%(CrO3) = w%(SiO2) = 50% или 0,5;
M(H2O) = 18 г/моль;
М(H2CrO4) = 118 г/моль;
М(CrO3) = 100 г/моль;
w%(H2CrO4) = ?
Рассчитаем массу CrO3, получим:
m(CrO3) = m(смесь) . w%(CrO3) = 10 . 0,5 = 5 г.
Рассчитаем количество CrO3, получим:
n(CrO3) = m(CrO3)/М(CrO3) = 5/100 = 0,05 моль.
Уравнение реакции имеет вид:
CrO3 + H2O = H2CrO4.
Из уравнения вытекает, что на образование 1 моль H2CrO4 затрачивается 1 моль CrO3 и 1 моль Н2О,
т.е. n(H2CrO4) = n(CrO3) = n(H2O).
Тогда
n(H2CrO4) = n(CrO3) = 0,05 моль.
Рассчитаем массу H2CrO4, получим:
m(H2CrO4) = n(H2CrO4) . М(H2CrO4) = 0,05 . 118 = 5,9 г.
Так как n(H2CrO4) = n(CrO3) = n(H2O), то масса полученного раствора равна массе воды и массе оксида хрома(VI):
m(р-ра) = m(H2O) + m(CrO3) = 95 + 5 = 100 г.
Тогда
w%(H2CrO4) = [m(H2CrO4) . 100%]/m(р-ра) = (5,9 . 100%)/100 = 5,9%.
Ответ: 5,9%.