Дорогие друзья продолжаем наши разборы задач и сегодня разберем “Что такое выход продукта химической реакции?” Не всегда в ходе практических опытов мы получаем то количество вещества, на которое изначально рассчитывали. Часть вещества может не прореагировать, часть потеряться. Поэтому, полностью реагенты вряд ли когда-то прореагируют, отсюда возникли понятия практический выход от теоретически возможного
Сначала основные термины:
Количество продукта реакции, которое должно получится из реагентов согласно стехиометрическим расчетам — это теоретическое количество (масса, объем) или теоретический выход продукта реакции nтеор.
Однако на практике это соотношение не выполняется, и в большинстве случаев образуется меньшее количество продукта реакции, чем было рассчитано — практическое количество (масса, объем) или практический выход продукта реакции nпр.
Массовая (мольная, объемная) доля выхода продукта реакции η или ω — это соотношение массы (количества вещества, объема) продукта, которая практически получена в ходе реакции, mпр., к массе (количеству, объему) продукта, которая рассчитана теоретически, mтеор.:
η = mпр./mтеор.
Массовую (мольную, объемную) долю выхода продукта реакции можно выражать в долях, а можно в процентах:
η = mпр./mтеор.·100%
Алгоритм решения задач
1.Записываем условие задачи, определяем известные и не известные данные
2.Составляем уравнение химической реакции (УХР), расставляем коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
3.Находим количество вещества известных данных
4.По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции
5.Находим массовую (объёмную) долю выхода продукта по формуле.
6.Если в условии задачи уже дан выход продуктов реакции, следовательно выводим из основной формулы практические или теоретические массы.
Пример 1. При хлорировании метана объемом 112 л (н. у.) получен дихлорметан массой 255 г. Определите долю выхода дихлорметана.
Пример 2. Определите массу осадка (г, н.у.), полученного при сливании двух растворов, один из которых содержит 4,5 г хлорида кальция, а другой 4,1 г ортофосфата натрия. Выход продукта реакции составляет 88%
Пример 3. Рассчитайте выход (%) продукта реакции 43,05 г анилина с избытком бромной воды, если для нейтрализации выделившегося бромоводорода потребовалось 62,5 г 40%-ного раствора гидроксида натрия
Задачи для самоконтроля
1.При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5,5 г. Определите выход продукта реакции (%). (91,67%.)
2.При взаимодействии натрия количеством вещества 0,5 моль с водой получили водород объемом 4,2 л. Вычислите практический выход газа(%). (75%.)
3.Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить восстановлением его оксида массой 228 кг, если практический выход хрома составляет 95%. (148,2 кг.)
4.При каталитическом гидрировании формальдегида получили метиловыи спирт, при взаимодейтвии которого с металлическим натрием образовался водород объемом 8,96 л (н. у.). Выход продукта на каждой стадии синтеза составил 80%. Определите исходную массу формальдегида. (37,5 г.)
5.Вычислите, какой объем раствора с массовой долей гидроксида калия 26% (р = 1,24 r/мл) необходим для реакции с алюминием, чтобы получить водород объемом 10,64 л, если выход водорода составляет 95%. (41,35)
Надеюсь, моя статья была для вас полезна. Еще больше интересной информации вы найдете в наших сообществах в ВКонтакте vk.com/biochemschool и Телеграме t.me/biochemschool.
Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического»
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
![]()
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход:
![]()
I. Первый тип задач
Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
| 1. Записываем краткое условие задачи |
Дано: m (Mg) = 1,2 г m практическая(MgSO4) = 5,5 г _____________________ Найти: |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(Mg) = 24 г/моль M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль |
|
4. Находим количество вещества реагента по формулам
|
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль |
| 5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим массовую (объёмную) долю выхода продукта по формуле
|
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим |
II. Второй тип задач
Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
|
1. Записываем краткое условие задачи |
Дано: m(CaO) = 16,8 г
___________________ Найти: m практ (CaC2) = ? |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
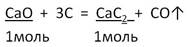 |
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(CaO) = 40 + 16 = 56 г/моль M(CaC2) = 40 + 2 · 12 = 64г/моль |
|
4. Находим количество вещества реагента по формулам
|
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль |
|
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
|
|
6. Находим массовую (объёмную) долю выхода продукта по формуле
|
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г Ответ: m практич (CaC2) = 15,36 г |
III. Третий тип задач
Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
| 1. Записываем краткое условие задачи |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = 28,56 л = 85% или 0,85 ____________________ Найти: m(Na2CO3) =? |
| 2. Находим по ПСХЭ молярные массы веществ, если это необходимо | M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль |
|
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы: |
Vтеоретич(CO2) = = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 5. Находим количество вещества реагента по УХР |
По УХР:
ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
6. Определяем массу (объём) реагента по формуле: m = ν · M V = ν · Vm |
m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г |
IV. Решите задачи
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Задача №2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Задача №3. Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Задача №4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
как определить массовую долю выхода от теоретически возможного?
Елена Безяева
Знаток
(412),
закрыт
13 лет назад
Лучший ответ
Feliche Rivares
Гуру
(4405)
13 лет назад
Рассчитать по уравнению реакции теоретический выход вещества.
Разделить реально полученную массу на теоретически рассчитанную величину и умножить на сто, чтобы выразить в процентах
Остальные ответы
Сапер [Connect Pro]
Ученик
(148)
13 лет назад
Рассчитать теоретически возможный выход, а потом умножить эту величину на процент практического выходи (перевести проценты в доли единицы).
Похожие вопросы
При обучении учащихся решению расчётных задач
по химии учителя сталкиваются с рядом проблем
- решая задачу, учащиеся не понимают сущности
задач и хода их решения; - не анализируют содержание задачи;
- не определяют последовательность действий;
- неправильно используют химический язык,
математические действия и обозначение
физических величин и др.;
Преодоление этих недостатков является одной из
главных целей, который ставит перед собой
учитель, приступая к обучению решению расчетных
задач.
Задача учителя состоит в том, чтобы научить
учащихся анализировать условия задач, через
составление логической схемы решения конкретной
задачи. Составление логической схемы задачи
предотвращает многие ошибки, которые допускают
учащиеся.
Цели урока:
- формирование умения анализировать условие
задачи; - формирование умения определять тип расчетной
задачи, порядок действий при ее решении; - развитие познавательных, интеллектуальных и
творческих способностей.
Задачи урока:
- овладеть способами решения химических задач с
использованием понятия “массовая доля выхода
продукта реакции от теоретического”; - отработать навыки решения расчетных задач;
- способствовать усвоению материала, имеющего
отношение к производственным процессам; - стимулировать углубленное изучение
теоретических вопросов, интерес к решению
творческих задач.
Ход урока
Определяем причину и сущность ситуации,
которые описываются в задачах “на выход
продукта от теоретического”.
В реальных химических реакциях масса продукта
всегда оказывается меньше расчетной. Почему?
- Многие химические реакции обратимы и не доходят
до конца. - При взаимодействии органических веществ часто
образуются побочные продукты. - При гетерогенных реакциях вещества плохо
перемешиваются, и часть веществ просто не
вступает в реакции. - Часть газообразных веществ может улетучиться.
- При получении осадков часть вещества может
остаться в растворе.
Вывод:
- масса теоретическая всегда больше
практической; - объём теоретический всегда больше объёма
практического.
Теоретический выход составляет 100%,
практический выход всегда меньше 100%.
Количество продукта, рассчитанное по уравнению
реакции, – теоретический выход, соответствует 100%.
Доля выхода продукта реакции (![]() – “этта”) – это отношение
– “этта”) – это отношение
массы полученного вещества к массе, которая
должна была бы получиться в соответствии с
расчетом по уравнению реакции.
Три типа задач с понятием “выход продукта”:
1. Даны массы исходного вещества и продукта
реакции. Определить выход продукта.
2. Даны массы исходного вещества и выход продукта
реакции. Определить массу продукта.
3. Даны массы продукта и выход продукта.
Определить массу исходного вещества.
Задачи.
1. При сжигании железа в сосуде, содержащем 21,3 г
хлора, было получено 24,3 г хлорида железа (III).
Рассчитайте выход продукта реакции.
2. Над 16 г серы пропустили водород при
нагревании. Определите объем (н.у.) полученного
сероводорода, если выход продукта реакции
составляет 85% от теоретически возможного.
3. Какой объём оксида углерода (II) был взят для
восстановления оксида железа (III), если получено
11,2г железа с выходом 80% от теоретически
возможного.
Анализ задач.
Каждая задача складывается из совокупности
данных (известные вещества) – условия задачи
(“выход” и т.п.) – и вопроса (вещества, параметры
которых требуется найти). Кроме этого, в ней есть
система зависимостей, которые связывают искомое
с данными и данные между собой.
Задачи анализа:
1) выявить все данные;
2) выявить зависимости между данными и
условиями;
3) выявить зависимости между данным и искомым.
Итак, выясняем:
1. О каких веществах идет речь?
2. Какие изменения произошли с веществами?
3. Какие величины названы в условии задачи?
4. Какие данные – практические или
теоретические, названы в условии задачи?
5. Какие из данных можно непосредственно
использовать для расчётов по уравнениям реакций,
а какие необходимо преобразовать, используя
массовую долю выхода?
Алгоритмы решения задач трёх типов:
Определение выхода продукта в % от теоретически
возможного.
1. Запишите уравнение химической реакции и
расставьте коэффициенты.
2. Под формулами веществ напишите количество
вещества согласно коэффициентам.
3. Практически полученная масса известна.
4. Определите теоретическую массу.
5. Определите выход продукта реакции (%), отнеся
практическую массу к теоретической и умножив на
100%.
6. Запишите ответ.
Расчет массы продукта реакции, если известен
выход продукта.
1. Запишите “дано” и “найти”, запишите
уравнение, расставьте коэффициенты.
2. Найдите теоретическое количество вещества
для исходных веществ. n =![]()
3. Найдите теоретическое количество вещества
продукта реакции, согласно коэффициентам.
4. Вычислите теоретические массу или объем
продукта реакции.
m = M * n или V = Vm * n
5. Вычислите практические массу или объем
продукта реакции (умножьте массу теоретическую
или объем теоретический на долю выхода).
Расчет массы исходного вещества, если известны
масса продукта реакции и выход продукта.
1. По известному практическому объёму или массе,
найдите теоретический объём или массу (используя
долю выхода продукта).
![]()
2. Найдите теоретическое количество вещества
для продукта.
3. Найдите теоретическое количество вещества
для исходного вещества, согласно коэффициентам.
4. С помощью теоретического количества вещества
найдите массу или объем исходных веществ в
реакции.
Домашнее задание.
Решите задачи:
1. Для окисления оксида серы (IV) взяли 112 л (н.у.)
кислорода и получили 760 г оксида серы (VI). Чему
равен выход продукта в процентах от теоретически
возможного?
2. При взаимодействии азота и водорода получили
95 г аммиака NH3 с выходом 35%. Какие объёмы
азота и водорода были взяты для реакции?
3. 64,8 г оксида цинка восстановили избытком
углерода. Определите массу образовавшегося
металла, если выход продукта реакции равен 65%.
Здравствуйте! Друзья!
Сегодня
мы познакомимся и научимся решать ещё один тип расчетных задач, связанных с
вычислениями по уравнению химической реакции. Это расчетные задачи типа
«Определение выхода продукта реакции в процентах от теоретического».
На
уроке нам понадобятся:
1.
Периодическая система химических элементов Д. И. Менделеева.
2.
Калькулятор.
3.
И, как всегда, огромное желание научиться чему-то новому!
Желаю вам успехов!
Задачи
на вычисление выхода продукта реакции от теоретически возможного
Признак
В условии задачи встречается слово
«выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём,
практическая масса или объём» могут быть использованы только для
веществ-продуктов.


Массовая доля выхода продукта обозначается
буквой h (эта), измеряется в процентах или долях,
объёмная доля выхода продукта может обозначаться в различных источниках h (эта)
Также для расчётов может использоваться
отношения количеств веществ:

Первый
тип задач – Известны масса (объём) исходного
вещества и масса (объём) продукта реакции. Необходимо определить выход продукта
реакции в %.
Задача
1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили
соль массой 5, 5 г. Определите выход продукта реакции (%).
|
1. |
Дано: m(Mg) = 1,2 г mпрактическая (MgSO4) = 5,5 _____________________ Найти:
|
|
2. Запишем Под |
|
|
3. |
M(Mg) = 24 г/моль M(MgSO4) = 24 |
|
4.
|
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 |
|
5. По |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим
|
Ответ: Выход сульфата магния составляет |
Второй
тип задач – Известны масса (объём) исходного
вещества (реагента) и выход (в %) продукта реакции. Необходимо найти
практическую массу (объём) продукта реакции.
Задача
2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид
кальция массой 16,8 г, если выход составляет 80%.
|
1. |
Дано: m(CaO) = 16,8 г
____________________ Найти: mпракт (CaC2) = ? |
|
2. Запишем Под |
|
|
3. |
M(CaO) = 40 + 16 = 56 M(CaC2) = 40 + |
|
4.
|
ν(CaO) = 16,8 (г) / 56 |
|
5. По |
|
|
6. Находим
|
mпрактич (CaC2) = 0,8 Ответ: mпрактич (CaC2) = 15,36 |
Третий
тип задач – Известны масса (объём) практически
полученного вещества и выход этого продукта реакции. Необходимо вычислить массу
(объём) исходного вещества.
Задача
3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу
карбоната натрия нужно взять для получения оксида углерода (IV)
объёмом 28,56 л (н. у.). Практический выход продукта 85%.
|
1. |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = φ = 85% или 0,85 _____________________ Найти: m(Na2CO3) =? |
|
2. Находим |
M (Na2CO3) =2·23 + |
|
3.
|
Vтеоретич(CO2) = Vпрактич(CO2) / 0,85 = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 |
|
4. Запишем Под |
|
|
5. |
По УХР:
, следовательно ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
5. Определяем m V |
m = ν · M m (Na2CO3) = 106 |














