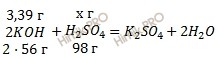Массовая доля серной кислоты
Для образования средней соли к 40 миллилитрам раствора серной кислоты (H2SO4) с плотностью 1,025 г/мл добавили 43,2 миллилитра 7,4-процентного раствора гидроксида калия (KOH) с плотностью 1,06г/мл. Рассчитайте массовую долю серной кислоты в растворе.
Решение задачи
Запишем уравнение реакции образования средней соли:
Рассчитаем массу раствора гидроксида калия (KOH) по формуле, устанавливающей связь между массой и объемом:
Получаем:
m (раствора KOH) = 43,2 ∙ 1,06 = 45,79 (г).
Массовая доля серной кислоты. Используя формулу нахождения массовой доли растворенного вещества:
выразим массу вещества:
Получаем:
m (вещества KOH) = 45,79 ∙ 0,074 = 3,39 (г).
Если раствор 7,4-процентный, то массовая доля гидроксида калия (KOH) в нем 0,074.
Массовая доля серной кислоты. Учитывая, что молярные массы гидроксида калия (KOH) и серной кислоты (H2SO4) соответственно равны 56 г/моль и 98 г/моль (смотри таблицу Менделеева), по уравнению реакции образования средней соли рассчитаем, сколько грамм серной кислоты (H2SO4) нужно для нейтрализации 3,39 г гидроксида калия (KOH):
на реакцию нейтрализации 112 г KOH нужно 98 г H2SO4
на реакцию нейтрализации 3,39 г KOH нужно х г H2SO4
Откуда:
Рассчитаем массу раствора серной кислоты (H2SO4) по формуле, устанавливающей связь между массой и объемом:
Получаем:
m (раствора H2SO4) = 40 ∙ 1,025 = 41 (г).
Массовая доля растворенного вещества в растворе – это отношение массы растворенного вещества к массе раствора. Выражается в долях единицы или в %.
Рассчитаем массовую долю серной кислоты в растворе:
Получаем, массовая доля серной кислоты равна:
w (H2SO4) = 2,97 / 41 = 0,072 или 7,2%
Ответ:
массовая доля серной кислоты равна 7,2 %.
Похожие задачи
как определить массовую долю элементов серной кислоты
Ученик
(95),
закрыт
10 лет назад
Есепчук Алексей
Высший разум
(774416)
10 лет назад
Сначала надо узнать относительную молекулярную массу вещества.
Для этого надо сложить относительные атомные массы образующих элементов ( с учетом числа атомов) .
Относительная атомная масса обозначена в таблице Менделеева.
Итак: Мr( H2SO4) = 2Ar(H) + Ar(S) + 4Ar(O)= 2*1 + 32+ 4* 16=98
Затем находим массовые доли элементов. Для этого надо число атомов элемента умножить на относительную атомную массу элемента ( Ar) и это произведение разделить на относительную молекулярную массу вещества ( Mr).
Итак: массовая доля водорода = (2*1) / 98 = примерно 0,02 = 2%
массовая доля серы = ( 1*32) / 98 = примерно 0,33 = 33%
массовая доля кислорода = ( 4* 16) /98 = примерно 0,65 = 65%
С растворами мы сталкиваемся регулярно, причём не только в химии, но и в обычной жизни. Например, чай с сахаром – самый что ни на есть раствор. Строго говоря, даже обычная вода, текущая из крана, – это раствор, потому что в ней растворены различные соли (загляните в чайник и убедитесь, что на стенках есть накипь. Это и есть соли, которые осели на стенках из воды). Растворы бывают концентрированными и разбавленными. В первых концентрация растворённого вещества велика (это когда вы в чашку чая насыпали 5 ложек сахара, во вторых – концентрация растворённого вещества мала (когда в чашу чая вы насыпали сахара совсем чуть-чуть). А вот характеристикой раствора является массовая доля растворённого вещества.
Массовая доля растворённого вещества в растворе – это отношение массы растворённого вещества к массе всего раствора.
Не забывайте, что масса раствора складывается из массы растворителя и растворённого вещества. Сразу разберём пример, чтобы стало понятно.
Пример 1.
У нас есть 200 г воды и 10 г сахара. Смешиваем воду и сахар и получаем раствор. Так вот масса раствора будет равна массе воды (здесь это растворитель) и сахара (растворённое вещество), то есть 200+10=210 г. Это очень важно, не упускайте этот момент из виду.
Теперь возвратимся к массовой доле. Она обозначается латинской буквой w и рассчитывается по простой формуле:
При этом помните, что
Удобнее выражать массовую долю в процентах, поэтому чаще используется такая формула:
Массовая доля растворенного вещества: задачи
Чтобы уяснить чётко, что же такое массовая доля вещества в растворе, потренируемся решать задачи по химии.
Пример 2.
Смешали 150 г воды и 20 г хлорида натрия NaCl. Определите массовую доля хлорида натрия в полученном растворе.
Решение:
Сначала найдём массу раствора. Она складывается из массы воды и хлорида натрия, то есть 150+20=170 г. Это и есть масса раствора. Теперь ищем массовую долю NaCl:
Ответ: в полученном растворе массовая доля хлорида натрия составляет 11,7%.
Пример 3.
Известно, что в 250 г раствора нитрата калия содержится 10 г нитрата калия. Определите массовую долю нитрата калия.
Решение:
Обратите внимание, что в условии уже дана масса раствора, это существенно облегчает задачу, поскольку можно сразу использовать формулу для определения массовой доли:
Ответ: массовая доля нитрата калия в этом растворе 4%.
Пример 4.
В учебниках по химии встречаются и обратные задачи, когда массовая доля известна и требуется найти массу растворённого вещества или раствора. Например, условие звучит так. Нужно приготовить раствор серной кислоты в воде массой 200 г с массовой долей серной кислоты 64%. Сколько потребуется серной кислоты.
Решение:
Давайте разберёмся. У нас должно получиться 200 г раствора, то есть масса раствора 200 г. Массовая доля – 64%. Теперь воспользуемся формулой:
С нашими условиями получается так:
64=mН2SO4/200*100%
Отсюда получаем, что mН2SO4=64*200/100=128 г.
Ответ: для приготовления раствора потребуется 128 г серной кислоты.
Пример 5.
Необходимо приготовить раствор сульфата меди с массовой долей 8%. Масса сульфата меди 12 г. Какова будет масса полученного раствора?
Решение:
Сразу берём формулу
и подставляем данные из условия: wCuSO4=8%, mCuSO4=12 г, тогда
8=12/mраствора*100%
Отсюда mраствора=12/8*100=150 г.
Ответ: масса полученного раствора составит 150 г.
Пример 6.
Ну и как обычно, заключительным будет сложный пример от репетитора по химии. Итак, химик взял 6 г гидроксида натрия, добавил воды и получил раствор с массовой долей гидроксида натрия 10%. Сколько воды он взял?
Решение:
Для начала давайте вспомним, что масса раствора складывается из массы растворённого вещества (гидроксид натрия) и растворителя (вода). Масса гидроксида известна из условия, а вот массу воды нужно найти, поэтому обозначим её Х. Тогда
И это действие было самым сложным. Теперь просто переходим к формуле расчёта массовой доли:
Подставим сюда данные из условия: wNaOH=10%, mNaOH=6 г, тогда
10=6/(6+X)*100%
Решаем:
10*(6+Х)=6*100
Х=54.
Ответ: химик для приготовления раствора взял 54 г воды.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
- Учебники
- 7 класс
- Химия 👍
- Габриелян
- №3
авторы: Габриелян, Остроумов, Сладков.
издательство: “Просвещение”
Раздел:
- ГЛАВА VII. Сложные вещества
- §23. Кислоты
- Проверьте свои знания
В 300 мл воды растворили 40 г серной кислоты. Найдите массовую долю серной кислоты в полученном растворе.
reshalka.com
ГДЗ Химия 7 класс класс Габриелян. §23. Проверьте свои знания. Номер №3
Решение
Дано:
m (воды) = 300 мл
m (кислоты) = 40 г.
Найти:
ω − ?
Решение:
m (воды) = ρ * V (воды) = 1 г/мл * 300 мл = 300 г
m (р−ра) = m(кислоты) + m(воды) = 40 г + 300 г = 340 г
ω = m (кислоты) : m(р−ра) = 40 г : 340 г = 11,76%
Ответ: ω = 11,76%
- Предыдущее
- Следующее
Нашли ошибку?
Если Вы нашли ошибку, неточность или просто не согласны с ответом, пожалуйста сообщите нам об этом
Решение:
1) Вычисляем относительную молекулярную массу серной кислоты:
Mr (H2SO4) = 1 • 2 + 32 + 16 • 4 = 98
2) Находим массу молярную массу гидроксида кальция:
М(Са(ОН)2) = 98•1 г/моль =98 г/моль
3) Вычисляем массовые доли элементов.
Для этого численное значение массы элемента (с учетом индекса) делят на молярную массу вещества:
Учитывая это и обозначая массовую долю элемента буквой ω, вычисления массовых долей проводят так:
ω(Н) = 2 : 98 = 0,0204, или 2,04%;
ω(S) = 32 : 98 = 0,3265, или 32,65%;
ω(О) = 64 : 98 =0,6531, или 65,31%
4) Проверяем правильность вычисления. Сумма массовых долей должна быть ровна 1,0 или 100%
0,0204+0,3265+0,6531=1 (мас. д.)
2,04%+32,65%+65,31%= 100%
Ответ: элементарный состав серной кислоты следующий: массовая доля водорода 0,0204, или 2,04% массовая доля серы 0,3265, или 32,65% массовая доля кислорода 0,6531, или 65,31%