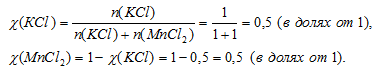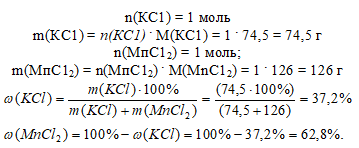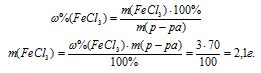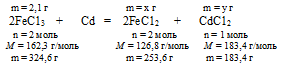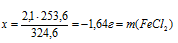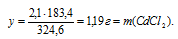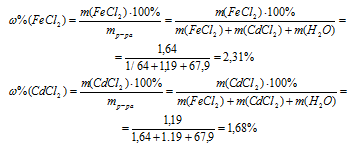Задачи на определение массовой и мольной доли каждой соли в смеси
Задача 33.
Через раствор перманганата калия (КМпО4) пропускали хлороводород до полного обесцвечивания раствора. После реакции раствор выпарили и получили смесь солей. Определите массовую и мольную долю каждой соли в смеси.
Дано:
числовых данных в условии не содержится.
Найти:
массовую и мольную долю каждой соли после реакции.
Решение:
В условии задачи описана реакция окисления хлороводорода раствором перманганата калия. Реакция происходит в кислой среде, т.к. хлороводород очень хорошо растворяется в воде и дает соляную кислоту.
2КМпО4 + 16НС1 = 2КС1 + 2МпС12 + 5С12↑ + 8Н2О
Очевидно, что после выпаривания остается смесь солей КС1 и МпС12, причем их соотношение в смеси будет определяться коэффициентами в химической реакции. На каждые 2 моль КС1 приходится 2 моль МпС12. Следовательно, соотношение количеств вещества (п, моль) этих двух солей 2 : 2 или 1 : 1 (после сокращения). Определим мольную долю каждой из солей. Выберем образец смеси, содержащей 2 моль солей. Так как соотношение количеств веществ (п, моль) в смеси 1 : 1, то выбранный образец будет содержать 1 моль КС1 и 1 моль МпС12.
Массовая доля определяется в том же выбранном образце (n(КС1) + n(МnС12) = 2 моль). Перейдем от количества вещества к массе и вычислим массовую долю:
Ответ: 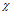


Задача 34.
Кадмиевую пластинку опустили в 70 г 3% -ного раствора FeС13 в воде. После окончания реакции пластинку извлекли из раствора. Определите массовую долю каждой из солей в полученном растворе.
Дано:
масса исходного раствора FеС13 в воде: mисх. р-ра = 70 г;
массовая доля FеС13 в исходном растворе: 
Найти:
массовую долю каждой из солей в конечном растворе.
Решение:
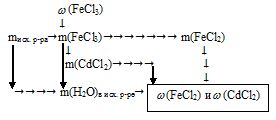
В условии описана реакция окисления металлического кадмия ионами Fе+3. Так как в ряду напряжений металлов кадмий стоит между медью и железом (в случае взаимодействия с металлом, стоящим в ряду напряжения между хромом и медью1), процесс восстановления идет только до Fе+2:
2FеС13 + Сd = 2FеС12 + СdС12
В условии указано, что после реакции пластинку вынули из раствора. Это говорит о том, что реакция прошла до конца, и FеС13 расходовался почти полностью2. Далее задачу можно
решить традиционным образом, используя уравнения реакции.
Можно использовать следующий алгоритм:
1. Определяем массу FеС13 в исходном растворе:
2. Определяем массу воды в исходном растворе:
m(Н2O)в исх. р-ре = mисх. р-ра – m(FеС13)в исх. р-ре = 70 – 2,1 = 67,9 г.
3. Используя уравнение реакции, определяем массы образовавшихся солей.
Составим две пропорции:
2,1 г FеС13 дает х г FеС12 (по условию)
324,6 г FеС13 дают 253,6 г FеС12 (по уравнению)
2,1 г FеС13 дает у г СdС12 (по условию)
324,6 г FеС13 дают 183,4 г СdС12 (по уравнению)
4. Определяем массовую долю FеС12 и СdС12 в растворе после реакции:
Ответ: 

Комментарии:
1Обратите внимание, что металлы, стоящие в ряду напряжения левее железа, восстанавливают его из любой степени окисления (при избытке восстанавливающего металла) до чистого железа.
Zn(избыток) + 2FеС13 = 2Fе + ZnС12. При недостатке цинка (или любого металла стоящего левее железа) железо из степени окисления (+3) восстановиться до степени окисления (+2).
Zn(недостаток) + 2FеС13(избыток) = 2FеС12 + ZnС12
2 Реально такие реакции представляют собой равновесия, и равновесные концентрации рассчитывают по уравнению Нернста. Этот материал вы будете подробно изучать в вузе. В данном же случае будем считать, что реакция идет до конца.
Массовая доля – один из важных параметров, который активно используется для расчетов и не только в химии. Приготовление сиропов и рассолов, расчет внесения удобрений на площадь под ту или иную культуру, приготовление и назначение лекарственных препаратов. Для всех этих расчетов нужна массовая доля. Формула для ее нахождения будет дана ниже.
В химии она рассчитывается:
- для компонента смеси, раствора;
- для составной части соединения (химического элемента);
- для примесей к чистым веществам.
Раствор – это тоже смесь, только гомогенная.
Массовая доля – это отношение массы компонента смеси (вещества) ко всей его массе. Выражают в обычных числах или в процентах.
Формула для нахождения такая:
? = (m (сост. части) · m (смеси, в-ва)) / 100% .
Содержание:
- Нахождение массовой доли химического элемента
- Нахождение массовой доли вещества в смесях и растворах
- Массовая доля примесей
- Видео
Нахождение массовой доли химического элемента
Массовая доля химического элемента в веществе находится по отношению атомной массы химического элемента, умноженной на количество его атомов в этом соединении, к молекулярной массе вещества.
Например, для определения w кислорода (оксигена) в молекуле углекислого газа СО2 вначале найдем молекулярную массу всего соединения. Она составляет 44. В молекуле содержится 2 атома кислорода. Значит w кислорода рассчитываем так:
w(O) = (Ar(O) · 2 ) / Mr(СО2)) х 100%,
w(O) = ((16 · 2) / 44) х 100% = 72,73%.
Аналогичным образом в химии определяют, например, w воды в кристаллогидрате – комплексе соединения с водой. В таком виде в природе находятся многие вещества в минералах.
Например, формула медного купороса CuSO4 · 5H2O. Чтобы определить w воды в этом кристаллогидрате, нужно в уже известную формулу подставить, соответственно, Mr воды (в числитель) и общую m кристаллогидрата (в знаменатель). Mr воды 18, а всего кристаллогидрата – 250.
w( H2O ) = ((18 · 5) / 250 ) · 100% = 36%
Нахождение массовой доли вещества в смесях и растворах
Массовая доля химического соединения в смеси или растворе определяется по той же формуле, только в числителе будет масса вещества в растворе (смеси), а в знаменателе – масса всего раствора (смеси):
? = (m (в-ва) · m (р-ра)) / 100% .
Следует обратить внимание, что массовая концентрация – это отношение массы вещества к массе всего раствора, а не только растворителя.
Например, растворили 10 г поваренной соли в 200 г воды. Нужно найти процентную концентрацию соли в полученном растворе.
Для определения концентрации соли нам нужна m раствора. Она составляет:
m (р-ра) = m (соли) + m (воды) = 10 + 200 = 210 (г).
Находим массовую долю соли в растворе:
? = ( 10 · 210) / 100% = 4,76%
Таким образом, концентрация поваренной соли в растворе составит 4,76%.
Если в условии задачи дается не m, а объем раствора, то его нужно перевести в массу. Делается это обычно через формулу для нахождения плотности:
p = m / V,
где m – масса вещества (раствора, смеси), а V – его объем.
Такую концентрацию используют чаще всего. Именно ее имеют в виду (если нет отдельных указаний), когда пишут о процентном содержании веществ в растворах и смесях.
Массовая доля примесей
В задачах часто дается концентрация примесей в веществе или вещества в его минералах. Следует обратить внимание на то, что концентрация (массовая доля) чистого соединения будет определяться путем вычитания из 100% доли примеси.
Например, если говорится, что из минерала получают железо, а процент примесей 80%, то чистого железа в минерале 100 – 80 = 20%.
Соответственно, если написано, что в минерале содержится только 20% железа, то во все химические реакции и в химическом производстве будут участвовать именно эти 20%.
Например, для реакции с соляной кислотой взяли 200 г природного минерала, в котором содержание цинка 5%. Для определения массы взятого цинка пользуемся той же формулой:
? = (m (в-ва) · m (р-ра)) / 100% ,
из которой находим неизвестную m раствора:
m (Zn) = ( w · 100% ) / m (минер.)
m (Zn) = (5 · 100) / 200 = 10 (г)
То есть, в 200 г взятого для реакции минерала содержится 5% цинка.
Задача. Образец медной руды массой 150 г содержит сульфид меди одновалентной и примеси, массовая доля которых составляет 15%. Вычислите массу сульфида меди в образце.
Решение задачи возможно двумя способами. Первый – это найти по известной концентрации массу примесей и вычесть ее из общей m образца руды. Второй способ – это найти массовую долю чистого сульфида и по ней уже рассчитать его массу. Решим обоими способами.
- I способ
Вначале найдем m примесей в образце руды. Для этого воспользуемся уже известной формулой:
? = ( m (примесей) · m (образца)) / 100% ,
m(примес.) = (w · m (образца)) · 100% , (А)
m(примес.) = (15 · 150) / 100% = 22,5 (г).
Теперь по разности найдем количество сульфида в образце:
150 – 22,5 = 127,5 г
- II способ
Вначале находим w соединения:
100 – 15 = 85%
А теперь по ней, воспользовавшись той же формулой, что и в первом способе (формула А), найдем m сульфида меди:
m(Cu2S) = (w · m (образца)) / 100% ,
m(Cu2S) = (85 · 150) / 100% = 127,5 (г).
Ответ: масса сульфида меди одновалентного в образце составляет 127,5 г.
Видео
Из видео вы узнаете, как правильно производить рассчеты по химическим формулам и как найти массовую долю.
Рубрика: Химия
Август 2020
Учитель химии
ГУО «Сорогский УПК ясли – сад – средняя школа имени К.В.Герчика»
Зубарь Наталья Александровна
Среди расчетов по уравнениям химических реакций, протекающих в растворах электролитов, можно выделить
группу задач на качественный и количественный анализ состава образующегося раствора. Особый интерес из этой группы представляют задания, связанные с кислотно-основным взаимодействием
в водных растворах. В зависимости от состава и количества исходных веществ в ходе реакции могут образоваться растворы, содержащие различные продукты. Предсказание этих продуктов, т.е. их
качественный анализ, и вызывает у учащихся некоторые затруднения.
Задачи, на взаимодействие однокислотного основания и
одноосновной кислоты (её кислотного оксида) решаются легко, т.к. в результате взаимодействия образуется только средняя соль:
MeOH + HAn = MeAn+H2O .
Если же во взаимодействие вступает многоосновная кислота или соответствующий ей кислотный оксид, то
могут образоваться как средняя, так и кислая соль, либо смесь обоих солей. Для данного случая возможны различные варианты взаимодействий. Наиболее характерными можно считать следующие
типы.
Взаимодействие оснований и многоосновных кислот:
1. MeOH +
H2An;
2. Me(OH)2 +
H2An;
3. MeOH +
H3An;
4. Me(OH)2 + H3An.
·
Поглощение газов (кислотных оксидов) растворами щелочей:
1. MeOH +
RO2;
2. Me(OH)2
+RO2;
3. MeOH
+R2O5;
4. Me(OH)2
+R2O5;
5. MeOH +
RO3;
6. Me(OH)2 +RO3.
Чтобы точно определить состав образовавшегося раствора, нужно знать мольное соотношение основания и
кислоты (кислотного оксида) Для решения задач подобного типа мы используем числовую прямую мольных соотношений щелочи и кислоты (кислотного оксида). Это помогает учащимся
визуализировать условие задачи, прогнозировать продукты реакции, упрощает и ускоряет ход решения.
Рассмотрим подробно
построение числовых прямых n(ME(OH)х)/n(HуAn) для решения некоторых
вариантов взаимодействия.
1.Взаимодействие однокислотного основания и двухосновной кислоты (MeOH + H2An).
а) Записываем уравнения реакций и исходя из них определяем мольные соотношения основания и кислоты для
каждого случая:
1. 2MeOH + H2An =
Me2An + 2H2O n(MEOH)/n(H2An)=2/1=2;
2. MeOH + H2An =
MeHAn+H2O n(MEOH)/n(H2An)=1/1=1.
б) Переносим полученные значения мольных соотношений (1;2) на числовую прямую.
(обозначим данные соотношения точками –
прямоугольниками).
Эти точки соответствуют составам растворов, в
которых образуется только один тип солей, а кислота и основание реагируют полностью: в точке (1)- MeHAn, в точке (2) – Me2An.
(надписываем формулы соответствующих солей над
точками)

в) В случае, если мольное соотношение 1<n(MEOH)/n(H2An)<2 ,т. е. лежит в интервале (1;2),то в растворе образуются кислая и средняя соли одновременно, и
вещества реагируют полностью.
(обозначим данный
интервал на числовой прямой голубой штриховкой, надписав формулы соответствующих солей).

г) Если мольное соотношение n(MEOH)/n(H2An)<1, то в растворе образуется кислая соль и остается избыток кислоты.
(обозначим данный интервал на числовой прямой, и
надпишем формулу образующейся соли MeHAn).
д) В случае, когда мольное отношение n(MEOH)/n(H2An)>2 , в растворе образуется средняя соль и остается избыток основания.
(обозначим данный интервал на числовой прямой и
надпишем формулу соли Me2 An).
В итоге числовая прямая
имеет вид:

2. Взаимодействие однокислотного основания и трехосновной кислоты
(MeOH + H3An):
1. 3MeOH + H3An = Me3An + 3H2O n(MEOH)/n(H2An)=3/1=3;
2. 2MeOH + H3An = Me2HAn+ 3H2O n(MEOH)/n(H2An)=2/1=2;
3. MeOH + H3An = MeH2An+ 3H2O n(MEOH)/n(H2An)=1/1=1.
Для данного случая числовая прямая имеет вид:

3. Взаимодействие двухкислотного основания и трехосновной кислоты (Me(OH)2 +H3An).
1. 3Me(OH)2 +2H3An =
Me3An2+6H2O n(ME(OH)2)/n(H3An)=3/2=1,5;
2. Me(OH)2 + H3An = MeHAn+
2H2O n(ME(OH)2)/n(H3An)=1/1=1;
3. Me(OH)2 +2H3An =
Me(H2An)2+H2O n(ME(OH)2)/n(H3An)=1/2=0,5.
Числовая прямая мольных отношений реагентов имеет вид:

4. Взаимодействие двухкислотного основания и двухосновной кислоты:
1. Me(OH)2 +H2An =
MeAn+2H2O
n(ME(OH)2)/n(H2An)=1/1=1;
2. Me(OH)2 + 2H2An = Me(HAn)2+2H2O
n(ME(OH)2)/n(H3An)=1/2=0,5.

Исследуем решение некоторых задач на образование смеси солей различного состава с использованием числовых
прямых мольных соотношений.
Задача 1. Укажите формулу(-ы) вещества (веществ), образующихся при взаимодействии 0,5
моль гидроксида бария и 0,4 моль фосфорной кислоты.
1. Записываем уравнения взаимодействия данных веществ (проводится добавление кислоты к основанию) и
определяем мольные соотношения основания и кислоты.
3Ba(OH)2+2H3PO4=Ba3(PO4)2+6H2O
n(Ba(OH)2)/n(H3PO4)=3/2=1,5;
Ba(OH)2+H3PO4=BaHPO4+2H2O
n(Ba(OH)2)/n(H3PO4)=1/1=1;
Ba(OH)2+2H3PO4=Ba(H2PO4)2+6H2O
n(Ba(OH)2)/n(H3PO4)=1/2=0,5.
Эти мольные отношения можно быстрее определить
исходя из формул солей, не прибегая к записи уравнений:
Ba3(PO4)2 n(Ba(OH)2)/n(H3PO4)=3/2=1,5;
BaHPO4
n(Ba(OH)2)/n(H3PO4)=1/1=1;
Ba(H2PO4)2
n(Ba(OH)2)/n(H3PO4)=1/2=0,5.
2. Определяем мольное соотношение реагирующих веществ :
n(Ba(OH)2)/n(H3PO4)=0,5/0,4=1,25.
3. Мы имеем случай взаимодействия двухкислотного основания и трехосновной
кислоты, поэтому используем числовую прямую (3). Записываем на ней формулы солей. На прямой отмечаем точкой найденное мольное соотношение реагентов.

4. Мы видим, что данное соотношение реагентов находится в
интервале (1;1,25), что соответствует образованию смеси солей Ва3(РО4)2 и
BaHPO4.
Ответ: Ва3 (РО4)2
и BaHPO4.
Задача 2. 6,4 г гидроксида натрия растворили в воде. Через полученный раствор пропустили 3,136
дм3 углекислого газа. Определите массы полученных солей.
1. Исследуем характер взаимодействия реагентов:
2NaOH +
CO2 =Na2CO3 + H2O n(NaOH) / n(CО2) = 2/1=2;
NaOH +
CO2 =NaHCO3
n(NaOH) / n(CO2) = 1/1=1.
2. Определяем химические количества реагентов данные в условии задачи:
n( NaOH)= m ( NaOH) / M( NaOH)
) n( NaOH)=0,16 моль;
n(СО2)= V ( CO2) / Vm
n(СО2)=0,14 моль.
3. Определяем мольное соотношение реагентов:
n ( NaOH)/n(СО2)=1,143.
4.Отмечаем данное отношение точкой на
числовой прямой:

Видно, что в ходе реакции в растворе образуется смесь
солей Na2CO3 и NaHCO3 , вещества прореагировали полностью.
5. Пусть количество углекислого газа, которое израсходовалось
на образование средней соли, равно x моль, а количество СО2, которое пошло на
образование кислой соли, равно у моль.
6. Учитывая, что углекислый газ и щелочь
прореагировали полностью, составляем систему:


7.Находим массы солей:
m(Na2CO3)= n(Na2 CO3) М(Na2CO3)= 0,02 · 106= 2,12(г);
m(NaHCO3)= n(Na НCO3) М(NaНCO3 )=0,12 · 84 =10,08 (г).
Ответ: m(Na2CO3)= 2,12г; m(NaHCO3)=10,08 г.
Задача 3. К 294г 5% ортофосфорной кислоты прибавили 342 г 10% гидроксида бария. Определите массовые доли
веществ в образовавшемся растворе.
1. Рассчитываем химические количества реагирующих веществ:
n(H3PO4)=mр (H3PO4)·ω(H3PO4)/M(H3PO4) =294 0,05/98=0,15(моль);
n(Ba(OH)2)=m(Ba(OH)2) ·ω(Ba(OH)2)/M(Ba(OH)2)=182,55 0,10/171=
=0,105(моль).
2. Определяем мольное соотношение реагентов:
n(Ba(OH)2)/n(H3PO4)= 0,105/0,15=0,70.
3. Т.к. мы имеем взаимодействие двухкислотного основания и трехосновной кислоты, то используем числовую
прямую (3), записав конкретные формулы солей. На
данной прямой отмечаем точкой найденное мольное отношение реагентов.

Следовательно, в растворе образуется смесь солей Ва(Н2РО4)2 и
ВаНРО4, вещества реагируют полностью.
4. Учитывая, что вещества прореагировали полностью, составляем систему уравнений:


5. Находим массы солей:
m(Ba (H2PO4)2 )= 14,895г;
m(BaHPO4 ) =13,98 г.
Ответ: m(Ba (H2PO4)2)= 14,895г; m(BaHPO4) =13,98 г.
Задача 4 ( № 15 §11 А.И.Врублевский Сборник
задач и упражнений по химии)
Оксид фосфора(V) массой 42,6 г добавили к раствору массой 128,0 г с
ω(NaOH)=25%. Определите массовые доли солей в образовавшемся растворе.
1. Определяем мольные отношения основания и оксида
фосфора (V) исходя из формул солей, не прибегая к записи уравнений:
Na3PO4 n(NaOH)/n(P2O5)=3/0.5=6;
Na2HPO4
n(NaOH/n(P2O5)=2/0,5=4;
NaH2PO4 n(NaOH/n(P2O5)=1/0.5=2.
2. Рассчитываем химические количества реагентов данные в условии задачи:
n(NaOH)= mр (NaOH) · ω(NaOH) /M(NaOH) ) n( NaOH)=0,8 моль;
n(P2O5 )= m(P2O5 ) /M( P2O5)
n(P2O5)=0,3 моль.
3. Определяем мольное соотношение реагирующих веществ:
n ( NaOH)/n(P2O5)=0.8/0.3=2.67
4.Строим прямую мольных соотношений реагирующих веществ.
Отмечаем на ней найденные соотношения основания и оксида
фосфора (V), надписываем соответствующие формулы
образующихся веществ, а также указываем мольное соотношение реагентов.

5. На числовой прямой видно, что мольное соотношение
реагентов находится в интервале (2;4), что соответствует образованию смеси солей Nа2HРО4 и NaHPO4, вещества реагируют полностью.

7. n(Na2HPO4)=0,2
моль; n(NaН2PO4) =0,4 моль.
8.Определяем массовые доли солей в образовавшемся растворе:
ω(Na2HPO4) = n(Na2HPO4)·M(Na2HPO4) / mр( NaOH) + m((P2O5 ) =
=0,2·142/128+42,6=0,166 или16,6%
ω(NaН2PO4) = n(NaН2PO4)·M(NaН2PO4) / mр(NaOH) + m((P2O5 ) =
=0,4·120/128+42,6=0,281 или 28,1%
Ответ: ω(Na2HPO4)=16,6%; ω(Na2HPO4)=28,1%.
Надеюсь, что предложенная схема решения задач вызовет интерес и будет с успехом
использоваться учителями и учащимися.
Массовая доля соли
Найдите массовую долю соли в полученном растворе, если к раствору хлорида кальция (CaCl2) массой 140 грамм с массовой долей 10% добавили 10 грамм этой же соли и 25 миллилитров воды (H2O).
Решение задачи
Для удобства решения задачи я предлагаю исходный раствор обозначить как 1 раствор, а полученный как 2 раствор.
Итак, запишем общую формулу для нахождения массовой доли соли в полученном растворе:
Учитывая, что после добавления хлорида кальция (CaCl2) масса соли изменилась, получаем:
Используя формулу, нахождения массовой доли соли в исходном растворе:
найдем массу исходного вещества хлорида кальция (CaCl2) в 1 растворе по формуле:
m1 (вещества) = 140 ⋅ 0,1 = 14 (г).
Если раствор 10-процентный, то массовая доля соли хлорида кальция (CaCl2) в нем 0,1.
Найдем массу второго вещества хлорида кальция (CaCl2) во 2 растворе:
m2 (вещества) = 14 + 10 = 24 (г).
После добавления воды и хлорида кальция (CaCl2) изменилась масса полученного раствора:
Используя вышеуказанную формулу, вычислим массу полученного раствора:
m2 (раствора) = 140 + 25 + 10 = 175 (г).
Так как плотность воды (H2O) равна 1 г/мл, то объём будет численно равен массе.
Найдем массовую долю соли хлорида кальция (CaCl2) во 2 растворе:
Ответ:
массовая доля соли 0,14.
При решении химических задач, при расчётах на работе, да и просто в жизни иногда приходится рассчитывать концентрации. Неважно, будет это школьная теоретическая задача, необходимость приготовить электролит для аккумулятора автомобиля, надобность узнать количество сахара для компота — все расчёты концентраций выполняются по известным формулам, которых не так много. Однако, с этим часто возникают трудности.
Прочитав эту статью, Вы научитесь легко рассчитывать концентрации веществ и при надобности играючи переводить одну концентрацию в другую. В статье приводятся примеры задач с решениями, а в конце приведём справочную табличку с формулами, которую можно распечатать и держать под рукой.
Массовая доля
Начнём с простого, но в то же время нужного способа выражения концентрации компонента в смеси — массовой доли.
Массовая доля есть отношение массы данного компонента к сумме масс всех компонентов. Обозначать её принято буквой w или ω (омега).
Рассчитывается массовая доля по формуле:
Large w_{i}=frac{m_{i}}{m}, ;;;;;(1)
где Large w_{i} — массовая доля компонента i в смеси,
Large m_{i} — масса этого компонента,
m — масса всей смеси.
И сразу разберём на примере:
Задача:
Зимой дороги посыпают песком с солью. Известно, что куча имеет массу 50 кг, и в неё всыпали 1 кг соли и перемешали. Найти массовую долю соли.
Решение:
Масса соли есть Large m_{i} по формуле выше. Масса всей смеси нам пока неизвестна, но найти её легко. Просуммируем массу песка и соли:
Large m = m_{п}+m_{с}= 50 кг + 1 кг = 51 кг
А теперь находим и массовую долю:
Large w_{с} = frac{m_{с}}{m} = 1 кг / 51 кг = 0.0196,
или умножаем на 100% и получаем 1.96%.
Ответ: 0.0196, или 1.96%.
Теперь решим что-то посложнее, и ближе к ЕГЭ.
Задача:
Смешали 200 г раствора глюкозы с массовой концентрацией 25% и 300 г раствора глюкозы с массовой концентрацией 10%. Найти массовую концентрацию полученного раствора, ответ округлить до целых.
Решение:
Обозначим первый и второй растворы соответственно Large m_{1} и Large m_{2}. Массу полученного после смешения раствора обозначим Large m и найдём:
Large m = m_{1} + m_{2} = 200 г + 300 г = 500 г
Массу самой глюкозы в первом и втором растворе обозначим Large m_{гл. 1} и Large m_{гл. 2}. По формуле (1) это будут наши массы компонентов. Массы растворов нам известны, их массовые концентрации тоже. Как найти массу компонента? Очень просто, находим неизвестное делимое умножением (и не забываем, что проценты — это сотые части):
Large m_{гл. 1} = w_{1}cdot m_{1} = 0.25 cdot 200 г = 50 г
Large m_{гл. 2} = w_{2}cdot m_{2} = 0.1 cdot 300 г = 30 г
Таким образом, общая масса глюкозы Large m_{гл}:
Large m_{гл} = m_{гл. 1} + m_{гл. 2} = 50 г + 30 г = 80 г.
Ответ: 80 г.
Задачи на смешение раствором с разными концентрациями одного вещества можно решать с помощью «конверта Пирсона».
Объёмная доля
Часто, когда мы имеем дело с жидкостями и газами, удобно оперировать их объёмами, а не массой. Поэтому, чтобы выражать долю какого-либо компонента в таких смесях (но и в твёрдых тоже вполне можно), пользуются понятием объёмной доли.
Объёмная доля компонента — отношение объёма компонента к сумме объёмов компонентов до смешивания. Объёмная доля измеряется в долях единицы или в процентах. Обычно обозначается греческой буквой φ (фи).
Рассчитывается объёмная доля по формуле:
Large phi_{B}=frac{V_{B}}{sum{V_{i}}}, ; ;;;; (2)
где Large phi_{B} — объёмная доля компонента B;
Large V_{B} — объём компонента B;
Large sum{V_{i}} — сумма объёмов всех компонентов.
Здесь важно понимать, что в формулу по возможности подставляем именно сумму объёмов всех компонентов, а не объём смеси, так как при смешивании некоторых жидкостей суммарный объём уменьшается. Так, если смешать литр воды и литр спирта, два литра аквавита мы не получим — будет примерно 1800 мл. В школьных задачах, как правило, это не так важно, но в уме держим и помним.
Задача:
Смешали 6 объёмов воды и 1 объём серной кислоты. Найти объёмную долю кислоты в полученном растворе.
Решение:
Так как объёмная доля — безразмерная величина, объёмы компонентов в условии задачи могут даваться в любых единицах — литрах, стаканах, баррелях, штофах, сексталях — главное, чтобы в одинаковых. Если не так — переводим одни в другие, если одинаковые — решаем. В нашем условии описаны просто некоторые «объёмы», их и подставляем.
Large phi_{H_{2}SO_{4}} = frac{V_{ H_{2}SO_{4} }} { V_{ H_{2}SO_{4}} + V_{H_{2}O}} = frac{1 : объём}{1 : объём + 6 : объёмов} = frac{1 : объём}{7 : объёмов} = 0.143, : или : 14.3%
Ответ: 14.3 %.
С газами всё обстоит немного интереснее — при не очень больших давлениях и температурах объёмная доля какого-либо газа в газовой смеси равна его мольной доле. (Ведь мы знаем, что молярный объём газов почти равен 22.4 л/моль).
Задача:
Мольная доля кислорода в сухом воздухе составляет 0.21. Найдите объёмную долю азота, если объёмная доля аргона составляет 1%.
Решение:
Внимательный читатель заметил, что мы написали о том, что объёмная и мольная доля для газов в смеси равны. Поэтому, объёмная доля кислорода равна также 0.21, или 21%. Найдём объёмную долю азота:
Large 100% – 21% – 1% = 78%.
Ответ: 78%.
Мольная доля
В тех случаях, когда нам известны количества веществ в смеси, мы можем выразить содержание того или иного компонента с помощью мольной доли.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. ИЮПАК рекомендует обозначать мольную долю буквой x (а для газов — y).
Находят мольную долю по формуле:
Large x_{B} = frac{n_{B}}{sum{n_{i}}}, ;;;;;(3)
где Large x_{B} — мольная доля компонента B;
Large n_{B} — количество компонента B, моль;
Large sum{n_{i}} — сумма количеств всех компонентов.
Разберём на примере.
Задача:
При неизвестных условиях смешали 3 кг азота, 1 кг кислорода и 0.5 кг гелия. Найти мольную долю каждого компонента полученной газовой смеси.
Решение:
Сначала находим количество каждого из газов (моль):
Large n_{N_{2}} = frac{ m_{N_{2}}}{M_{N_{2}}} = frac {3000 : г}{28 : ^г/_{моль}} = 107.14 : моль
Large n_{O_{2}} = frac{ m_{O_{2}}}{M_{O_{2}}} = frac {1000 : г}{32 : ^г/_{моль}} = 31.25 : моль
Large n_{He} = frac{ m_{He}}{M_{He}} = frac {500 : г}{4 : ^г/_{моль}} = 125 : моль
Затем считаем сумму количеств:
Large sum {n} = 107.14 : моль + 31.25 : моль + 125 : моль = 263.39 : моль
И находим мольную долю каждого компонента:
Large y_{N_{2}} = frac {107.14 : моль}{263.39 : моль} = 0.4068, : или : 40.68 %;
Large y_{O_{2}} = frac {31.25 : моль}{263.39 : моль} = 0.1186, : или : 11.86 %;
Large y_{He} = frac {125 : моль}{263.39 : моль} = 0.4746, : или : 47.46 %;
Проверяем:
Large 40.68 % + 11.86 % + 47.46 % = 100%.
И радуемся правильному решению.
Ответ: 40.68%, 11.86% , 47.46%.
Молярность (молярная объёмная концентрация)
А сейчас рассмотрим, вероятно, самый часто встречающийся способ выражения концентрации — молярную концентрацию.
Молярная концентрация (молярность, мольность) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также иногда говорят просто «молярность», и обозначают буквой М. Это значит, что, например, обозначение «0.5 М раствор соляной кислоты» следует понимать как «полумолярный раствор соляной кислоты», или 0.5 моль/л.
Обозначают молярную концентрацию буквой c (латинская «цэ»), или заключают в квадратные скобки вещество, концентрация которого указывается. Например, [Na+] — концентрация катионов натрия в моль/л. Кстати, слово «моль» в обозначениях не склоняют — 5 моль/л, 3 моль/л.
Рассчитывается молярная концентрация по формуле:
Large c_{B} = frac{n_{B}}{V} ; ; ;;; (4)
где Large n_{B} — количество вещества компонента B, моль;
Large V — общий объём смеси, л.
Разберём на примере.
Задача:
В пивную кружку зачем-то насыпали 24 г сахара и до краёв заполнили кипятком. А нам зачем-то нужно найти молярную концентрацию сахарозы в полученном сиропе. И кстати, дело происходило в Британии.
Решение:
Молекулярная масса сахарозы равна 342 (посчитайте, может мы ошиблись — C12H22O11). Найдём количество вещества:
Large n_{сахарозы} = frac{24 : г}{342 : г/моль} = 0.0702 моль
Британская пинта (мера объёма такая) равна 0.568 л. Поэтому молярная концентрация находится так:
Large c_{сахарозы} = frac{0.0702 : моль}{0.568 : л} = 0.1236 моль/л
Ответ: 0.1236 моль/л.
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
Обозначается нормальная концентрация как сн, сN, или даже c(feq B). Рассчитывается нормальная концентрация по формуле:
Large c_{N} = z cdot c_{B} = z cdot frac{n_{B}}{V}= frac{1}{f_{eq}} cdot frac {n_{B}}{V} ; ;;;; (5)
где Large n_{B} — количество вещества компонента В, моль;
V — общий объём смеси, л;
z — число эквивалентности (фактор эквивалентности Large f_{eq} = 1/z ).
Значение нормальной концентрации для растворов записывают как «н» или «N», а говорят «нормальность» или «нормальный». Например, раствор с концентрацией 0.25 н — четвертьнормальный раствор.
Разберём на примере.
Задача:
Рассчитать нормальность раствора объёмом 1 л, если в нём содержится 40 г перманганата калия. Раствор приготовили для последующего проведения реакции в нейтральной среде.
Решение:
В нейтральной среде перманганат калия восстанавливается до оксида марганца (IV). При этом в окислительно-восстановительной реакции 1 атом марганца принимает 3 электрона (проверьте на любой окислительно-восстановительной реакции перманганата калия с образованием оксида, расставив степени окисления), что означает, что число эквивалентности будет равно 3. Для расчёта концентрации по формуле (5) выше нам ещё не хватает количества вещества KMnO4. найдём его:
Large n_{KMnO_{4}}=frac{m _{KMnO_{4}}}{M _{KMnO_{4}} } = frac{40 : г}{158 г/моль}= 0.253 моль
Теперь считаем нормальную концентрацию:
Large c_{N_{KMnO_{4}}}= z cdot frac{n_{KMnO_{4}}}{V} = 3 cdot frac{0.253 : моль}{1 : л} = 0.759 моль-экв/л
Ответ: 0.759 моль-экв/л.
Таким образом, заметим важное на практике свойство — нормальная концентрация больше молярной в z раз.
Мы не будем рассматривать в данной статье особо экзотические способы выражения концентраций, о них вы можете почитать в литературе или интернете. Поэтому расскажем ещё об одном способе, и на нём остановимся — массовая концентрация.
Моляльная концентрация
Моляльная концентрация (моляльность, молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется моляльная концентрация в молях на кг. Как и с молярной концентрацией, иногда говорят «моляльность», то есть раствор с концентрацией 0.25 моль/кг можно назвать четвертьмоляльным.
Находится моляльная концентрация по формуле:
Large m_{B} = frac{n_{B}}{m_{A}}, ;;;;; (6)
где Large n_{B} — количество вещества компонента B, моль;
Large m_{A} — масса растворителя, кг.
Казалось бы, зачем нужна такая единица измерения для выражения концентрации? Так вот, у моляльной концентрации есть одно важное свойство — она не зависит от температуры, в отличие, например, от молярной. Подумайте, почему?
Массовая концентрация
Массовая концентрация — отношение массы растворённого вещества к объёму раствора. По рекомендации ИЮПАК, обозначается символом γ или ρ.
Находится массовая концентрация по формуле:
Large rho_{B}=frac{m_{B}}{V}, ;;;;; (7)
где Large m_{B} — масса растворенного вещества, г;
Large V — общий объём смеси, л.
В системе СИ выражается в кг/м3.
Разберём на примере.
Задача:
Рассчитать массовую концентрацию перманганата калия по условиям предыдущей задачи.
Решение:
Решение будет совсем простым. Считаем:
Large rho_{ KMnO_{4} }=frac{m_{ KMnO_{4} }}{V} =frac{40 : г}{1 : л} = 40 г/л.
Ответ: 40 г/л.
Также в аналитической химии пользуются понятием титра по растворенному веществу. Титр по растворенному веществу находится так же, как и массовая концентрация, но выражается в г/мл. Легко догадаться, что в задаче выше титр будет равен 0.04 г/мл (для этого надо умножить наш ответ на 0.001 мл/л, проверьте). Кстати, обозначается титр буквой Т.
А теперь, как обещали, табличка с формулами перевода одной концентрации в другую.
Таблица перевода одной концентрации в другую.
В таблице слева — ВО ЧТО переводим, сверху — ЧТО. Если стоит знак «=», то, естественно, эти величины равны.
| Массовая доля, large omega, % | Мольная доля, large x , % | Объёмная доля, large phi, % | Молярная концентрация, large c, моль/л | Нормальная концентрация, large c_{N} , моль-экв/л | Моляльная концентрация, large m, моль/кг | Массовая концентрация, large rho, г/л | |
| Массовая доля, large omega, % | = | large omega_{B}=LARGE frac{x_{B} cdot M(B)}{sum x_{i} cdot M_{i}} | Для газов: omega = LARGE frac{phi_{A} cdot M(A)}{sum (M_{i} cdot phi_{i})} |
large omega_{B}= LARGE frac{c_{B} cdot M(B)}{rho} | large omega_{B}=LARGE frac{c_{N} cdot M(B)}{rho cdot z} | large omega_{B}= LARGE frac{gamma_{B}}{rho} | |
| Мольная доля, large x , % | large x_{B}=LARGE frac{frac{omega_{B}}{M(B)}}{sum frac{omega_{i}}{M_{i}}} | = | large x_{B}=LARGE frac{m_{B}}{m_{B}+frac{1}{M(A)}} | ||||
| Объёмная доля, large phi, % | Для газов: large phi_{A}=LARGE frac{frac{omega_{A}}{M(A)}}{sum frac{omega_{i}}{M_{i}}} |
= | |||||
| Молярная концентрация, large c, моль/л | large c_{B}=LARGE frac{rho cdot omega_{B}}{M(B)} | = | large c_{B}=Large frac{c_{N}}{z} | ||||
| Нормальная концентрация, large c_{N} , моль-экв/л | large c_{N}=LARGE frac{rho cdot omega_{B} cdot z}{M(B)} | large c_{N}=c_{B} cdot z | = | ||||
| Моляльная концентрация, large m, моль/кг | large m_{B}=Large frac{x_{B}}{M(A)(1-x_{B})} | = | |||||
| Массовая концентрация, large gamma, г/л | large gamma_{B}=rho cdot omega_{B} | = |
Таблица будет пополняться.