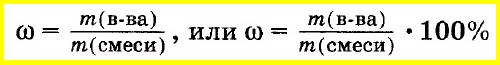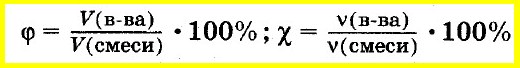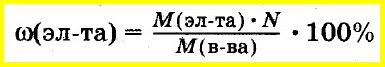4.3.1. Расчеты с использованием понятия «массовая доля вещества в растворе».
Раствором называют гомогенную смесь двух или более компонентов.
Вещества, смешением которых получен раствор, называют его компонентами.
Среди компонентов раствора различают растворенное вещество, которое может быть не одно, и растворитель. Например, в случае раствора сахара в воде сахар является растворенным веществом, а вода является растворителем.
Иногда понятие растворитель может быть применимо в равной степени к любому из компонентов. Например, это касается тех растворов, которые получены смешением двух или более жидкостей, идеально растворимых друг в друге. Так, в частности, в растворе, состоящем из спирта и воды, растворителем может быть назван как спирт, так и вода. Однако чаще всего в отношении водосодержащих растворов традиционно растворителем принято называть воду, а растворенным веществом — второй компонент.
В качестве количественной характеристики состава раствора чаще всего используют такое понятие, как массовая доля вещества в растворе. Массовой долей вещества называют отношение массы этого вещества к массе раствора, в котором оно содержится:
где ω(в-ва) – массовая доля вещества, содержащегося в растворе (г), m(в-ва) – масса вещества, содержащегося в растворе (г), m(р-ра) – масса раствора (г).
Из формулы (1) следует, что массовая доля может принимать значения от 0 до 1, то есть составляет доли единицы. В связи с этим массовую долю можно также выражать в процентах (%), причем именно в таком формате она фигурирует практически во всех задачах. Массовая доля, выраженная в процентах, рассчитывается по формуле, схожей с формулой (1) с той лишь разницей, что отношение массы растворенного вещества к массе всего раствора умножают на 100%:
Для раствора, состоящего только из двух компонентов, могут быть соответственно рассчитаны массовые доли растворенного вещества ω(р.в.) и массовая доля растворителя ω(растворителя).
Массовую долю растворенного вещества называют также концентрацией раствора.
Для двухкомпонентного раствора его масса складывается из масс растворенного вещества и растворителя:
Также в случае двухкомпонентного раствора сумма массовых долей растворенного вещества и растворителя всегда составляет 100%:
Очевидно, что, помимо записанных выше формул, следует знать и все те формулы, которые напрямую из них математически выводятся. Например:
Также необходимо помнить формулу, связывающую массу, объем и плотность вещества:
m = ρ∙V
а также обязательно нужно знать, что плотность воды равна 1 г/мл. По этой причине объем воды в миллилитрах численно равен массе воды в граммах. Например, 10 мл воды имеют массу 10 г, 200 мл — 200 г и т.д.
Для того чтобы успешно решать задачи, помимо знания указанных выше формул, крайне важно довести до автоматизма навыки их применения. Достичь этого можно только прорешиванием большого количества разнообразных задач. Задачи из реальных экзаменов ЕГЭ на тему «Расчеты с использованием понятия «массовая доля вещества в растворе»» можно порешать здесь.
Примеры задач на растворы
Пример 1
Рассчитайте массовую долю нитрата калия в растворе, полученном смешением 5 г соли и 20 г воды.
Решение:
Растворенным веществом в нашем случае является нитрат калия, а растворителем — вода. Поэтому формулы (2) и (3) могут быть записаны соответственно как:
Из условия m(KNO3) = 5 г, а m(Н2O) = 20 г, следовательно:
Пример 2
Какую массу воды необходимо добавить к 20 г глюкозы для получения 10%-ного раствора глюкозы.
Решение:
Из условий задачи следует, что растворенным веществом является глюкоза, а растворителем — вода. Тогда формула (4) может быть записана в нашем случае так:
Из условия мы знаем массовую долю (концентрацию) глюкозы и саму массу глюкозы. Обозначив массу воды как x г, мы можем записать на основе формулы выше следующее равносильное ей уравнение:
Решая это уравнение находим x:
т.е. m(H2O) = x г = 180 г
Ответ: m(H2O) = 180 г
Пример 3
150 г 15%-ного раствора хлорида натрия смешали со 100 г 20%-ного раствора этой же соли. Какова массовая доля соли в полученном растворе? Ответ укажите с точностью до целых.
Решение:
Для решения задач на приготовление растворов удобно использовать следующую таблицу:
1-й раствор
2-й раствор
3-й раствор
mр.в.
mр-ра
ωр.в.
где mр.в., mр-ра и ωр.в. — значения массы растворенного вещества, массы раствора и массовой доли растворенного вещества соответственно, индивидуальные для каждого из растворов.
Из условия мы знаем, что:
m(1)р-ра = 150 г,
ω(1)р.в. = 15%,
m(2)р-ра = 100 г,
ω(1)р.в. = 20%,
Вставим все эти значения в таблицу, получим:
1-й раствор |
2-й раствор |
3-й раствор |
|
mр.в. |
|||
mр-ра |
150 г | 100 г | |
ωр.в. |
15% | 20% | искомая величина |
Нам следует вспомнить следующие формулы, необходимые для расчетов:
ωр.в. = 100% ∙ mр.в./mр-ра , mр.в. = mр-ра ∙ ωр.в./100% , mр-ра = 100% ∙ mр.в. /ωр.в.
Начинаем заполнять таблицу.
Если в строчке или столбце отсутствует только одно значение, то его можно посчитать. Исключение — строчка с ωр.в., зная значения в двух ее ячейках, значение в третьей рассчитать нельзя.
В первом столбце отсутствует значение только в одной ячейке. Значит мы можем рассчитать его:
m(1)р.в. = m(1)р-ра ∙ ω(1)р.в. /100% = 150 г ∙ 15%/100% = 22,5 г
Аналогично у нас известны значения в двух ячейках второго столбца, значит:
m(2)р.в. = m(2)р-ра ∙ ω(2)р.в. /100% = 100 г ∙ 20%/100% = 20 г
Внесем рассчитанные значения в таблицу:
1-й раствор |
2-й раствор |
3-й раствор |
|
mр.в. |
22,5 г | 20 г | |
mр-ра |
150 г | 100 г | |
ωр.в. |
15% | 20% | искомая величина |
Теперь у нас стали известны два значения в первой строке и два значения во второй строке. Значит мы можем рассчитать недостающие значения (m(3)р.в. и m(3)р-ра):
m(3)р.в. = m(1)р.в. + m(2)р.в. = 22,5 г + 20 г = 42,5 г
m(3)р-ра = m(1)р-ра + m(2)р-ра = 150 г + 100 г = 250 г.
Внесем рассчитанные значения в таблицу, получим:
1-й раствор |
2-й раствор |
3-й раствор |
|
mр.в. |
22,5 г | 20 г | 42,5 г |
mр-ра |
150 г | 100 г | 250 г |
ωр.в. |
15% | 20% | искомая величина |
Вот теперь мы вплотную подобрались к расчету искомой величины ω(3)р.в.. В столбце, где она расположена, известно содержимое двух других ячеек, значит мы можем ее рассчитать:
ω(3)р.в. = 100% ∙ m(3)р.в./m(3)р-ра = 100% ∙ 42,5 г/250 г = 17%
Пример 4
К 200 г 15%-ного раствора хлорида натрия добавили 50 мл воды. Какова массовая доля соли в полученном растворе. Ответ укажите с точностью до сотых _______%
Решение:
Прежде всего следует обратить внимание на то, что вместо массы добавленной воды, нам дан ее объем. Рассчитаем ее массу, зная, что плотность воды равна 1 г/мл:
mдоб.(H2O) = Vдоб.(H2O) ∙ ρ(H2O) = 50 мл ∙ 1 г/мл = 50 г
Если рассматривать воду как 0%-ный раствор хлорида натрия, содержащий соответственно 0 г хлорида натрия, задачу можно решить с помощью такой же таблицы, как в примере выше. Начертим такую таблицу и вставим известные нам значения в нее:
1-й раствор |
2-й раствор |
3-й раствор |
|
mр.в. |
0 г | ||
mр-ра |
200 г | 50 г | |
ωр.в. |
15% | 0% | искомая величина |
В первом столбце известны два значения, значит можем посчитать третье:
m(1)р.в. = m(1)р-ра ∙ ω(1)р.в./100% = 200 г ∙ 15%/100% = 30 г,
Во второй строчке тоже известны два значения, значит можем рассчитать третье:
m(3)р-ра = m(1)р-ра + m(2)р-ра = 200 г + 50 г = 250 г,
Внесем рассчитанные значения в соответствующие ячейки:
1-й раствор |
2-й раствор |
3-й раствор |
|
mр.в. |
30 г | 0 г | |
mр-ра |
200 г | 50 г | 250 г |
ωр.в. |
15% | 0% | искомая величина |
Теперь стали известны два значения в первой строке, значит можем посчитать значение m(3)р.в. в третьей ячейке:
m(3)р.в. = m(1)р.в. + m(2)р.в. = 30 г + 0 г = 30 г
1-й раствор |
2-й раствор |
3-й раствор |
|
mр.в. |
30 г | 0 г | 30 г |
mр-ра |
200 г | 50 г | 250 г |
ωр.в. |
15% | 0% | искомая величина |
Теперь можем рассчитать массовую долю в третьем растворе:
ω(3)р.в. = 30/250 ∙ 100% = 12%.
ПОДГОТОВКА К ЭКЗАМЕНУ
«Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей»
Алгоритмы решения задач:
Пример 1. Вычисление массовой доли растворенного вещества
Определите массовую долю нитрата калия в растворе, полученном растворением 50 г нитрата калия в 200 г воды.
|
Дано: m(KNO3 ) = 50 г, m(Н2О) = 200 г. |
Решение ω(в-ва) = m(в-ва) / m(р-ра)*100 (%). m(р-ра) = m(в-ва) + m(Н2 О) = = 50 (г) + 200 (г) = 250 г. ω(KNO3 ) = = 50 (г) / 250 (г) * 100 (%) = 20 %. Ответ. ω(KNO3) = 20 %. |
|
ω(KNO3 ) – ? |
Пример 2. Вычисление массы растворенного вещества
Вычислите массу гидроксида калия в растворе объемом 600 мл и плотностью 1,082 г/мл, если массовая доля гидроксида калия составляет 10 %.
|
Дано: V(р-ра) = 600 мл, ρ = 1,082 г/мл, ω(KОН) = 10 %, или 0,1. |
Решение m(в-ва) = ω(в-ва)*m(р-ра). m(р-ра) = ρ*V(р-ра) = = 1,082 (г/мл)*600 (мл) = 649,2 г. m(KОН) = 649,2 (г)*0,1 = 64,92 г. Ответ. m(KОН) = 64,92 г. |
|
m(KОН) – ? |
Пример 3. Смешивание растворов с разными концентрациями одного вещества Смешали 300 г раствора с массовой долей хлорида натрия 20 % и 500 г раствора того же вещества с массовой долей 40 %. Вычислите массовую долю хлорида натрия в полученном растворе.
|
Дано: m1 = 300 г, ω1 = 20 %, или 0,2, m2 = 500 г, ω2 = 40 %, или 0,4. |
Решение m1 *ω1 + m2 *ω2 = m3 *ω3 , где m1 , m2 , m3 – массы растворов. 300 (г)*0,2 + 500 (г)*0,4 = = 800 (г)*ω3 , 60 (г) + 200 (г) = 800 (г)*ω3 , 260 (г) = 800 (г)*ω3 , ω3 = 260 (г) / 800 (г) = 0,325, или 32,5 %. Ответ. ω3 (NaCl) = 32,5 %. |
|
ω3 – ? |
Пример 4. Разбавление водой
ω2 = 0, т.к. в воде не содержится вещество, находящееся в первом растворе.
Какую массу воды надо добавить к раствору гидроксида натрия массой 150 г с массовой долей 10 %, чтобы получить раствор с массовой долей 2 %?
|
Дано: m1 = 150 г, ω1 = 10 %, или 0,1, ω2 = 0, ω3 = 2 %, или 0,02. |
Решение m1 *ω1 + m2 *ω2 = m3 *ω3 . 150 (г)*0,1 + m2 *0 = = (150 (г) + m2 )*0,02, 15 (г) + 0 = 3 (г) + 0,02m2 , 0,02m2 = 12 г, m2 = 12 (г) / 0,02 = 600 г. Ответ. m(Н2О) = 600 г. |
|
m2 – ? |
Пример 5. Концентрирование (добавление твердого вещества)
ω2 = 100 %, или 1, т.к. добавляемое вещество чистое.
Какую массу хлорида бария надо добавить к раствору хлорида бария массой 150 г с массовой долей 10 %, чтобы получить раствор с массовой долей 25 %?
|
Дано: m1 = 150 г, ω1 = 10 %, или 0,1, ω2 = 100 %, или 1, ω3 = 25 %, или 0,25. |
Решение m1 *ω1 + m2 *ω2 = m3 *ω3 . 150 (г)*0,1 + m2 *1 = = (150 (г) + m2 )*0,25, 15 (г) + 1*m2 = 37,5 (г) + 0,25m2 , 0,75m2 = 22,5 г, m2 = 22,5 (г) / 0,75 = 30 г. Ответ. m(BaCl2 ) = 30 г. |
|
m2 – ? |
Пример 6. Упаривание раствора (частичное выпаривание воды)
Вычислите массовую долю хлорида натрия в растворе, если из 200 г 30 %-го раствора испарилось 50 г воды.
|
Дано: m1 = 200 г, ω1 = 30 %, или 0,3, m2 = 50 г, ω2 = 0. |
Решение m1 *ω1 + m2 *ω2 = m3 *ω3 . 200 (г)*0,3 + 50 (г)*0 = = 150 (г)*ω3 , 60 (г) = 150 (г)*ω3 , ω3 = 60 (г) / 150 (г) = 0,4, или 40 %. Ответ. ω3 (NaCl) = 40 % |
|
ω3 – ? |
ПРИМЕРЫ ЗАДАЧ
1. Какая масса карбоната натрия (в граммах) потребуется для приготовления 0,5 л 13%-го раствора плотностью 1,13 г/мл?
а) 73,45; б) 50; в) 72; г) 75.
2. Из раствора хлорида бария массой 100 г с массовой долей соли 3 % выпарили 25 г воды и до- бавили в него 15 г соли. Массовая доля соли (в %) в полученном растворе равна:
а) 12; б) 15; в) 18; г) 20.
3. Смешали 120 г раствора серной кислоты с массовой до лей 20 % и 40 г 50%-го раствора того же вещества. Определите массовую долю кислоты (в %) в полученном растворе.
а) 25; б) 27,5; в) 27; г) 29,5.
4. Какая масса азотной кислоты (в граммах) содержится в 1 л ее 20%-го раствора с плотностью 1,05 г/мл?
а) 105; б) 63; в) 210; г) 176.
5. Какая масса соли (в граммах) вводится в организм человека при вливании 353 г 0,85%-го физиологического раствора?
а) 3; б) 6; в) 4; г) 2 г.
6. К 180 г 8%-го раствора хлорида натрия добавили 20 г NaCl. Найдите массовую долю (в %) хлорида натрия в образовавшемся растворе.
а) 17,2; б) 17,4; в) 18; г) 12,7.
7. К раствору хлорида кальция массой 140 г с массовой долей соли 5 % добавили 10 г этой же соли. Определите массовую долю (в %) хлорида кальция в полученном растворе.
а) 13,1; б) 14; в) 11,3; г) 25.
8. Какую массу соли (в граммах) надо добавить к 60 г раствора с массовой долей этой соли 10 %, чтобы получить раствор с массовой долей 40 %?
а) 15; б) 22; в) 17; г) 30.
9. Смешали 200 г 15%-го раствора нитрата хрома(III) и 300 г 20%-го раствора той же соли. Вычислите массовую долю (в %) ни- трата хрома(III) в полученном растворе.
а) 24; б) 18; в) 17,9; г) 18,1.
10. Из 150 г раствора хлорида натрия с массовой долей 5 % выпарили 10 г воды и добавили 5 г той же соли. Вычислите массовую долю (в %) соли в полученном растворе.
а) 8,4; б) 8,6; в) 9; г) 11,2.
11. Смешали 200 г 5%-го и 400 г 12,5%-го растворов серной кислоты. Найдите массу кислоты в полученном растворе (в граммах).
а) 60; б) 98; в) 49; г) 58.
12. При растворении 16 г гидроксида натрия получили 10%- й раствор. Определите массу (в граммах) взятой для этого воды.
а) 126; б) 144; в) 151; г) 164.
13. К 200 г 10%-го раствора ни- трата калия добавили некоторую порцию нитрата калия и получи- ли 20%-й раствор. Найдите массу (в граммах) добавленной порции твердого вещества. а) 2,5; б) 5; в) 25; г) 15.
14. Найдите массу воды (в граммах), которую нужно добавить к 300 г 8%-го раствора сульфата натрия для получения 5%-го раствора.
а) 90; б) 45; в) 18; г) 180.
15. Какая масса раствора (в граммах) получится при упаривании 200 г 5%-го раствора гидроксида калия до 20%-го раствора?
а) 10; б) 45; в) 100; г) 50.
16. 92 мл 10%-го раствора серной кислоты (плотность 1,066 г/мл) полностью нейтрализовали 40%-м раствором гидроксида натрия. Найдите массу затраченного на нейтрализацию раствора гидроксида натрия (в граммах).
а) 10; б) 55; в) 20; г) 30.
17. Определите, какую массу гидроксида калия (в граммах) нужно добавить к 150 г 20%-го раствора гидроксида калия для получения 40%-го раствора.
а) 5; б) 50; в) 56; г) 78.
18. К 200 г 8%-го раствора хлорида натрия добавили 50 г воды. Вычислите массовую долю (в %) соли в образовавшемся растворе.
а) 6,4; б) 6,5; в) 6,1; г) 6,2.
19. Определите массу воды (в граммах), которую надо добавить к 20 г 70%-го раствора уксусной кислоты для получения 5%-го раствора уксуса.
а) 260; б) 130; в) 26; г) 258.
20. Определите массу сахара (в граммах), необходимую для приготовления 0,5 кг 45%-го раствора.
а) 245; б) 225; в) 345; г) 500.
21. Вычислите массовую долю соляной кислоты (в %) в растворе, полученном при растворении 11,2 л (н.у.) хлороводорода в 1 л воды.
а) 1,3; б) 1,6; в) 1,8; г) 3,6.
22. Вычислите массу 40%-го раствора уксусной кислоты (в граммах), которую необходимо добавить к 500 г воды для получения 15%-го раствора.
а) 29; б) 32; в) 48; г) 300.
23. Массовая доля соли в морской воде составляет 3,5 %. Найдите массу соли (в граммах), которая останется после выпаривания 5 кг морской воды.
а) 175; б) 170; в) 167; г) 163.
24. Смешали 250 г раствора гидроксида натрия с массовой долей 16 % и 300 мл раствора (ρ = 1,2 г/мл) с массовой долей того же вещества 20 %. Рассчитайте массу гидроксида натрия (в граммах) в полученном растворе:
а) 120; б) 112; в) 11; г) 115.
25. Какова масса поваренной соли (в граммах), которую следует растворить в 250 г раствора этой соли с массовой долей 10 % для получения раствора с массовой долей 18 %?
а) 22; б) 42,4; в) 24,4; г) 44.
26. К 50 г раствора хлорида кальция с массовой долей 3,5 % добавили 5 г этой же соли и 20 г воды. Определите массовую долю (в %) соли в полученном растворе.
а) 6; б) 7; в) 8; г) 9.
27. Какая масса серной кисло ты (в граммах) содержится в 0,6 л ее 40%-го раствора с плотностью 1,3 г/мл?
а) 63; б) 26; в) 60; г) 312.
28. Найдите массу хлорида натрия (в граммах), который необходимо растворить в 50 г воды для приготовления раствора с массовой долей соли 20 %.
а) 20; б) 12,5; в) 5; г) 24.
29. К 350 г водного раствора этанола с массовой долей 20 % добавили 120 мл спирта (плотность 0,8 г/мл). Рассчитайте массу спирта (в граммах) в полученном растворе.
а) 167; б) 156; в) 166; г) 170.
30. Из 50 г раствора хлорида натрия с массовой долей 2 % выпарили 10 г воды и добавили 5 г этой же соли. Определите массовую долю соли (в %) в полученном растворе.
а) 6,3; б) 13,3; в) 8,9; г) 9,4
Ответы. 1–а, 2–г, 3–б, 4–в, 5–а, 6–а, 7–в, 8–г, 9–б, 10–б, 11–а, 12–б, 13–в, 14–г, 15–г, 16–в, 17–б, 18–а, 19–а, 20–б, 21–в, 22–г, 23–а, 24–б, 25–в, 26–г, 27–г, 28–б, 29–в, 30–б.
Решение задач с долей вещества в смеси, в соединении
Ключевые слова конспекта: массовая доля вещества в смеси или растворе, молярная доля вещества, объемная доля вещества, массовая доля элемента в соединении, масса элемента, массовая доля элемента.
Массовую долю вещества в смеси или растворе вычисляют как отношение массы вещества, входящего в состав смеси, к массе всей смеси. Массовую долю часто выражают в процентах. Для этого отношение массы вещества к массе смеси умножают на 100%:
Аналогично объемную долю вещества вычисляют как отношение объема вещества к объему смеси, а молярную долю вещества — как отношение количества вещества одного из компонентов смеси к сумме количеств веществ всех компонентов смеси:
Массовую долю элемента в соединении вычисляют как отношение массы элемента, входящего в состав данного соединения, к массе всего соединения:
Зная молекулярную формулу соединения, массу элемента, входящего в его состав, вычисляют как произведение молярной массы элемента на число атомов этого элемента в соединении.
В этом случае массовую долю элемента в соединении рассчитывают как отношение этой величины к молярной массе всего соединения:
Цитаты из пособия «Задачи по химии 8-9 кл.» (авт. О.С. Габриелян и др.) использованы в учебных целях. Ссылка на покупку книги указана в конце конспекта.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
25 г оксида магния смешали с 35 г оксида алюминия. Определите массовую долю оксида магния в данной смеси.
Ответ. ω(MgO) = 0,417, или 41,7%.
Задача № 2.
Вычислите объемную долю азота в смеси газов, содержащей 32 л азота, 48 л углекислого газа, 36 л гелия и 14 л водорода.
Ответ. φ(N2) = 0,246, или 24,6%.
Задача № 3.
Вычислите молярную и массовую долю (в %) оксида углерода (II) в смеси, содержащей 16,8 л (н. у.) оксида углерода (II) и 13,44 л (н. у.) оксида углерода (IV).
Ответ. χ(СО) = 55,56%, ω(СО) = 44,3%.
Задача № 4.
В воде растворили 15 г хлорида натрия. Вычислите массу полученного раствора, если массовая доля соли в нем равна 5%.
Ответ: m(р-ра) = 300 г.
Задача № 5.
Образец сплава меди с цинком имеет массу 75 г. Массовая доля меди в этом сплаве равна 64%. Определите массу цинка в данном образце.
Ответ. m(Zn) = 27 г.
[highlight]Задача № 6.[/highlight] Объемная доля аммиака в смеси с кислородом равна 40%. Вычислите плотность данной смеси по воздуху.
Посмотреть РЕШЕНИЕ
Ответ. Dвозд(смеси) = 0,896.
Задача № 7.
Найдите массовую долю кислорода в фосфате натрия.
Посмотреть РЕШЕНИЕ
Ответ. ω (O) = 39%.
[highlight]Задача № 8.[/highlight] Определите массовую долю фосфора в смеси, содержащей 55 г фосфата натрия и 70 г дигидрофосфата натрия.
Посмотреть РЕШЕНИЕ
Ответ. ω(Р) = 22,77%
[highlight]Задача № 9.[/highlight] Массовая доля серы в техническом сульфате натрия равна 20,48%. Рассчитайте массовую долю примесей в данном продукте (в %).
Посмотреть РЕШЕНИЕ
Ответ. ω (примесей) = 9,12%.
Задача № 10.
Плотность смеси оксида азота (II) и оксида азота (IV) по водороду равна 17,8. Найдите массовую долю оксида азота (IV) в данной смеси.
Посмотреть РЕШЕНИЕ
Ответ. ω(NO2) = 45,2%.
Решение задач с долей вещества в смеси, в соединении. Выберите дальнейшие действия:
- Перейти к следующей теме: Решение задач на вывод формул соединений
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
- Купить книгу Задачи по химии и способы их решения. 8-9 кл. / О.С. Габриелян и др. — М.: Дрофа.
Задание на массовую долю вещества в растворе и действия с растворами.
-
Расчетная формула, по которой решаются данные задачи выглядит следующим образом:
ωвещества = m вещества* 100%, где ωвещества – массовая доля растворенного вещества, %
m раствора m вещества – масса растворенного вещества, гр.
m раствора – масса всего раствора, гр.
m раствора = m вещества + m растворителя, гр.
Рассмотрим несколько примеров на применение данной формулы.
Пример 1. Вычислите массовую долю раствора, которая получается при растворении 15 граммов карбоната натрия в 250 граммах воды.
Дано: Решение.
m (Na2CO3) = 15 гр. Запишем расчетную формулу:
m (H2O) = 250 гр. ω(Na2CO3) = m вещества* 100%
m раствора
Найти: Подставим данные из условия:
ω (Na2CO3) – ? ω(Na2CO3) = 15 гр. /250 гр. + 15 гр. *100% = 5,7 %
Ответ: ω(Na2CO3) = 5,7 %
Задачи для самостоятельной работы.
-
Вычислите массовую долю хлорида натрия, которая получается при растворении 50 гр. поваренной соли в 400 гр. воды.
-
Какая массовая доля раствора получится при смешивании 300 гр. воды и 25 гр. гидроксида натрия.
-
Вычислите массовую долю раствора, которая получается при растворении в 550 гр. воды 42 гр. хлорида кальция.
-
В 150 гр. воды растворили 17 гр. нитрата калия. Вычислите полученную массовую долю раствора.
-
К 800 гр. воды добавили 25 гр. хлорида бария. Какова массовая доля вещества в полученном растворе.
Примечание: в качестве растворителя могут быть использованы и другие вещества, например, спирт.
Растворяемое вещество может быть указано конкретно, т.е. хлорид натрия, гидроксид калия и т.д., а может быть просто названо «веществом». Алгоритм решения задачи при этом не меняется.
Пример 2. Какую массу хлорида магния нужно добавить, чтобы получить 180 гр. 15% раствора этой соли?
Дано: Решение:
m раствора = 180 гр. Запишем расчетную формулу и проанализируем ее с учетом условия задачи:
ω (MgCl2) = 15 % ω(MgCl2) = m вещества * 100%
m раствора
-
Вариант решения: подставим все данные из условия:
Найти: 15% = m вещества * 100%
m (MgCl2) – ? 180 гр
.
m вещества = 180 гр. *15 % = 27 гр.
100 %
-
Вариант решения: сразу в дано разделим массовую долю на 100 %, получим:
0,15 = m вещества
180 гр.
m вещества = 0,15 * 180 гр. = 27 гр.
Ответ: m (MgCl2) = 27 гр.
По итогу следует запомнить один из вариантов решения задачи:
-
Через выражение из формулы массовой доли нужной нам массы вещества:
m вещества = m раствора * ω вещества
100 %
-
Через перевод массовой доли из процентов в доли путем деления на 100%:
m вещества = ω вещества (в долях) * m раствора
Задачи для самостоятельной работы.
-
Какую массу нитрата серебра нужно взять, чтобы получить 250 гр. 25 % раствора?
-
Сколько граммов карбоната натрия нужно взять для приготовления 325 гр. раствора с массовой долей карбоната 12,5%?
-
Какую массу сульфата калия следует взять для приготовления 230 гр. раствора с массовой долей соли 10 %?
-
Сколько граммов хлорида меди необходимо взять для получения 450 гр. раствора с массовой долей 14 %?
-
Какую массу фторида калия необходимо взять для приготовления раствора с массовой долей соли 23%?
Пример 3. Сколько воды потребуется для приготовления раствора сульфата калия с массовой долей соли 5 % если соли взято 10 гр.?
Дано: Решение:
m (K2SO4) = 10 гр. Запишем расчетную формулу и проанализируем ее с учетом условия задачи:
ω(K2SO4) = m вещества * 100%
m раствора
ω(K2SO4) = 5% 1. Вариант решения: подставим все данные из условия:
Найти: 5% = 10 гр. * 100%
m раствора
m(H2O) – ? m раствора = 10 гр. * 100% = 200 гр.
5 %
m (H2O) = m раствора – m вещества
m (H2O) = 200 гр. – 10 гр. = 190 гр.
2. Вариант решения: сразу в дано разделим массовую долю на 100 %:
0,05 = 10 гр.
m раствора
m раствора = 10 гр./ 0,05 = 200 гр.
m (H2O) = m раствора – m вещества
m (H2O) = 200 гр. – 10 гр. = 190 гр.
Ответ: m (H2O) = 190 гр.
По итогу следует запомнить один из вариантов решения задачи:
-
Через выражение из формулы массовой доли массы раствора:
m раствора = m вещества *100 %
ω вещества
m (растворителя) = m раствора – m вещества
-
Через перевод массовой доли из процентов в доли путем деления на 100%:
m раствора = m вещества/ω вещества (в долях)
m (растворителя) = m раствора – m вещества
Задачи для самостоятельной работы.
-
Какую массу воды следует взять для того, чтобы приготовить 15 % раствор из силиката калия массой 52 гр.?
-
Сколько воды потребуется для приготовления раствора гидроксида натрия с массовой долей соли 5 % если взято 10 гр. гидроксида?
-
Вычислите массу воды, которая необходима для получения из 25 гр. нитрата магния раствора с массовой долей 32 %?
-
Какую массу воды следует взять для того, чтобы приготовить 25 % раствор из гидроксида калия массой 17гр.?
-
Какую массу воды нужно взять для приготовления из 30 гр. йодида марганца раствора с массовой долей 17 %?
Далее рассмотрим задачи, в которых происходят изменения с уже приготовленным раствором. К таким изменениям относятся:
а) добавление вещества (увеличение массовой доли раствора)
б) добавление растворителя (разбавление раствора)
в) выпаривание – убавление массы растворителя
г) смешивание двух растворов с разной массовой долей, но одинаковым растворенным веществом.
д) комбинированные задачи, включающие не одно действие с раствором.
Пример: К 150 гр. раствора гидроксида калия с массовой долей 12% добавили 15 граммов гидроксида. Какова массовая доля полученного раствора?
Дано: 1. Находим массу растворенного вещества в исходном растворе:
m (раствора KOH) = 150 гр. m (KOH) = 0,12 * 150 гр. = 18 гр.
ω (KOH) = 12% = 0,12 2. Рассчитываем массовую долю получившегося раствора:
m (KOH) = 15 гр. ω1 (KOH) = m (KOH)исходного раствора + m (KOH) * 100%
m (раствора KOH) + m (KOH)
Найти: ω1 (KOH) = 18 гр. + 15 гр. *100% = 20 %
ω1 (KOH) – ? 150 гр. + 15 гр.
Ответ: ω1 (KOH) = 20 %
При добавлении вещества к раствору его массовая доля увеличивается. А при расчете новой массовой доли мы прибавляем массу этого вещества как в числитель, так и в знаменатель.
Задачи для самостоятельной работы.
-
К 200 гр. раствора хлорида натрия с массовой долей соли 10 % добавили 20 гр. этой же соли. Вычислите полученную массовую долю раствора.
-
25 гр. карбоната натрия добавили в раствор этой же соли массой 300 гр. и массовой долей 17 %. На сколько изменилась массовая доля в полученном растворе?
-
К 450 гр. раствора фторида калия с массовой долей 8% добавили 35 граммов фторида. Какова массовая доля полученного раствора?
Пример: Раствор сернистой кислоты массой 250 гр. и массовой долей 10 % разбавили 100 гр. воды. Вычислите массовую долю кислоты в полученном растворе.
Дано: 1. Найдем массу растворенной сернистой кислоты в исходном растворе:
m (раствора) = 250 гр. m (H2SO3) = 0,1 * 250 гр. = 25 гр.
ω (H2SO3) = 10% = 0,1 2. Рассчитаем массовую долю получившегося раствора:
m (H2O) = 100 гр. ω1 (H2SO3) = m (H2SO3) *100 %
Найти: m (раствора) + m (H2O)
ω1 (H2SO3) – ? ω1 (H2SO3) = 25 гр. * 100% = 7 %
250 гр. + 100 гр.
Ответ: ω1 (H2SO3) = 7 %
При добавлении растворителя к раствору его массовая доля уменьшается. А при расчете новой массовой доли мы прибавляем массу растворителя только в знаменатель.
При выпаривании, наоборот, массовая доля в новом растворе будет увеличиваться. А при вычислениях из знаменателя мы вычитаем массу испарившейся воды (или другого растворителя).
Задачи для самостоятельной работы.
-
Раствор соляной кислоты массой 350 гр. и массовой долей 20 % разбавили 50 гр. воды. Вычислите массовую долю кислоты в полученном растворе.
-
Из раствора карбоната натрия массой 500 гр. и массовой долей растворенной соли 14 % выпарили 120 гр. воды. Рассчитайте массовую долю карбоната в полученном растворе.
-
Раствор перманганата калия массой 150 гр. и массовой долей соли 5 % разбавили 50 гр. воды. Вычислите массовую долю соли в полученном растворе.
Пример: Смешали 250 гр. раствора серной кислоты с массовой долей 10 % и 320 гр. раствора серной кислоты с массовой долей 15 %. Вычислите массовую долю серной кислоты в полученном растворе.
Дано: Решение:
m1 (раствора) = 250 гр. 1. Найдем массу растворенной серной кислоты в 1 и 2 растворах:
ω1 (H2SO4) = 10 % = 0,1 m1 (H2SO4) = 250 гр. * 0,1 = 25 гр.
m2 (раствора) = 320 гр. m2 (H2SO4) = 320 гр. * 0,15 = 48 гр.
ω2 (H2SO4) = 15 % = 0,15 2. Найдем массу растворенной серной кислоты в 3 растворе, а так же
Найти: массу 3 раствора:
ω3 – ? m3 (H2SO4) = m1 (H2SO4) + m2 (H2SO4)
m3 (H2SO4) = 25 гр. + 48 гр. = 73 гр.
m3 (раствора) = m1 (раствора) + m2 (раствора)
m2 (раствора) = 250 гр. + 320 гр. = 570 гр.
3. Найдем массовую долю 3 раствора:
ω3 = m3 (вещества) * 100%
m3 (раствора)
ω3 = 73 гр. * 100 % = 12,8 %
570 гр.
Ответ: ω3 = 12,8 %
Задачи для самостоятельной работы.
-
Смешали 150 гр. раствора азотной кислоты с массовой долей 15 % и 240 гр. раствора азотной кислоты с массовой долей 20 %. Вычислите массовую долю серной кислоты в полученном растворе.
-
К раствору гидроксида натрия массой 400 гр. и массовой долей 14 % добавили 150 гр. раствора гидроксида натрия с массовой долей 18 %. Вычислите массовую долю серной кислоты в полученном растворе.
-
Смешали 50 гр. раствора хлорида калия с массовой долей 35 % и 620 гр. раствора хлорида калия с массовой долей 12 %. Вычислите массовую долю серной кислоты в полученном растворе.
Задачи по теме «массовая доля ЕГЭ.
-
Вычислите массу соли, которую нужно добавить к 164 г 15% раствора этой же соли, чтобы получить 20%-ный раствор. Ответ запишите с точность до целых.
-
Определите массу (в граммах) 15%-го раствора соли, который необходимо добавить к 130 г 5% раствора соли, чтобы получить 5% раствор. Ответ запишите с точностью до целых.
-
Вычислите массовую долю (в %) соли в растворе, полученном после добавления 500 гр. воды и 10 г соли к 200 г 18%-го раствора этой же соли. Ответ запишите с точностью до целых.
-
Вычислите массу 15% раствора соли, который нужно добавить к 300 г 35% раствора этой же соли, чтобы получить 20% раствор. Ответ запишите с точностью до целых.
-
Вычислите массу 17% раствора (в граммах), при разбавлении которого можно получить 240 г 7%-го раствора. Ответ запишите с точностью до целых.
-
Вычислите массовую долю (в процентах) соли в растворе, полученном после выпаривания 40 мл воды из 260 г 9%-го раствора соли. Ответ запишите с точностью до целых.
-
Вычислите массу воды, которую нужно выпарить из к 500 г 11%-го раствора соли, чтобы получить 24%-ный раствор. Ответ запишите с точностью до целых.
-
Смешали 300 г 25%-го раствора соли и 180 г 13%-го раствора этой же соли. Вычислите массу воды в полученном растворе (в г). Ответ запишите с точностью до десятых.
-
Из 285 г раствора с массовой долей йодида калия 6% выпарили 20 мл воды и добавили 10 г этой же соли. Массовая доля соли в конечном растворе составила _____ %. Запишите число с точностью до десятых.
-
Какую массу воды (в граммах) нужно добавить к 300 мл 20% раствора гидроксида натрия (p=1,22p=1,22 г/мл), чтобы массовая доля щелочи в полученном растворе составила 5%? Запишите число с точностью до целых.
Самое главное при решении таких задач (а именно номер 27 в ЕГЭ по химии) это знать всего 3 формулы:
- массовой доли w=m(в-ва)/m(р-ра) * 100%
- молярной доли по массе М=m/v
- молярной доли по объему Vm=V/v
Вообще, основной тип этих задач – смешивание каких-либо растворов, и задача определить массовую долю вещества в получившемся растворе или масса выделившегося вещества
Алгоритм решения достаточно простой:
1) Вычислить массу растворённого вещества в каждом данном растворе
2) Вычислить общую массу смешиваемых растворов (получится новый раствор)
3) Вычислить общую массу растворённых веществ, полученных в пункте 1
4) Если требуется найти массовую долю в полученном растворе, то используя формулы, данные выше, разделить общую массу растворённых веществ (результат 3-его пункта) на массу смешиваемых растворов (результат 2-го пункта) и получить ответ.
Если же требуется получить массу какого-то побочного продукта, то надо вычесть из общей массы раствора массу данного раствора (всё это будет дано или получено, если требуется получить массу побочного продукта).
Итак, перейдём к практике:)
№1. Смешали 80 г раствора с массовой долей нитрата натрия 25 % и 20 г раствора этой же соли с массовой долей 40 %. Вычислите массовую долю соли в полученном растворе. Ответ дайте в процентах с точностью до целых.
Действуем согласно алгоритму:
1)Вычислим массу нитрата натрия в обоих растворах.
Используя формулу w=m(в-ва)/m(р-ра) * 100% , выражаем массу растворённого вещества, то есть нитрата натрия в КАЖДОМ РАСТВОРЕ:
m(в-ва1) = w(в-ва1) * m(р-ра1) : 100% = 80 г*25%:100%= 20г
m(в-ва2) = w(в-ва1) * m(р-ра2) : 100% = 20 г*40%:100%= 8г
2) Вычисляем общую массу растворов, которые смешиваем
m(р-ра) = m(р-ра1)+m(р-ра2)=80г+20г=100г
3)Вычисляем общую массу растворённых веществ
m(в-ва)=m(в-ва1)+m(в-ва2)=20г+8г=28г
4)Нам требуется получить массовую долю соли в полученном растворе. Масса соли получена в 3-ем пункте, масса раствора – во 2-м. Так что, используя формулу w=m(в-ва)/m(р-ра) * 100% вычисляем массовую долю соли в получившемся растворе.
w=m(в-ва)/m(р-ра) * 100% = 28г/100г*100%=28%
Сказано округлить до целых, но ответ уже в целых, так что так и пишем в ответе: 28%
Ответ: 28%. Задача решена.
Задача №2 будет немного другим типом, так что алгоритм немного нарушается
№2. Упариванием 500 г раствора с массовой долей соли 10 % получен раствор с массовой долей соли 14 %. Вычислите массу выпаренной при этом воды. Ответ укажите в граммах с точностью до целых.
Эта задача как раз и является тем случаем, когда нужно найти массу побочного продукта (конкретно здесь – воды)
1) Вычисляем массу соли в растворе по уже знакомой формуле
m(соли) = w(соли) * m(р-ра) : 100% = 10%*500г/100% = 50г
2) Общая масса растворов и есть данный раствор, так как фактически мы просто выделяем из него воду. Так что считать общую массу не нужно, она нам дана
3) В этой задаче действуем по другому – вычисляем раствор, который получится. То есть нам дана массовая доля соли в новом растворе, и массу этой соли мы уже знаем (1 пункт), так что мы можем вычислить массу раствора по формуле:
w=m(в-ва)/m(р-ра1) * 100%
Получается, что m(р-ра1) = m(в-ва)*100%/ w = 50г *100%/14%=примерно 357,1г.
4) Вычитаем из массы общего раствора массу получившегося раствора и получаем массу выпаренной воды, которую нам и нужно найти:
m(воды)=m(р-ра)-m(р-ра1)= 500г-357,1г=142,9г
Нам по условию нужно указать ответ с точностью до целых, то есть ответ 143 грамма.
Как видите, решать подобные задачи довольно просто. В них даже не надо знать никаких реакций, чтобы решать. Теперь вы сможете решить любую задачу на эту тему.
ПОНРАВИЛАСЬ СТАТЬЯ? ОБЯЗАТЕЛЬНО ПОДПИШИСЬ И ПОСТАВЬ ЛАЙК! ТАКЖЕ ПОДПИСЫВАЙСЯ НА МЕНЯ ВКОНТАКТЕ ПО ССЫЛКЕ: https://vk.com/hello_there_2021 Удачи!
P.S. Пишите в комментарии или в личку задачи, которые были бы Вам интересны для разбора или которые вызывают трудности. Постараюсь всем ответить!