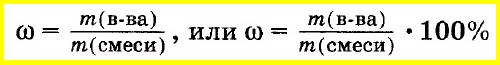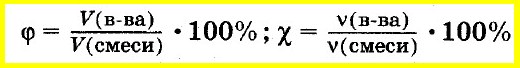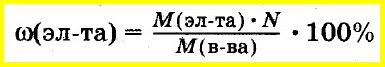При решении химических задач, при расчётах на работе, да и просто в жизни иногда приходится рассчитывать концентрации. Неважно, будет это школьная теоретическая задача, необходимость приготовить электролит для аккумулятора автомобиля, надобность узнать количество сахара для компота — все расчёты концентраций выполняются по известным формулам, которых не так много. Однако, с этим часто возникают трудности.
Прочитав эту статью, Вы научитесь легко рассчитывать концентрации веществ и при надобности играючи переводить одну концентрацию в другую. В статье приводятся примеры задач с решениями, а в конце приведём справочную табличку с формулами, которую можно распечатать и держать под рукой.
Массовая доля
Начнём с простого, но в то же время нужного способа выражения концентрации компонента в смеси — массовой доли.
Массовая доля есть отношение массы данного компонента к сумме масс всех компонентов. Обозначать её принято буквой w или ω (омега).
Рассчитывается массовая доля по формуле:
Large w_{i}=frac{m_{i}}{m}, ;;;;;(1)
где Large w_{i} — массовая доля компонента i в смеси,
Large m_{i} — масса этого компонента,
m — масса всей смеси.
И сразу разберём на примере:
Задача:
Зимой дороги посыпают песком с солью. Известно, что куча имеет массу 50 кг, и в неё всыпали 1 кг соли и перемешали. Найти массовую долю соли.
Решение:
Масса соли есть Large m_{i} по формуле выше. Масса всей смеси нам пока неизвестна, но найти её легко. Просуммируем массу песка и соли:
Large m = m_{п}+m_{с}= 50 кг + 1 кг = 51 кг
А теперь находим и массовую долю:
Large w_{с} = frac{m_{с}}{m} = 1 кг / 51 кг = 0.0196,
или умножаем на 100% и получаем 1.96%.
Ответ: 0.0196, или 1.96%.
Теперь решим что-то посложнее, и ближе к ЕГЭ.
Задача:
Смешали 200 г раствора глюкозы с массовой концентрацией 25% и 300 г раствора глюкозы с массовой концентрацией 10%. Найти массовую концентрацию полученного раствора, ответ округлить до целых.
Решение:
Обозначим первый и второй растворы соответственно Large m_{1} и Large m_{2}. Массу полученного после смешения раствора обозначим Large m и найдём:
Large m = m_{1} + m_{2} = 200 г + 300 г = 500 г
Массу самой глюкозы в первом и втором растворе обозначим Large m_{гл. 1} и Large m_{гл. 2}. По формуле (1) это будут наши массы компонентов. Массы растворов нам известны, их массовые концентрации тоже. Как найти массу компонента? Очень просто, находим неизвестное делимое умножением (и не забываем, что проценты — это сотые части):
Large m_{гл. 1} = w_{1}cdot m_{1} = 0.25 cdot 200 г = 50 г
Large m_{гл. 2} = w_{2}cdot m_{2} = 0.1 cdot 300 г = 30 г
Таким образом, общая масса глюкозы Large m_{гл}:
Large m_{гл} = m_{гл. 1} + m_{гл. 2} = 50 г + 30 г = 80 г.
Ответ: 80 г.
Задачи на смешение раствором с разными концентрациями одного вещества можно решать с помощью «конверта Пирсона».
Объёмная доля
Часто, когда мы имеем дело с жидкостями и газами, удобно оперировать их объёмами, а не массой. Поэтому, чтобы выражать долю какого-либо компонента в таких смесях (но и в твёрдых тоже вполне можно), пользуются понятием объёмной доли.
Объёмная доля компонента — отношение объёма компонента к сумме объёмов компонентов до смешивания. Объёмная доля измеряется в долях единицы или в процентах. Обычно обозначается греческой буквой φ (фи).
Рассчитывается объёмная доля по формуле:
Large phi_{B}=frac{V_{B}}{sum{V_{i}}}, ; ;;;; (2)
где Large phi_{B} — объёмная доля компонента B;
Large V_{B} — объём компонента B;
Large sum{V_{i}} — сумма объёмов всех компонентов.
Здесь важно понимать, что в формулу по возможности подставляем именно сумму объёмов всех компонентов, а не объём смеси, так как при смешивании некоторых жидкостей суммарный объём уменьшается. Так, если смешать литр воды и литр спирта, два литра аквавита мы не получим — будет примерно 1800 мл. В школьных задачах, как правило, это не так важно, но в уме держим и помним.
Задача:
Смешали 6 объёмов воды и 1 объём серной кислоты. Найти объёмную долю кислоты в полученном растворе.
Решение:
Так как объёмная доля — безразмерная величина, объёмы компонентов в условии задачи могут даваться в любых единицах — литрах, стаканах, баррелях, штофах, сексталях — главное, чтобы в одинаковых. Если не так — переводим одни в другие, если одинаковые — решаем. В нашем условии описаны просто некоторые «объёмы», их и подставляем.
Large phi_{H_{2}SO_{4}} = frac{V_{ H_{2}SO_{4} }} { V_{ H_{2}SO_{4}} + V_{H_{2}O}} = frac{1 : объём}{1 : объём + 6 : объёмов} = frac{1 : объём}{7 : объёмов} = 0.143, : или : 14.3%
Ответ: 14.3 %.
С газами всё обстоит немного интереснее — при не очень больших давлениях и температурах объёмная доля какого-либо газа в газовой смеси равна его мольной доле. (Ведь мы знаем, что молярный объём газов почти равен 22.4 л/моль).
Задача:
Мольная доля кислорода в сухом воздухе составляет 0.21. Найдите объёмную долю азота, если объёмная доля аргона составляет 1%.
Решение:
Внимательный читатель заметил, что мы написали о том, что объёмная и мольная доля для газов в смеси равны. Поэтому, объёмная доля кислорода равна также 0.21, или 21%. Найдём объёмную долю азота:
Large 100% – 21% – 1% = 78%.
Ответ: 78%.
Мольная доля
В тех случаях, когда нам известны количества веществ в смеси, мы можем выразить содержание того или иного компонента с помощью мольной доли.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. ИЮПАК рекомендует обозначать мольную долю буквой x (а для газов — y).
Находят мольную долю по формуле:
Large x_{B} = frac{n_{B}}{sum{n_{i}}}, ;;;;;(3)
где Large x_{B} — мольная доля компонента B;
Large n_{B} — количество компонента B, моль;
Large sum{n_{i}} — сумма количеств всех компонентов.
Разберём на примере.
Задача:
При неизвестных условиях смешали 3 кг азота, 1 кг кислорода и 0.5 кг гелия. Найти мольную долю каждого компонента полученной газовой смеси.
Решение:
Сначала находим количество каждого из газов (моль):
Large n_{N_{2}} = frac{ m_{N_{2}}}{M_{N_{2}}} = frac {3000 : г}{28 : ^г/_{моль}} = 107.14 : моль
Large n_{O_{2}} = frac{ m_{O_{2}}}{M_{O_{2}}} = frac {1000 : г}{32 : ^г/_{моль}} = 31.25 : моль
Large n_{He} = frac{ m_{He}}{M_{He}} = frac {500 : г}{4 : ^г/_{моль}} = 125 : моль
Затем считаем сумму количеств:
Large sum {n} = 107.14 : моль + 31.25 : моль + 125 : моль = 263.39 : моль
И находим мольную долю каждого компонента:
Large y_{N_{2}} = frac {107.14 : моль}{263.39 : моль} = 0.4068, : или : 40.68 %;
Large y_{O_{2}} = frac {31.25 : моль}{263.39 : моль} = 0.1186, : или : 11.86 %;
Large y_{He} = frac {125 : моль}{263.39 : моль} = 0.4746, : или : 47.46 %;
Проверяем:
Large 40.68 % + 11.86 % + 47.46 % = 100%.
И радуемся правильному решению.
Ответ: 40.68%, 11.86% , 47.46%.
Молярность (молярная объёмная концентрация)
А сейчас рассмотрим, вероятно, самый часто встречающийся способ выражения концентрации — молярную концентрацию.
Молярная концентрация (молярность, мольность) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также иногда говорят просто «молярность», и обозначают буквой М. Это значит, что, например, обозначение «0.5 М раствор соляной кислоты» следует понимать как «полумолярный раствор соляной кислоты», или 0.5 моль/л.
Обозначают молярную концентрацию буквой c (латинская «цэ»), или заключают в квадратные скобки вещество, концентрация которого указывается. Например, [Na+] — концентрация катионов натрия в моль/л. Кстати, слово «моль» в обозначениях не склоняют — 5 моль/л, 3 моль/л.
Рассчитывается молярная концентрация по формуле:
Large c_{B} = frac{n_{B}}{V} ; ; ;;; (4)
где Large n_{B} — количество вещества компонента B, моль;
Large V — общий объём смеси, л.
Разберём на примере.
Задача:
В пивную кружку зачем-то насыпали 24 г сахара и до краёв заполнили кипятком. А нам зачем-то нужно найти молярную концентрацию сахарозы в полученном сиропе. И кстати, дело происходило в Британии.
Решение:
Молекулярная масса сахарозы равна 342 (посчитайте, может мы ошиблись — C12H22O11). Найдём количество вещества:
Large n_{сахарозы} = frac{24 : г}{342 : г/моль} = 0.0702 моль
Британская пинта (мера объёма такая) равна 0.568 л. Поэтому молярная концентрация находится так:
Large c_{сахарозы} = frac{0.0702 : моль}{0.568 : л} = 0.1236 моль/л
Ответ: 0.1236 моль/л.
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
Обозначается нормальная концентрация как сн, сN, или даже c(feq B). Рассчитывается нормальная концентрация по формуле:
Large c_{N} = z cdot c_{B} = z cdot frac{n_{B}}{V}= frac{1}{f_{eq}} cdot frac {n_{B}}{V} ; ;;;; (5)
где Large n_{B} — количество вещества компонента В, моль;
V — общий объём смеси, л;
z — число эквивалентности (фактор эквивалентности Large f_{eq} = 1/z ).
Значение нормальной концентрации для растворов записывают как «н» или «N», а говорят «нормальность» или «нормальный». Например, раствор с концентрацией 0.25 н — четвертьнормальный раствор.
Разберём на примере.
Задача:
Рассчитать нормальность раствора объёмом 1 л, если в нём содержится 40 г перманганата калия. Раствор приготовили для последующего проведения реакции в нейтральной среде.
Решение:
В нейтральной среде перманганат калия восстанавливается до оксида марганца (IV). При этом в окислительно-восстановительной реакции 1 атом марганца принимает 3 электрона (проверьте на любой окислительно-восстановительной реакции перманганата калия с образованием оксида, расставив степени окисления), что означает, что число эквивалентности будет равно 3. Для расчёта концентрации по формуле (5) выше нам ещё не хватает количества вещества KMnO4. найдём его:
Large n_{KMnO_{4}}=frac{m _{KMnO_{4}}}{M _{KMnO_{4}} } = frac{40 : г}{158 г/моль}= 0.253 моль
Теперь считаем нормальную концентрацию:
Large c_{N_{KMnO_{4}}}= z cdot frac{n_{KMnO_{4}}}{V} = 3 cdot frac{0.253 : моль}{1 : л} = 0.759 моль-экв/л
Ответ: 0.759 моль-экв/л.
Таким образом, заметим важное на практике свойство — нормальная концентрация больше молярной в z раз.
Мы не будем рассматривать в данной статье особо экзотические способы выражения концентраций, о них вы можете почитать в литературе или интернете. Поэтому расскажем ещё об одном способе, и на нём остановимся — массовая концентрация.
Моляльная концентрация
Моляльная концентрация (моляльность, молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется моляльная концентрация в молях на кг. Как и с молярной концентрацией, иногда говорят «моляльность», то есть раствор с концентрацией 0.25 моль/кг можно назвать четвертьмоляльным.
Находится моляльная концентрация по формуле:
Large m_{B} = frac{n_{B}}{m_{A}}, ;;;;; (6)
где Large n_{B} — количество вещества компонента B, моль;
Large m_{A} — масса растворителя, кг.
Казалось бы, зачем нужна такая единица измерения для выражения концентрации? Так вот, у моляльной концентрации есть одно важное свойство — она не зависит от температуры, в отличие, например, от молярной. Подумайте, почему?
Массовая концентрация
Массовая концентрация — отношение массы растворённого вещества к объёму раствора. По рекомендации ИЮПАК, обозначается символом γ или ρ.
Находится массовая концентрация по формуле:
Large rho_{B}=frac{m_{B}}{V}, ;;;;; (7)
где Large m_{B} — масса растворенного вещества, г;
Large V — общий объём смеси, л.
В системе СИ выражается в кг/м3.
Разберём на примере.
Задача:
Рассчитать массовую концентрацию перманганата калия по условиям предыдущей задачи.
Решение:
Решение будет совсем простым. Считаем:
Large rho_{ KMnO_{4} }=frac{m_{ KMnO_{4} }}{V} =frac{40 : г}{1 : л} = 40 г/л.
Ответ: 40 г/л.
Также в аналитической химии пользуются понятием титра по растворенному веществу. Титр по растворенному веществу находится так же, как и массовая концентрация, но выражается в г/мл. Легко догадаться, что в задаче выше титр будет равен 0.04 г/мл (для этого надо умножить наш ответ на 0.001 мл/л, проверьте). Кстати, обозначается титр буквой Т.
А теперь, как обещали, табличка с формулами перевода одной концентрации в другую.
Таблица перевода одной концентрации в другую.
В таблице слева — ВО ЧТО переводим, сверху — ЧТО. Если стоит знак «=», то, естественно, эти величины равны.
| Массовая доля, large omega, % | Мольная доля, large x , % | Объёмная доля, large phi, % | Молярная концентрация, large c, моль/л | Нормальная концентрация, large c_{N} , моль-экв/л | Моляльная концентрация, large m, моль/кг | Массовая концентрация, large rho, г/л | |
| Массовая доля, large omega, % | = | large omega_{B}=LARGE frac{x_{B} cdot M(B)}{sum x_{i} cdot M_{i}} | Для газов: omega = LARGE frac{phi_{A} cdot M(A)}{sum (M_{i} cdot phi_{i})} |
large omega_{B}= LARGE frac{c_{B} cdot M(B)}{rho} | large omega_{B}=LARGE frac{c_{N} cdot M(B)}{rho cdot z} | large omega_{B}= LARGE frac{gamma_{B}}{rho} | |
| Мольная доля, large x , % | large x_{B}=LARGE frac{frac{omega_{B}}{M(B)}}{sum frac{omega_{i}}{M_{i}}} | = | large x_{B}=LARGE frac{m_{B}}{m_{B}+frac{1}{M(A)}} | ||||
| Объёмная доля, large phi, % | Для газов: large phi_{A}=LARGE frac{frac{omega_{A}}{M(A)}}{sum frac{omega_{i}}{M_{i}}} |
= | |||||
| Молярная концентрация, large c, моль/л | large c_{B}=LARGE frac{rho cdot omega_{B}}{M(B)} | = | large c_{B}=Large frac{c_{N}}{z} | ||||
| Нормальная концентрация, large c_{N} , моль-экв/л | large c_{N}=LARGE frac{rho cdot omega_{B} cdot z}{M(B)} | large c_{N}=c_{B} cdot z | = | ||||
| Моляльная концентрация, large m, моль/кг | large m_{B}=Large frac{x_{B}}{M(A)(1-x_{B})} | = | |||||
| Массовая концентрация, large gamma, г/л | large gamma_{B}=rho cdot omega_{B} | = |
Таблица будет пополняться.
Химическая формула соединения рассказывает нам не только о том, из каких элементов состоит вещества, но и о соотношении элементов в веществе. Давайте, например, посмотрим на серную кислоту Н2SO4 и сернистую кислоту H2SO3. Это два разных вещества, хотя оба состоят из водорода Н, серы S и кислорода О. Но из-за того, что соотношения элементов в них разное (в серной кислоте 4 атома кислорода, а в сернистой – 3), свойства у них тоже разные.
Используя химическую формулу, можно узнать и массовую доля элемента в соединении.
Массовая доля элемента в соединении показывает, какую часть составляет масса конкретного элемента от массы вещества.
Чтобы понять это сложное (на первый взгляд сложное, на самом деле оно простое) определения, представьте, что вы принесли из магазина пакет с покупками. В нём батон хлеба, пачка масла, два эскимо и упаковка чипсов. Весит пакет 1 килограмм. Какой вклад в это вносят чипсы? Пусть чипсы весят 50 граммов. Значит, от 1 килограмма (всей массы пакета с покупками) на чипсы приходится всего 50 граммов. Значит, можно посчитать, что чипсы – всего лишь 0,05 часть от всей массы пакета с покупками (50/1000=0,05).
Более удобно вычислять массовую долю в процентах, поэтому можно записать простую пропорцию:
1 килограмм (весь пакет с покупками) – 100%
50 граммов (упаковка чипсов) – Х%
Отсюда Х=50 г*100%/1000 г=5%. То есть массовая доля чипсов в пакете с покупками – 5%.
Теперь перейдём от покупок в супермаркете к химическим формулам.
Пример 1.
Определите массовую долю водорода и хлора в хлориде водорода.
Решение:
Формула хлорида водорода HCl. Чтобы определить массовые доли, нужно посчитать по таблице Менделеева молекулярную массу хлорида водорода. Она составляет 36,5 (1+35,5).
Из формулы мы видим, что в составе молекулы 1 атом водорода и 1 атом хлора. Обязательно обращайте на это внимание! Из примеров ниже будет видно, что это очень важно. Итак, составим пропорцию для определения массовой доли водорода:
36,5 (молекулярная масса соединения) – 100%
1 (атомная масса 1 атома водорода, входящего в соединение) – Х%
Отсюда Х=1*100/36,5=2,7%
Аналогично для хлора:
36,5 (молекулярная масса соединения) – 100%
35,5 (атомная масса 1 атома водорода, входящего в соединение) – Y%
Y=35,5*100/36,5=97,3%.
Таким образом, ответ: в хлориде водорода массовая доля водорода 2,7%, массовая доля хлора 97,3%.
Не лишним будет себя проверить, сложив все массовые доли. В сумме они должны давать 100 процентов. В нашем случае массовая доля водорода 2,7%+массовая доля хлора 97,3%=100%. Значит, мы всё сделали верно.
Пример 2.
Определите массовые доли углерода и кислорода в углекислом газе.
Решение:
Формула углекислого газа СО2. Обратите внимание, что здесь 2 атома кислорода. Это очень важно!
Теперь посчитаем молекулярную массу СО2, используя периодическую таблицу. Она будет равна 44: 12 (атомная масса углерода)+2*16 (атомная масса кислорода, умноженная на 2, потому что в формуле 2 атома кислорода).
Переходим к расчёту массовых долей с помощью пропорций.
Для углерода:
44 (молекулярная масса СО2) – 100%
12 (атомная масса 1 атома углерода) – Х%
Х=12*100/44=27,3%
Для кислорода:
44 (молекулярная масса СО2) – 100%
32 (масса 2 атомов кислорода, входящих в формулу) – Y%
Y=32*100/44=72,7%
Здесь мы взяли не 16 (атомная масса кислорода), а 32 потому, что в формуле СО2 2 атома кислорода. Помните, что выше я обращала на это внимание? Не упускайте это из виду, иначе будут ошибки.
Но ответ мы уже получили: в углекислом газе массовая доля углерода 27,3%, массовая доля кислорода 72,7%. (Проверим себя, сложив массовые доли: 27,3+72,7=100. Значит, всё верно).
Пример 3.
Этот пример от строгого репетитора по химии, который готовит к огэ по химии. Итак, найдите массовые доли алюминия и кислорода в оксиде алюминия.
Решение:
Формула оксида алюминия Al2O3. Не забудьте учесть число атомов алюминия и кислорода (как в примере выше)!
Сначала найдём молекулярную массу оксида алюминия, пользуясь таблицей Менделеева. Атомная масса алюминия 27, атомная масса кислорода 16. Молекулярная масса Al2O3 2*27+3*16 (потому что у нас 2 атома алюминия и 3 атома кислорода)=102.
Рассчитываем массовые доли.
Для алюминия:
102 (молекулярная масса Al2O3) – 100%
54 (масса 2 атомов алюминия, входящих в формулу) – Х%
Х=54*100/102=52,9%
Для кислорода:
102 (молекулярная масса Al2O3) – 100%
48 (масса 3 атомов кислорода, входящих в формулу) – Y%
Y=48*100/102=47,1%
Ответ: в оксиде алюминия массовая доля алюминия 52,9%, массовая доля кислорода 47,1% (проверка: 52,9+47,1=100).
А можно узнать формулу соединения, если известны массовые доли? И сделать это очень просто.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Массовая доля или .
По закону Авогадро
плотности различных газов прямо
пропорциональны молекулярным массам,
тогда
.
в) Мольной долейгаза в смеси
называется отношение числа молейi-го
газаi,
к общему количеству молей газов в смеси
,
т.е.
.
Рассмотрим способ определения состава
смеси через числа молей компонентов.
Пусть смесь состоит из nгазов; тогда приведённые (парциальные)
объёмы каждого из них можно выразить
числом молей, т.е.
.
.
,
где
…
–
объёмы моля-го
газа;
…
–
их числа молей;
Объём смеси газов
также можно выразить через число молей
смеси, т.е.
,
где
– условное число молей смеси.
На
основании уравнения (1), запишем

Но
т.к. объём моля для всех газов, в том
числе и для смеси при одинаковых
параметрах, есть величина постоянная,
то уравнение можно записать в виде:
.
Таким
образом, задание смеси мольными долями
равносильно заданию ее объёмными долями.
Вычисление кажущейся молекулярной
массы
производится следующим образом: вычисляем
для каждого–го
газа–
по уравнению, т.е.:
.
Просуммировав все
эти уравнения, получаем
.
Но.
Тогда
,
откуда
.
(2)
По
уравнению (2) можно определить кажущийся
молекулярный вес (или молекулярную
массу), если она задана объемными долями.
Использовав
уравнение (2), можно определить газовую
постоянную смеси:

где
=8314
Дж/кмоль·К – универсальная газовая
постоянная.
Если известны массовые доли
-ых газов, входящих в смесь
,
то величинуможно
определить:
.
где
–
газовая постоянная-го
газа.
В том случае, если известно число молей
газов для
кг смеси, газовую постоянную смеси можно
вычислить по следующей зависимости.
Учитывая, что
,
получим
.
Для 1 кг смеси
.
7. Первый закон термодинамики
7.1 Равновесное и неравновесное состояние
и термодинамические процессы
Равновесное состояние тела–
состояние, при котором во всех точках
его объема давление, температура,
удельный объем и все другие физические
свойства одинаковы.
Это состояние может быть при условии
механического и термического равновесия
между газом и внешней средой. Под
механическим равновесием понимают
равенство давлений газов и внешней
среды, подтермическим –равенство
их температур.
Только равновесные состояния могут
быть описаны количественно с помощью
уравнения состояния.
Состояния термодинамических систем,
не удовлетворяющие указанным выше
требованиям, называются неравновесными.
Совокупность
изменений термодинамической системы
при переходе из одного состояния (р1,
Т1,
W1)
в другое (р2,
Т2,
W2)
называют термодинамическим
процессом.
Эти процессы могут быть равновесными
и неравновесными.
Процесс называют равновесным, если в
каждый момент времени газ находится в
равновесном состоянии.
Обратимый процесс
– это процесс,
который может протекать как в прямом,
так и в обратном направлении. При этом
рабочее тело (газ) и внешняя среда
последовательно проходят в обратном
процессе точно те же состояния, через
которые они проходили в прямом процессе.
Свойством обратимости обладают
только равновесные процессы.
Под необратимым процессом
понимают такой процесс, при которомгаз (и внешняя среда)
проходит через неравновесные состояния.
После необратимого
процесса система (газ) может быть
возвращена в начальное состояние
только при затрате энергии извне.
Техническая термодинамика, в первую
очередь, изучает обратимые процессы.
Они могут быть выражены аналитическими
зависимостями и графиками.
Для учета необратимости процесса, в
случае необходимости, в полученные
аналитические зависимости вводят
коэффициенты согласования.
7.2 Внутренняя энергия газа и внешняя
работа
Молекулы реального газа обладают двумя
видами механической энергии:
-
внутренней кинетической энергией,
-
внутренней потенциальной энергией.
Внутренняя кинетическая энергия молекул
включает энергию:
-
поступательного движения молекул,
-
вращательного движения электронов
вокруг атомного ядра, -
внутримолекулярного колебания атомов.
Внутренняя потенциальная энергия
молекул – энергия сил сцепления
молекул.
Сумма всех указанных
видов энергии составляет внутреннюю
энергию газа.
Внутреннюю энергию
газа для одного кг
газа обозначают
малой буквой
и, с
размерностью Дж1кг.
Для массы т
кг газа –
U,
размерность
Дж. Внутренняя
кинетическая энергия – функция температуры.
Внутренняя потенциальная энергия
– функцияр (илиw).
В бесконечно малом процессе для 1кг газа
Для всех термодинамических процессов
изменение внутренней энергии идеального
газа равно
Где сw– удельная
теплоемкость приw=const
Внешняя работа
газа– передача
энергии от одного тепла к другому,
связанная с изменением объема, с
перемещением его во внешнем пространстве
или с изменением его положения,
называется работой.
/ = p(w2
–w1) =pΔw
7.3 Энтальпия
В прошлом столетии
известный американский физик Гиббс
ввел в практикv
тепловых расчетов новую функцию, которая
была названа энтальпией
(или тепловой функцией Гиббса).
Обозначается для 1кг газа буквойi.
Она представляет собой по определению
сложную функцию вида
i =u
+ pw,
Где рw
– потенциальная
энергия давления,
и – внутренняя
энергия.
Входящие в формулу параметры p,w
ии являются параметрамисостояния,
следовательно, и сама энтальпия будет
также параметром (функцией)
состояния
Физическая сущность энтальпии – это
энергия газа, являющаяся сумой его
внутренней энергии и потенциальной
энергии давления (pvv).
7.4 Физический
смысл первого закона термодинамики
Это есть общий закон сохранения и
превращения энергии.
Первый закон
термодинамики является
частным случаем общего закона
сохранения и превращения энергии
(применительно к тепловым явлениям).
Установлен экспериментальным путем и
утверждает, что теплота
(тепловая
энергия) может превращаться в механическую
энергию (в виде совершения
работы) и наоборот, работа – в теплоту,
причем определенное количество
тепла всегда эквивалентно определенному
количеству работы, т.е. 0,427кгсл;
= 4,186ХДж.
Аналитическое выражение первого закона
термодинамики для 1 кг газа имеет вид:
q
= Δu
+ l
Для m
кг Q = ΔU
+ L
Физический смысл выражений следующий.
При подводе к
газу тепла в общем случае одна часть
его расходуется на увеличение
внутренней энергии газа, вторая – на
совершение газом внешней работы.
Для бесконечно малого процесса уравнение
dq = du
+ dl– математическое
выражение.
7.5 Уравнение Майера
Уравнение Майера показывает, что
теплоемкость при р=constвсегда больше чем теплоемкость приw=const.
Из уравнения следует
Где
– показатель адиабаты
С учетом величины К:
8
Решение задач с долей вещества в смеси, в соединении
Ключевые слова конспекта: массовая доля вещества в смеси или растворе, молярная доля вещества, объемная доля вещества, массовая доля элемента в соединении, масса элемента, массовая доля элемента.
Массовую долю вещества в смеси или растворе вычисляют как отношение массы вещества, входящего в состав смеси, к массе всей смеси. Массовую долю часто выражают в процентах. Для этого отношение массы вещества к массе смеси умножают на 100%:
Аналогично объемную долю вещества вычисляют как отношение объема вещества к объему смеси, а молярную долю вещества — как отношение количества вещества одного из компонентов смеси к сумме количеств веществ всех компонентов смеси:
Массовую долю элемента в соединении вычисляют как отношение массы элемента, входящего в состав данного соединения, к массе всего соединения:
Зная молекулярную формулу соединения, массу элемента, входящего в его состав, вычисляют как произведение молярной массы элемента на число атомов этого элемента в соединении.
В этом случае массовую долю элемента в соединении рассчитывают как отношение этой величины к молярной массе всего соединения:
Цитаты из пособия «Задачи по химии 8-9 кл.» (авт. О.С. Габриелян и др.) использованы в учебных целях. Ссылка на покупку книги указана в конце конспекта.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
25 г оксида магния смешали с 35 г оксида алюминия. Определите массовую долю оксида магния в данной смеси.
Ответ. ω(MgO) = 0,417, или 41,7%.
Задача № 2.
Вычислите объемную долю азота в смеси газов, содержащей 32 л азота, 48 л углекислого газа, 36 л гелия и 14 л водорода.
Ответ. φ(N2) = 0,246, или 24,6%.
Задача № 3.
Вычислите молярную и массовую долю (в %) оксида углерода (II) в смеси, содержащей 16,8 л (н. у.) оксида углерода (II) и 13,44 л (н. у.) оксида углерода (IV).
Ответ. χ(СО) = 55,56%, ω(СО) = 44,3%.
Задача № 4.
В воде растворили 15 г хлорида натрия. Вычислите массу полученного раствора, если массовая доля соли в нем равна 5%.
Ответ: m(р-ра) = 300 г.
Задача № 5.
Образец сплава меди с цинком имеет массу 75 г. Массовая доля меди в этом сплаве равна 64%. Определите массу цинка в данном образце.
Ответ. m(Zn) = 27 г.
[highlight]Задача № 6.[/highlight] Объемная доля аммиака в смеси с кислородом равна 40%. Вычислите плотность данной смеси по воздуху.
Посмотреть РЕШЕНИЕ
Ответ. Dвозд(смеси) = 0,896.
Задача № 7.
Найдите массовую долю кислорода в фосфате натрия.
Посмотреть РЕШЕНИЕ
Ответ. ω (O) = 39%.
[highlight]Задача № 8.[/highlight] Определите массовую долю фосфора в смеси, содержащей 55 г фосфата натрия и 70 г дигидрофосфата натрия.
Посмотреть РЕШЕНИЕ
Ответ. ω(Р) = 22,77%
[highlight]Задача № 9.[/highlight] Массовая доля серы в техническом сульфате натрия равна 20,48%. Рассчитайте массовую долю примесей в данном продукте (в %).
Посмотреть РЕШЕНИЕ
Ответ. ω (примесей) = 9,12%.
Задача № 10.
Плотность смеси оксида азота (II) и оксида азота (IV) по водороду равна 17,8. Найдите массовую долю оксида азота (IV) в данной смеси.
Посмотреть РЕШЕНИЕ
Ответ. ω(NO2) = 45,2%.
Решение задач с долей вещества в смеси, в соединении. Выберите дальнейшие действия:
- Перейти к следующей теме: Решение задач на вывод формул соединений
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
- Купить книгу Задачи по химии и способы их решения. 8-9 кл. / О.С. Габриелян и др. — М.: Дрофа.
Состав смесей жидкостей, паров и газов задают массовыми или мольными долями. Состав газовых смесей дополнительно задают объемными долями компонентов смеси.
Массовой долей компонента смеси называют величину, равную отношению массы данного компонента к массе всей смеси.
Если смесь состоит из нескольких компонентов, например п, то
;
;
, (4.1)
где ,
,…
– массовые доли компонентов смеси,
,
,…
– индивидуальные массы компонентов смеси,
– масса всей смеси.
Сумма массовых долей компонентов смеси равна единице, т.е.
. (4.2)
Например, смесь состоит из азота массой 10 кг, кислорода массой 4 кг и водяного пара массой 6 кг. Для такой смеси
= 10 + 4 + 6 = 20 кг
Массовые доли компонентов смеси равны:
азота = 10 / 20 = 0,5;
кислорода = 4 / 20 = 0,2;
пара = 6 / 20 = 0,3.
Сумма массовых долей компонентов смеси равна:
.
Молярной долей компонента называют величину, равную отношению числа молей компонента смеси к числу молей всей смеси.
Молярная доля компонента смеси, в состав которой входят компонентов, определяется по формуле:
;
; …
, (4.3)
где ,
,…
– молярные доли компонентов смеси,
,
,…
– число молей компонентов смеси,
– число молей всей смеси.
Сумма молярных долей компонентов, составляющих смесь, равна единице:
. (4.4)
При решении задач на смеси нередко требуется определить молярный состав смеси, если известны массовые доли компонентов, и, наоборот, определить массовые доли компонентов при известных значениях молярных долей.
Найдем эти соотношения для i-го компонента путем деления уравнение (4.2.) на уравнение (4.3.):
.
Исходя из определения молярной массы вещества, получим:
откуда имеем:
или
(4.5)
Уравнения (4.5) позволяют по известным молярным долям компонентов смеси находить их массовые доли и наоборот.
Найдем выражения для определения молярной массы смеси в случае задания ее компонентов молярными и массовыми долями.
Очевидно, что сумма всех масс компонентов, составляющих смесь, равна массе смеси, т.е.
.
Подставим в это уравнение выражения для масс из уравнения . Получим:
.
Поделим левую и правую часть последнего уравнения на число молей всей смеси (п) и с учетом соотношения (4.3.) найдем:
. (4.6)
Следовательно, молярная масса смеси равна сумме произведений молярных масс компонентов на их мольные доли.
При задании смеси массовыми долями в уравнение:
подставим значение количества вещества из формулы . Получим:
,
откуда молярная масса смеси равна:
.
Разделив числитель и знаменатель дроби этого уравнения на массу смеси , найдем:
.
С учетом того, что . окончательно получим:
. (4.7)
Следовательно, молярная масса смеси равна единице, деленной на сумму отношений массовых долей компонентов к их молярным массам.