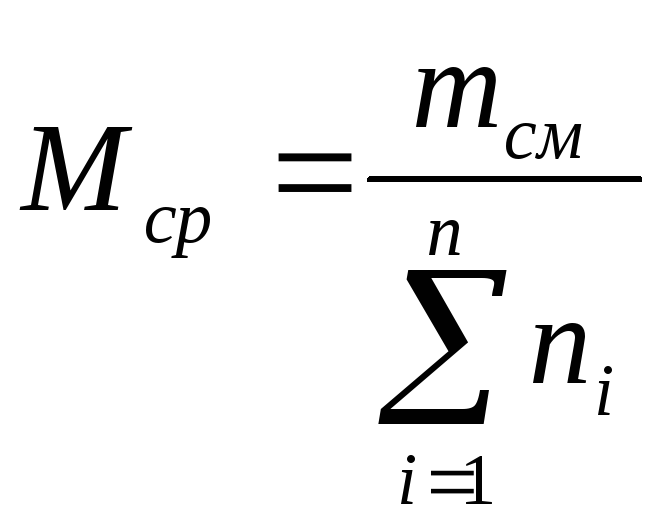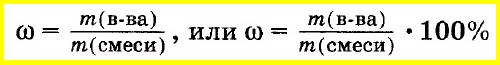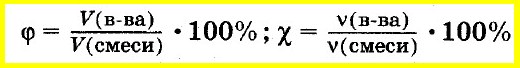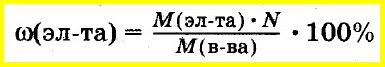Смесь, состоящая из
двух и более компонентов, характеризуется
свойствами и содержанием этих компонентов.
Состав смеси может быть задан массой,
объемом, количеством (числом молей или
килограмм-молей) отдельных компонентов,
а также значениями их концентраций.
Концентрацию компонента в смеси можно
выразить в весовых, мольных и объемных
долях или процентах, а также в других
единицах.
Массовая
доля i
какого-либо компонента определяется
отношением массы mi
данного компонента к массе всей смеси
mсм:
Учитывая,
что суммарная масса смеси равна сумме
масс отдельных компонентов, т.е.
можно написать:
или сокращенно:
Пример
4. Смесь
состоит из двух компонентов: m1
= 500 кг, m2
= 1500 кг. Определить массовую долю каждого
компонента в смеси.
Решение.
Массовая
доля первого компонента:
mсм=
m1
+ m2
= 500 + 1500 = 2000 кг
Массовая доля второго компонента:
Массовую
долю второго компонента можно определить
также, используя равенство:
1
+ 2
= 1
2
= 1 – 1
= 1 – 0,25 = 0,75
Объемная
доля i
компонента в смеси равна отношению
объема Vi
данного компонента к объему всей смеси
V:
Учитывая, что:
можно написать:
Пример
5.
Газ состоит из двух компонентов: V1
= 15,2 м3
метана и V2
= 9,8 м3
этана. Подсчитать объемный состав смеси.
Решение.
Общий объем смеси равен:
V
= V1
+ V2
= 15,2 + 9,8 = 25 м3
Объемная доля в смеси:
метана
этана
v2
= 1 – v1
= 1 – 0,60 = 0,40
Мольная
доля ni
какого-либо компонента смеси определяется
как отношение числа киломолей Ni
данного компонента к общему числу
киломолей N
смеси:
Учитывая,
что:
получим:
Пересчет мольных
долей в массовые можно проводить по
формуле:
Пример
6. Смесь
состоит из 500 кг бензола и 250 кг толуола.
Определить мольный состав смеси.
Решение.
Молекулярный
вес бензола (С6Н6)
равен 78, толуола (С7Н8)
– 92. Число килограмм-молей равно:
бензола
толуола
общее число
килограмм-молей:
N
= N1
+ N2
= 6,41 + 2,72 = 9,13
Мольная доля
бензола равна:
Для толуола мольная
доля может быть найдена из равенства:
n1
+ n2
= 1
откуда: n2= 1 –n1= 1 – 0,70 = 0,30
Среднюю молекулярную
массу смеси можно определить, зная
мольную долю и молекулярную массу
каждого компонента смеси:
(21)
где
ni
— содержание
компонентов в смеси, мол. доли; Mi
— молекулярная
масса компонента смеси.
Молекулярную массу смеси нескольких
нефтяных фракций можно определить по
формуле

или
(23)
где
m1,
m2,…,
mn
— масса
компонентов смеси, кг; M1,
М2,….,.Мп
– молекулярная масса компонентов смеси;
– % масс. компонента.
Молекулярную
массу нефтепродукта можно определить
также по формуле Крэга

Пример
7.
Определить среднюю молекулярную массу
смеси бензола с изооктаном, если мольная
доля бензола составляет 0,51, изооктана
0,49.
Решение.
Молекулярная масса бензола 78, изооктана
114. Подставляя эти значения в формулу
(21), получаем
Мср
= 0,51
78 + 0,48114
= 95,7
Пример
8. Смесь
состоит из 1500кг бензола и 2500кг н-октана.
Определить среднюю молекулярную массу
смеси.
Решение.
Используем формулу (22)
Объемный
молярный состав пересчитывают в массовый
следующим образом. Данный объемный
(молярный) состав в процентах принимают
за 100 молей. Тогда концентрация каждого
компонента в процентах будет выражать
число его молей. Затем число молей
каждого компонента умножают на его
молекулярную массу и получают массу
каждого компонента в смеси. Разделив
массу каждого компонента на общую массу,
получают его массовую концентрацию.
Массовый
состав пересчитывают в объемный
(молярный) следующим образом. Принимают,
что смеси взято 100 (г, кг, т) (если массовый
состав выражен в процентах), массу
каждого компонента делят на его
молекулярную массу. Получают число
молей. Делением числа молей каждого
компонента на их общее число получают
объемные (молярные) концентрации каждого
компонента.
Средняя плотность
газа определяется по формуле:
кг/м3;
г/см3
или, исходя из
объемного состава:
,
или, исходя из
массового состава смеси:

Относительную плотность определяют по
формуле:
Пример 9.Пересчитать массовый
состав газа в объемный и определить его
молекулярную массу, его плотность и
относительную плотность.
|
Компоненты |
М г/моль |
массовый % масс. |
mi |
Число
|
Объемный |
|
|
доли единицы |
% об. |
|||||
|
Метан |
16 |
40 |
40 |
40:16=2,50 |
0,669 |
66,9 |
|
Этан |
30 |
10 |
10 |
10:30=0,33 |
0,088 |
8,8 |
|
Пропан |
44 |
15 |
15 |
15:44=0,34 |
0,091 |
9,1 |
|
Бутан |
58 |
25 |
25 |
25:58=0,43 |
0,115 |
11,5 |
|
Пентан + высшие |
72 |
10 |
10 |
10:72=0,14 |
0,037 |
3,7 |
|
100 |
100 |
3,74 |
1,000 |
100,0 |
Для
простоты расчета примем массу смеси за
100 г, тогда масса каждого компонента
будет численно совпадать с процентным
составом. Найдем число молей ni
каждого компонента. Для этого массу
каждого компонента mi
разделим на мольную массу:
Находим объемный
состав смеси в долях единицы
i(CH4)
= 2,50 : 3,74 = 0,669;
(C2H6)
= 0,33 : 3,74 = 0,088;
(C5H8)
= 0,34 : 3,74 = 0,091;
(C4H10)
= 0,43 : 3,74 = 0,115;
(C5H12)
= 0,14 : 3,74 = 0,037.
Находим
объемный состав смеси в процентах,
умножив данные в долях единицы на 100%.
Все полученные данные заносим в таблицу.
Рассчитываем
среднюю массу смеси.
Мср
= 100 : 3,74 =
26,8 г/моль
Находим
плотность смеси
Находим относительную
плотность:
Пример 10.Пересчитать объемный
состав в массовый и определить его
молекулярную массу, его плотность и
относительную плотность.
|
Компоненты |
М г/моль |
Объемный % об. |
число |
Масса г. |
Весовой |
|
|
доли единицы |
% масс. |
|||||
|
Метан |
16 |
30 |
30 |
3016=480 |
0,117 |
11,7 |
|
Этан |
30 |
15 |
15 |
15·30=450 |
0,109 |
10,9 |
|
Пропан |
44 |
20 |
20 |
20·44=880 |
0,214 |
21,4 |
|
Бутан |
58 |
15 |
15 |
15·58=870 |
0,211 |
21,1 |
|
Пентан + высшие |
72 |
20 |
20 |
20·72=1440 |
0,349 |
34,9 |
|
100 |
100 |
4120 |
1,000 |
100,0 |
(CH4)
= 480 : 4120 = 0,117;
(C2H6)
= 450 : 4120 = 0,109;
(C3H8)
= 880 : 4120 = 0,214;
(C4H10)
= 870 : 4120 = 0,211;
(C5H12)
= 1440 : 4120 = 0,349.
Мср
= 4120 : 100 =
41,2 г/моль.
г/л
Задача 15. Смесь состоит из пяти
компонентов. Определить массовую,
объемную и мольную долю каждого компонента
в смеси, среднюю молекулярную массу
смеси.
|
Компоненты смеси |
Вариант |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
mi |
mi |
mi |
||||||||
|
метан |
5 |
30 |
55 |
80 |
100 |
75 |
50 |
25 |
5 |
30 |
|
этан |
10 |
35 |
60 |
85 |
95 |
70 |
45 |
20 |
10 |
35 |
|
пропан |
15 |
40 |
65 |
90 |
90 |
65 |
40 |
15 |
15 |
40 |
|
н-бутан |
20 |
45 |
70 |
95 |
85 |
60 |
35 |
10 |
20 |
45 |
|
изобутан |
25 |
50 |
75 |
100 |
80 |
55 |
30 |
5 |
25 |
50 |
Задача 16.Пересчитать массовый
состав газа в объемный и определить его
молекулярную массу, плотность и
относительную плотность по воздуху.
|
Компоненты смеси |
ω% массовый |
|||||||||
|
Варианты |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
метан |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
50 |
|
этан |
50 |
45 |
40 |
35 |
30 |
25 |
20 |
15 |
10 |
5 |
|
пропан |
5 |
10 |
20 |
10 |
5 |
10 |
15 |
20 |
25 |
30 |
|
бутан |
10 |
10 |
20 |
15 |
30 |
25 |
20 |
15 |
10 |
5 |
|
пентан |
30 |
25 |
5 |
20 |
10 |
20 |
10 |
10 |
10 |
10 |
Задача 17. Пересчитать объемный
состав газа в массовый и определить его
молекулярную массу, плотность и
относительную плотность по воздуху.
|
Компоненты смеси |
объемный состав |
|||||||||
|
Варианты |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
метан |
10 |
5 |
20 |
5 |
20 |
10 |
10 |
35 |
40 |
10 |
|
этан |
45 |
50 |
15 |
20 |
25 |
30 |
10 |
20 |
15 |
5 |
|
пропан |
10 |
5 |
10 |
20 |
10 |
5 |
25 |
15 |
20 |
30 |
|
бутан |
10 |
10 |
35 |
40 |
25 |
30 |
10 |
20 |
15 |
5 |
|
пентан |
15 |
30 |
20 |
15 |
30 |
25 |
45 |
10 |
10 |
50 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
Решение задач с долей вещества в смеси, в соединении
Ключевые слова конспекта: массовая доля вещества в смеси или растворе, молярная доля вещества, объемная доля вещества, массовая доля элемента в соединении, масса элемента, массовая доля элемента.
Массовую долю вещества в смеси или растворе вычисляют как отношение массы вещества, входящего в состав смеси, к массе всей смеси. Массовую долю часто выражают в процентах. Для этого отношение массы вещества к массе смеси умножают на 100%:
Аналогично объемную долю вещества вычисляют как отношение объема вещества к объему смеси, а молярную долю вещества — как отношение количества вещества одного из компонентов смеси к сумме количеств веществ всех компонентов смеси:
Массовую долю элемента в соединении вычисляют как отношение массы элемента, входящего в состав данного соединения, к массе всего соединения:
Зная молекулярную формулу соединения, массу элемента, входящего в его состав, вычисляют как произведение молярной массы элемента на число атомов этого элемента в соединении.
В этом случае массовую долю элемента в соединении рассчитывают как отношение этой величины к молярной массе всего соединения:
Цитаты из пособия «Задачи по химии 8-9 кл.» (авт. О.С. Габриелян и др.) использованы в учебных целях. Ссылка на покупку книги указана в конце конспекта.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
25 г оксида магния смешали с 35 г оксида алюминия. Определите массовую долю оксида магния в данной смеси.
Ответ. ω(MgO) = 0,417, или 41,7%.
Задача № 2.
Вычислите объемную долю азота в смеси газов, содержащей 32 л азота, 48 л углекислого газа, 36 л гелия и 14 л водорода.
Ответ. φ(N2) = 0,246, или 24,6%.
Задача № 3.
Вычислите молярную и массовую долю (в %) оксида углерода (II) в смеси, содержащей 16,8 л (н. у.) оксида углерода (II) и 13,44 л (н. у.) оксида углерода (IV).
Ответ. χ(СО) = 55,56%, ω(СО) = 44,3%.
Задача № 4.
В воде растворили 15 г хлорида натрия. Вычислите массу полученного раствора, если массовая доля соли в нем равна 5%.
Ответ: m(р-ра) = 300 г.
Задача № 5.
Образец сплава меди с цинком имеет массу 75 г. Массовая доля меди в этом сплаве равна 64%. Определите массу цинка в данном образце.
Ответ. m(Zn) = 27 г.
[highlight]Задача № 6.[/highlight] Объемная доля аммиака в смеси с кислородом равна 40%. Вычислите плотность данной смеси по воздуху.
Посмотреть РЕШЕНИЕ
Ответ. Dвозд(смеси) = 0,896.
Задача № 7.
Найдите массовую долю кислорода в фосфате натрия.
Посмотреть РЕШЕНИЕ
Ответ. ω (O) = 39%.
[highlight]Задача № 8.[/highlight] Определите массовую долю фосфора в смеси, содержащей 55 г фосфата натрия и 70 г дигидрофосфата натрия.
Посмотреть РЕШЕНИЕ
Ответ. ω(Р) = 22,77%
[highlight]Задача № 9.[/highlight] Массовая доля серы в техническом сульфате натрия равна 20,48%. Рассчитайте массовую долю примесей в данном продукте (в %).
Посмотреть РЕШЕНИЕ
Ответ. ω (примесей) = 9,12%.
Задача № 10.
Плотность смеси оксида азота (II) и оксида азота (IV) по водороду равна 17,8. Найдите массовую долю оксида азота (IV) в данной смеси.
Посмотреть РЕШЕНИЕ
Ответ. ω(NO2) = 45,2%.
Решение задач с долей вещества в смеси, в соединении. Выберите дальнейшие действия:
- Перейти к следующей теме: Решение задач на вывод формул соединений
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
- Купить книгу Задачи по химии и способы их решения. 8-9 кл. / О.С. Габриелян и др. — М.: Дрофа.
Задачи на определение количественного состава смеси – частые гости на экзаменах или контрольных любых уровней и классов. Многие из этих задач имеют схожую идею решения, поэтому, поняв основные принципы и методы, можно с легкостью решить задачу любой сложности на эту тематику.
Воздействие на смесь химическими реактивами
Первой идеей, или типом задач, являются те, где на смесь действуют определенными химическими реактивами. Эти вещества взаимодействуют только с одним компонентов смеси, что позволяет рассчитать его массу. Необходимым для решения являются знания характерных химических реакций, ведь без этого, попросту нереально написать соответствующие уравнения реакций. Рассмотрим это на таком примере.
Пример 1
Смесь, масса которой 41,8 г, которая содержит натрий карбонат, натрий нитрат и натрий сульфат, поместили в раствор H2SO4, масса которого равна 98 г, а массовая часть кислоты – 10%, и нагрели. Выделилось 2,24 л газа. К полученному раствору добавили избыток барий хлорида и получили 46,6 г осадка. Определите массовую часть натрий нитрата в исходной смеси.
Решение
Итак, первое, что нужно определить: какой газ выделяется при растворении в сульфатной кислоте? Это только карбонат натрия, другие компоненты не взаимодействуют с сульфатной кислотой. Тогда:
Na2CO3 + H2SO4 →rightarrow Na2SO4 + CO2 ↑uparrow + H2O
Тогда найдем количество моль газа и карбоната натрия:
nCO2=V/V0=2,24/22,4=0,1 моль
Далее в раствор добавляют хлорид бария. Как известно, ионы бария взаимодействую с сульфат-ионами и выпадает осадок сульфата бария.
Ba2+ + SO42- →rightarrow BaSO4
Стоит быть внимательным, т.к. в растворе есть два источника сульфат-ионов – сульфат натрия и сульфатная кислота. Можем найти, сколько было сульфата натрия:
nBaSO4=m/Mr=46,6/(233)=0,2 моль
nH2SO4=m/Mr=mр-ра ⋅cdot W/Mr=98 ⋅cdot 0,1/98=0,1 моль
Таким образом, nNa2SO4=nBaSO4 – nH2SO4 = 0,2 – 0,1=0,1 моль
Теперь, зная сколько было натрий сульфата и карбоната, можем найти массу натрий нитрата:
mNa2SO4=n ⋅cdot Mr=0,1 ⋅cdot 142=14,2 г
mNa2CO3=n ⋅cdot Mr=0,1 ⋅cdot 106=10,6 г
mNaNO3=m- mNa2CO3 – mNa2SO4=41,8-14,2-10,6=17 г
WNaNO3=mNaNO3/m=17/41,8 ⋅cdot 100%=40,67%
Нахождение состава смеси по плотности
Другим типом задач является нахождение состава смеси по известной плотности. Для решения таких задач требуется умение составления и решения несложных уравнений. Рассмотрим этот тип задач на таком примере
Пример 2
Смесь водорода и аммиака имеет плотность в 12,57 раза меньше плотности углекислого газа. Определите объемную часть водорода в смеси.
Решение
Сначала найдем, какую плотность имеет смесь. Как известно, плотность прямо пропорциональна молярной массе, поэтому молярная масса смеси
Mrсмеси=MrCO2/12,57=44/12,57=3,5 г/моль
Далее, пусть x – объемная доля водорода в смеси, тогда (1-х) – объемная доля аммиака. Тогда, составим такое уравнение:
MrH2 ⋅cdot x+MrNH3 ⋅cdot (1-x)=Mrсмеси
2 ⋅cdot x + 17 ⋅cdot (1-x)=3,5
15x=13,5
x=0,9
Или 90% водорода в смеси.
Взаимодействие реагента с обоими компонентами смеси
Далее рассмотрим тип задач, в которых реагент взаимодействует с обоими компонентами смеси. Для решения таких задач нужно составить уравнение. Рассмотрим такой пример.
Пример 3
На 25 г смеси алюминия и меди подействовали концентрированной азотной кислотой и нагрели. Получили 33,6 л газа. Определите массовую часть алюминия в смеси.
Решение
Первое, что нужно сделать – написать уравнения реакций:
Cu + 4HNO3 →rightarrow Cu(NO3)2 + 2NO2 + 2H2O
Al + 6HNO3 →rightarrow Al(NO3)3 + 3NO2 + 3H2O
Стоит отметить, что здесь азотная кислота реагирует с алюминием, поскольку взята горячая кислота.
Заметим, что на один моль меди приходится 2 моль газа, а на 1 моль алюминия – 3 моль газа.
Найдем количество газа:
n=V/V0=33,6/22,4=1,5 моль
Далее составим такой уравнение:
Пусть x г – масса алюминия в смеси, тогда (25-х) г – масса меди.
Тогда:
(nAl) ⋅cdot 3+(nCu) ⋅cdot 2=0,5
Или x/MrAl ⋅cdot 3+(25-x)/MrCu ⋅cdot 2=1,5
(x/27) ⋅cdot 3+(25-x) ⋅cdot 2/64=1,5
Решая, получаем х=9 г
Или W=m/mсмеси=9/25 ⋅cdot 100%=36%
В итоге, имеем, что для успешной борьбы с задачами на определение количественного состава смеси, важно иметь знания как в химии, так и обладать определенными математическими навыками.
Это отработанный пример задачи, показывающий, как рассчитать массовый процентный состав. Процентный состав указывает относительные количества каждого элемента в соединении. Для каждого элемента формула массового процента выглядит следующим образом:
% mass = (масса элемента в 1 моль соединения)/(молярная масса соединения) x 100%
или
массовый процент = (масса растворенного вещества/масса раствора) x 100%
Обычно единицы массы – граммы. Массовый процент также известен как массовый процент или мас./Мас.%. Молярная масса – это сумма масс всех атомов в одном моль соединения. Сумма всех массовых процентов должна составлять в сумме 100%. Следите за ошибками округления в последней значащей цифре, чтобы убедиться, что все проценты складываются.
Содержание
- Ключевые выводы
- Проблема массового процентного состава
- Процентный состав воды
- Массовый процент диоксида углерода
- Массовый процент раствора
- Советы по расчету массового процента
Ключевые выводы
- Состав в массовых процентах описывает относительные количества элементов в химическом соединении.
- Состав в массовых процентах также известен в процентах по массе. Он сокращенно обозначается как мас./Мас.%.
- Для раствора массовый процент равен массе элемента в одном моль соединения, деленной на молярную массу соединения, умноженную на 100%.
Проблема массового процентного состава
Бикарбонат соды (гидрокарбонат натрия) используется во многих коммерческих препаратах. Его формула – NaHCO 3 . Найдите массовые проценты (мас.%) Na, H, C и O в гидрокарбонате натрия.
Раствор
Сначала найдите атомные массы для элементов из Периодической таблицы. Атомные массы оказались следующими:
- Na = 22,99
- H = 1,01
- C – 12,01
- O – 16,00
Затем определите, сколько граммов каждого в одном моль NaHCO 3 :
- 22,99 г (1 моль) Na
- 1,01 г (1 моль) H
- 12,01 г (1 моль) C
- 48,00 г (3 моль x 16,00 грамм на моль) O
Масса одного моля NaHCO 3 составляет:
22,99 г + 1,01 г + 12,01 г + 48,00 г = 84,01 г
И масса процентное содержание элементов составляет
- масс.% Na = 22,99 г/84,01 г x 100 = 27,36%
- % масс H = 1,01 г/84,01 г x 100 = 1,20%
- % масс C = 12,01 г/84,01 г x 100 = 14,30%
- % масс O = 48,00 г /84,01 gx 100 = 57,14%
Ответ
- % масс Na = 27,36%
- % масс H = 1,20%
- массовый% C = 14,30%
- массовый% O = 57,14%
При вычислении массовых процентов всегда рекомендуется проверять, чтобы ваши массовые проценты в сумме составляли 100% (помогает отловить математические ошибки):
27,36 + 14,30 + 1,20 + 57,14 = 100. 00
Процентный состав воды
Другой простой пример – определение массового процентного состава элементов в воде, H 2 O.
Сначала найдите молярную массу воды, сложив атомные массы элементов. Используйте значения из периодической таблицы:
- H составляет 1,01 грамма на моль
- O составляет 16,00 граммов на моль
Получите молярную массу, сложив все массы элементов в соединении. Нижний индекс после водорода (H) указывает на наличие двух атомов водорода. После кислорода (O) нет индекса, что означает, что присутствует только один атом.
- молярная масса = (2 x 1,01) + 16,00
- молярная масса = 18,02
Теперь разделите массу каждого элемента на общую массу, чтобы получить массовые проценты:
масс% H = (2 x 1,01)/18,02 x 100%
масс% H = 11,19%
массовый% O = 16,00/18,02
массовый% O = 88,81%
Массовые проценты водорода и кислорода в сумме составляют 100%.
Массовый процент диоксида углерода
Какова масса процентное содержание углерода и кислорода в диоксиде углерода, CO 2 ?
Массовый процент раствора
Шаг 1: Найдите массу отдельных атомов.
Найдите атомные массы углерода и кислорода из Периодическая таблица. На этом этапе рекомендуется определиться с количеством значащих цифр, которые вы будете использовать. Атомные массы оказались следующими:
- C = 12,01 г/моль
- O = 16,00 г. /моль
Шаг 2: Найдите количество граммов каждого компонента, составляющего один моль CO. 2.
Один моль CO 2 содержит 1 моль атомов углерода и 2 моля атомов кислорода.
- 12,01 г (1 моль) C
- 32,00 г (2 моль x 16,00 грамм на моль) O
Масса одного моля CO 2 составляет:
- 12,01 г + 32,00 г = 44,01 г
Шаг 3: Найдите массовый процент каждого атома.
mass% = (масса компонента/масса всего) x 100
И массовые проценты элементов составляют
Для углерод:
- мас.% C = (масса 1 моля углерода/масса 1 моль CO 2 ) x 100
- мас.% C = (12,01 г/44,01 г) x 100
- массовый% C = 27,29%
Для кислорода:
- мас.% O = (масса 1 моля кислорода/масса 1 моль CO 2 ) x 100
- мас.% O = (32,00 г/44,01 г) x 100
- мас.% O = 72,71%
Ответ
- массовый% C = 27,29%
- массовый% O = 72. 71%
Опять же, убедитесь, что ваши массовые проценты в сумме составляют 100%. Это поможет выявить любые математические ошибки.
- 27,29 + 72,71 = 100,00
Сумма ответов составляет 100%, чего и ожидалось.
Советы по расчету массового процента
- Вам не всегда будет дана общая масса смеси или раствора. Часто вам нужно складывать массы. Это может быть неочевидно. Вам могут быть заданы мольные доли или моль, а затем потребуется преобразовать их в единицу массы.
- Следите за своими значащими цифрами.
- Всегда проверяйте сумму массовых процентов всех компонентов составляет 100%. В противном случае вам нужно вернуться и найти свою ошибку.