1
frmnte
[15.4K]
более года назад
Пусть х – масса первого раствора. Тогда
30-х – масса второго раствора,
0,1х – масса соли в первом растворе,
0,25(30-х) – масса соли во втором растворе,
0,1х+0,25(30-х) – масса соли в третьем растворе, равная по условию 0,2*30:
0,1х+0,25(30-х)=6,
х+2,5*30-2,5х=60,
1,5х=15,
х=10 кг.
Ответ: 10 кг.
автор вопроса выбрал этот ответ лучшим
комментировать
в избранное
ссылка
отблагодарить
Вычисление массы воды для растворения кристаллической соды
Рассчитайте массу воды (H2О), в которой надо растворить 100 грамм кристаллической соды (Na2CO3 ∙ 10 H2O) для получения 10-процентного раствора карбоната натрия (Na2CO3).
Решение задачи
Рассчитаем молярные массы карбоната натрия (Na2CO3) и кристаллической соды (Na2CO3 ∙ 10 H2O):
M (Na2CO3) = 106 (г/моль),
M (Na2CO3 ∙ 10 H2O) = 106+ 10 ∙ 18 = 286 (г/моль).
Учитывая, что в 1 моль кристаллической соды (Na2CO3 ∙ 10 H2O) содержится 1 моль карбоната натрия (Na2CO3), найдем массы данных веществ по формуле, устанавливающей связь между массой и химическим количеством вещества:
![]()
Получаем:
m (Na2CO3) = 1 моль ∙ 106 г/моль = 106 (г)
m (Na2CO3 ∙ 10 H2O) = 1 моль ∙ 286 г/моль = 286 (г).
Вычислим, какое количество карбоната натрия (Na2CO3) (в г) содержится в 100 г кристаллогидрата (кристаллической соды (Na2CO3 ∙ 10 H2O)). Составим пропорцию:
в 286 г Na2CO3 ∙ 10 H2O содержится 106 г Na2CO3
в 100 г Na2CO3 ∙ 10 H2O содержится ![]() г Na2CO3
г Na2CO3
Откуда:
![]()
Массу кристаллизационной воды можно вычислить по формуле:
![]()
Получаем:
m (крист. воды) = 100 – 37,06 = 62,94 (г).

Используя формулу нахождения массовой доли вещества:
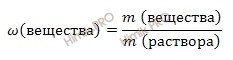 найдем массу 10-процентного раствора карбоната натрия (Na2CO3) по формуле:
найдем массу 10-процентного раствора карбоната натрия (Na2CO3) по формуле:
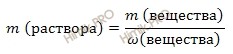 Получаем:
Получаем:
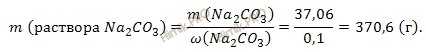
Если раствор 10-процентный, то массовая доля карбоната натрия (Na2CO3) в нем 0,1.
Вычислим массу воды (H2O) в 10-процентном растворе по формуле:
![]() Получаем:
Получаем:
m (H2O) = 370,6 – 37,06 = 333,54 (г).
Найдем массу воды (H2O), которую необходимо взять для приготовления раствора:
m (H2O для растворения кристаллогидрата) = m (H2O в растворе) — m (кристаллизационной H2O)
m (H2O) = 333,54 – 62,94 = 270,6 (г).
Ответ: масса воды равна 270,6 грамм.
Похожие задачи
Дано:
m(р-раCuCI₂)=270г.
ω%(CuCI₂)=10%
——————————-
m(р-раNaOH)10%-?
1. Определим массу хлорида меди в 270г. 10% раствора:
m(CuCI₂)=ω%(CuCI₂) x m(р-раCuCI₂)÷100% =10%×270г.÷100%=27г.
2.Определим молярную массу хлорида меди и ее количество вещества в 27г.:
M(CuCI₂)=64+35.5×2=135г./моль
n(CuCI₂)=m(CuCI₂)÷M(CuCI₂)=27г.÷135г./моль=0,2моль
3. Запишем уравнение реакции:
2NaOH + CuCI₂ = Cu(OH)₂ + 2NaCI
по уравнению реакции:
n(NaOH)=2моль, n(CuCI₂)=1моль
по условию задачи:
n(CuCI₂)=0,2моль, значит потребуется количество вещества гидроксида натрия в два раза больше это 0,4моль.
n(NaOH)=0,4моль
4. Определим молярную массу гидроксида натрия и его массу количеством вещества 0,4моль:
M(NaOH)=23+16+1=40г./моль
m(NaOH)=n(NaOH) x M(NaOH)=0,4мольх40г./моль=16г.
(это мы определили массу чистого гидроксида натрия)
5. Определим массу 10% раствора гидроксида натрия:
ω%=m(вещества)÷m(раствора)×100%, отсюда
m(раствора)=m(вещества)÷ω%х100%
m(р-раNaOH)=m(NaOH)÷ω%(NaOH)×100%
m(р-раNaOH)=16г.÷10%×100%=160г.
6. Ответ: для полного осаждения гидроксида меди(ll) из 270 гр 10% хлорида меди(ll) потребуется 160г. 10% гидроксида натрия.
-

а) m (соли) = ω*m (р-ра) = 0,1 * 100 г = 10 г
m (воды) = m (р-ра) – m (соли) = 100 г – 10 г = 90 г
б) m (соли) = ω*m (р-ра) = 0,15 * 200 г = 30 г
m (воды) = m (р-ра) – m (соли) = 200 г – 30 г = 170 г
- Комментировать
- Жалоба
- Ссылка
-

а) масса соли = массовая доля*массу растовра=0,1*100=10. Масса воды = масса раствора-масса вещества = 100-10=90
б) масса соли = массовая доля*массу растовра=0,15*200=30. Масса воды = масса раствора-масса вещества = 200-30=170
- Комментировать
- Жалоба
- Ссылка
Найди верный ответ на вопрос ✅ «какую массу поваренной соли и воды надо взять, чтобы получить а) 100 г 10 процентного раствора; б) 200 г 15 процентного? …» по предмету 📙 Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
Главная » Химия » какую массу поваренной соли и воды надо взять, чтобы получить а) 100 г 10 процентного раствора; б) 200 г 15 процентного?
3HCl + Fe(OH)₃ = FeCl₃ + 3H₂O
M(Fe(OH)₃)=107 г/моль
M(HCl)=36,5 г/моль
m(Fe(OH)₃)=21,4 г
m(HCl)=х г
1) Через расчет по уравнению реакции найдем массу чистого (безводного) HCl которую необходимо затратить на полное растворение Fe(OH)₃:
3×36,5 г HCl растворяют 107 г Fe(OH)₃
х г HCl расворяют 21,4 г Fe(OH)₃
г безводного HCl
2) Найдем массу 10%-ного раствора:
100 г раствора содержит 10 г HCl
у г раствора содержит 21,9 г HCl
г 10%-ного раствора.
Ответ: для полного растворения 21,4 г Fe(OH)₃ потребуется 219 г 10%-ного раствора HCl.
