Ученик
(93),
закрыт
9 лет назад
Geselle
Гений
(63461)
9 лет назад
Если вас интересует масса безводной соли, то надо указать количество кристаллогидрата.
А так можно найти только массовую долю.
1) Считаем (или смотрим в интернете) молярную массу AlCl3
2) Считаем молярную массу AlCl3.6Н2О
3) делим 1) на 2) и умножаем на 100 – получим массовую долю AlCl3 в процентах.
Получается 55 % (округленно)
Это означает, что в 100 г кристаллогидрата содержится 55 г безводной соли.
«Методика решения задач на растворимость и
массовую долю вещества в растворе».
Выполнена учителем химии МБОУ СОШ № 18 г.
Ногинска Московской области Ломать Светланой Петровной.
1. Растворимость
– это способность вещества растворяться в воде или
другом растворителе. Количественно растворимость определяют коэффициентом
растворимости или просто растворимостью вещества.
Растворимость вещества X
(s)
– это масса вещества, которая может раствориться при данных условиях в 100г
растворителя с образованием насыщенного раствора:
S=
m(x)
/ m(H2O)
× 100 (г).
Массовая доля безводного
вещества Х в насыщенном растворе связана с его растворимостью соотношением:
W(X)
= s / s
+100
Для вычисления массы безводного
вещества в определенной массе насыщенного раствора можно вывести формулу:
W(x) = m(x) / m(р–ра)
=> m(x) / m(р–ра)=
s / s + 100 ; откуда
m (x) = (s / s + 100 ) ∙
m(р–ра).
Пример 1. Определите,
какая масса нитрата бария может раствориться в воде объемом 500 мл при 300С.
Растворимость нитрата бария при данной температуре составляет 14,2 г.
Решение:
Плотность воды составляет
1 г/мл, поэтому
m(Н2О)
= 500 ∙ 1 = 500 г.
Определяем массу нитрата
бария.
По формуле:
s = m(Ba(NO3)2) / m(H2O) ∙ 100 =>
ð m(Ba(NO3)2)
= s ∙ m(H2O) / 100 = 14,2 ∙ 500 / 100 = 71г.
Ответ:
m(Ba(NO3)2)
=71 г.
Пример 2. Массовая
доля хлорида аммония в насыщенном растворе при 300С
. равна 29,5%. Определите растворимость NH4Cl
при данной температуре.
Решение:
1. Вычисляем
массу соли в растворе массой 100г:
m(NH4Cl)
= m(р-ра)
∙ w(NH4Cl)
= 100 ∙ 0,295 = 29,5 г.
2.
Находим массу воды в растворе массой 100
г:
m(H2O)
= m(р-ра)
– m(NH4Cl)
= 100 -29,5 =70,5 г
3.
Определяем растворимость NH4Cl.
S30
= m(NH4Cl) / m(H2O) ∙ 100 = 29,5 / 70,5 ∙ 100 = 41,84 г.
Ответ:
S30
= 41,84 г.
Пример 3. Вычислите,
какая масса нитрата калия выпадет в осадок, если 100
г . насыщенного при температуре
700С раствора KNO3
охладить до температуры 00С. .
Растворимость нитрата калия составляет 138г при t0=700
и 13,3г при t0
ρ=00C.
Решение:
1. Находим
массу соли в насыщенном растворе массой 100 г при 700С.
По формуле: s70
= m70(KNO3)
/ m(H2O)
∙ 100 = m70(KNO3)
/ (m(р-ра)
– m70(KNO3))
∙100 => m70(KNO3)
= (s70
∙ (m(р-ра)
– m70(KNO3))
/ 100 = 138 ∙ ( 100 – m70(KNO3))
/ 100 ; отсюда m70(KNO3)
= 57, 98 г.
2. Находим
массу воды в насыщенном растворе массой 100 г:
m(H2O)
= m(р-ра)
– m70(KNO3)
= 100 – 57,98 = 42,02 г.
3. Находим
массу соли, выпавшей в осадок:
m(
осадка KNO3)
= m70(KNO3)
– m0(KNO3)
= 57,98 – 5,59 = 52,39 г.
Ответ: m(осадка
KNO3)
= 52,39 г.
2. Массовая
доля растворенного вещества – это отношение массы
растворенного вещества к общей массе раствора:
W(раств.в-ва)
= m(раств.в-ва)
/ m(р-ра)
( в долях единицы), откуда
m(раств.в-ва)
= m(р-ра)
∙ w(раств.в-ва);
W(раств.в-ва)
= m(раств.в-ва)
/ m(р-ра)
∙ 100% ( в процентах).
Эта формула указывает
массу безводного вещества, содержащегося в 100 г раствора. Раствор состоит из
растворенного вещества и растворителя.
m(р-ра)
= m(раств.в-ва)
+ m(H2O)
W(раств.в-ва)
= m(раств.в-ва)
/ (m(раств.в-ва)
+ m(H2O))/
Массу раствора можно
выразить через объем раствора (V)и
его плотность (ρ): m(р-ра) = V ∙ ρ. Откуда:
W(раств.в-ва)
= m(раств.в-ва)
/ V ∙ ρ ;
m(раств.в-ва)
= V
∙ ρ ∙ w(раств.в-ва).
Пример 1. Определите
массовую долю (%) соли в растворе, полученном при растворении 50 г соли в 200 г
воды.
Решение:
W(соли)
= m(соли)
/ (m(соли)
+ m(H2O)
= 50 / (50+ 200) = 0,2 или 20%
Ответ: W(соли)
=0,2 или 20%.
Пример 2. Вычислите
массу гидроксида калия в растворе объемом 600 мл и плотностью 1,082 г/мл, если
массовая доля гидроксида калия составляет 10% .
Решение:
W(KOH)
= m(KOH)
/ V∙
ρ;
m(KOH)
= w(KOH)
∙ V
∙ ρ
= 0,1 ∙ 600 ∙ 1,082 = 64,92 (г).
Ответ:
m(KOH)
= 64,92 (г).
Пример 3. Какую
массу воды надо прибавить к раствору гидроксида натрия массой 150 г с массовой
долей 10%, чтобы получить раствор с массовой долей 2%?
Решение:
m2(р-ра)
= m1(р-ра)
+ m
(воды)
w2(NaOH)
= m(NaOH)
/ m2
(р-ра) = m1(р-ра)
∙ w1(NaOH)
/ (m1(р-ра)
+ m(H2O));
0,02 = 150 ∙ 0,1 / (150 +
m(H2O);
m(H2O)
= 600г.
Ответ:
m(Н2О)
=600 г.
Пример 4. Какую
массу раствора с массовой долей уксусной кислоты 40% надо прибавить к 500 г
воды для получения раствора с массовой долей уксусной кислоты 15%?
Решение:
W2(CH3COOH)
= m(р-ра)
∙ m1(CH3COOH)
/ (m(р-ра)
+ 500;
0,15 = m(р-ра)
∙ 0,4 / (m(р-ра) +500 ;
m(р-ра)
= 300 г.
Ответ:
m(р-ра)
= 300 г.
Пример 5. Какой
объем раствора с массовой долей гидроксида калия 50% ( плотностью 1,538 г/ мл)
требуется для приготовления 3 л раствора гидроксида калия с массовой долей 6% (
плотностью 1,048 г/мл)?
Решение:
W2
(KOH)
= V1
∙ ρ1
∙ w1(KOH)
/ V2
∙ ρ2 ;
0,06 = 0,5 ∙ 1,538 ∙ V1
/ 3000 ∙ 1,048;
0,06 ∙ 3000 ∙ 1,048 = 0,5
∙ 1,538 ∙ V1
;
V1
= 245,3 мл.
Ответ:
V1
= 245,3 мл.
ЗАДАЧИ на Вычисление массы
растворенного вещества
Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе. Элемент ЕГЭ: 4.3.1. Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе».
Расчёты с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
Раствор — это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности. Растворы состоят из растворителя (например, воды) и растворенного вещества.
Массовой долей растворенного вещества (ω) называют отношение его массы m(В) к массе раствора m(p).
ω(В) = m(В) : m(p)
Это безразмерная величина, поэтому выражается в долях единицы (изменяется от 0 до 1), но иногда выражается в процентах (тогда изменяется от 0 до 100 %).
Обозначение ω(В) аналогично обозначению ω(р. в-ва) или ω(в-ва);
обозначение m(В) аналогично обозначению m(р. в-ва) или m(в-ва);
обозначение m(р) аналогично обозначению m(р-ра),
где р-ра – сокращение слова «раствора», а р. в-ва и в-ва – сокращения слов «растворенного вещества».
Обратите внимание также на следующие обозначения:
m(в) — масса безводного вещества;
m(р-ля) — масса растворителя.
Соотношения между величинами, характеризующими раствор


Следует учитывать, что любой способ выражения содержания растворенного вещества в растворе дается в расчете на безводное вещество, даже если для приготовления раствора использован кристаллогидрат. Если для приготовления растворов используют не безводное вещество, а его кристаллогидрат, B • nH20, то масса растворителя (воды) рассчитывается по формуле: m(H20) = m(р) – m(кр.), где m(кр.) — масса кристаллогидрата, в граммах. Следует учитывать, что количество (моль) кристаллогидрата равно количеству (моль) безводного вещества, т.е. m(кр.) : М(кр.) = m(в) : М(в).
Молярная концентрация характеризует количество растворенного вещества, выраженное, в молях, содержащееся в 1 л раствора. Молярная концентрация вычисляется по формуле С = v / V, где С — молярная концентрация (измеряется в моль/л), v — количество вещества, V — объем раствора, измеренный в литрах. Часто размерность молярной концентрации обозначают символом М. Например, раствор с концентрацией 1 М (одномолярный раствор) содержит 1 моль растворенного вещества в 1л раствора, 0,1 М (децимолярный раствор) — 0,1 моль растворенного вещества в 1 л раствора и т. д.
Титр (Т) определяет массу растворенного вещества (в г), содержащуюся в 1 мл раствора: T = m / V.
Растворимость характеризует способность вещества растворяться в том или ином растворителе. Растворимость обозначается символом S, она равна концентрации насыщенного при данной температуре раствора. Чаще всего растворимость измеряют числом граммов вещества, способных раствориться в 100 г растворителя при данной температуре. Важно не путать растворимость с массовой долей вещества в растворе, так как растворимость показывает, сколько граммов растворенного вещества содержится в 100 г растворителя, а массовая доля — сколько граммов растворенного вещества содержится в 100 г раствора. Растворимость веществ зависит от температуры. Растворимость твердых веществ при повышении температуры, как правило, увеличивается, растворимость газов — уменьшается.
Приготовление растворов. Способы приготовления растворов: 1) Разбавление раствора водой; 2) Выпаривание воды из раствора; 3) Сливание двух растворов; 4) Выпадение кристаллов.

Способы приготовления растворов в задачах на Вычисление массы растворенного вещества
РЕШЕНИЯ ЗАДАЧ с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
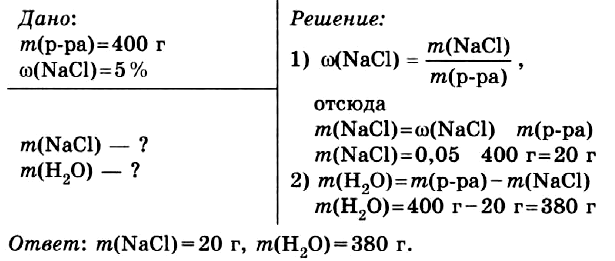
Задача № 1.
Приготовить 400 г водного раствора с массовой долей хлорида натрия в нём 5 %.
Правильный ОТВЕТ: m(NaCl) = 20 г, m(H2O) = 380 г.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 2.
Найти массовую долю растворённого вещества (в %) в растворе, полученном при смешивании 450 г воды и 50 г сахара.
Правильный ОТВЕТ: ω(сах.) = 10%.
Смотреть РЕШЕНИЕ задачи в тетради

Задача № 3.
Вычислите молярную концентрацию 4%-ного раствора поваренной соли, плотность которого равна 1,027 г/мл.
Правильный ОТВЕТ: C(NaCl) ≈ 0,7 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 4.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 5.
При 25 °С растворимость хлорида калия в воде составляет 25 г соли на 100 г воды. Вычислите массовую долю соли в насыщенном растворе и его молярную концентрацию, если плотность насыщенного раствора равна 1,132 г/мл.
Правильный ОТВЕТ: ω(KCl) = 20%, С(KCl) = 3,04 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 6.
Массовая доля соли в растворе, насыщенном при температуре 40 °С, равна 35%. При охлаждении 300 г этого раствора до температуры 10 °С в осадок выпадает 45 г соли. Определите растворимость соли при 10 °С.
Правильный ОТВЕТ: S10°С = 30,77 г.
Смотреть РЕШЕНИЯ заданий в тетради

Задачи с ответами
на Вычисление массы растворенного вещества
Задача № 7.
Масса нитрата калия, которую следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%, равна ______. (Записывайте ответ с точностью до десятых.)
Правильный ОТВЕТ: 3,4 г.
Задача № 8.
Плотность 10% -ного раствора хлорида калия составляет 1,063 г/мл. Определите массу (г) хлорида калия, который содержится в 750 мл такого раствора.
Правильный ОТВЕТ: 75,0 г.
Задача № 9.
Рассчитайте массовую долю (%) нитрата натрия в растворе, полученном при смешивании 250 г 10%-ного и 750 г 15%-ного растворов этой соли.
Правильный ОТВЕТ: 13,75 %.
Задача № 10.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Задача № 11.
В 125 г воды растворили 25 г азотной кислоты. Вычислите титр образовавшегося раствора, если его плотность равна 1,095 г/мл.
Правильный ОТВЕТ: T(HNO3) = 0,182 г/мл.
Задача № 12.
Титр раствора сульфата аммония равен 0,223 г/мл, а его плотность — 1,115 г/мл. Рассчитайте массовую долю сульфата аммония в данном растворе и молярную концентрацию раствора.
Правильный ОТВЕТ: ω((NH4)2SO4) = 20%, C((NH4)2SO4) = 1,689 моль/л.
(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «ЗАДАЧИ на Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Масса растворенного вещества в растворе определяется по формуле: Масса (г) = Объем (л) x Концентрация (моль/л) x Молекулярная масса (а. е. м.)
Как найти массу вещества в растворе зная объем?
Масса раствора определяется по формуле m (раствора)= m (масса растворенного вещества)/ w (массовая доля растворенного вещества). Или m = r (плотность раствора — г/см3) * V (объем раствора).
Как вычислить концентрацию вещества в растворе?
Определяется по формуле: СМ= ν / V, (моль/л). Величина молярной концентрации показывает, сколько моль вещества содержится в 1 литре раствора.
Как найти массу растворенного вещества формула?
Массу растворённого вещества вычислим по формуле: m ( в − ва ) = w ( в − ва ) ⋅ m ( р − ра ) ; m ( H 2 SO 4 ) = w ( H 2 SO 4 ) ⋅ m ( р − ра ) = 0,64 ⋅ 200 = 128
Как найти массу если есть объем?
Вес можно рассчитать по формуле: m=V*p, где р – плотность, V – объем материала. Например, 10 м3 речного песка весят 13 тонн. Если известна масса материала, то объем можно узнать по формуле: V = m/ p.
Как найти массу сухого вещества в растворе?
Масса растворенного вещества в растворе определяется по формуле: Масса (г) = Объем (л) x Концентрация (моль/л) x Молекулярная масса (а. е. м.)
Как найти массу через концентрацию и объем?
Запишите уравнение C = m/V, где m — масса растворенного вещества и V — общий объем раствора. Подставьте величины массы и объема и выполните деление, чтобы определить концентрацию раствора.
Как приготовить водный раствор вещества определенной концентрации?
ПРИГОТОВЛЕНИЕ РАСТВОРА ЗАДАННОЙ КОНЦЕНТРАЦИИ СМЕШИВАНИЕМ РАСТВОРОВ БОЛЕЕ ВЫСОКОЙ И БОЛЕЕ НИЗКОЙ КОНЦЕНТРАЦИИ. Раствор можно готовить, непосредственно вводя рассчитанное количество вещества в растворитель, или путем разбавления более концентрированных растворов до требуемого значения концентрации.
Как рассчитать процент вещества в растворе?
% = [(Объем растворенного вещества) / (объем раствора)] x 100%. Обратите внимание, что объемный процент относится к объему раствора, а не к объему растворителя .
Как определить процентное содержание вещества в растворе?
Концентрация вещества или процентное содержание вещества в сплаве — это отношение массы вещества к массе сплава, записанное в виде процентов : K=(mв/M)*100%, где mв — масса вещества, M – масса всего сплава, К – концентрация (процентное содержание) вещества. Пример раствора.
Как можно найти массу вещества?
И наоборот, массу вещества определяют как произведение молярной массы на количество вещества: m = n . M. Так, масса 0,1 моля Na составляет 0,1 моль×23 г/моль = 2,3 Молярная масса численно всегда совпадает с молекулярной массой (или атомной массой — если вещество состоит не из молекул, а из атомов).
Как найти m растворенного вещества?
m(растворённого вещества)=V×p-m(раствора).
Как найти массу вещества из массовой доли?
Массовая доля растворённого вещества — это величина, равная отношению массы растворённого вещества к массе раствора.
- w ( в − ва ) = m ( в − ва ) m ( р − ра ) .
- w ( в − ва ) = m ( в − ва ) m ( в − ва ) + m ( р − ля ) .
- w ( в − ва ) = m ( в − ва ) m ( р − ра ) ⋅ 100 %.
Как найти массу силу тяжести?
Формула силы тяжести Fт=m*g, где m-масса тела, g-ускорение свободного падения. Для тела массой m=400 г =0.4 кг сила тяжести составит Fт=0.4*10=4 Н. Формула силы тяжести: F=mg, где m- масса тела, g-Н/кг.
Как найти массу и объем газа?
Vm=M/p, где Vm – молярный объем, М – молярная масса, а p – плотность вещества. Рис. 2.
Как найти количество вещества Если дан объем?
Выразим из формулы молярного объёма n : n ( X ) = V ( X ) V m — химическое количество газа можно вычислить, если его объём разделить на молярный объём.
Один из способов решения задач на
проценты
При решении задач на проценты учащиеся
испытывают определенные трудности, особенно при
нахождении массы сухого вещества.
Предлагаю один из самых доступных (на
мой взгляд) способов решения задач такого типа.
А.Г. Мордкович “Математика 6”
Задача № 362
Свежий гриб содержит 90% воды, а сушеный
– 15%. Сколько получится сушеных грибов из 17кг
свежих? Сколько надо взять свежих грибов, чтобы
получить 3,4кг сушеных?
Решение.
Составим таблицу:
1 часть задачи:
|
Вещество |
Масса вещества (кг) |
Процентное содержание воды |
Процентное содержание сухого |
Масса сухого вещества (кг) |
|
Свежий гриб |
17 |
90% |
10% |
17 х 0,1 = 1.7 |
|
Сушеный гриб |
х |
15% |
85% |
0,85х |
Так как масса сухого вещества в сухих и
свежих грибах остается неизменной, получим
уравнение: 0,85х = 1,7,
х = 1,7 : 0,85,
х = 2.
2 часть задачи:
|
Вещество |
Масса вещества (кг) |
Процентное содержание воды |
Процентное содержание сухого |
Масса сухого вещества (кг) |
|
Свежий гриб |
х |
90% |
10% |
0,1х |
|
Сушеный гриб |
3.4 |
15% |
85% |
3,4 ?0,85 = 2,89 |
0,1х = 2,89,
х = 2,89 : 0,1,
х = 28.9.
Ответ: из 17кг свежих грибов
получится 2кг сушеных; чтобы получить 3,4кг
сушеных грибов, надо взять 28,9кг свежих.
Задача № 573
Свежий виноград содержит 90% воды, а
изюм – 55%. Сколько изюма получится из 13,5кг
винограда? Сколько винограда надо взять, чтобы
получить 10кг изюма?
Задача №575
На столе лежал расколотый арбуз массой
10кг, содержащий 99% воды. Через некоторое время
часть воды испарилась, и ее процентное
содержание в арбузе понизилась до 96%. Найдите
новую массу арбуза.
Решение:
|
Вещество |
Масса вещества (кг) |
Процентное содержание воды |
Процентное содержание сухого |
Масса сухого вещества (кг) |
|
Свежий арбуз |
10 |
99% |
1% |
0,1 |
|
“Высохший” арбуз |
х |
96% |
4% |
0,04х |
0,04х = 0,1,
х = 2,5.
Ответ: 2,5кг – новая масса арбуза
Л.В.Кузнецова, С.Б. Суворова “Сборник
заданий для подготовки к итоговой аттестации в
9-м классе”
Задача № 7.29(1)
Влажность свежескошенной травы 60%,
сена 20%. Сколько сена получится из 1т
свежескошенной травы?
Задача № 7.29.(2)
Влажность свежих грибов 90%, а сухих –
15%. Сколько сухих грибов получится из 1,7 кг свежих?
