Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
Для расчета массы (объема, количества вещества) продукта реакции, если данные по одному из веществ представлены в виде раствора с определенной массовой долей этого растворенного вещества, следует воспользоваться нижеследующим алгоритмом:
1) Прежде всего следует найти массу растворенного вещества. Возможны две ситуации:
* В условии даны масса раствора и массовая доля растворенного вещества (концентрация). В этом случае масса растворенного вещества рассчитывается по формуле:
* В условии даны объем раствора вещества, плотность этого раствора и массовая доля растворенного вещества в этом растворе. В таком случае следует воспользоваться формулой для расчета массы раствора:
После чего следует рассчитать массу растворенного вещества по формуле 1.
2) Рассчитать количество вещества (моль) участника реакции, масса которого стала известна из расчетов выше. Для этого воспользоваться формулой:
3) Записать уравнение реакции и убедиться в правильности расставленных коэффициентов.
4) Рассчитать количество моль интересующего участника реакции исходя из известного количества другого участника реакции, зная, что количества веществ любых двух участников реакции A и B относятся друг к другу как коэффициенты перед этими же веществами в уравнении реакции, то есть:
Если в условии требовалось рассчитать количество вещества, то действия на этом заканчиваются. Если же требуется найти его массу или объем, следует переходить к следующему пункту.
5) Зная количество вещества, определенное в п.4, мы можем рассчитать его массу по формуле:
Также, если вещество является газообразным и речь идет о нормальных условиях (н.у.), его объем может быть рассчитан по формуле:
Рассмотрим пару примеров расчетных задач по этой теме.
Пример 1
Рассчитайте массу осадка, который образуется при добавлении к 147 г 20%-ного раствора серной кислоты избытка раствора нитрата бария.
Решение:
1) Рассчитаем массу чистой серной кислоты:
m(H2SO4) = w(H2SO4) ∙ m(р-ра H2SO4)/100% = 147 г ∙ 20% /100% = 29,4 г
2) Рассчитаем количество вещества (моль) серной кислоты:
n(H2SO4) = m(H2SO4) / M(H2SO4) = 29,4 г/98 г/моль = 0,3 моль.
3) Запишем уравнение взаимодействия серной кислоты с нитратом бария:
H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3
4) В результате расчетов стало известно количество вещества серной кислоты. Осадок представляет собой сульфат бария. Зная, что:
n(BaSO4)/n(H2SO4) = k(BaSO4)/k(H2SO4), где n — количество вещества, а k — коэффициент в уравнении реакции,
можем записать:
n(BaSO4) = n(H2SO4) ∙ k(H2SO4)/k(BaSO4) = 0,3 моль ∙ 1/1 = 0,3 моль
5) Тогда масса осадка, т.е. сульфата бария, может быть рассчитана следующим образом:
m(BaSO4) = M(BaSO4) ∙ n(BaSO4) = 233 г/моль ∙ 0,3 моль = 69,9 г
Пример 2
Какой объем газа (н.у.) выделится при растворении необходимого количества сульфида железа (II) в 20%-ном растворе соляной кислоты с плотностью 1,1 г/мл и объемом 83 мл.
Решение:
1) Рассчитаем массу раствора соляной кислоты:
m(р-ра HCl) = V(р-ра HCl) ∙ ρ(р-ра HCl) = 83 мл ∙ 1,1 г/мл = 91,3 г
Далее рассчитаем массу чистого хлороводорода, входящего в состав кислоты:
m(HCl) = m(р-ра HCl) ∙ w(HCl)/100% = 91,3 г ∙ 20%/100% = 18,26 г
2) Рассчитаем количество вещества хлороводорода:
n(HCl) = m(HCl)/M(HCl) = 18,26 г/36,5 г/моль = 0,5 моль;
3) Запишем уравнение реакции сульфида железа (II) с соляной кислотой:
FeS + 2HCl = FeCl2 + H2S↑
4) Исходя из уравнения реакции следует, что количество прореагировавшей соляной кислоты с количеством выделившегося сероводорода связано соотношением:
n(HCl)/n(H2S) = 2/1, где 2 и 1 — коэффициенты перед HCl и и H2S соответственно
Следовательно:
n(H2S) = n(HCl)/2 = 0,5/2 = 0,25 моль
5) Объем любого газа, находящегося при нормальных условиях, можно рассчитать по формуле V(газа) = Vm ∙ n(газа), тогда:
V(H2S) = Vm ∙ n(H2S) = 22,4 л/моль ∙ 0,25 моль = 5,6 л
Автор: С.И. Широкопояс https://scienceforyou.ru/
Пример 5. Определите массу нитрата
натрия и воды, необходимые для приготовления
800 г раствора с ω(NaNO3) = 12%.
Решение:
Масса растворенной соли:
m(NaNO3) = ω(NaNO3)·m(р-ра) = 0,12·800 =
96 г.
m(р-ра) = m(NaNO3) + m(H2O)
Отсюда
m(H2O) = m(р-ра) – m(NaNO3) = 800 – 96
= 704 г.
Ответ: m(NaNO3) = 96 г, m(H2O) =
704 г.
Пример 6. Определите массу
кристаллогидрата CuSO4·5H2O и
воды, необходимые для приготовления
0,4 кг раствора с ω(CuSO4) = 8%.
Решение (см. пример 2):
ω(CuSO4) =
=
m(H2O) = m(р-ра) – m(CuSO4·5H2O)
m(CuSO4·5H2O) = n(CuSO4·5H2O)·M(CuSO4·5H2O)
n(CuSO4·5H2O)·= n(CuSO4) =
Находим
m(CuSO4) = ω(CuSO4)·m(р-ра) = 0,08·400
= 32 г.
n(CuSO4) =
=
0,2 моль.
Отсюда m(CuSO4·5H2O) = 0,2·250 = 50 г
Масса воды m(H2O) = 400 – 50 = 350 г
Ответ: m(CuSO4·5H2O) = 50 г,
m(H2O) = 350 г.
1. 2. Вычисление массы раствора определенной концентрации по заданной массе растворенного вещества или растворителя
Пример 7. Определить массу раствора
с массовой долей K2SO4 10%,
который можно приготовить из 200 г воды
и сульфата калия.
Решение:
m(р-ра) =
Из условия задачи m(K2SO4)
неизвестна, но известна масса воды, а
поскольку вода – один из компонентов
раствора, то:
ω(Н2О) = 100% – ω(K2SO4) =
100 – 10 = 90%
m(р-ра) =
=
= 222,2 г.
Ответ: можно приготовить 222,2 г
раствора.
Пример 8. При растворении в 400 г воды
некоторого количества CuSO4·5H2O
получен раствор с массовой долей CuSO4
5%. Рассчитать массу использованного
кристаллогидрата и массу полученного
раствора.
Решение (см. примеры 2, 6):
m(р-ра) =
=
В этом уравнении неизвестны m(р-ра) и
m(CuSO4), но
m(р-ра) = m(CuSO4·5H2O) + m(H2O)
= m(CuSO4·5H2O) + 400
Таким образом, неизвестны две величины:
m(р-ра) и m(CuSO4·5H2O).
m(CuSO4) = n(CuSO4)·m(CuSO4)
m(CuSO4·5H2O) = n(CuSO4·5H2O)·m(CuSO4·5H2O)
m(CuSO4)
= 160 г/моль, m(CuSO4·5H2O)
= 250 г/моль.
Подставим эти величины в исходную
формулу:
400 + n(CuSO4)·250 =
Решаем уравнение относительно n(CuSO4):
20 + 0,05·250· n(CuSO4) = n(CuSO4)·160,
n(CuSO4) =
= 0,136 моль.
Отсюда
m(CuSO4·5H2O) = 0,136·250 = 34 г,
m(р-ра) = 400 + 34 = 434 г.
Возможны и другие варианты решения этой
задачи:
ω(CuSO4) =
=
В этом уравнении тоже два неизвестных
– m(CuSO4) и m(CuSO4·5H2O), но
величину m(CuSO4) можно представить
в виде m(CuSO4·5H2O)·х.
Здесь х – массовая доля CuSO4 в
кристаллогидрате, она равна:
х =
=
= 0,64
С учетом исходных данных, теперь можно
записать:
0,05 =
Решаем уравнение относительно
m(CuSO4·5H2O):
20 + 0,05 m(CuSO4·5H2O) = 0,66·m(CuSO4·5H2O)
m(CuSO4·5H2O) = 34 г.
Находим m(р-ра) = 400 + 34 = 434 г.
Ответ: для приготовления раствора
используют 34 г CuSO4·5H2O, масса
полученного раствора 434 г.
1. 3. Разбавление и концентрирование растворов
При решении задач, связанных с разбавлением
и концентрированием растворов, следует
помнить, что масса растворенного
вещества остается неизменной, т.е.
m(Х) = const. Изменяется только масса
растворителя и, соответственно, масса
раствора.
Пример 9. К 50 мл раствора H2SO4
(ω1 = 48%, ρ = 1,38 г/мл) добавили 950 мл
воды. Определить массовую долю H2SO4
в полученном растворе.
Решение:
ω2(H2SO4) =
m2(р-ра) = m1(р-ра) + m(H2O)
m(H2O) = V(H2O)·ρ(H2O) = 950·1 =
950 г
m1(р-ра) = V1(р-ра)·ρ(р-ра) =
50·1,38 = 69 г
m1(H2SO4) = m1(р-ра)
ω1(H2SO4) = 69·0,48 = 33,12 г
ω2(H2SO4) =
= 0,032 или 3,2%
Ответ: ω(H2SO4) в новом
растворе 0,032 или 3,2%.
Пример 10. Какой объем воды необходимо
добавить к 100 мл раствора азотной кислоты
(ρ = 1,1 г/мл, ω1 = 20%), чтобы получить
раствор HNO3 с ω2 = 5%?
Решение:
V(H2O) =
m(H2O) = m2(р-ра) – m1(р-ра)
m1(р-ра) = V1(р-ра)·ρ(р-ра) =
100·1,1 = 110 г
Масса искомого раствора определяется
по формуле:
m2(р-ра) =
m(HNO3) = m1(р-ра)·ω1(р-ра)
= 110·0,2 = 22 г.
Отсюда масса нового раствора:
m2(р-ра) =
= 440 г
Масса и объем добавленной воды будут
равны
m(H2O) = 440 – 110 = 330 г V(H2O) =
=
330 мл
Ответ: следует добавить 330 мл воды.
Пример 11. Из 200 мл раствора сульфата
меди (ρ = 1,1 г/мл, ω1 = 8%)
выпарили
100 мл воды. Определить ω(CuSO4)
в полученном растворе.
Решение:
ω2(CuSO4) =
При концентрировании растворов масса
растворенного вещества, как и при
разбавлении, остается неизменной, т.е.
m(CuSO4) = const.
m(CuSO4) = m1(р-ра)·ω1(р-ра)
= 220·0,08 = 17,6 г
Масса раствора после упаривания
уменьшилась на 100 г:
m(H2O) = V(H2O)·ρ(H2O) = 100·1
= 100 г
Масса исходного раствора
m1(р-ра) = V1(р-ра)·ρ(р-ра) =
200·1,1 = 220 г
Следовательно, m2(р-ра) = 220 – 100 =
120 г
Отсюда ω2(CuSO4) =
= 0,147 или 14,7%
Ответ: ω(CuSO4) в полученном
растворе равна 0,147 или 14,7%.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Масса растворенного вещества в растворе определяется по формуле: Масса (г) = Объем (л) x Концентрация (моль/л) x Молекулярная масса (а. е. м.)
Как найти массу вещества в растворе зная объем?
Масса раствора определяется по формуле m (раствора)= m (масса растворенного вещества)/ w (массовая доля растворенного вещества). Или m = r (плотность раствора — г/см3) * V (объем раствора).
Как вычислить концентрацию вещества в растворе?
Определяется по формуле: СМ= ν / V, (моль/л). Величина молярной концентрации показывает, сколько моль вещества содержится в 1 литре раствора.
Как найти массу растворенного вещества формула?
Массу растворённого вещества вычислим по формуле: m ( в − ва ) = w ( в − ва ) ⋅ m ( р − ра ) ; m ( H 2 SO 4 ) = w ( H 2 SO 4 ) ⋅ m ( р − ра ) = 0,64 ⋅ 200 = 128
Как найти массу если есть объем?
Вес можно рассчитать по формуле: m=V*p, где р – плотность, V – объем материала. Например, 10 м3 речного песка весят 13 тонн. Если известна масса материала, то объем можно узнать по формуле: V = m/ p.
Как найти массу сухого вещества в растворе?
Масса растворенного вещества в растворе определяется по формуле: Масса (г) = Объем (л) x Концентрация (моль/л) x Молекулярная масса (а. е. м.)
Как найти массу через концентрацию и объем?
Запишите уравнение C = m/V, где m — масса растворенного вещества и V — общий объем раствора. Подставьте величины массы и объема и выполните деление, чтобы определить концентрацию раствора.
Как приготовить водный раствор вещества определенной концентрации?
ПРИГОТОВЛЕНИЕ РАСТВОРА ЗАДАННОЙ КОНЦЕНТРАЦИИ СМЕШИВАНИЕМ РАСТВОРОВ БОЛЕЕ ВЫСОКОЙ И БОЛЕЕ НИЗКОЙ КОНЦЕНТРАЦИИ. Раствор можно готовить, непосредственно вводя рассчитанное количество вещества в растворитель, или путем разбавления более концентрированных растворов до требуемого значения концентрации.
Как рассчитать процент вещества в растворе?
% = [(Объем растворенного вещества) / (объем раствора)] x 100%. Обратите внимание, что объемный процент относится к объему раствора, а не к объему растворителя .
Как определить процентное содержание вещества в растворе?
Концентрация вещества или процентное содержание вещества в сплаве — это отношение массы вещества к массе сплава, записанное в виде процентов : K=(mв/M)*100%, где mв — масса вещества, M – масса всего сплава, К – концентрация (процентное содержание) вещества. Пример раствора.
Как можно найти массу вещества?
И наоборот, массу вещества определяют как произведение молярной массы на количество вещества: m = n . M. Так, масса 0,1 моля Na составляет 0,1 моль×23 г/моль = 2,3 Молярная масса численно всегда совпадает с молекулярной массой (или атомной массой — если вещество состоит не из молекул, а из атомов).
Как найти m растворенного вещества?
m(растворённого вещества)=V×p-m(раствора).
Как найти массу вещества из массовой доли?
Массовая доля растворённого вещества — это величина, равная отношению массы растворённого вещества к массе раствора.
- w ( в − ва ) = m ( в − ва ) m ( р − ра ) .
- w ( в − ва ) = m ( в − ва ) m ( в − ва ) + m ( р − ля ) .
- w ( в − ва ) = m ( в − ва ) m ( р − ра ) ⋅ 100 %.
Как найти массу силу тяжести?
Формула силы тяжести Fт=m*g, где m-масса тела, g-ускорение свободного падения. Для тела массой m=400 г =0.4 кг сила тяжести составит Fт=0.4*10=4 Н. Формула силы тяжести: F=mg, где m- масса тела, g-Н/кг.
Как найти массу и объем газа?
Vm=M/p, где Vm – молярный объем, М – молярная масса, а p – плотность вещества. Рис. 2.
Как найти количество вещества Если дан объем?
Выразим из формулы молярного объёма n : n ( X ) = V ( X ) V m — химическое количество газа можно вычислить, если его объём разделить на молярный объём.
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 450 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов). Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Несколько миллионов. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества. Обозначается как M
Есть еще молекулярная масса — Mr
Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 гмоль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=mM
n=V22.4 (лмоль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (лмоль)
или вот еще удобная табличка:
Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
В ОГЭ и ЕГЭ по химии задач , в которых нужно было бы найти только объем массу кол-во моль нет — это обычно ЧАСТЬ решения задачи. Однако, чтобы легко решать более сложные задачи, нужно тренироваться на таких вот небольших упражнениях.
Находим количество вещества по массе
1 Какое количество вещества алюминия содержится в образце металла массой 10.8 г?2 Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
3 Определите количество моль брома, содержащееся в массе 12.8 г.
Находим массу по количеству вещества:
4. Определите массу карбоната натрия количеством вещества 0.25 моль.Объем по количеству вещества:
5. Какой объем будет иметь азот при н.у., если его количество вещества 1.34 моль?6. Какой объем занимают при н.у. 2 моль любого газа?
Ответы:/p>
- 0.4 моль
- 0.15 моль
- 0.08 моль
- 26.5 г
- 30 л
- 44.8 л
Категории:
|
Обсуждение: “Основные формулы для решения задач по химии”
(Правила комментирования)
ЗАДАЧИ на Вычисление массы
растворенного вещества
Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе. Элемент ЕГЭ: 4.3.1. Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе».
Расчёты с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
Раствор — это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности. Растворы состоят из растворителя (например, воды) и растворенного вещества.
Массовой долей растворенного вещества (ω) называют отношение его массы m(В) к массе раствора m(p).
ω(В) = m(В) : m(p)
Это безразмерная величина, поэтому выражается в долях единицы (изменяется от 0 до 1), но иногда выражается в процентах (тогда изменяется от 0 до 100 %).
Обозначение ω(В) аналогично обозначению ω(р. в-ва) или ω(в-ва);
обозначение m(В) аналогично обозначению m(р. в-ва) или m(в-ва);
обозначение m(р) аналогично обозначению m(р-ра),
где р-ра – сокращение слова «раствора», а р. в-ва и в-ва – сокращения слов «растворенного вещества».
Обратите внимание также на следующие обозначения:
m(в) — масса безводного вещества;
m(р-ля) — масса растворителя.
Соотношения между величинами, характеризующими раствор
Следует учитывать, что любой способ выражения содержания растворенного вещества в растворе дается в расчете на безводное вещество, даже если для приготовления раствора использован кристаллогидрат. Если для приготовления растворов используют не безводное вещество, а его кристаллогидрат, B • nH20, то масса растворителя (воды) рассчитывается по формуле: m(H20) = m(р) – m(кр.), где m(кр.) — масса кристаллогидрата, в граммах. Следует учитывать, что количество (моль) кристаллогидрата равно количеству (моль) безводного вещества, т.е. m(кр.) : М(кр.) = m(в) : М(в).
Молярная концентрация характеризует количество растворенного вещества, выраженное, в молях, содержащееся в 1 л раствора. Молярная концентрация вычисляется по формуле С = v / V, где С — молярная концентрация (измеряется в моль/л), v — количество вещества, V — объем раствора, измеренный в литрах. Часто размерность молярной концентрации обозначают символом М. Например, раствор с концентрацией 1 М (одномолярный раствор) содержит 1 моль растворенного вещества в 1л раствора, 0,1 М (децимолярный раствор) — 0,1 моль растворенного вещества в 1 л раствора и т. д.
Титр (Т) определяет массу растворенного вещества (в г), содержащуюся в 1 мл раствора: T = m / V.
Растворимость характеризует способность вещества растворяться в том или ином растворителе. Растворимость обозначается символом S, она равна концентрации насыщенного при данной температуре раствора. Чаще всего растворимость измеряют числом граммов вещества, способных раствориться в 100 г растворителя при данной температуре. Важно не путать растворимость с массовой долей вещества в растворе, так как растворимость показывает, сколько граммов растворенного вещества содержится в 100 г растворителя, а массовая доля — сколько граммов растворенного вещества содержится в 100 г раствора. Растворимость веществ зависит от температуры. Растворимость твердых веществ при повышении температуры, как правило, увеличивается, растворимость газов — уменьшается.
Приготовление растворов. Способы приготовления растворов: 1) Разбавление раствора водой; 2) Выпаривание воды из раствора; 3) Сливание двух растворов; 4) Выпадение кристаллов.
Способы приготовления растворов в задачах на Вычисление массы растворенного вещества
РЕШЕНИЯ ЗАДАЧ с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
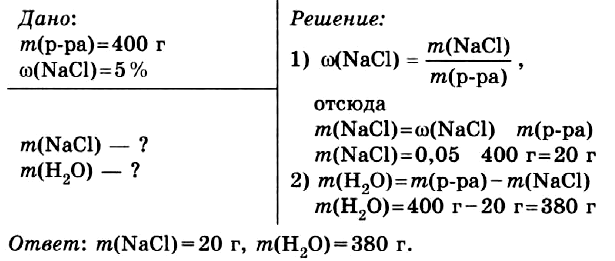
Задача № 1.
Приготовить 400 г водного раствора с массовой долей хлорида натрия в нём 5 %.
Правильный ОТВЕТ: m(NaCl) = 20 г, m(H2O) = 380 г.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 2.
Найти массовую долю растворённого вещества (в %) в растворе, полученном при смешивании 450 г воды и 50 г сахара.
Правильный ОТВЕТ: ω(сах.) = 10%.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 3.
Вычислите молярную концентрацию 4%-ного раствора поваренной соли, плотность которого равна 1,027 г/мл.
Правильный ОТВЕТ: C(NaCl) ≈ 0,7 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 4.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 5.
При 25 °С растворимость хлорида калия в воде составляет 25 г соли на 100 г воды. Вычислите массовую долю соли в насыщенном растворе и его молярную концентрацию, если плотность насыщенного раствора равна 1,132 г/мл.
Правильный ОТВЕТ: ω(KCl) = 20%, С(KCl) = 3,04 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради
Задача № 6.
Массовая доля соли в растворе, насыщенном при температуре 40 °С, равна 35%. При охлаждении 300 г этого раствора до температуры 10 °С в осадок выпадает 45 г соли. Определите растворимость соли при 10 °С.
Правильный ОТВЕТ: S10°С = 30,77 г.
Смотреть РЕШЕНИЯ заданий в тетради
Задачи с ответами
на Вычисление массы растворенного вещества
Задача № 7.
Масса нитрата калия, которую следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%, равна ______. (Записывайте ответ с точностью до десятых.)
Правильный ОТВЕТ: 3,4 г.
Задача № 8.
Плотность 10% -ного раствора хлорида калия составляет 1,063 г/мл. Определите массу (г) хлорида калия, который содержится в 750 мл такого раствора.
Правильный ОТВЕТ: 75,0 г.
Задача № 9.
Рассчитайте массовую долю (%) нитрата натрия в растворе, полученном при смешивании 250 г 10%-ного и 750 г 15%-ного растворов этой соли.
Правильный ОТВЕТ: 13,75 %.
Задача № 10.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Задача № 11.
В 125 г воды растворили 25 г азотной кислоты. Вычислите титр образовавшегося раствора, если его плотность равна 1,095 г/мл.
Правильный ОТВЕТ: T(HNO3) = 0,182 г/мл.
Задача № 12.
Титр раствора сульфата аммония равен 0,223 г/мл, а его плотность — 1,115 г/мл. Рассчитайте массовую долю сульфата аммония в данном растворе и молярную концентрацию раствора.
Правильный ОТВЕТ: ω((NH4)2SO4) = 20%, C((NH4)2SO4) = 1,689 моль/л.
(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «ЗАДАЧИ на Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии