Найдите эквивалент гидроксида натрия
Опубликовано 29/08/2019
Легкое задание по химии:
Найдите эквивалент гидроксида натрия
Решается оно очень быстро. Так выглядит ответ:
Нам нужно найти эквивалент гидроксида натрия. В дано запишем гидроксид натрия NaOH. Для решения задания мы должны воспользоваться формулой, которая дана выше во втором столбце. Необходимо в неё подставить все известные нам данные из таблицы Менделеева и посчитать. Сорок разделить на один получится 40. Именно такой показатель и является эквивалентом гидроксида натрия. Это и будет правильный ответ на поставленный вопрос.
Эквивалент. Закон зквивалентов. Определение эквивалентной массы вещества
Определение объема водорода
Задача № 11.
Некоторое количество металла, эквивалентная масса которого равна 27,9 г/моль, вытесняет из кислоты 700 мл водорода, измеренного при нормальных условиях. Определить массу металла.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
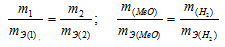
Та как водород находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 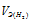 , молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4/2 = 11,2 л/моль или 12000 мл/моль.
, молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4/2 = 11,2 л/моль или 12000 мл/моль.
Тогда можно записать:
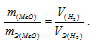
Отсюда:
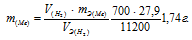
Ответ: 1,74г.
Определение эквивалентной массы вещества
Задача № 12.
1,60г кальция и 2,61г цинка вытесняют из кислоты одинаковые количества водорода. Вычислить эквивалентную массу цинка, зная, что эквивалентная масса кальция равна 20,0 г/моль.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
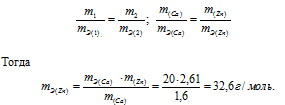
Ответ: 32,6г/моль.
Определение отношения масс реагирующих веществ
Задача № 13.
Серная и ортофосфорная кислоты имеют одинаковую молекулярную массу. Каково отношение масс этих кислот, пошедших на нейтрализацию одного и того же количества щелочи, если образовались соответственно сульфат и дигидроортофосфат?
Решение:
Формула сульфата имеет вид MeSO4, а дигидроортофосфата – MeH2PO4. Таким образом, на образование сульфата затрачивается две эквивалентные массы щёлочи, а на образование дигидроортофосфата – одна эквивалентная масса щёлочи. Так как H2SO4 с двумя эквивалентными массами щёлочи, то её эквивалентная масса в реакции нейтрализации равна М/2 г/моль, а фосфорная кислота реагирует с одной эквивалентной массой щёлочи, то её эквивалентная масса равна М/1г/моль. Отсюда, отношение мас этих кислот, с учётом, что их молекулярные массы равны будет иметь вид:
mH2SO4 : mH3PO4 = ½M : 1M = 1 : 2
Это можно подтвердить уравнениями реакций нейтрализации этих кислот с гидроксидом натрия:
H2SO4 +2NaOH = Na2SO4 + 2H2O;
H3PO4 + NaOH = NaH2PO4 +H2O.
Ответ: mH2SO4 : mH3PO4 = 1 : 2.
Задача № 14.
Медь образует два оксида. На определенное количество меди при образовании первого оксида пошло вдвое больше кислорода, чем при образовании второго. Каково отношение валентности меди в первом оксиде к ее валентности во втором?
Решение:
Согласно закону эквивалентов 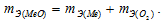 По условию задачи при образовании первого оксида ушло в два раза больше кислорода, чем при образовании второго, следовательно, эквивалентная масса меди в первом оксиде будет в два раза меньше, чем во втором. Валентность металла определяется из соотношения mэ =A/B, где mэ – эквивалентная масса металла; А – мольная масс металла; В – стехиометрическая валентность металла. Тогда B = A/mэ. Приняв, что А и mэ – постоянные величины, запишем соотношения валентностей для первого и второго оксидов:
По условию задачи при образовании первого оксида ушло в два раза больше кислорода, чем при образовании второго, следовательно, эквивалентная масса меди в первом оксиде будет в два раза меньше, чем во втором. Валентность металла определяется из соотношения mэ =A/B, где mэ – эквивалентная масса металла; А – мольная масс металла; В – стехиометрическая валентность металла. Тогда B = A/mэ. Приняв, что А и mэ – постоянные величины, запишем соотношения валентностей для первого и второго оксидов:
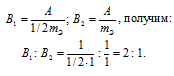
Таким образом, валентность меди в первом оксиде равна II, а во втором – I.
Ответ: 2 : 1.
Определение значения эквивалентной массы вещества
Задача № 15
При взаимодействии ортофосфорной кислоты со щелочью образовалась соль Na2HPO4. Найти для этого случая значение эквивалентной массы ортофосфорной кислоты.
Решение:
Уравнение реакции имеет вид:
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
Эквивалент (эквивалентная масса) кислоты равна мольной массе (М) делённой на число атомов водорода, замещённых в данной реакции на металл (на число вступающих в реакцию атомов водорода). Так как при взаимодействии ортофосфорной кислоты со щёлочью образовалась соль Na2HPO4, т.е. на натрий заместилось два атома водорода в кислоте H3PO4. Следовательно, эквивалентная масса ортофосфорной кислоты в реакции со щёлочью при образовании гидрофосфата натрия равна М/2 = М(H3PO4)/2 = 98/ 2 = 49г/моль.
Ответ: 49г/моль.
Задача № 16
На нейтрализацию 2,45г кислоты идет 2,00г гидроксида натрия. Определить эквивалентную массу кислоты.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
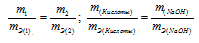
Эквивалентная масса гидроксида натрия равна М(NaOH)0/1 = 40г/моль.
Тогда
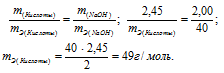
Ответ: 49г/моль.
Задача № 17
При взаимодействии 5,95г некоторого вещества с 2,75г хлороводорода получилось 4,40г соли. Вычислить эквивалентные массы вещества и образовавшейся соли.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
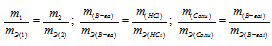
Эквивалентная масса хлороводорода равна М(HCl) = 36,5/1 = 36,5г/моль.
Тогда
а) Находим эквивалентную массу вещества:
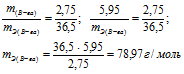
б) Находим эквивалентную массу соли:
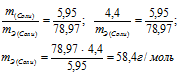
Ответ: а) 58,4г/моль; б) 78,97 г/моль.
Определение эквивалентного объема водорода
Задача № 18.
0,376г алюминия при взаимодействии с кислотой вытеснили 0,468л водорода, измеренного при нормальных условиях. Определить эквивалентный объем водорода, зная, что эквивалентная масса алюминия равна 8,99 г/моль.
Решение:
Если одно из веществ находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
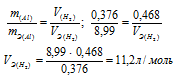
Ответ: 11,2л/моль.
чему равна эквивалентная масса гидроксида натрия
Найдите правильный ответ на вопрос ✅ «чему равна эквивалентная масса гидроксида натрия …» по предмету 📘 Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Главная » Химия » чему равна эквивалентная масса гидроксида натрия
|
Как рассчитать молярную массу эквивалентов кислоты, если (см)?Саяны 7 лет назад
Рассчитайте молярную массу эквивалентов кислоты, если на нейтрализацию 0,009 кг ее израсходовано 0,008 кг гидроксида натрия. Абдигапар более года назад Молярная масса эквивалентов гидроксида натрия NaOH определяется следующим образом: Э = М(NaOH)/n = 40/1 = 40г. Э(кис)/Э(NaOH)=m(кис)/m(NaOH) Э(кис)/40 = 9/8 Э(кис) = 9*40/8 = 45 г. Ответ: Молярная масса эквивалентов кислоты равно 45 г. комментировать
в избранное
ссылка
отблагодарить Знаете ответ? |
Закон эквивалентов
относится к Важнейшим законам, образующим
основу химии как фундаментальной науки.
Без его усвоения невозможны количественные
химические расчеты.
Основные понятия и определения.
|
Эквивалент ( |
– |
|
Эквивалентная |
– |
|
Эквивалентный |
– |
|
Закон |
– |
Пример 1.
Определите эквивалент и эквивалентные
массы элементов в соединениях НВr,
Н2О
и NН3.
Решение.
В указанных соединениях с 1 молем атомов
водорода соединяется 1 моль атомов
брома, 1/2 моля атомов кислорода и 1/3 моля
атомов азота. Следовательно, согласно
определению, эквиваленты брома, кислорода
и азота равны соответственно 1 молю, 1/2
и 1/3 моля. Исходя из мольных масс атомов
этих элементов, находим, что эквивалентная
масса брома равна
79,9 г/моль, кислорода
– 16 х 1/2 = 8 г/моль, азота – 14 x 1/3 =
= 4,67 г/моль.
Для определения
эквивалента (эквивалентной массы)
элемента необязательно исходить из его
соединения с водородом. Эквивалент
(эквивалентную массу) можно вычислить
по составу соединения данного элемента
с любым другим, эквивалент которого
известен.
Пример 2.
При соединении 5,6 г железа с серой
образовалось 8,8 г сульфида железа.
Найдите эквивалентную массу железа ЭFе
и его эквивалент, если известно, что
эквивалентная масса серы равна 16 г/моль.
Решение.
Из условия задачи следует, что в сульфиде
железа на 5,6 г железа приходится:
8,8 – 5,6 = 3,2 г серы.
Согласно закону
эквивалентов, массы взаимодействующих
веществ пропорциональны их эквивалентным
массам. Следовательно:
5,6 г железа
эквивалентны 3,2 г серы
ЭFе
г/моль
железа эквивалентны 16 г/моль серы.
Откуда ЭFе
= 5,6 x 16/3,2 = 28 г/моль.
Мольная масса
атомов железа, численно совпадающая с
его относительной молекулярной массой,
равна 56 г/моль. Поскольку эквивалентная
масса железа (28 г/моль) в два раза меньше
мольной массы его атомов, то в 1 моле
железа содержится 2 эквивалента.
Следовательно, эквивалент железа равен
1/2 моля.
На основе закона
эквивалентов можно вывести следующие
формулы для вычисления эквивалентных
масс сложных веществ:
Эоксида
= Моксида/Число
атомов элемента х валентность элемента
Экислоты=
Мкислоты/Основность
кислоты
Эоснования=Моснования/Кислотность
основания
Эсоли=Мсоли/Число
атомов металла х валентность металла,
здесь М – мольная масса соединений.
Пример 3.
Определите массу гидросульфата натрия,
образующегося при нейтрализации серной
кислотой раствора, содержащего 8 г NaOH.
Решение.
Находим эквивалентную массу гидроксида
натрия:
Э(NaOH)
= M(NaOH)/1
= 40 г/моль. Следовательно, 8 г NaOH
составляют 8/40 = 0,2 эквивалентной массы
NaOH.
Согласно закону эквивалентов, масса
образовавшейся соли также составляет
0,2 ее эквивалентной массы.
Находим эквивалентную
массу соли: NaHSО4
= M(NaHSO4)/I
=
= 120 г/моль. Масса образовавшегося
гидросульфата натрия равна 120 х 0,2 = 24 г.
При решении
некоторых задач, содержащих сведения
об объемах газообразных участников
реакции, целесообразно пользоваться
значением эквивалентного объема.
Эквивалентным
объемом называется
объем, занимаемый при данных условиях
1 эквивалентом вещества. Значение
эквивалентного объема вещества,
находящегося в газообразном состоянии,
можно найти, зная, что в мольном объеме
любого газа, состоящего из одноатомных
молекул, содержится 1 моль атомов,
состоящего из двухатомных молекул – 2
моля атомов и т. д. Так, в 22,4 л Н2
содержатся
при нормальных условиях 2 моля атомов
водорода. Поскольку эквивалент водорода
равен 1 моль, то в
22,4 л Н2
содержатся 2 эквивалента водорода;
значит, эквивалентный объем водорода
равен 22,4/2= 11,2 л/моль.
Пример 4.
Некоторое количество металла, эквивалентная
масса которого равна 28 г/моль, вытесняет
из кислоты 0,7 л водорода, измеренного
при нормальных условиях. Определите
массу металла.
Решение.
Зная, что эквивалентный объем водорода
равен 11,2 л/моль, составляем пропорцию:
28 г металла
эквивалентны 11,2 л водорода
х
г
металла
эквивалентны 0,7 л водорода
х = 0,7 x 28 / 11,2 = 1,75 г.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
