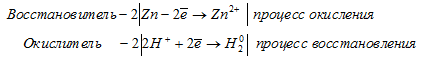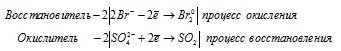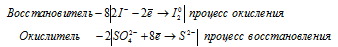При взаимодействии серной кислоты (H2SO4) со щелочью образуются соли гидросульфат калия (KHSO4) и сульфат калия (K2SO4). Вычислить эквивалент и молярные массы эквивалентов кислоты для каждого случая. Написать соответствующие уравнения реакций.
Решение задачи
Запишем уравнения реакций:
Фактор эквивалентности (fэкв) (эквивалент) – число, показывающее какая доля частицы (атома, молекулы) этого вещества равноценна одному иону водорода (H+) в реакциях обмена или одному электрону в окислительно-восстановительных реакциях.
Таким образом, эквивалент серной кислоты (H2SO4) в первой реакции равен 1 (f экв. (H2SO4) = 1), а во второй реакции эквивалент серной кислоты (H2SO4) равен 1/2 (f экв. (H2SO4) = 1/2).
Учитывая, что молярная масса серной кислоты (H2SO4) равна 98 г/моль, рассчитаем молярную массу эквивалента:
Напомню то, что молярная масса эквивалента – это масса одного моль эквивалента вещества, равная произведению фактора эквивалентности на молярную массу вещества.
Получаем:
Ответ:
эквивалент равен 1 и 1/2, молярные массы эквивалентов серной кислоты равны 98 г/моль и 49 г/моль.
Вычисление эквивалентной массы серной кислоты в химических реакциях
Задача 641.
Вычислить эквивалентную массу H2SO4 в следующих‚реакциях:
а) Zn + H2SO4(разб.) = ZnSO4 + H2;
б) 2HBr + H2SO4(конц.) = Br2 + SO2 + 2H2O;
в) HI + H2SO4(конц.) = 2I2 + H2S + 4H2O.
Решение:
M(H2SO4) = 98,66 г/моль.
а) Zn + H2SO4(разб.) = ZnSO4 + H2
Ионно-молекулярные уравнения процесса окисления-восстановления:
В данной реакции в процессе восстановления участвовало 2 электрона от молекулы H2SO4, значит, fЭ(H2SO4) = 1/2.
Тогда
МЭ(H2SO4) = М(H2SO4)/2 = 98,66/2 = 49,33 г/моль.
б) 2HBr + H2SO4(конц.) = Br2 + SO2 + 2H2O
Ионно-молекулярные уравнения процесса окисления-восстановления:
В данной реакции в процессе восстановления участвовало 2 электрона от молекулы H2SO4, значит, fЭ(H2SO4) = 1/2.
Тогда
МЭ(H2SO4) = М(H2SO4)/2 = 98,66/2 = 49,33 г/моль.
в) HI + H2SO4(конц.) = 2I2 + H2S + 4H2O
Ионно-молекулярные уравнения процесса окисления-восстановления:
В данной реакции в процессе восстановления участвовало 8 электрона от молекулы H2SO4, значит, fЭ(H2SO4) = 1/8.
Тогда
МЭ(H2SO4) = М(H2SO4)/8 = 98,66/8 = 12,3325 г/моль.
Задача 642.
Вычислить эквивалентные массы следующих восстановителей: хлорида олова (II); фосфора, если он окисляется до Н3РО4 и пероксида водорода, окисляющегося до молекулярного кислорода.
Решение:
М(SnCl2) = 189,596г/моль; M(P) = 30,973г/моль; M(H2O2) = 34г/моль.
а) Уравнение электронного баланса окисления олова (II):
Sn2+ – 2
Из уравнения следует, что атом олова в молекуле хлорида олова (II) окисляясь отдаёт 2 электрона, значит, fЭ(SnCl2) = 1/2.
Тогда эквивалентная масса хлорида олова (II) равна:
МЭ(SnCl2) = М(SnCl2)/2 = 189,596/2 = 94,798г/моль.
б) Уравнение электронного баланса окисления Р:
P0 – 5
Из уравнения следует, что атом фосфора окисляясь отдаёт 5 электронов, значит, fЭ(Р) = 1/5.
Тогда эквивалентная масса фосфора равна:
МЭ(Р) = М(Р)/5 = 30,973/5 = 6,195г/моль.
в) Уравнение электронного баланса окисления пероксида водорода:
2H2O2 -4

Из уравнения следует, что каждый атом кислорода в молекуле пероксида водорода окисляясь, отдаёт 1 электрон, т.е. молекула Н2О2 как восстановитель отдаёт 2 электрона, значит, fЭ(Н2О2) = 1/2.
Тогда эквивалентная масса Н2О2 равна:
МЭ(Н2О2) = М(Н2О2)/2 = 34/2 = 17г/моль.
Как определить эквивалент вещества
Эквивалент вещества – это условная или реальная частица, которая может высвобождать, присоединять или любым другим способом быть эквивалентна катиону водорода, участвующему в ионно-обменных реакциях, или электрону в окислительно-восстановительных реакциях. При решении задач под эквивалентом вещества подразумевают эквивалентную молярную массу вещества.

Вам понадобится
- – молярная масса;
- – валентность;
- – кислотность;
- – основность.
Инструкция
Эквивалентная масса является одной из важнейших характеристик веществ. При решении задач она обозначается как M экв. Определяется молярная масса эквивалента какого-либо соединения, исходя из химической формулы исследуемого вещества и его принадлежности к определенному классу химических соединений.
Для того чтобы успешно находить молярные массы эквивалентов, вам потребуется знать такие показатели, как молярная масса – масса одного моля вещества. Основность кислоты – количество атомов водорода, которое кислота может присоединить. Кислотность основания определяется количеством ионов OH-. Валентность – количество химических связей, которое образует атом с другими элементами в соединении.
Формула нахождения эквивалентной массы вещества зависит от того, к какому классу относится исследуемое соединение. К примеру, для нахождения эквивалента вещества у оксидов, вам будет необходимо разделить молярную массу соединения на число атомов кислорода, предварительно умноженное на два. К примеру, для оксида железа Fe2O3 эквивалентная масса будет равняться 56*2 + 16*3/3*2 = 26,7 г/моль.
Для нахождения молярной массы эквивалента вещества у основания, разделите молярную массу основания на его кислотность. Так, для основания Ca(OH)2 эквивалент будет равняться 40 + (16+2)*2/2 = 37 г/моль.
Чтобы найти эквивалент вещества для кислоты, вам будет необходимо сделать следующее действие: поделите молярную массу кислоты на ее основность. Для нахождения молярной массы эквивалента вещества серной кислоты H2SO4 разделите 1*2 + 32 + 16*4/2 = 49 г/моль.
Наконец, для нахождения эквивалента вещества соли разделите молярную массу вещества на число атомов металла, помноженное на его валентность. К примеру, молярная масса эквивалента вещества соли Al2(SO4)3 = 27*2 + (32 + 16*4)*3/1*2 = 171 г/моль.
Источники:
- определение эквивалента
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Эквиваленты и молярные массы эквивалентов
|
Элемент
или сложное |
Эквивалент |
Молярная |
|
Элемент Например, Са |
Ээл
Э |
Мэкв
М(½Ca) = 20 г/моль |
|
Кислота
Например, |
Э
Э |
Мэкв M/основность
М(½Н2S).=34 = 17 г/моль |
|
Основание
Например, |
Эосн = 1/кислотность
Э |
Мэкв
=
М[½Ca(OH)2] = 74 / 2 = 37 г/моль |
|
Соль
Например, |
Эсоли
= |
М
=
М(1/6 = 150 / 6 = 25 г/моль |
Эквивалент
и молярная масса эквивалента сложного
вещества определяются конкретной
реакцией, в которой участвует данное
вещество.
Пример
1.
Чему
равен эквивалент и молярная масса
эквивалента серной кислоты в реакциях
с раствором щелочи, если образуется:
а)
NаНSО4
и б) Nа2SО4?
Решение.
А)
В реакции с образованием гидросульфата
натрия серная кислота нейтрализуется
не полностью:
Н2SО4
+ NаОН
= NаНSO4
+ Н2О.
В
этой реакции серная кислота проявляет
основность
равную
1.
Из этого
следует, что фактор эквивалентности
этой кислоты в данной реакции равен 1.
Найдем значение эквивалента кислоты в
данной реакции:
Э
(H2SO4)
=1∙ f
= 1/основность = 1.
Найдем
значение молярной массы эквивалента
кислоты:
Мэкв
(H2SO4)
=M
∙ f
= M/основность
= 98/1 = 98 г/экв,
б)
Сульфат натрия образуется при полной
нейтрализации кислоты:
Н2SО4
+ 2NаОН
= Na2SO4
+2Н2О.
В
этой реакции основность, проявляемая
Н2SO4,
равна 2 и значение фактора эквивалентности
в этом случае равно 2.
Отсюда:
Э
(H2SO4)
=1 ∙ f
= 1/основность
= 1/2 моль,
Мэкв
(½H2SO4)
= M/основность
= 98/2= 49 г/моль.
Для
газообразных веществ удобно пользоваться
понятием молярный
объем эквивалента (Vэкв).
Молярный
объем эквивалента
представляет собой объем одного моль
эквивалентов газообразного вещества
при нормальных условиях. Размерность
молярного объема эквивалента [л/моль].
Так,
1 моль эквивалентов водорода (один моль
атомов Н) имеет массу 1 г.
Пример
2.
Используя
следствие из закона Авогадро, рассчитать
объем, занимаемый одним эквивалентом
водорода.
Решение.
1
моль молекул Н2
имеет массу 2 г и занимает объем 22,4 л, а
объем, занимаемый одним эквивалентом
водорода (одним моль атомов элемента
водорода), который имеет массу 1 г, найдем
из пропорции:
2
г Н2
→ 22,4 л
1
г Н2
→ х
л
x
= 11,2 л, т.е. Vэкв
(H)
=11,2 л/моль.
Аналогично
можно рассчитать молярный объем
эквивалента для кислорода, который
будет равен:
Vэкв
(½O)
= 5,6 л/моль.
Введение
в химию понятия «эквивалент» позволило
сформулировать закон, называемый законом
эквивалентов:
массы реагирующих друг с другом веществ
пропорциональны молярным массам их
эквивалентов.
Закон
эквивалентов можно записать в следующем
виде:
где
m1
и m2
–
массы взаимодействующих веществ; Мэкв.1
и Мэкв.2
–
молярные массы эквивалентов.
Если
вещества находятся в газообразном
состоянии, удобно пользоваться понятием
«молярный объем эквивалента» и следующей
формулировкой закона
эквивалентов:
объемы
реагирующих друг с другом газообразных
веществ пропорциональны молярным
объемам их эквивалентов.
V1/V2
= Vэкв1/Vэкв2
, где
V1
и V2
–
объемы реагирующих газообразных веществ,
Vэкв1
и Vэкв2
–
молярные объемы их эквивалентов.
Пример
3.
Выразите в молях:
а)
6,02·1021 молекул СО2;
б)
1,20·1024 атомов кислорода;
в) 2,00·1023 молекул
воды. Чему равна мольная (молярная) масса
указанных веществ?
Решение.
Моль – это количество вещества, в котором
содержится число частиц любого
определенного сорта, равное постоянной
Авогадро (6,02·1023). Отсюда
а) 6,02·1021, т.е. 0,01
моль;
б) 1,20·1024, т.е. 2 моль;
в) 2,00·1023, т.е. 1 /З
моль.
Масса моля вещества
выражается в г/моль. Мольная (молярная)
масса вещества в граммах численно равна
его относительной молекулярной (атомной)
массе, выраженной в атомных единицах
массы (а.е.м).
Так
как молекулярные массы СО2 и
Н2О
и атомная масса кислорода соответственно
равны 44, 18 и 16 а.е.м., то их мольные
(молярные) массы равны:
а) 44 г/моль;
б) 18г/моль;
в) 16 г/моль.
Пример
4.
Вычислите
значение грамм-эквивалента серной
кислоты, гидроксида кальция и сульфата
алюминия.
Решение:
ЭH2SO4 =МH2SO4 /2=98/2=49г
ЭСа(OH)2 =МСа(OH)2 /2=74/2=37г
Э
Al2(SO4)3 =
М
Al2(SO4)3 /
(2· 3) = 342 / 2= 57 г
Пример 5.
На
восстановление 7,09 г оксида двухвалентного
металла требуется 2,24 л водорода (н.у.).
Вычислите эквивалентную массу оксида
и эквивалентную массу металла. Чему
равна атомная масса металла?
Решение.
Нормальные
условия по Международной системе единиц
(СИ): давление 1,013·105 Па
(760 мм 16Т.
Ст., 1 атм), температура 273 К или 0°С.
Согласно
закону эквивалентов
m1/Мэ(1) =
m2/Мэ(2)
m(МеО)/Мэ(МеО)
= m(Н2)/Мэ(Н2)
Если
одно из веществ находится в газообразном
состоянии, то, как правило, его количество
измеряется в объемных единицах (мл, л,
м 3).
Объем,
занимаемый при данных условиях мольной
или эквивалентной массой газообразного
вещества, называется мольным или,
соответственно, эквивалентным объемом
этого вещества. Мольный объем любого
газа при н.у. равен 22,4 л. Отсюда эквивалентный
объем водорода (Vэ)
молекула которого состоит из двух
атомов, т.е. содержит два моля атомов
водорода, равен 22,4:2 = 11,2 л. Отношение
mH2 /МЭ(Н2)
заменяем
равным ему отношением VH2 /VЭ(Н2), где
VH2 –
объем водорода, VЭ(Н2) эквивалентный
объем водорода:
m(МеО)/Мэ(МеО)
= V(Н2)/Vэ(Н2)
Находим
эквивалентную массу оксида металла
МЭ(МеО)
7,09/МЭ(МеО) =
2,24/11,2; МЭ(МеО) =
7,09·11,2/2,24 = 35,45 г/моль.
Согласно
закону эквивалентов МЭ(МeO) =
МЭ(Мe) +
МЭ(O2),
отсюда
МЭ(Мe) =
МЭ(МeО) –
МЭ(O2) =
35,45 – 8 = 27,45 г/моль.
Мольная
масса металла определяется из соотношения:
МЭ =
А/В,
где:
МЭ –
эквивалентная масса, г/моль
А
– мольная масса металла, г/моль
В
– валентность элемента;
А = Мэ·В = 27,45•2 =
54,9 г/моль.
Так как атомная
масса в а.е.м. численно равна мольной
(молярной) массе, выражаемой в г/моль,
то искомая атомная масса металла 54,9
а.е.м.
Пример
6.
При
25 0С
и давлении
93 кПа. (745 мм
17Т. Ст.)
некоторое количество газа занимает
объем 152 мл. Найти, какой объем займет
это же количество газа при 00С
и давлении 101,33 кПа.
Решение.
Подставляя данные
задачи в последнее уравнение, получаем:
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Ученик
(149),
на голосовании
12 лет назад
Голосование за лучший ответ
Владимир Рогозин
Мудрец
(11728)
12 лет назад
Чтобы определить грамм-эквивалент кислоты необходимо молярную массу этой кислоты разделить на ее основность. Основность к-ты определяется количеством атомов водорода, входящих в состав к-ты.
М (H2SO4)=98г/моль
грамм-экв=98/2=49