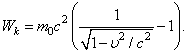From Wikipedia, the free encyclopedia
| Constant | Values | Units |
|---|---|---|
| me | 9.1093837015(28)×10−31[1] | kg |
| 5.48579909065(16)×10−4[2] | Da | |
| 0.51099895000(15) | MeV/c2 | |
| mec2 | 8.1871057769(25)×10−14 | J |
| 0.51099895000(15)[3] | MeV |
In particle physics, the electron mass (symbol: me) is the mass of a stationary electron, also known as the invariant mass of the electron. It is one of the fundamental constants of physics. It has a value of about 9.109×10−31 kilograms or about 5.486×10−4 daltons, which has an energy-equivalent of about 8.187×10−14 joules or about 0.511 MeV.[3]
Terminology[edit]
The term “rest mass” is sometimes used because in special relativity the mass of an object can be said to increase in a frame of reference that is moving relative to that object (or if the object is moving in a given frame of reference). Most practical measurements are carried out on moving electrons. If the electron is moving at a relativistic velocity, any measurement must use the correct expression for mass. Such correction becomes substantial for electrons accelerated by voltages of over 100 kV.
For example, the relativistic expression for the total energy, E, of an electron moving at speed v is
where
- c is the speed of light;
- γ is the Lorentz factor,
- me is the “rest mass”, or more simply just the “mass” of the electron.
This quantity me is frame invariant and velocity independent. However, some texts[which?] group the Lorentz factor with the mass factor to define a new quantity called the relativistic mass, mrelativistic = γme.[citation needed]
Determination[edit]
Since the electron mass determines a number of observed effects in atomic physics, there are potentially many ways to determine its mass from an experiment, if the values of other physical constants are already considered known.
Historically, the mass of the electron was determined directly from combining two measurements. The mass-to-charge ratio of the electron was first estimated by Arthur Schuster in 1890 by measuring the deflection of “cathode rays” due to a known magnetic field in a cathode ray tube. Seven years later J. J. Thomson showed that cathode rays consist of streams of particles, to be called electrons, and made more precise measurements of their mass-to-charge ratio again using a cathode ray tube.
The second measurement was of the charge of the electron. This was determined with a precision of better than 1% by Robert A. Millikan in his oil drop experiment in 1909. Together with the mass-to-charge ratio, the electron mass was determined with reasonable precision. The value of mass that was found for the electron was initially met with surprise by physicists, since it was so small (less than 0.1%) compared to the known mass of a hydrogen atom.
The electron rest mass can be calculated from the Rydberg constant R∞ and the fine-structure constant α obtained through spectroscopic measurements. Using the definition of the Rydberg constant:
thus
where c is the speed of light and h is the Planck constant.[4] The relative uncertainty, 5×10−8 in the 2006 CODATA recommended value,[5] is due entirely to the uncertainty in the value of the Planck constant. With the re-definition of kilogram in 2019, there is no uncertainty by definition left in Planck constant anymore.
The electron relative atomic mass can be measured directly in a Penning trap. It can also be inferred from the spectra of antiprotonic helium atoms (helium atoms where one of the electrons has been replaced by an antiproton) or from measurements of the electron g-factor in the hydrogenic ions 12C5+ or 16O7+.
The electron relative atomic mass is an adjusted parameter in the CODATA set of fundamental physical constants, while the electron rest mass in kilograms is calculated from the values of the Planck constant, the fine-structure constant and the Rydberg constant, as detailed above.[4][5]
Relationship to other physical constants[edit]
The electron mass is used to calculate[citation needed] the Avogadro constant NA:
Hence it is also related to the atomic mass constant mu:
where
- Mu is the molar mass constant (defined in SI);
- Ar(e) is a directly measured quantity, the relative atomic mass of the electron.
Note that mu is defined in terms of Ar(e), and not the other way round, and so the name “electron mass in atomic mass units” for Ar(e) involves a circular definition (at least in terms of practical measurements).
The electron relative atomic mass also enters into the calculation of all other relative atomic masses. By convention, relative atomic masses are quoted for neutral atoms, but the actual measurements are made on positive ions, either in a mass spectrometer or a Penning trap. Hence the mass of the electrons must be added back on to the measured values before tabulation. A correction must also be made for the mass equivalent of the binding energy Eb. Taking the simplest case of complete ionization of all electrons, for a nuclide X of atomic number Z,[4]
As relative atomic masses are measured as ratios of masses, the corrections must be applied to both ions: the uncertainties in the corrections are negligible, as illustrated below for hydrogen 1 and oxygen 16.
| Physical parameter | 1H | 16O |
|---|---|---|
| relative atomic mass of the XZ+ ion | 1.00727646677(10) | 15.99052817445(18) |
| relative atomic mass of the Z electrons | 0.00054857990943(23) | 0.0043886392754(18) |
| correction for the binding energy | −0.0000000145985 | −0.0000021941559 |
| relative atomic mass of the neutral atom | 1.00782503207(10) | 15.99491461957(18) |
The principle can be shown by the determination of the electron relative atomic mass by Farnham et al. at the University of Washington (1995).[6] It involves the measurement of the frequencies of the cyclotron radiation emitted by electrons and by 12C6+ ions in a Penning trap. The ratio of the two frequencies is equal to six times the inverse ratio of the masses of the two particles (the heavier the particle, the lower the frequency of the cyclotron radiation; the higher the charge on the particle, the higher the frequency):
As the relative atomic mass of 12C6+ ions is very nearly 12, the ratio of frequencies can be used to calculate a first approximation to Ar(e), 5.4863037178×10−4. This approximate value is then used to calculate a first approximation to Ar(12C6+), knowing that 
References[edit]
- ^ “2018 CODATA Value: electron mass”. The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2019-05-20.
- ^ “2018 CODATA Value: electron mass in u”. The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2020-06-21.
- ^ a b “2018 CODATA Value: electron mass energy equivalent in MeV”. The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2022-07-11.
- ^ a b c “CODATA Value: electron mass”. The NIST Reference on Constants, Units and Uncertainty. May 20, 2019. Retrieved May 20, 2019.
- ^ a b The NIST reference on Constants, Units, and Uncertainty, National Institute of Standards and Technology, 10 June 2009
- ^ Farnham, D. L.; Van Dyck Jr., R. S.; Schwinberg, P. B. (1995), “Determination of the Electron’s Atomic Mass and the Proton/Electron Mass Ratio via Penning Trap Mass Spectroscopy”, Phys. Rev. Lett., 75 (20): 3598–3601, Bibcode:1995PhRvL..75.3598F, doi:10.1103/PhysRevLett.75.3598, PMID 10059680
Электрон — это стабильная отрицательно заряженная элементарная частица.
Электроны играют важную роль почти во всех физических эффектах. Поскольку электроны несут заряд, они также генерируют электрическое поле. Если привести электрон в движение, то возникнет магнитное поле. Если электрон проходит через другое внешнее электрическое поле, его путь изменяется под действием силы Лоренца.
Электрон принадлежит к лептонному семейству частиц. Существует несколько различных семейств частиц, перечисленных в стандартной модели физики частиц.
Спин электрона и магнитный момент электрона.
Согласно современному уровню знаний, лептоны являются элементарными частицами. По сравнению с другими лептонами, электрон имеет самую низкую массу среди лептонов, несущих заряд. Он принадлежит к первому поколению лептонов. Второе и третье поколения — мюон и тауон. Эти две частицы имеют одинаковые с электроном заряды и спин, но отличаются от него большей массой.
Лептоны отличаются от других фундаментальных частиц, таких как кварки, отсутствием сильного взаимодействия. Все лептоны принадлежат к семейству фермионов, поэтому электрон имеет собственный вращательный момент ( спин ) s = ½ в единицах ℏ, где ℏ — приведённая постоянная Планка).
« Как и любая заряженная частица со спином, электрон обладает магнитным моментом, причём магнитный момент делится на нормальную часть и аномальный магнитный момент (добавка примерно 0,116 %). Магнитный момент электрона μe = -9,2847647043(28)⋅10−24 Дж/Тл. »
Википедия
Атомы и молекулы.
Электроны связаны с ядрами атомов «притягивающей» кулоновской силой. Такой состав из атомного ядра и одного или нескольких электронов называется атомом. Электроны движутся вокруг ядра атома. Если число электронов отличается от заряда ядра, то это ион.
Волновая природа связанных электронов описывается атомными орбиталями. Каждая из этих орбиталей имеет ряд квантовых чисел, таких как энергия и момент. Кроме того, у атома может быть только дискретное число орбиталей. В силу принципа Паули на орбитали может находиться максимум два электрона, спин которых имеет разные знаки.
Химическая связь между атомами возникает благодаря электромагнитным взаимодействиям, которые описываются с помощью квантовой физики. Самые прочные связи создаются путем обмена или передачи электронов. Это позволяет образовывать молекулы. В молекулах электроны движутся аналогично атомам и занимают молекулярные орбитали. Однако фундаментальным отличием является образование пар электронов с разными спинами. Это позволяет нескольким электронам занимать одну орбиталь без нарушения принципа Паули.
Делимость электрического заряда
Хорошо известно, что молекулы и атомы в их нормальном состоянии не имеют электрического заряда. Поэтому мы не можем объяснить электризацию их движением. Однако если мы предположим, что частицы с электрическим зарядом существуют в природе, то мы должны обнаружить, что существует предел деления электрического заряда.
Согласно различным экспериментам, проведенным советским ученым Абрамом Федоровичем Иоффе и американским ученым Робертом Милликеном, было обнаружено, что существует заряженная частица с минимальным зарядом, который невозможно разделить.
В своих экспериментах они электризовали маленькие частицы цинковой пыли. Заряд пылинок меняли и вычисляли. Это было проделано несколько раз. При этом заряд оказывался каждый раз другим. Однако все изменения были кратны целому числу, большему, чем некоторый минимальный заряд (т.е. 2, 3, 4 и т.д.). Этот результат можно интерпретировать только следующим образом. Только наименьший заряд (или целое число таких зарядов) присоединяется к пылинке цинка или отсоединяется от нее. Этот заряд дальше уже не делится. Частица с наименьшим зарядом называется электроном.
Также в ходе опытов было установлено, что любая частица вещества либо электрически нейтральна, либо имеет заряд, кратный по модулю заряду электрона.
Свойства электрона
Электрон характеризуется и другими важными свойствами, помимо спина и магнитного момента. Рассмотрим их.
Масса электрона
Электроны очень малы. Масса электрона составляет me = 9,109 • 10-31 кг или 5, 489 • 10-4 атомных единиц массы (а. е. м). Эта масса примерно в 3700 раз меньше массы молекулы водорода, которая является самой маленькой из всех молекул. Из-за эквивалентности массы и энергии в соответствии с принципом относительности это приводит к энергии покоя 0,511 МэВ (мегаэлектронвольт).
Отношение массы протона к массе электрона равно 1836, то есть протон в 1836 раз «тяжелее» электрона.
Заряд электрона
Электрический заряд — одно из основных свойств электрона. Невозможно представить, что с электронов можно снять заряд. Они неотделимы друг от друга.
Электрический заряд — это физическая величина. Она обозначается буквой q. Единицей электрического заряда является кулон (Кл). Эта единица названа в честь французского физика Шарля Кулона. Электрон — это частица с наименьшим отрицательным зарядом. Его заряд равен e0 = — 1,6 • 10-19 Кл.
Модуль заряда электрона назвали элементарным электрическим зарядом. Его обозначают е. Измерения показали, что e = 1,6 • 1019 Кл.
Обратите внимание, что любой, даже самый малый, заряд тела содержит целое число элементарных зарядов. Так как заряд тела обозначается буквой q, то получаем: q = eN, где N — целое число (N = 1, 2, 3, … ).
Элементарный заряд может показаться очень малым, однако вспомним: в любом теле, видимом невооружённым глазом, содержится невообразимо большое число заряженных частиц. Так, суммарный заряд электронов в одной столовой ложке воды равен по модулю примерно миллиону кулонов (а вы уже знаете, как велик заряд всего в 1 Кл).
Важно! Термин элементарный заряд был придуман, когда предположили, что этот заряд является наименьшим электрическим зарядом в природе. Сегодня мы знаем, что 1/3 элементарного заряда также приходится на кварки.
Энергия покоя электрона
Энергия электрона рассчитывается из эквивалентности массы и энергии. Вы знаете это как формулу из теории относительности E=mc2. E означает энергию, m — массу, а c — скорость света. Как было уже сказано выше в этой статье: «из-за эквивалентности массы и энергии в соответствии с принципом относительности это приводит к энергии покоя 0,511 МэВ (мегаэлектронвольт)».
В формуле это можно рассчитать следующим образом: E = mec2 = 9,109 • 10-31 • (3 • 108 )2 = 8,2 • 10-14 Дж = 0,511 • 106 эВ ≈ 0,511 МэВ
Список литературы
Список литературы
- Тихомирова С. А., Яворский Б. М. Физика (базовый уровень) – М.: Мнемозина, 2012.
- Перышкин А. В. Физика 8. – М.: Дрофа, 2010.
- Бронштейн М. П. Атомы и электроны. — М.: Наука. — 1980. — 152 с., Библиотечка «Квант», вып. 1. Тир. 150000 экз.
Масса электрона — стабильная, отрицательно заряженная элементарная частица. Является фермионом (то есть имеет полуцелый спин).
[Кг]
Название «электрон» происходит от греческого слова, которое означает «янтарь». Еще в глубокой древней Греции естествоиспытателями проводились эксперименты — куски янтаря тёрли шерстью, после чего те начинали притягивать к себе мелкие предметы, такие как : мелкие бумажки, песчинки. Открытие электрона, как частицы принадлежит Э. Вихерту и Дж. Дж. Томсону, который в 1897 установил, что отношение заряда к массе для катодных лучей не зависит от материала источника.
В формуле мы использовали :
— Масса электрона
Согласно специальной теории относительности, масса тела увеличивается при увеличении скорости. Формула для вычисления этой массы выглядит так:
m = m0 / квадратный корень из(1 – v^2/c^2)
где m0 – “неподвижная” (инвариантная) масса тела, v – скорость тела относительно наблюдателя, c – скорость света.
В данном случае нужно найти массу электрона, относительно земли, при движении со скоростью 0,9с внутри корабля, который движется относительно земли со скоростью 0,8с.
Находим сначала относительную скорость электрона относительно земли:
v1 = v – v0 = 0,9c – 0,8c = 0,1c
Теперь можем вычислить массу электрона, используя формулу:
m = m0 / квадратный корень из(1 – (v1/c)^2) = m0 / кв.корень(1 – 0.01) = 1.005 m0
Таким образом, масса электрона при движении со скоростью 0,9с внутри корабля, который движется относительно земли со скоростью 0,8с, увеличивается на 0,5%.
Это 1, второе в комментариях напишу
Имя ФамилиюПрофи (565)
3 недели назад
v = 0,4с – 0,7с = -0,3с
s = vt = -0,3с * t
s = 0,7с * t
0,7с * t = -0,3с * t
t = 0
Ответ: время, прошедшее на первом корабле до того момента, когда его догонит второй корабль, равно 2 годам.
Имя ФамилиюПрофи (565)
3 недели назад
По формуле для специальной теории относительности:
Δt’ = Δt / √(1 – v²/c²),
где
Δt’ – разница времени на зонде,
Δt – разница времени на Земле,
v – скорость зонда,
c – скорость света.
Подставляем значения:
1 = Δt / √(1 – (61500 км/ч)²/(299792 км/с)²)
Решаем уравнение относительно Δt:
Δt = √(1 – (61500 км/ч)²/(299792 км/с)²)
Δt ≈ 0,9999999984310559
Чтобы это произошло, зонд должен находиться в полёте примерно 1 год.
В опыте по измерению массы электрона с помощью масс-спектрографа на фотопластинке обнаруживается только одна полоска. Так как заряд каждого электрона равен одному элементарному заряду, мы приходим к заключению, что все электроны обладают одной и той же массой.
Масса, однако, оказывается непостоянной. Она растет при увеличении разности потенциалов
, ускоряющей электроны в масс-спектрографе (рис. 351), Так как кинетическая энергия электрона
прямо пропорциональна ускоряющей разности потенциалов
, то отсюда следует, что масса электрона растет с его кинетической энергией. Опыты приводят к следующей зависимости массы от энергии:
, (199.1)
где
— масса электрона, обладающего кинетической энергией
,
— постоянная величина,
— скорость света в вакууме
. Из формулы (199.1) вытекает, что масса покоящегося электрона (т. е. электрона с кинетической энергией
) равна
. Величина
получила поэтому название массы покоя электрона.
Измерения с различными источниками электронов (газовый разряд, термоэлектронная эмиссия, фотоэлектронная эмиссия и др.) приводят к совпадающим значениям массы покоя электрона. Масса эта оказывается крайне малой:
Таким образом, электрон (покоящийся или медленно движущийся) почти в две тысячи раз легче атома легчайшего вещества — водорода.
Величина
в формуле (199.1) представляет собой добавочную массу электрона, обусловленную его движением. Пока эта добавка мала, можно при вычислении кинетической энергии приближенно заменить
на
, и положить
. Тогда
отсюда видно, что наше предположение о малости добавочной массы по сравнению с массой покоя
равносильно условию, что скорость электрона много меньше скорости света
. Напротив, когда скорость электрона приближается к скорости света, добавочная масса становится большой.
Альберт Эйнштейн (1879—1955) в теории относительности (1905 г.) теоретически обосновал соотношение (199.1). Он доказал, что оно применимо не только к электронам, но и к любым частицам или телам без исключения, причем под
нужно понимать массу покоя рассматриваемой частицы или тела. Выводы Эйнштейна были проверены в дальнейшем в разнообразных опытах и полностью подтвердились. Теоретическая формула Эйнштейна, выражающая зависимость массы от скорости, имеет вид
(199.2)
Таким образом, масса любого тела возрастает при увеличении его кинетической энергии или скорости. Однако, как и для электрона, добавочная масса, обусловленная движением, заметна только тогда, когда скорость движения приближается к скорости света. Сравнивая выражения (199.1) и (199.2), получим формулу для кинетической энергии движущегося тела, учитывающую зависимость массы от скорости:
(199.3)
В релятивистской механике, (т. е. механике, основанной на теории относительности) так же как и в классической, импульс тела определяется как произведение его массы на скорость. Однако теперь масса сама зависит от скорости (см. (196.2)}, и релятивистское выражение для импульса имеет вид
(199.4)
В механике Ньютона масса тела считается величиной постоянной, не зависящей от его движения. Это означает, что ньютонова механика (точнее, 2-й закон Ньютона) применима только к движениям тел со скоростями очень малыми по сравнению со скоростью света. Скорость света колоссальна; при движении земных или небесных тел всегда выполняется условие
, и масса тела практически неотличима от его массы покоя. Выражения для кинетической энергии и импульса (199.3) и (199.4) при
переходят в соответствующие формулы для классической механики (см. упражнение 11 в конце главы).
Ввиду этого при рассмотрении движения таких тел можно и нужно пользоваться механикой Ньютона.
Иначе обстоит дело в мире мельчайших частиц вещества — электронов, атомов. Здесь нередко приходится сталкиваться с быстрыми движениями, когда скорость частицы уже не мала по сравнению со скоростью света. В этих случаях механика Ньютона неприменима и нужно пользоваться более точной, но и более сложной механикой Эйнштейна; зависимость массы частицы от ее скорости (энергии) — один из важных выводов этой новой механики.
Другим характерным выводом релятивистской механики Эйнштейна является заключение о невозможности движения тел со скоростью, большей скорости света в вакууме. Скорость света является предельной скоростью движения тел.
Существование предельной скорости движения тел можно рассматривать как следствие возрастания массы со скоростью: чем больше скорость, тем тяжелее тело и тем труднее дальнейшее увеличение скорости (так как ускорение уменьшается с увеличением массы).