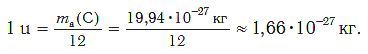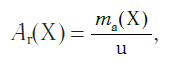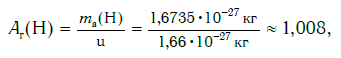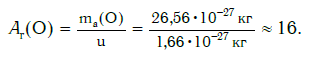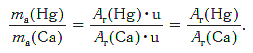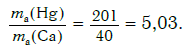Как найти массу элемента
Масса химического элемента – масса молекулы какого-либо химического элемента, которая выражается в единицах атомной массы.Чтобы найти массу элемента, не потребуется больших умственных усилий.
Инструкция
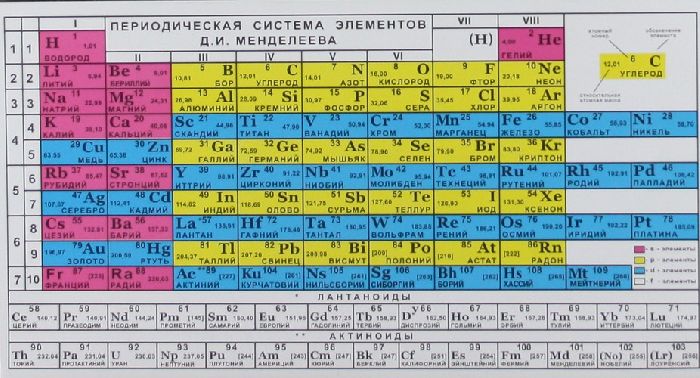
Прежде чем приступить к нахождению массы элемента, необходимо обзавестись периодической таблицей химических элементов Менделеева. Она представляет собой упорядоченную таблицу-схему, в которой каждому химическому элементу присвоено свое место.
Имея на руках таблицу Менделеева, надо обратить внимание на нижний левый угол ячейки, которая определена для каждого элемента отдельно. Это и есть масса элемента. Все элементы в этой таблице распределены по мере увеличения их масс.
Чаще всего требуется найти не массу какого-то элемента, а молекулярную массу какого-либо вещества. Это связано с тем, что массу молекулы какого либо вещества хоть и не очень сложно найти, но гораздо труднее, нежели массу одного элемента.
Для большей наглядности можно рассмотреть пример:
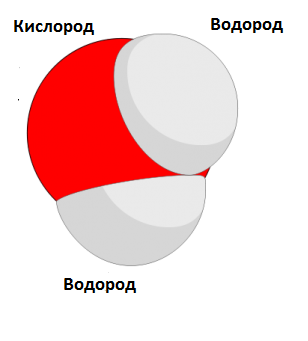
Требуется найти молекулярную массу воды. Это означает, что в данной задаче необходимо найти молекулярную массу одной молекулы воды. Химическая формула воды H2O, откуда становится видно, что одна молекула воды содержит в себе молекулу кислорода и две молекулы водорода. Тогда, изучив таблицу Менделеева, найти молекулярную массу воды не составит труда:
M = 2*1 + 16 = 18 а.е.м. (атомных единиц массы)
Видео по теме
Обратите внимание
Интересно отметить, что понятие “атомная единица массы” ввел в обиход Джон Дальтон в 1803 году. Тогда химики всего мира опирались на утверждение о том, что за единицу атомной массы принималась масса одной молекулы водорода, равная 1.
В 1906 году была принята кислородная шкала, согласно которой единица атомной массы была равна 1/16 атомной массы кислорода.
В настоящий момент принята к использованию углеродная шкала.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
В уроке 2 «Относительная атомная масса химических элементов» из курса «Химия для чайников» рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается.
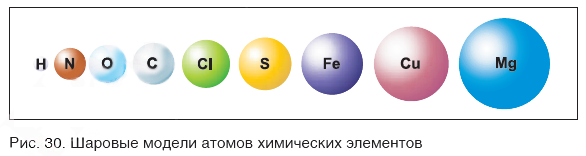
Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.
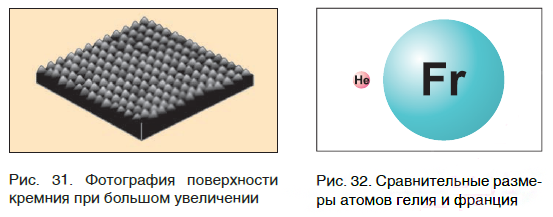
На заметку: В конце XX в. у ученых появились более совершенные микроскопы, позволяющие достигать увеличения в несколько десятков миллионов раз. Они называются туннельными микроскопами. На рисунке 31 показана фотография поверхности кремния. На ней отчетливо видны отдельные атомы, расположенные на поверхности этого вещества.
Размеры и масса атомов
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода. Его масса равна 0,0000000000000000000000000016735 кг. Самым маленьким является атом гелия He. Диаметр этого атома равен приблизительно 0,00000000098 м. Записывать и читать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10−27 кг и 9,8·10−10 м. Атомы большинства химических элементов по своим размерам значительно больше атома гелия. Самый большой из них — атом элемента франция Fr. Его диаметр в 7 раз больше диаметра атома гелия (рис. 32).
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом ma и выражается в единицах массы СИ (кг). Так, например, масса атома углерода равна: ma(С) = 19,94·10−27 кг, а атома кислорода — ma(О) = 26,56·10−27 кг. Масса атома самого тяжелого из существующих на Земле элементов — урана U — почти в 237 раз больше массы атома водорода.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.
В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода (рис. 33). Она получила название атомной единицы массы (а. е. м.). Ее международное обозначение — u (от английского слова «unit» — единица):
Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10−27 кг.
Относительная атомная масса
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента — это физическая величина, которая показывает, во сколько раз масса атома данного химического элемента больше 1/12 части массы атома углерода.
Относительная атомная масса обозначается символами Ar (А — первая буква английского слова «atomic» —атомный, r — первая буква английского слова «relative», что значит относительный), следовательно:
где Х — символ данного элемента.
Например, относительная атомная масса водорода:
а кислорода:
Как видите, относительная атомная масса показывает, во сколько раз масса атома данного элемента больше атомной единицы массы u.
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными до целых значениями этих величин (см. урок 1).
Внимание! Очень часто относительную атомную массу называют просто атомной массой. Однако следует отличать атомную массу — величину относительную (например, Ar(О) = 16) — от массы атома — величины, выражаемой в единицах массы — килограммах (ma(O) = 26,56·10−27 кг) или атомных единицах массы (ma(O) = 16·u).
Пример. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны: Ar(Hg) = 201 и Ar(Ca) = 40.
Масса атома ртути равна: ma(Hg) = Ar(Hg)·u (кг).
Масса атома кальция равна: ma(Са) = Ar(Са)·u (кг).
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс. Следовательно, отношение масс атомов ртути и кальция равно:
Ответ: в 5,03 раза.
Краткие выводы урока:
- Атомная единица массы представляет собой 1/12 часть массы атома углерода.
- Относительная атомная масса химического элемента равна отношению массы его атома к 1/12 части массы атома углерода.
- Относительная атомная масса химического элемента является величиной безразмерной и показывает, во сколько раз масса атома данного элемента больше атомной единицы массы.
Надеюсь урок 2 «Относительная атомная масса химических элементов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Исторически сначала был открыт закон Дальтона (закон кратных отношений) – что элементы вступают в реакции всегда в строго определённом весовом соотношении. Это позволило составить таблицу относительных атомных масс. Было найдено, что наименьшая атомная масса – у водорода, а массы всех прочих кратны ей, поэтому массы атомов всех остальных элементов стали выражать через массу атома водорода. Собсно, именно это утверждение и составляет суть упомянутого метода Конницаро.
Но это ещё никак не говорило о том, чему же равна масса атома водорода “в граммах”. То есть не существовало абсолютной единицы атомной массы.
Способ к определению этой единицы появился с открытием закона Авогадро (это произошло вскоре после открытия Дальтона): в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул. Вскоре этот закон был распространён и на остальные вещества. Так появилось понятие моля и молярной массы, поэтому всё, что осталось, – это определить точное значение числа Авогадро (сущий пустяк…).
Путь к численному определению яисла Авогадро, а значит, и к определению “истинной массы” атома, открыл закон Фарадея для электролиза: на выделение 1 моля вещества при электролизе требуется заряд, пропорциональный “постоянной Фарадея” (коэффициент пропорциональности – валентность элемента, выделяемого при электролизе). Как только в конце 19 века Милликену удалось непосредственно измерить заряд электрона, по величине этого заряда и по значению постоянной Фарадея удалось вычислить значение числа Авогадро, а значит – вычислить и “атомную единицу массы”, массу одного атома водорода (сейчас у 1 а.е.м несколько другое определение, но оно связано чисто с методологией измерения, обеспечивающей максимальную точность и воспроизводимость, а не с природой оной массы).
Справедливости ради стоит отметить, что ещё до определения заряда электрона значение числа Авогадро определил австрийский физик Й. Лошмидт (“число Лошмидта” иногда используется и по сей день). Он, на основе газокинетической теории газов, сумел определить число молекул газа в 1 см³, откуда враз вычисляется число Авогадро. Но определение через заряд электрона и постоянную Фарадея оказалось более точным.
А масс-спектрометры – это уже совсем другая история…
Относительная атомная и молекулярная массы

4.6
Средняя оценка: 4.6
Всего получено оценок: 1211.
4.6
Средняя оценка: 4.6
Всего получено оценок: 1211.
Для измерения массы атома используется относительная атомная масса, которая выражается в атомных единицах массы (а. е. м.). Относительная молекулярная масса складывается из относительных атомных масс веществ.
Понятия
Для осознания, что такое относительная атомная масса в химии, следует понимать, что абсолютная масса атома слишком мала, чтобы выражать её в граммах, а тем более в килограммах. Поэтому в современной химии за атомную единицу массы (а. е. м.) взята 1/12 часть массы углерода. Относительная атомная масса равна отношению абсолютной массы к 1/12 абсолютной массы углерода. Другими словами относительная масса отражает, во сколько раз масса атома конкретного вещества превышает 1/12 массы атома углерода. Например, относительная масса азота – 14, т.е. атом азота содержит 14 а. е. м. или в 14 раз больше, чем 1/12 часть атома углерода.
Среди всех элементов водород самый лёгкий, его масса равна 1 единице. Самые тяжёлые атомы имеют массу в 300 а. е. м.
Молекулярная масса – значение, показывающее, во сколько раз масса молекулы превышает 1/12 часть массы углерода. Также выражается в а. е. м. Масса молекулы складывается из массы атомов, поэтому для вычисления относительной молекулярной массы необходимо сложить значения масс атомов вещества. Например, относительная молекулярная масса воды равна 18. Это значение складывается из относительных атомных масс двух атомов водорода (2) и одного атома кислорода (16).
Как видно, эти два понятия имеют несколько общих характеристик:
- относительная атомная и молекулярная массы вещества – безразмерные величины;
- относительная атомная масса имеет обозначение Ar, молекулярная – Mr;
- единица измерения одинакова в обоих случаях – а. е. м.
Молярная и молекулярная массы совпадают численно, но отличаются по размерности. Молярная масса – это отношение массы вещества к количеству молей. Она отражает массу одного моля, который равен числу Авогадро, т.е. 6,02 ⋅ 1023. Например, 1 моль воды весит 18 г/моль, а Mr(Н2О) = 18 а. е. м. (тяжелее в 18 раз одной атомной единицы массы).
Как рассчитать
Чтобы выразить относительную атомную массу математически, следует определить, что 1/2 часть углерода или одна атомная единица массы равна 1,66⋅10−24 г. Следовательно, формула относительной атомной массы имеет следующий вид:
Ar(X) = ma(X) / 1,66⋅10−24,
где ma – абсолютная атомная масса вещества.
Относительная атомная масса химических элементов указана в периодической таблице Менделеева, поэтому её не нужно рассчитывать самостоятельно при решении задач. Относительные атомные массы принято округлять до целых. Исключение составляет хлор. Масса его атомов равна 35,5.
Следует обратить внимание, что при расчёте относительной атомной массы элементов, имеющих изотопы, учитывается их среднее значение. Атомная масса в этом случае высчитывается следующим образом:
Ar = ΣAr,ini,
где Ar,i – относительная атомная масса изотопов, ni – содержание изотопов в природных смесях.
Например, кислород имеет три изотопа – 16О,17О, 18О. Их относительная масса равна 15,995, 16,999, 17,999, а их содержание в природных смесях – 99,759 %, 0,037 %, 0,204 % соответственно. Поделив проценты на 100 и подставив значения, получим:
Ar = 15,995 ∙ 0,99759 + 16,999 ∙ 0,00037 + 17,999 ∙ 0,00204 = 15,999 а.е.м.
Обратившись к периодической таблице, легко найти это значение в клетке кислорода.
Относительная молекулярная масса – сумма масс атомов вещества:
Mr = ΣAr.
При определении значения относительной молекулярной массы учитываются индексы символов. Например, вычисление массы H2CO3 выглядит следующим образом:
Mr = 1 ∙ 2 + 12 + 16 ∙ 3 = 62 а. е. м.
Зная относительную молекулярную массу, можно вычислить относительную плотность одного газа по второму, т.е. определить, во сколько раз одно газообразное вещество тяжелее второго. Для этого используется уравнение D(y)x = Mr(х) / Mr(y).
Что мы узнали?
Из урока 8 класса узнали об относительной атомной и молекулярной массе. За единицу относительной атомной массы принята 1/12 часть массы углерода, равная 1,66⋅10−24 г. Для вычисления массы необходимо абсолютную атомную массу вещества разделить на атомную единицу массы (а. е. м.). Значение относительной атомной массы указано в периодической системе Менделеева в каждой клетке элемента. Молекулярная масса вещества складывается из суммы относительных атомных масс элементов.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Александр Котков
10/10
-
Захар Харитонов
10/10
-
Александр Котков
10/10
-
Евгения Медникова
10/10
-
Александр Котков
10/10
-
Сергей Ефремов
9/10
-
Сергей Макаров
10/10
-
Вася Загайнов
9/10
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 1211.
А какая ваша оценка?