Как найти массу элемента
Масса химического элемента – масса молекулы какого-либо химического элемента, которая выражается в единицах атомной массы.Чтобы найти массу элемента, не потребуется больших умственных усилий.
Инструкция
Прежде чем приступить к нахождению массы элемента, необходимо обзавестись периодической таблицей химических элементов Менделеева. Она представляет собой упорядоченную таблицу-схему, в которой каждому химическому элементу присвоено свое место.
Имея на руках таблицу Менделеева, надо обратить внимание на нижний левый угол ячейки, которая определена для каждого элемента отдельно. Это и есть масса элемента. Все элементы в этой таблице распределены по мере увеличения их масс.
Чаще всего требуется найти не массу какого-то элемента, а молекулярную массу какого-либо вещества. Это связано с тем, что массу молекулы какого либо вещества хоть и не очень сложно найти, но гораздо труднее, нежели массу одного элемента.
Для большей наглядности можно рассмотреть пример:
Требуется найти молекулярную массу воды. Это означает, что в данной задаче необходимо найти молекулярную массу одной молекулы воды. Химическая формула воды H2O, откуда становится видно, что одна молекула воды содержит в себе молекулу кислорода и две молекулы водорода. Тогда, изучив таблицу Менделеева, найти молекулярную массу воды не составит труда:
M = 2*1 + 16 = 18 а.е.м. (атомных единиц массы)
Видео по теме
Обратите внимание
Интересно отметить, что понятие “атомная единица массы” ввел в обиход Джон Дальтон в 1803 году. Тогда химики всего мира опирались на утверждение о том, что за единицу атомной массы принималась масса одной молекулы водорода, равная 1.
В 1906 году была принята кислородная шкала, согласно которой единица атомной массы была равна 1/16 атомной массы кислорода.
В настоящий момент принята к использованию углеродная шкала.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
В уроке 7 «Относительная молекулярная и относительная формульная массы» из курса «Химия для чайников» научимся вычислять относительную молекулярную массу, а также относительную формульную массу веществ; кроме того, выясним что такое массовая доля и приведем формулу для ее вычисления. Напоминаю, что в прошлом уроке «Валентность» мы дадим определение валентности, научились ее определять; рассмотрели элементы с постоянной и переменной валентностью, кроме того научились составлять химические формулы по валентности.

Каждый химический элемент характеризуется определенным значением относительной атомной массы. Состав любого вещества выражается молекулярной или простейшей формулой его структурной единицы. Такая структурная единица состоит из определенного числа атомов химических элементов. Поэтому масса структурной единицы может быть выражена в атомных единицах массы.
Содержание
- Относительная молекулярная масса
- Относительная формульная масса
- Вычисление массовой доли химического элемента по формуле вещества
Относительная молекулярная масса
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Mr.
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды H2O:
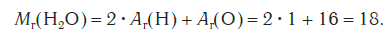
Относительная молекулярная масса серной кислоты H2SO4:

Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными. Значение Мr показывает, во сколько раз масса молекулы данного вещества больше атомной единицы массы u. Например, если Mr(H2O) = 18, это значит, что масса молекулы H2O в 18 раз больше 1/12 части массы атома углерода, т. е. в 18 раз больше атомной единицы массы. Соответственно, масса молекулы H2SO4 в 98 раз больше 1/12 части массы атома углерода.
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr. При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:
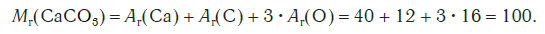
Относительная формульная масса вещества Al2(SO4)3 равна:
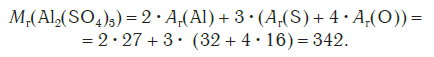
Относительная формульная масса показывает, во сколько раз масса формульной единицы данного вещества больше 1/12 части массы атома углерода, или атомной единицы массы u.
Вычисление массовой доли химического элемента по формуле вещества
По формуле вещества можно рассчитать массовую долю атомов каждого химического элемента, который входит в состав этого вещества, т. е. определить, какую часть от общей массы вещества составляет масса атомов данного элемента.
Массовая доля (w) атомов химического элемента в веществе показывает, какая часть относительной молекулярной (формульной) массы вещества приходится на атомы данного элемента.
Массовая доля атомов элемента А в сложном веществе АxBy рассчитывается по формуле:
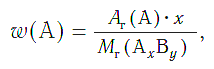
где w («дубль-вэ») — массовая доля элемента А;
Ar(А) — относительная атомная масса элемента А;
х, у — числа атомов элементов А и В в формуле вещества;
Mr(АхBy) — относительная молекулярная (формульная) масса вещества АхBy.
Массовые доли выражаются в долях единицы или в процентах.
Пример. Определите массовые доли элементов в фосфорной кислоте H3PO4
Спойлер

[свернуть]
Краткие выводы урока:
- Относительная молекулярная (формульная) масса вещества — это физическая величина, равная отношению массы молекулы (формульной единицы) вещества к 1/12 части массы атома углерода.
- Эта величина равна сумме относительных атомных масс химических элементов, входящих в состав молекулы (формульной единицы) данного вещества, с учетом числа атомов каждого элемента.
Надеюсь урок 7 «Относительная молекулярная и относительная формульная массы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
1
При данном в условии задачи объеме и плотности вычисляйте массу следующим образом: m = V*p, где m – масса, V – объем, p – плотность.
2
В других случаях рассчитывайте массу так: m = n*M, где m – масса, n – количество вещества, M – молярная масса. Молярную массу не трудно подсчитать, для этого нужно сложить все атомные массы простых веществ, входящих в состав сложного (атомные массы указаны в таблице Д.И. Менделеева по обозначение элемента).
3
Выражайте значение массы из формулы массовой доли вещества: w = m(x)*100%/m, где w – массовая доля вещества, m(x) – масса вещества, m – масса раствора, в котором растворено данное вещество. Чтобы найти массу вещества необходимо: m(x) = w*m/100%.
4
Из формулы выхода продукта вычисляйте нужную вам массу: выход продукта = mp(x)*100%/m(x), где mp(x) – масса продукта x, полученного в реальном процессе, m(x) – рассчитанная масса вещества x. Выводите: mp(x ) = выход продукта* m(x)/100% или m(x) = mp(x)*100%/ выход продукта. При данном в условии задачи выходе продукта эта формула будет необходима. Если выход продукта не дан, то следует считать, что он равен 100%.
5
Если в условии присутствует уравнение реакции, то решайте задачу по нему. Для этого сначала составьте уравнение реакции, затем вычислите из него количества вещества полученного или затраченного для данной реакции и уже это количество вещества подставьте в нужные формулы. Например, Na2SO4 + BaCl2 = BaSO4 + 2NaCl. Известно, что масса BaCl2 равна 10,4 г, нужно найти массу NaCl. Рассчитайте количество вещества хлорида бария: n = m/M. M (BaCl2) = 208 г/моль. n(BaCl2) = 10,4/208 = 0,05 моль. Из уравнения реакции следует, что из 1 моля BaCl2 образовалось 2 моль NaCl. Вычислите какое количество вещества образуется из 0,05 моль BaCl2. n(NaCl) = 0,05*2/1 = 0,1 моль. В задаче же требовалось найти массу хлорида натрия, найдите, предварительно рассчитав молярную массу хлорида натрия. M(NaCl) = 23+35,5 = 58,5 г/моль. m(NaCl) = 0,1*58,5 = 5,85 г. Задача решена.
Исторически сначала был открыт закон Дальтона (закон кратных отношений) – что элементы вступают в реакции всегда в строго определённом весовом соотношении. Это позволило составить таблицу относительных атомных масс. Было найдено, что наименьшая атомная масса – у водорода, а массы всех прочих кратны ей, поэтому массы атомов всех остальных элементов стали выражать через массу атома водорода. Собсно, именно это утверждение и составляет суть упомянутого метода Конницаро.
Но это ещё никак не говорило о том, чему же равна масса атома водорода “в граммах”. То есть не существовало абсолютной единицы атомной массы.
Способ к определению этой единицы появился с открытием закона Авогадро (это произошло вскоре после открытия Дальтона): в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул. Вскоре этот закон был распространён и на остальные вещества. Так появилось понятие моля и молярной массы, поэтому всё, что осталось, – это определить точное значение числа Авогадро (сущий пустяк…).
Путь к численному определению яисла Авогадро, а значит, и к определению “истинной массы” атома, открыл закон Фарадея для электролиза: на выделение 1 моля вещества при электролизе требуется заряд, пропорциональный “постоянной Фарадея” (коэффициент пропорциональности – валентность элемента, выделяемого при электролизе). Как только в конце 19 века Милликену удалось непосредственно измерить заряд электрона, по величине этого заряда и по значению постоянной Фарадея удалось вычислить значение числа Авогадро, а значит – вычислить и “атомную единицу массы”, массу одного атома водорода (сейчас у 1 а.е.м несколько другое определение, но оно связано чисто с методологией измерения, обеспечивающей максимальную точность и воспроизводимость, а не с природой оной массы).
Справедливости ради стоит отметить, что ещё до определения заряда электрона значение числа Авогадро определил австрийский физик Й. Лошмидт (“число Лошмидта” иногда используется и по сей день). Он, на основе газокинетической теории газов, сумел определить число молекул газа в 1 см³, откуда враз вычисляется число Авогадро. Но определение через заряд электрона и постоянную Фарадея оказалось более точным.
А масс-спектрометры – это уже совсем другая история…
Для того чтобы разобраться с понятием «молярная масса», необходимо вспомнить важный химический термин «моль». Моль тесно связан с химической константой – числом Авогадро и химическим элементом углерод (С), который взят за основу при определении количества вещества, равного 1 молю. Помнить наизусть его значение необязательно, любой электронный или бумажный справочник легко напомнит нам, что число Авогадро (оно обозначается NА) составляет 6,02х1023. Это число частиц вещества (количество молекул или атомов), которое содержится в одном его моле. Принято считать, что в 1 моле любого химического соединения содержится такое количество вещества, которое содержат 12 г атома углерода.
Простыми словами молярную массу можно идентифицировать как «вес 1 моля химического вещества».
В международной системе единиц СИ в соответствии с принятыми стандартами молярную массу определяют в граммах на моль (г/моль). В определенных случаях ее также указывают в кг/моль, если так удобнее производить расчеты. В процессе решения задач по химии молярную массу обозначают большой буквой «М».
Молярную массу не надо путать с весом молекулы, атома и иона, эти понятия отнюдь не тождественны, хотя их числовые величины могут и совпадать. Далеко не для всех химических веществ молярная масса и молекулярный вес равны друг другу. Молярная и молекулярная массы соединений имеют одинаковые значения для химических веществ, состоящих из атомов.
Не путайте молярную массу с весом молекулы!
Рассмотрим это на примере галогена из 7-й группы таблицы Менделеева – хлора (CL):
• атом хлора Cl «весит» 35,5;
• ион хлора Cl– – 35,5;
• молекула хлора Cl2 – 71.
Отличаются между собой эти значения и для другого газа – азота (N2):
• молекула азота, состоящая из 2 атомов, имеет массу 28;
• атом элемента N – 14.
Вывод напрашивается сам по себе – молярные массы элемента, иона и вещества могут существенно различаться.
Как вычислить молярную массу
Чтобы рассчитать значение молярной массы химического вещества, целесообразно придерживаться следующего алгоритма:
- Подготовить таблицу Менделеева (она может понадобиться для определения валентности и атомных масс химических элементов).
- Правильно составить химическую формулу вещества, пользуясь знаниями об основных классах неорганических соединений и их свойствах и сведениями, почерпнутыми из таблицы Менделеева, например:
- углекислый газ – СО2;
- серная кислота – Н2SO4;
- хлорид кальция CaCL2;
- гидроксид алюминия Al(OH)3.
Прежде всего при составлении формул соединений необходимо помнить о валентности элементов, из которых они состоят.
- Определяем молекулярный вес и молярную массу каждого из вышеуказанных химических соединений (вес атомов опять берем в ячейке химического элемента в таблице Менделеева):
- СО2 – 1 атом углерода (12) + 2 атома кислорода (32) = 44;
- Н2SO4 – 2 атома водорода (2) + 1 атом серы (32) + 4 атома кислорода (64) = 98;
- CaCL2 – 1 атом кальция (40) + 2 атома хлора (71) = 111;
- Al(OH)3 – 1 атом алюминия (27) + 3 атома водорода (3) + 3 атома кислорода (48) = 78.
Как видно из приведенных примеров, для выполнения необходимых вычислений достаточно сложить значения атомных масс элементов, находящихся в составе сложных веществ. Для простых веществ следует взять этот показатель, относящийся к соответствующему элементу, из таблицы Менделеева, принимая во внимание количество атомов в одной молекуле вещества (индекс в его формуле).
- Определяем массу одной молекулы каждого из этих неорганических соединений с помощью числа Авогадро:
- m(СО2) = Мr(СО2) : NA= 44:6,02·1023 = 7,3·1023 г;
- m(H2SO4) = Мr(H2SO4) : NA= 98:6,02·1023 = 16,28·1023 г;
- m(CaCL2) = Мr(CaCL2) : NA= 111:6,02·1023 = 18,5·1023 г;
- m(Al(OH)3) = Мr(Al(OH)3) : NA= 78:6,02·1023 = 13,0·1023 г.
Практическое значение молярной массы вещества
Термин «молярная масса» широко используется в таких научных дисциплинах, как химия и физика. Значения молярных масс соединений часто требуется вычислять в химической промышленности при разработке полимерных комплексов и в ряде других ситуаций. Современную фармакологию также трудно представить без проведения расчетов этой величины.
Молярная масса – одно из ключевых понятий при проведении биохимических исследований.
Таким образом, молярную массу необходимо уметь вычислять не только ученым-химикам и сотрудникам химических лабораторий, но и специалистам из ряда других областей науки, фармакологам и работникам ряда отраслей промышленного производства.
