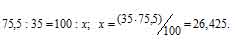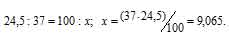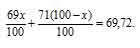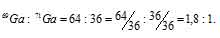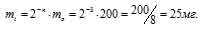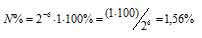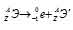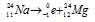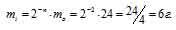All atoms of an element have the same number of protons in their nuclei; different isotopes, however, have different numbers of neutrons in their nuclei. Hydrogen, for example, has only one proton in its nucleus, but an isotope of hydrogen called deuterium has a neutron in addition to the proton. Isotopes are generally designated by the mass number, which is the number of protons and neutrons in a nucleus of that isotope. The binding energy of the nucleons in the nucleus causes the actual mass of the atom to be slightly different from the mass number, so the actual mass can only be determined experimentally. You can determine the mass number, however, merely by adding up the number of neutrons and protons.
- Calculator
- Periodic table
Write down the number of protons in the nucleus of the element you are studying. The number of protons is the same as the atomic number of the element on the periodic table. Carbon, for example, has atomic number 6 and hence six protons in its nucleus.
Write down the number of neutrons. This depends on the isotope you chose to study. Carbon-13, for example, has seven neutrons.
Add the number of neutrons to the number of protons to find the nominal mass or mass number. The mass number of carbon-13, for example, is 13. Keep in mind that owing to the binding energy for nucleons, the actual mass of carbon-13 will be very slightly different from the nominal mass. For most calculations the nominal mass should be sufficient.
Look up the exact atomic mass in the table at the National Institute of Standards and Technology Atomic Weights Web page if you need the exact atomic mass. This figure can only be determined experimentally.
Things You’ll Need
Как узнати или вичислить атомную масу изотопа?
Знаток
(250),
закрыт
11 лет назад
Дополнен 11 лет назад
ну а теоритически как? мне нужно решыть задачку на обчисление енергии, которая виделяется при химической реакции, для етого нужно найти дефект масс, но вот не могу обчислить атомную масу изотопа лития.
Дополнен 11 лет назад
Найти енергию Q, которая виделяется при реакции Li3/7+H1/1=He4/2+He2/2 .енергия исчисляется умнодением квадрата скорости света на дефект массы. Сума мас исходных частиц=(7,01600+1,00783)= 8,02383 в табличке видно, что 1,00783= атомная маса водорода, а как нашлась атомная маса изотопа лития, в табличке для лития 6,9410
Дополнен 11 лет назад
я извеняюсь, но ето в решебнике написано, что атомная маса изотопа лития 3-7 =7,01600, в умове задачки дана только реакцыя, как мне найти (вичислить чило 7,01600 ну или обяснить где оно взялось?
Дополнен 11 лет назад
спасибо большое))
Николаев Александр
Мыслитель
(7792)
11 лет назад
Атомная масса – это масса атома выраженная в атомных единицах массы. Атомная единица массы равна 1/12 массы изотопа углерода 12. Стало быть атомная масса углерода-12 строго равна 12, у остальных атомов масса выражается не целым числом из-за убыли массы на связь нуклонов и разницы в массе между протоном и нейтроном.
В таблице Менделеева приведена атомная масса химического элемента или средняя атомная масса. Это средневзвешенное значение для разных изотопов химического элемента с учетом их распространенности в земной коре. Т. е. для лития, например, это средневзвешенная атомная масса изотопов литий-6 и литий-7.
У Вас в задаче берется именно атомная масса отдельного изотопа Литий-7
Все атомы элемента имеют одинаковое количество протонов в своих ядрах; Однако разные изотопы имеют разное количество нейтронов в своих ядрах. Водород, например, имеет только один протон в своем ядре, но изотоп водорода, называемый дейтерием, имеет нейтрон в дополнение к протону. Изотопы обычно обозначаются массовым числом, которое является числом протонов и нейтронов в ядре этого изотопа. Энергия связи нуклонов в ядре приводит к тому, что фактическая масса атома немного отличается от массового числа, поэтому фактическая масса может быть определена только экспериментально. Вы можете определить массовое число, просто сложив число нейтронов и протонов.
Запишите количество протонов в ядре изучаемого элемента. Количество протонов совпадает с атомным номером элемента в периодической таблице. Например, углерод имеет атомный номер 6 и, следовательно, шесть протонов в своем ядре.
Запишите количество нейтронов. Это зависит от того, какой изотоп вы выбрали для изучения. Например, в углероде-13 содержится семь нейтронов.
Добавьте число нейтронов к числу протонов, чтобы найти номинальную массу или массовое число. Массовое число углерода-13, например, равно 13. Имейте в виду, что из-за энергии связи для нуклонов фактическая масса углерода-13 будет очень незначительно отличаться от номинальной массы. Для большинства расчетов номинальная масса должна быть достаточной.
Посмотрите точную атомную массу в таблице на веб-странице Национального института стандартов и технологий по атомным весам, если вам нужна точная атомная масса. Эта цифра может быть определена только экспериментально.
Запись символов изотопов элементов. Расчет количественного соотношения изотопов
Задача 206.
Символ одного из изотопов элемента 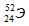
Решение:
Заряд ядра атома искомого элемента 24 численно совпадает с порядковым номером элемента в периодической системе химических элементов. Элемент №24 – хром (Cr).
Число нейтронов в ядре данного элемента равно 28:
N = A – Z = 28, где
N – число нейтронов в ядре, A – массовое число элемента (округленная масса атома), Z – заряд ядра.
Число электронов равно заряду ядра; в данном случае число электронов равно 24.
Ответ: Cr
Задача 207.
Ядро атома некоторого элемента содержит 16 нейтронов, а электронная оболочка этого атома — 15 электронов. Назвать элемент, изотопом которого является данный атом. Привести запись его символа с указанием заряда ядра и массового числа.
Решение:
Количество электронов в атоме численно равно заряду атома. В данном случае заряд ядра атома равен +15. Заряд ядра атома искомого элемента 15 численно совпадает с номером элемента в периодической системе химических элементов. Элемент №15 – фосфор – символ – Р.
Массовое число данного изотопа фосфора равно:
A = N + Z = 16 + 15 + 31
Символ изотопа фосфора будет иметь вид: 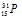
Ответ: 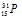
Задача 208.
Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Указать число протонов и нейтронов в ядре атома и название элемента.
Решение:
Количество электронов в атоме равно количеству протонов. В данном случае число протонов равно 73. Число нейтронов в данном ядре равно 108:
N = A – Z = 181 – 73 = 108, где
N – число нейтронов, A – массовое число атома, Z – заряд ядра.
Заряд ядра атома искомого элемента 73 численно совпадает с порядковым номером элемента в периодической системе химических элементов. Элемент №73 –тантал, символ – +73Ta.
Ответ: +73Та.
Задача 209.
В природных соединениях хлор находится в виде изотопов 35Cl [75,5% (масс.)] и 37Cl [24,5% (масс.)]. Вычислить среднюю атомную массу природного хлора.
Решение:
Рассчитаем содержание 35Cl в природном хлоре, т.е. долю его в атомной массе из пропорции:
Теперь рассчитаем массу 37Cl, содержащуюся в природном хлоре из пропорции:
Вычисляем среднюю массу природного хлора, состоящего из двух изотопов
214,5 + 9,065 = 35,49.
Ответ: 35,49.
Задача. 210.
Природный магний состоит из изотопов: 24Mg, 25Mg, 26Mg. Вычислить среднюю атомную массу природного магния, если содержание отдельных изотопов в атомных процентах соответственно равно 78,6, 10,1 и 11,3.
Решение:
Вычислим атомную массу изотопов, содержащихся в природном магнии
а) (24 . 78,6)/100 = 18,864;
б) (25 . 10,1)/100 = 2,525;
в) (26 . 11,3)/100 = 2,938.
Находим среднюю массу атома магния:
18,864 + 2,525 + 2,938 = 24, 327.
Ответ: Ar(Mg) = 24,327.
Задача 211.
Природный галлий состоит из изотопов 71Ga, 69Ga. В каком количественном соотношении находятся между собой числа атомов этих изотопов, если средняя атомная масса галлия равна 69,72.
Решение:
Для решения задач применим алгебраический метод расчёта:
Обозначим процентное содержание изотопа 69Ga через x. Тогда процентное содержание изотопа 71Ga будет равно 100 – x. масса изотопа 69Ga в атоме будет составлять 69 . (x/100). Масса изотопа 71Ga будет составлять 71 . (x/100).
В сумме масса обоих изотопов будет равняться атомной массе галлия:
Освобождаемся от знаменателя и получим уравнение:
69x – 71x + 7100 = 69,72
Решаем его и, получаем:
-2x = -128x; x = 64
Значит, процент изотопа 69Ga составляет 64%, а процент изотопа 71Ga – 36% (100 – 64 = 100).
Теперь находим, в каком количественном соотношении находятся эти изотопы в природном галлии:
Ответ: 1,8 : 1.
Задача 212.
Найти массу изотопа 81Sr(T1/2 = 8,5ч), оставшуюся через 25,5 ч хранения, если первоначальная масса его составляла 200 мг.
Решение:
За время хранения радиоактивного изотопа прошло 3 периода полураспада (25,5/8,5 = 32). Массу нераспавшегося изотопа, оставшаяся после 25,5ч хранения, рассчитаем из уравнения:
mi = 2-n – m0, где
mi – масса изотопа, оставшаяся после хранения, m0 – исходная масса изотопа, n – период полураспада.
Тогда
Ответ: 25мг.
Задача 213.
Вычислить процент атомов изотопа 128I(T1/2 = 25ч), оставшихся не распавшимися после его хранения в течение 2,5 ч.
Решение:
За время хранения радиоактивного изотопа прошло 6 периодов полураспада [(2,5 . 60)/25 = 6)]. Тогда процент атомов изотопа, оставшихся после радиоактивного распада, находим из формулы:
N% = 2-n . N0 . 100%, где
N% – процент атомов изотопа, N0 – первоначальное число ядер изотопа, n – число периодов полураспада.
Отсюда
Ответ: 1,56%.
Задача 214.
Период полураспада 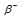
Решение:
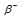
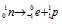
при испускании электрона заряд ядра увеличивается на единицу, а массовое число не изменяется. Дочернее ядро – изобар исходного – принадлежит элементу, стоящему следующим после исходного в таблице периодической системы химических элементов:
Уравнение радиоактивного распада должны удовлетворять правилу равенства сумм индексов.
Запишем уравнение реакции распада:
За время хранения 24Na прошло 2 периода полураспада (29,6/14,2 = 2). Массу не распавшегося изотопа, оставшуюся после 14,8ч хранения находим по формуле:
mi = 2-n – m0, где
mi – масса изотопа, оставшаяся после хранения, m0 – исходная масса изотопа, n – период полураспада.
Тогда
Таким образом, радиоактивному распаду подверглось 18г 24Na и столько же образовалось 24Mg (24 – 6 = 18).
Ответ: 18 г.
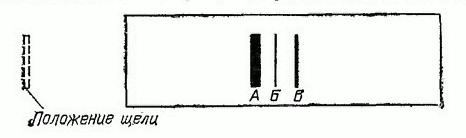
Рассмотрим результаты опытов по измерению массы положительных ионов. На рис. 352 представлена масс-спектрограмма положительных ионов неона. На спектрограмме четко видны три полоски различной интенсивности. Сравнивая расстояния от полосок до щели, можно подсчитать, что полоскам соответствуют величины
, находящиеся в отношениях
.
Появление трех полосок нельзя объяснить различием в заряде ионов. Ион неона может нести заряд, не превышающий нескольких элементарных единиц. Отношение зарядов может быть , но никак не
. Остается принять, что полоски
обусловлены ионами, несущими один и тот же заряд, но обладающими различными массами, относящимися, как
. Атомная масса неона равна 20,2. Следовательно, среднее значение массы атома неона есть
. Массы же ионов, обусловивших полоски
, равны
. Мы приходим к выводу, что элемент неон представляет собой смесь атомов трех типов, отличающихся друг от друга по массе. Сравнивая интенсивность почернения линий на масс-спектрограмме, можно найти относительные количества различных атомов в природном неоне. Количество атомов неона с массами 20, 21 и 22 относятся, как
.
Рис. 352. Масс-спектограмма неона
Вычислим среднюю массу атома неона:
Совпадение с атомной массой неона, найденной из опыта, подтверждает представление, согласно которому элемент неон является смесью трех типов атомов. Важно отметить, что пропорция атомов с массами 20, 21 и 22 одна и та же в образцах неона различного происхождения (атмосферный неон, неон из горных пород и т. д.). Пропорция эта не изменяется или изменяется в очень малой степени при обычных физических и химических процессах: сжижение, испарение, диффузия и т. д. Это доказывает, что три разновидности неона почти тождественны по своим свойствам.
Атомы одного и того же элемента, отличающиеся только массой, носят название изотопов. Все изотопы одного и того же элемента тождественны по химическим и очень близки по физическим свойствам.
Наличие изотопов является особенностью не только неона. Большинство элементов представляет собой смесь двух или нескольких изотопов. Примеры изотопного состава даны в табл. 11.
Таблица 11. Изотопный состав некоторых элементов
|
Элемент |
Атомная масс (округленная) |
Изотопы |
|
|
масса округленная |
содержание, % |
||
|
Водород Кислород Хлор Уран |
1 16 35,5 238 |
1 2 16 17 18 35 37 234 235 238 |
99,985 0,015 99,76 0,04 0,20 75,5 24,5 0,006 0,720 99,274 |
Как видно из табл. 11, массы изотопов всех элементов выражаются целым числом атомных единиц масс. Смысл этой важной закономерности мы выясним в § 225. Точные измерения показывают, что правило целочисленности масс изотопов является приближенным. Массы изотопов обнаруживают, как правило, небольшие отклонения от целочисленности (во втором — четвертом знаках после запятой). В некоторых задачах эти малые отклонения от целочисленности играют основную роль (см., например, §226).
Для многих целей можно, однако, пользоваться значением массы, округленным до целого числа атомных единиц массы. Масса изотопа в (атомная масса), округленная до целого числа, называется массовым числом.
Выше мы отметили постоянство изотопного состава неона и почти полное совпадение большинства свойств его изотопов. Эти положения справедливы также и для всех остальных элементов, обладающих изотопами.
Для обозначения изотопов химический символ соответствующего элемента снабжают знаком, указывающим массовое число изотопа. Так, например, — изотоп кислорода с массовым числом 17,
— изотоп хлора с массовым числом 37 и т. д. Иногда внизу указывают еще порядковый номер элемента в периодической системе Менделеева
и т. д.