Условие задачи:
Определить массу молекулы кислорода.
Задача №4.1.2 из «Сборника задач для подготовки к вступительным экзаменам по физике УГНТУ»
Дано:
(m_0-?)
Решение задачи:
Рассмотрим (nu) (произвольное количество) моль кислорода. Напомним, что формула кислорода такая: O2.
Чтобы найти массу (m) некоторого количества кислорода, нужно молярную массу кислорода (M) умножить на число молей (nu).
[m = nu cdot M]
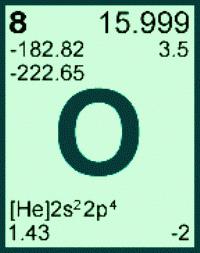
Используя таблицу Менделеева, легко определить, что молярная масса кислорода (M) равна 32 г/моль или 0,032 кг/моль.
В одном моле содержится число Авогадро молекул (N_А), а в (nu) моль – в (nu) раз больше, то есть:
[N = nu {N_А}]
Чтобы найти массу одной молекулы (m_0), нужно всю массу (m) поделить на число молекул (N).
[{m_0} = frac{m}{N}]
[{m_0} = frac{{nu cdot M}}{{nu cdot {N_А}}}]
[{m_0} = frac{M}{{{N_А}}}]
Число Авогадро (N_А) – это табличная величина, равна 6,022·1023 моль-1. Произведем вычисления:
[{m_0} = frac{{0,032}}{{6,022 cdot {{10}^{23}}}} = 5,3 cdot {10^{ – 26}};кг = 5,3 cdot {10^{ – 23}};г]
Ответ: 5,3·10-23 г.
Если Вы не поняли решение и у Вас есть какой-то вопрос или Вы нашли ошибку, то смело оставляйте ниже комментарий.
Смотрите также задачи:
4.1.1 В баллоне находится 20 моль газа. Сколько молекул газа находится
4.1.3 Сколько молекул содержится в 5 кг кислорода?
4.1.4 При температуре 320 К средняя квадратичная скорость молекулы кислорода 500 м/с
|
Если под данным вопросом подразумевается вычисление массы одной молекулы кислорода, то надо выполнить следующие действия. Найти молярную массу М из таблицы Менделеева. Молярная масса вещества – это масса одного моля вещества, выраженная в граммах, для молекулы кислорода (О2) это значение равно 32 грамм/моль. Чтобы найти массу молекулы, надо молярную массу разделить на число Авогадро N (число молекул в моле вещества). Число Авогадро равно примерно 6.022*10 в 23 степени. Итак, М делим на N и получаем величину массы молекулы кислорода – 5.3*10 в минус 23 степени грамм. Знаете ответ? |
LU4IK
Мастер
(1040)
12 лет назад
Исходя из данных задачи, формула М=n/m, где M – молярная масса вещества, n – количество вещества, m – масса не подойдет.
Чтобы найти масссу молекулы кислорода нужно воспользоваться формулой, предложенной Валентиной.
масса молекулы кислорода равна (32 * 10 ^-3)/ (6 * 10 ^ 23) = 5,3 * 10 ^- 26
Максим Грищук
Гуру
(4493)
12 лет назад
М=n/m, где M – молярная масса вещества, n – количество вещества, m – масса. Значит m=n/M. Подставляй значения в формулу и все.
Как найти массу кислорода
Кислород по праву называют жизненно важным химическим элементом. Кроме того, он входит в состав многих соединений, некоторые из Них не менее важны для жизни, чем он сам. Множество кислородосодержащих веществ находит применение в промышленности и сельском хозяйстве. Навыки определения массы кислорода необходимы как тем, кто изучает химию, так и сотрудникам химических лабораторий и заводов.

Инструкция
Без кислорода жизнь на Земле была бы невозможна. Этот элемент встречается в соединениях, входящих в состав воздуха, воды, почвы, живых организмов. Кислород обладает интересными свойствами. Во-первых он представляет собой сильный окислитель, участвующий в процессах горения и коррозии металлов. Во-вторых, он образует со многими элементами оксиды. Помимо этого, атомы кислорода присутствуют в некоторых неорганических кислотах (H2SO4, HNO3, HMnO4). Кислород считается одним из самых активных элементов, поэтому он широко применяется в металлургии, химической промышленности, а также в качестве окислителя для ракетных двигателей.
Довольно часто условиях химических задач выглядят следующим образом. Кислород находится в свободном виде и его объем равен V. Требуется определить массу кислорода O2 при нормальных условиях.Молярный объем газа Vm при нормальных условиях составляет 22,4л/моль. Существует также формула, воспользовавшись которой, можно найти в отношении кислорода количество вещества, а затем и массу. Эта формула представлена ниже:n(O2)=V(O2)/Vm, где Vm=const=22,4 л/мольТеперь, зная количество вещества, можно определить массу:m(O2)=n(O2)*M(O2)Поскольку молекула кислорода состоит из двух атомов, а молекулярная масса этого элемента в соответствии с данными из таблицы Менделеева равна 16, то М(O2)=32 г/моль. Отсюда следует, что m(O2)=32n(O2)=32V/22,4, где V – заданный в условии задачи объем.
В промышленности чистый кислород обычно получают разложением разилчных оксидов. Например:2HgO=2Hg+O2Вследствие этого, встречаются задачи, в которых требуется найти количество вещества и массу по заданным уравнениям реакций. Если дано количество вещества в отношении оксида, из которого получается кислород, то такую задачу можно решить следующим образом, обращая особое внимание на коэффициенты уравнения:2HgO(n)=2Hg+O2(x)
2моль 2моль 1мольЗа x в уравнении принято неизвестное количество вещества кислорода, за n – количество оксида HgO. Уравнение можно преобразовать в пропорцию:x/n=1/2, где 1 и 2 – коэффициенты уравненияСоответственно, n(O2)=n(HgO)/2Так как известно количество вещества кислорода, можно найти его массу. Она равна:m(O2)=n(O2)*M(O2)=n(HgO)/2*M(O2)
Видео по теме
Полезный совет
В качестве примера можно привести следующую задачу:
Какая масса кислорода получается при разложении 0,8 моля оксида ртути?
Уравнение нагревания оксида ртути выглядит следующим образом:
2HgO (0,8 моля)=2Hg+O2 (x молей)
Из уравнения видно, что при разложении 2 молей оксида ртути получается 1 моль кислорода. Составив пропорцию, получим:
x/0,8=1/2; x=n(O2), n(HgO)=0,8 моля
Отсюда следует, что n(O2)=n(HgO)/2=0,4 моля
Так как известно количество кислорода, получившегося при разложении ртути, можно найти массу O2:
m(O2)=n(O2)*M(O2)=0,4*32=12,8 г
Ответ: m(O2)=12,8 г
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Атомы элементов и молекулы веществ обладают ничтожно малой массой. Для изучения количественных отношений, характерных для химических реакций, используется несколько физических величин. Одна из них — молярная масса, которую можно рассчитать для атомов, ионов и молекул. Один из важнейших элементов на Земле — кислород, с его участием протекают многие реакции и процессы. Для выполнения расчетов по формулам соединений, уравнениям реакций используется молярная масса кислорода, которая численно равна относительной массе его атома или молекулы.
Кислород
Общие сведения о кислороде (химическом элементе):
- латинское название — Oxygenium;
- химический символ — O;
- находится в верхней части 16-й группы (ранее — группы VI A) периодической таблицы;
- расположен во втором периоде сразу после азота, перед фтором;
- относится к семейству халькогенов;
- номер элемента в периодической таблице и заряд ядер его атомов — 8.
Кислород как один из компонентов атмосферы долгое время не могли выделить в чистом виде. Газ называли «животворящим», «эликсиром жизни». Честь открытия кислорода делят между собой ученые с мировым именем: К. Шееле, Дж. Пристли, А. Лавуазье. Термин «оксиген» предложил А. Лавуазье, исходя из важной роли вещества, его атомов в процессах образования оксидов и кислот.
Как находят молярную массу элемента или вещества?
При выполнении химических расчетов нужно знать массы участвующих в реакциях атомов и молекул веществ. Но они слишком малы, что затрудняет использование таких единиц измерения, как граммы и килограммы. Выход был найден: предложены другие величины, облегчающие расчеты. Например, в химии используются относительные значения атомных и молекулярных масс. Относительная масса атома (Ar) как физическая величина была введена в 1961 году. Ее значение равно 1/12 массы атома углерода (изотопа 12C).
Для выполнения расчетов по формулам и уравнениям с применением этой и других величин нужно помнить несколько правил:
- Масса атома указана в периодической системе рядом с химическим знаком. Молярная масса имеет такое же численное значение, но с единицами измерения г/моль.
- Массу одного моля вещества определяют по формуле соединения, для чего находят сумму молярных масс всех частиц в молекуле.
- Если в химической формуле есть индекс, указывающий на количество структурных единиц, то необходимо умножить молярную массу на этот коэффициент.
Атомная и молекулярная масса кислорода
Масса атома кислорода получена с учетом количества и распространения трех его природных изотопов: Ar (О) = 15,999 (в а. е. м.). В расчетах это значение обычно округляют, получается 16. Для каждого элемента его атомная масса — постоянная величина. По известной массе атомов элемента с порядковым номером 8 может быть найдена молярная масса элемента кислорода. М(О) = 16. Еще одна безразмерная физическая величина — молекулярная масса кислорода — относится к простому веществу. Вычисляют массу молекулы кислорода, умножив массу атома на стехиометрический коэффициент в формуле: Mr(O2) = Ar (О) . 2 = 16 . 2 = 32. На практике нет необходимости выяснять, какая молярная масса кислорода, ведь ее значение численно равно массе молекулы вещества, но с единицей измерения г/моль. Для конкретного соединения его молекулярная масса является постоянной величиной, широко используется при расчетах количества и массы вещества.
Количество вещества
В химии для удобства расчетов используется одна из важнейших физических величин — количество вещества. Относится она не к массе, а к числу структурных единиц. За единицу измерения количества вещества в Международной системе (СИ) принят 1 моль. Зная, что 1 моль включает столько же частиц, сколько их содержится в 12 г углеродного изотопа 12С, можно рассчитать число атомов, молекул, ионов, электронов, содержащихся в навеске любого вещества. Еще одна постоянная величина получила название в честь великого итальянского ученого Авогадро (обозначается NА), Она характеризует число структурных частиц, которые содержит вещество, если его количество — 1 моль. Численное значение постоянной Авогадро — 6,02 . 1023 1/моль. Именно такое количество атомов (молекул, ионов) обладает молярной массой. Обозначение этой физической величины — М, единица измерения — 1 г/моль, формула для расчета — М = m/n (m — масса (г), n — количество вещества (моль)).
Чему равна молярная масса кислорода
На практике нет необходимости пользоваться формулой М = m/n для вычисления молярной массы кислорода. При решении задач чаще требуется определить, чему равна масса, или найти количество вещества. В первом случае используют для расчетов формулу m = n . M, во втором — n = m/M. Численное значение молярной массы элемента совпадает с массой атома, а для вещества — молекулы. Например, массу 16 г имеет 1 моль элемента кислорода. М (О2) — молярная масса молекулы кислорода, которая равна 32 г/моль.
Молярная масса эквивалента кислорода
Эквивалентной называют величину, равную массе 1 моля атомов любого одновалентного элемента. В общем случае можно определить эквивалентную массу, поделив молярную массу атомов химического элемента на его валентность, найденную по формуле конкретного соединения. В большинстве своих соединений кислород, как химический элемент-халькоген, двухвалентен. Молярная масса кислорода может быть найдена по таблице Менделеева, ее округленное значение — 16. Эквивалентная масса в 2 раза меньше — 8. В химии применяется закон эквивалентов, который гласит, что вещества вступают в реакцию между собой в количествах, равных их эквивалентам. При выполнении расчетов можно использовать молярную массу эквивалента кислорода, чтобы определить массу эквивалента вещества, для которого она неизвестна.
Кислород — один из важнейших элементов в земной коре, на него приходится 46,6 % массы. Простое соединение с тем же названием — второе по распространенности в атмосфере Земли. Содержание молекулярного кислорода в воздухе — 20,947 % по объему. При участии атомов элемента и молекул вещества протекают многие реакции и процессы в технике, промышленности, живой и неживой природе. Важно учесть количественные отношения в этих процессах, что значительно облегчает использование физических величин, в том числе молярной массы кислорода.