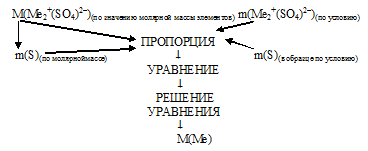
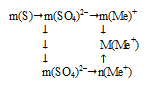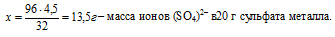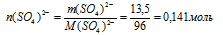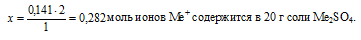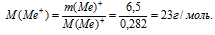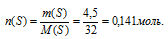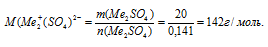Способы определения молекулярной формулы соли, если известна степень окисления металла
Задача 114.
В 20 г сульфата некоторого металла содержится 4,5 г атомов серы. Определите формулу соли, если известно, что металл проявляет в этом соединении степень окисления (+1).
Дано: масса образца сульфата некоторого металла: m(соли) = 20 г; масса серы в образце: m(S) = 4,5 г; степень окисления неизвестного металла: +1.
Найти: формулу сульфата.
Решение:
Для идентификации металла необходимо определить его молярную массу. Здесь возможны 2 способа решения.
I способ (последовательно-разветвленный алгоритм).
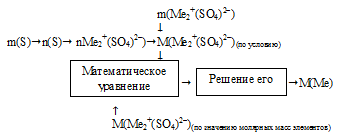
Схематично алгоритм данного способа можно записать следующим образом:
Применим предложенный алгоритм.
1) m(S) → m(SО4)2–
По степени окисления металла в сульфате определяем общую формулу искомого вещества Ме2+(SO4)2–. В кислотном остатке серной кислоты (SО4)2– соотношение атомов строго определено уже известными индексами. Поэтому мы легко сможем определить массу кислотного остатка в 20 г сульфата металла по массе серы:
М(SО4)2– = М(S) . 1 + М(О) . 4 = 32 . 1 + 16 . 4 = 96 г/моль.
Масса 1 моль кислотного остатка (SО4)2– составляет 96 г1.
Составим пропорцию:
вклад серы в 96 г ионов (SО4)2– составляет 32 г (по молярной массе)
вклад серы в х г ионов (SО4)2– составляет 4,5 г (по условию)
2) m(SО4)2– → n(SО4)2–
Находим количество вещества ионов (SО4)2–
3) n(SО4)2– → n(Me+)
Находим количество вещества ионов Ме+, соответствующее содержанию ионов кислотного остатка n(SО4)2– = 0,141 моль. Используя формулу Ме2+(SО4)2–, составим пропорцию:
на 2 моль ионов Ме+ приходится 1 моль ионов (SО4)2– (по индексам в формуле)
на х моль ионов Ме+, приходится 0,141 моль ионов (SО4)2– (по условию)
4) m(SО4)2– → m(Me)+
Находим массу металла в 20 г соли Ме2SО4.
m(Ме+) = m Ме2+(SО4)2– – m(SО4)2– = 20 – 13,5 = 6,5 г.
5) Находим молярную массу атомов металла
В данном случае молярную массу ионов металла можно приравнять к молярной массе незаряженных атомов:
М(Ме+) = М(Ме) = 23 г/моль.
По таблице Д.И. Менделеева находим элемент, имеющий молярную массу 23г/моль. Подходит натрий. Этот элемент действительно проявляет степень окисления (+1) и образует сульфат Nа2SО4.
II способ (встречный алгоритм).
Схематично алгоритм данного способа можно записать следующим образом:
Применим данный алгоритм.
1) По степени окисления металла в сульфате определяем общую формулу искомого вещества Ме2+(SО4)2–
2) По массе серы в образце определяем ее количество вещества:
3) По записи формулы сульфата Ме2+моль ионов Ме+ содержится в 20 г соли Ме2SO4 видно, что количество вещества серы равно количеству вещества соли:
n(S) = nМе2+(SО4)2–. = 0,141 моль.
4) По значениям количества вещества и массы образца сульфата определяем значение молярной массы соли:
5) Записываем выражение для определения молярной массы для сульфата металла, исходя из значений молярных масс элементов:
М(Ме2+(SО4)2–) = М(Ме) . 2 + М(S) . 1 + М(О) . 4 =
= М(Ме) . 2 + 32 . 1 + 16 . 4 = [М(Ме) . 2 + 96] г/моль.
6) Приравниваем полученное выражение к значению молярной массы соли, полученному в четвертом действии:
М(Ме) . 2 + 96 = 142.
Получили одно математическое уравнение с одним неизвестным. Его решение дает нам молярную массу искомого металла: М(Ме) = 23 г/моль.
По таблице Д. И. Менделеева находим элемент, имеющий молярную массу 23 г/моль. Подходит натрий. Этот элемент действительно проявляет степень окисления (+1) и образует сульфат Nа2SО4.
III способ (встречный алгоритм).
Графический алгоритм данного способа будет следующим:
Применим данный алгоритм.
1) По степени окисления металла в сульфате определяем общую формулу искомого вещества Ме2+(SО4)2–. Записываем значение молярной массы для этого вещества:
М(Ме2+(SО4)2–) = М(Ме) . 2 + М(S) . 1 + М(О) .4 =
= М(Ме) . 2 + 32 . 1 + 64 . 4 = (М(Ме) . 2 + 96) г/моль.
Вклад серы в общую массу 1 моль Ме2+(SО4)2– составляет:
М(S) . 1 = 32 . 1 = 32 г.
Выбираем в качестве образца массу 1 моль Ме2+(SО4)2–:
M(Ме2+(SО4)2–) = (М(Ме) . 2 + 96) г
Масса серы в этом выбранном образце: m(S) = 32 г.
2) Составляем пропорцию:
(М(Ме) . 2 + 96) г Ме2+(SО4)2– содержит 32 г (S) (по молярной массе)
20 г Ме2+(SО4)2– содержит 4,5 г (S) (по условию)
3) Из пропорции получаем уравнение с одним неизвестным:
(M(Ме) . 2 + 96) . 4,5 = 20 . 32
4) Решая уравнение, получаем значение молярной массы искомого металла:
М(Ме) = 23,1 г/моль.
По таблице Д.И. Менделеева находим элемент, имеющий молярную массу 23,1 г/моль. Подходит натрий. Этот элемент действительно проявляет степень окисления (+1) и образует сульфат Nа2SО4.
Ответ: Nа2SО4.
Комментарии:
1 Молярную массу любых ионов можно считать точно так, как и молярную массу нейтральных частиц. Молярная масса любого иона отличается от молярной массы такой же незаряженной частицы на массу нескольких электронов. Если заряд иона «+n», то М(иона) < М(незаряженной частицы) на массу n электронов, если заряд иона «-n», то M(иона) > М(незаряженной частицы) на массу n электронов. Так как масса электрона значительно меньше (в 1840 раз) массы даже самого легкого атома водорода, не говоря уже о более тяжелых атомах других металлов, то массой электронов при подсчете молярной массы можно пренебречь и считать условно, что M(иона) = М(незаряженной частицы).
Молярная масса кислотных остатков
вадим аитбаев
Знаток
(261),
закрыт
5 лет назад
Чему равна молярная масса кислотных остатков кислот: азотистая, азотная, соляная, сернистая, серная, сероводородная, фосфорная, угольная, кремнивая?
Долго болел не знаю (
Дивергент
Высший разум
(1538845)
8 лет назад
46, 62, 35,5, 80, 96, 32, 95, 60, 76
соляная – 35,5!
Кислота бывает кремниЕвая!
ghesoctouing4
Вопрос по химии:
Молярная масса кислотных остатков
Чему равна молярная масса кислотных остатков кислот: азотистая, азотная, соляная, сернистая, серная, сероводородная, фосфорная, угольная, кремниевая?
Долго болел не знаю (
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок – бесплатно!
Ответы и объяснения 1
sepen
Азотистая 47. Азотная 63. Соляная 36,5. Сернистая 82. Серная 98. Сероводородная 34. Фосфорная 98. Угольная 62. Кремниевая 78.
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат – это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи –
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
При взаимодействии основных оксидов с водой получаются основания. А вот при взаимодействии с водой кислотных оксидов получаются кислоты.
Кислоты – это большой класс химических соединений, в которых есть атом водорода и так называемый кислотный остаток.
Правильно определять кислотные остатки и понимать, как определяется их валентность, просто необходимо, иначе будет сложно составлять формулы солей. Ниже мы поговорим о классификации кислот и узнаём побольше о кислотных остатках.
Классификация кислот
Делить кислоты на группы можно по разным признакам, но нас сейчас будут интересовать два: содержание кислорода и основность.
Классификация кислот по содержанию кислорода
Тут всё просто: в составе некоторых кислот кислород есть (и они называются кислородсодержащими), в составе других кислорода нет (и эти кислоты называют бескислородными).
Примеры кислородсодержащих кислот: серная Н2SO4, фосфорная H3PO4, азотная HNO3.
Примеры бескислородных кислот: сероводородная H2S, соляная HCl, плавиковая HF.
Классификация кислот по основности
Тут мы должны остановиться более подробно.
Основность определяется числом атомов водорода в составе кислоты.
Для того, чтобы узнать основность, нужно взглянуть на формулу. Например, соляная кислота HCl одноосновная, потому что здесь только один атом водорода, сернистая кислота H2SO3 – двухосновная (здесь два атома водорода), а фосфорная H3PO4 – трёхосновная (в формуле три атома водорода). Запомните, как определять основность, тогда вам будет значительно проще составлять формулы солей при составлении химических уравнений.
Теперь давайте уделим внимание второй составной части кислоты – кислотному остатку.
Кислотный остаток – это то, что останется от кислоты, если убрать водород.
То есть, в азотной кислоте HNO3 кислотный остаток -NO3, в сероводородной Н2S кислотный остаток -S, в фосфорной кислоте H3PO4 кислотный остаток – PO4. Обратите внимание, что в кислородсодержащей кислоте остаток кислород содержит, а в бескислородной не содержит.
Валентность кислотного остатка
Говорить о валентности кислотного остатка не совсем корректно, поскольку валентность – это способность атомов образовывать химические связи. Если же речь идёт о кислотном остатке кислородсодержащей кислоты, то у нас имеется группа атомов (например, кислотный остаток –NO3). Но мы всё равно будем говорить о валентности, чтобы проще было составлять формулы.
Итак,
валентность кислотного остатка определяется числом атомов водорода.
Фактически валентность равна основности. Например, у двухосновной серной кислоты H2SO4 есть кислотный остаток –SO4, валентность которого II. И для чего же нам нужно это знание? Давайте рассмотрим примеры.
Пример 1.
Составьте формулу сульфида натрия.
Натрий – металл первой группы с валентностью I. Сульфид – соль сероводородной кислоты H2S. Когда образуется соль (в данной ситуации сульфид натрия), металл замещает водород в кислоте, то есть соль состоит из металла и кислотного остатка. Тогда в сульфиде натрия будут натрий и сера. Сероводородная кислота – двухосновная, поскольку в ней два атома водорода. Следовательно, у кислотного остатка –S валентность II. Составляем формулу, используя знания о валентности:
Ответ: формула сульфида натрия H2S.
Пример 2.
Составьте формулу сульфита калия.
Этот пример посложнее: в нём фигурирует кислородсодержащая двухосновная сернистая кислота H2SO3. Из формулы видно, что валентность кислотного остатка –SO3 будет II. Калий же – металл первой группы, его валентность I. Составляем формулу:
Ответ: формула сульфита калия К2SO3.
Пример 3.
Составьте формулу нитрата кальция.
Итак, нитрат – соль азотной кислоты HNO3. Это одноосновная кислота, поэтому кислотный остаток -NO3 имеет валентность I. Кальций – металл второй группы с валентностью II. Составляем формулу:
Ответ: формула нитрата кальция Ca(NO3)2.
Обратите внимание на очень важный момент! Мы взяли кислотный остаток NO3 в скобки и внизу поставили индекс 2. Это показывает, что в формуле два кислотных остатка! Не забывайте ставить скобки, иначе это будет ошибкой. Фактически в соединении Ca(NO3)2 один атом кальция, два атома азота и шесть атомов кислорода (если раскрыть скобки), но написание CaN2O6 ничего не показывает, а вот из формулы Ca(NO3)2 сразу видно, что у нас имеется атом кальция и два кислотных остатка азотной кислоты.
Пример 4.
В заключение самый сложный пример от репетитора по химии. Нужно составить формулу фосфата магния.
Магний – металл второй группы, его валентность II. Фосфат – соль фосфорной кислоты H3PO4. Здесь кислотный остаток PO4 и его валентность III. Составляем формулу:
Формула выглядит громоздко, но она всё предельно точно рассказывает о составе вещества: в фосфате магния имеется три атома магния и два кислотных остатка фосфорной кислоты.
Ответ: формула фосфата магния Мg3(PO4)2.
Кстати, кислоты реагируют с металлами, но не всеми. Об этом читайте в тексте «Химические свойства кислот».
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Таблица кислот и кислотных остатков.
Таблица кислот и кислотных остатков (1 часть):
| Формула кислоты | Название кислоты | Формула кислотного остатка |
Название кислотного остатка |
| HN3 | Азотистоводородная (Азоимид, Азидоводород) | N3– | Азид |
| HNO2 | Азотистая | NO2– | Нитрит |
| HNO3 | Азотная | NO3– | Нитрат |
| HBrO2 | Бромистая | BrO2– | Бромит |
| HBrO3 | Бромноватая | BrO3– | Бромат |
| HBrO | Бромноватистая (Гипобромистая кислота) | BrO– | Гипобромит |
| HBr | Бромоводород (Бромистоводородная кислота) | Br– | Бромид |
| HVO3 | Ванадиевая | VO3– | Ванадат |
| H2WO4 | Вольфрамовая | WO42– | Вольфрамат |
| H4GeO4 или Ge(OH)4 | Германиевая кислота (Гидроксид германия (IV)) | GeO44– | Германат |
| H2S2O7 | Дисерная | S2O72– | Дисульфат |
| H4P2O7 | Дифосфорная | P2O74– | Пирофосфат или дифосфат (по номенклатуре IUPAC) |
| H2Cr2O7 | Дихромовая | Cr2O72– | Дихромат |
| HIO4 | Йодная | IO4– | Периодат |
| HIO | Йодноватистая | IO– | Гипоиодит |
| HI | Йодоводород (Йодоводородная кислота) | I– | Йодид |
| H2SiO3 | Кремниевая | SiO32– | Силикат |
| H2MnO4 | Марганцовистая | MnO42– | Манганат |
| HMnO4 | Марганцовая | MnO4– | Перманганат |
| HCOOH | Метановая (Муравьиная кислота) | HCOO– | Формиат |
| HBO | Метаборная | BO– | Метаборат |
| HAsO2 | Метамышьяковистая | AsO2– | Метаарсенит |
| H2TiO3 или TiO(OH)2 | Метатитановая (β-титановая кислота) | TiO32– | Титанат |
| HPO3 | Метафосфорная | PO3– | Метафосфат |
Таблица кислот и кислотных остатков (2 часть):
| H2MoO4 | Молибденовая | MoO42– | Молибдат |
| H3BO3 | Ортоборная (Борная кислота) | BO33– | Борат |
| H3AsO4 | Ортомышьяковая | AsO43– | Арсенат |
| H3AsO3 | Ортомышьяковистая | AsO33– | Ортоарсенит |
| H2PbO4 | Ортосвинцовая кислота | PbO42– | Ортоплюмбат или плюмбат |
| H3PO4 | Ортофосфорная (Фосфорная кислота) | PO43– | Фосфат |
| H2SO5 | Кислота Каро (пероксомоносерная кислота, мононадсерная кислота) | SO52– | Пероксомоносульфат или кароат |
| HNCS | Роданистоводородная (Тиоциановая кислота) | SCN– | Тиоцианат |
| C7H6O3 | Салициловая | C7H6O3– | Салицилат |
| H2SO4 | Серная | SO42– | Сульфат |
| H2SO3 | Сернистая | SO32– | Сульфит |
| H2S | Сероводород (Сероводородная кислота) | S2– | Сульфид |
| H2SO3S | Тиосерная | SO3S2– | Тиосульфат |
| H2CO3 | Угольная | CO32– | Карбонат |
| HF | Фтороводород (Плавиковая кислота) | F– | Фторид |
| HCl | Хлороводород (Соляная кислота) | Cl– | Хлорид |
| H2CrO4 | Хромовая | CrO42– | Хромат |
| HClO2 | Хлористая | ClO2– | Хлорит |
| HClO4 | Хлорная | ClO4– | Перхлорат |
| HClO3 | Хлорноватая | ClO3– | Хлорат |
| HClO | Хлорноватистая | ClO– | Гипохлорит |
| HCN | Циановодород (Синильная кислота) | CN— | Цианид |
| H2C2O4 | Этандиовая (Щавелевая кислота) | C2O42– | Оксалат |
| CH3COOH | Этановая (Уксусная кислота) | CH3COO– | Ацетат |
| C4H6O5 | Яблочная (Оксиянтарная, Гидроксибутандиовая кислота) | C4H4O52– | Малат |
Коэффициент востребованности
19 729