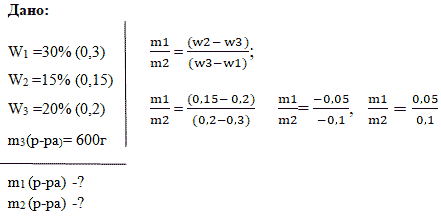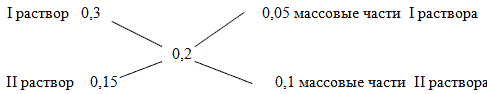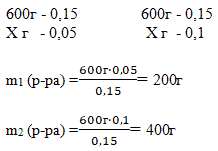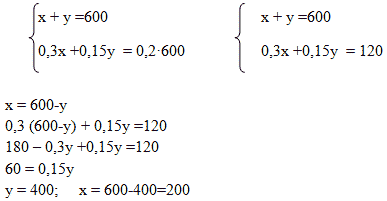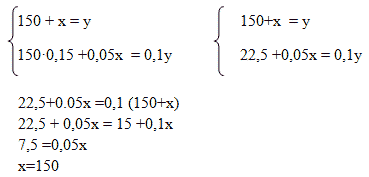Как найти массу конечного раствора в задачке по химии?
Ученик
(155),
закрыт
2 года назад
Екатерина Ганженко
Высший разум
(132713)
10 лет назад
NaOH + SO2 = NaHSO3 2NaOH + SO2 = Na2SO3 + H2O
m NaOH = 1.12*178.6*0.05 = 10.002г v NaOH = 10/40 = 0.25 моль
vSO2 = 3.36/22.4 = 0.15моль
х моль соли NaHSO3 образовалось, прореагировало х моль NaOH и х моль SO2
v Na2SO3 = (0.25 -x) /2 . v SO2 = (0.25-x) /2 по реакции образования средней соли
(0,25-х) /2 = 0,15-х, х= 0,05 моль
mNaHSO3 = 104*0.05 = 5.2г m Na2SO3 = 126*0.1 = 12.6г, масса раствора = 1,12*178,6 + 0,15*64 = 209,632г
w NaHSO3 = 5.2/ 210 = 0.025 или 2,5% w Na2SO3 = 12.6/210 = 0.06 или 6%
В ЕГЭ по химии несколько расчетных задач. Три из них относительно просты. Это задача на растворы (№27) и задачи, связанные с расчетами по химическому уравнению (№№ 28 и 29).
Более сложная задача на нахождение массовой доли вещества в смеси
(№ 34) отличается своеобразием как в химизме, так и в расчетах. В основе этой задачи как минимум 2 последовательных или параллельных реакции различных типов, включая электролиз и гидролиз. Набор реагентов, промежуточных веществ и продуктов – самый разнообразный, от олеума до кислых и комплексных солей.
Особенности расчетов связаны с использованием растворимости веществ, избытка одного из реагентов, неполнотой протекания реакции или использования реакционной смеси, применением в реакции металлической пластинки и т.д.
Можно сказать, что 34 задача – один из самых «грозных» вопросов ЕГЭ по химии. По силу справиться с ней только тому, кто не допустит ошибок в химизме и правильно выберется из лабиринта расчетов.
В интернете представлено множество видеоматериалов и статей, направленных на помощь школьникам в решении этой задачи. Общим для большинства материалов является подход, учитывающий особенности оценки 34 задачи: сперва – рекомендуется написать все уравнения, затем – выявить логику решения и в соответствии с ней провести расчеты. Этот подход сформировался в то время, когда задание на нахождение массовой доли было проще и «прозрачнее» (см.таблицу).
Для устранения (уменьшения) этих проблем мною при обучении школьников решению 34 задачи применяется прием «step by step» (шаг за шагом). Его сущность заключается в анализе каждого предложения текста задачи, извлечении из него максимума информации, и только после этого мы переходим к следующему предложению. В этом случае на каждый этап решения задачи ученик приходит уже полностью вооруженным информацией о составе реакционной смеси. Это дает ему возможность более успешно определиться с химизмом и логикой последующего решения.
Продемонстрирую данный прием на решении задач, приведенных в таблице.
1. Задача 2018 года
Для проведения электролиза (на инертных электродах) взяли 282 г 40%-ного раствора нитрата меди(II). После того как масса раствора уменьшилась на 32 г, процесс остановили. К образовавшемуся раствору добавили 140 г 40%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
Необходимо отметить, что я давно перестала заносить числовую информацию в раздел «Дано». Причины – в ЕГЭ не оценивается наличие этого раздела, на его запись тратится драгоценное время, а самое главное – прием «step by step» позволяет обходиться без дополнительного акцентирования внимания на числах.
При оформлении решения буду выделять цель каждого действия.
Решение.
1. Цель – анализ и использование информации из 1 предложения
«Для проведения электролиза (на инертных электродах) взяли 282 г 40%-ного раствора нитрата меди(II)».
а) уравнение реакции:
2Cu(NO3)2 +2H2O=2Cu↓+O2↑+4HNO3(1)
б) находим количество вещества Cu(NO3)2:
n Cu(NO3)2=282*0,4/188=0,6моль
2. Цель – извлечение максимума информации из 2 предложения
«После того как масса раствора уменьшилась на 32 г, процесс остановили».
а)Из уравнения реакции (1) видно, что 32 г= m(Cu)+m(O2)
На основании этой информации находим количество вещества Cu и O2.
Пусть n O2 = х моль, тогда n Cu = 2 х моль
32х+64*2х=32, откуда х=0,2 моль.
n O2= 0,2 моль, n Cu = 0,4 моль
б) на основании полученных результатов по уравнению реакции (1) находим количества
образовавшейся HNO3: n HNO3 = 0,8 моль
прореагировавшей Cu(NO3)2 : n Cu(NO3)2 прореаг = 0,4 моль
оставшейся в растворе Cu(NO3)2 : n Cu(NO3)2 оставш = 0,6-0,4 =0,2 моль
в) найдем массу образовавшегося раствора:
m пол.рра= m исх.рра –Δm=282-32=250 г
г) подведем итоги: в образовавшемся растворе содержатся
n HNO3 = 0,8 моль, n Cu(NO3)2 оставш = 0,2 моль, m пол.рра= 250 г
3. Цель – анализ и использование информации из 3 предложения
«К образовавшемуся раствору добавили 140 г 40%-ного раствора гидроксида натрия».
а) напишем уравнения потенциально возможных реакций между образовавшимся раствором и щелочью:
HNO3 +NaOH=NaNO3 +H2O (2)
Cu(NO3)2 + 2NaOH=NaNO3 +Cu(OH)2↓ (3)
б) найдем n NaOH исх =140*0,4/40=1,4 моль
найдем n NaOH прореаг = 0,8+0,2*2=1,2 моль (по 2 и 3 реакциям)
n NaOH оставш.=1,4-1,2=0,2 моль
в) найдем массу конечного раствора:
m кон.рра= 250 + m рра NaOH – m Cu(OH)2 =250+ 140-0,2*98=370,4 г
4.W(NaOH)=100*0,2*40/370,4=2,16%
Задача 2019 года
Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 200 мл воды. Раствор разлили на две колбы. К раствору в первой колбе добавили избыток соляной кислоты, при этом выделился газ объёмом 4,48 л (н.у.). К раствору во второй колбе добавили 222 г 25%-го раствора хлорида кальция. Определите массовую долю хлорида кальция в конечном растворе во второй колбе.
Решение.
1. Цель – извлечение максимума информации о приготовленном растворе
«Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 200 мл воды.».
а)найдем массу и количество вва Na2CO3, растворившегося в 200 мл воды:
В 100 г воды ——–31,8 г Na2CO3
В 200 г воды ———х г Na2CO3, откуда х=63,6 г
n Na2CO3=63,6/106=0,6 моль
б)найдем массу раствора: m рра=200+63,6=263,6г
2. Цель – анализ и использование информации из 2 предложения
«К раствору в первой колбе добавили избыток соляной кислоты, при этом выделился газ объёмом 4,48 л (н.у.).».
а)уравнение реакции
Na2CO3 +2HCl=2NaCl+CO2↑+H2O (1)
n(CO2)=4,48/22,4=0,2моль
б)найдем количество вва Na2CO3 в первой колбе
n1 Na2CO3=0,2 моль
в)найдем количество вва Na2CO3 и массу раствора во второй колбе
n2 Na2CO3=0,6-0,2 =0,4 моль, m2 раствора= 263,6*0,4/0,6=175,7 г
3. Цель – извлечение максимума информации из 3 предложения
«К раствору во второй колбе добавили 222 г 25%-го раствора хлорида кальция. Определите массовую долю хлорида кальция в конечном растворе во второй колбе».
а) уравнение :
Na2CO3 +СаCl2=2NaCl+СаСО3↓ (2)
Б)найдем n исх СаCl2=222*0,25/111=0,5 моль
Из условия задачи следует, что СаCl2- в избытке
Тогда n прореаг СаCl2= n2 Na2CO3=0,4 моль
n СаCl2 оставш=0,5-0,4=0,1 моль
в) найдем массу конечного раствора во второй колбе:
m кон.рра= 222+175,7- mСаСО3 =222+175,7-0,4*100=357,7 г
4.W(СаCl2)=100*0,1*111/357,7=3,1%
Таким образом, на двух примерах был продемонстрирован прием «step by step», упрощающий решение сложных многостадийных задач.
В следующей публикации будет разобрано решение этим приемом задач с участием кислых и комплексных солей.
Пример 5. Определите массу нитрата
натрия и воды, необходимые для приготовления
800 г раствора с ω(NaNO3) = 12%.
Решение:
Масса растворенной соли:
m(NaNO3) = ω(NaNO3)·m(р-ра) = 0,12·800 =
96 г.
m(р-ра) = m(NaNO3) + m(H2O)
Отсюда
m(H2O) = m(р-ра) – m(NaNO3) = 800 – 96
= 704 г.
Ответ: m(NaNO3) = 96 г, m(H2O) =
704 г.
Пример 6. Определите массу
кристаллогидрата CuSO4·5H2O и
воды, необходимые для приготовления
0,4 кг раствора с ω(CuSO4) = 8%.
Решение (см. пример 2):
ω(CuSO4) =
=
m(H2O) = m(р-ра) – m(CuSO4·5H2O)
m(CuSO4·5H2O) = n(CuSO4·5H2O)·M(CuSO4·5H2O)
n(CuSO4·5H2O)·= n(CuSO4) =
Находим
m(CuSO4) = ω(CuSO4)·m(р-ра) = 0,08·400
= 32 г.
n(CuSO4) =
=
0,2 моль.
Отсюда m(CuSO4·5H2O) = 0,2·250 = 50 г
Масса воды m(H2O) = 400 – 50 = 350 г
Ответ: m(CuSO4·5H2O) = 50 г,
m(H2O) = 350 г.
1. 2. Вычисление массы раствора определенной концентрации по заданной массе растворенного вещества или растворителя
Пример 7. Определить массу раствора
с массовой долей K2SO4 10%,
который можно приготовить из 200 г воды
и сульфата калия.
Решение:
m(р-ра) =
Из условия задачи m(K2SO4)
неизвестна, но известна масса воды, а
поскольку вода – один из компонентов
раствора, то:
ω(Н2О) = 100% – ω(K2SO4) =
100 – 10 = 90%
m(р-ра) =
=
= 222,2 г.
Ответ: можно приготовить 222,2 г
раствора.
Пример 8. При растворении в 400 г воды
некоторого количества CuSO4·5H2O
получен раствор с массовой долей CuSO4
5%. Рассчитать массу использованного
кристаллогидрата и массу полученного
раствора.
Решение (см. примеры 2, 6):
m(р-ра) =
=
В этом уравнении неизвестны m(р-ра) и
m(CuSO4), но
m(р-ра) = m(CuSO4·5H2O) + m(H2O)
= m(CuSO4·5H2O) + 400
Таким образом, неизвестны две величины:
m(р-ра) и m(CuSO4·5H2O).
m(CuSO4) = n(CuSO4)·m(CuSO4)
m(CuSO4·5H2O) = n(CuSO4·5H2O)·m(CuSO4·5H2O)
m(CuSO4)
= 160 г/моль, m(CuSO4·5H2O)
= 250 г/моль.
Подставим эти величины в исходную
формулу:
400 + n(CuSO4)·250 =
Решаем уравнение относительно n(CuSO4):
20 + 0,05·250· n(CuSO4) = n(CuSO4)·160,
n(CuSO4) =
= 0,136 моль.
Отсюда
m(CuSO4·5H2O) = 0,136·250 = 34 г,
m(р-ра) = 400 + 34 = 434 г.
Возможны и другие варианты решения этой
задачи:
ω(CuSO4) =
=
В этом уравнении тоже два неизвестных
– m(CuSO4) и m(CuSO4·5H2O), но
величину m(CuSO4) можно представить
в виде m(CuSO4·5H2O)·х.
Здесь х – массовая доля CuSO4 в
кристаллогидрате, она равна:
х =
=
= 0,64
С учетом исходных данных, теперь можно
записать:
0,05 =
Решаем уравнение относительно
m(CuSO4·5H2O):
20 + 0,05 m(CuSO4·5H2O) = 0,66·m(CuSO4·5H2O)
m(CuSO4·5H2O) = 34 г.
Находим m(р-ра) = 400 + 34 = 434 г.
Ответ: для приготовления раствора
используют 34 г CuSO4·5H2O, масса
полученного раствора 434 г.
1. 3. Разбавление и концентрирование растворов
При решении задач, связанных с разбавлением
и концентрированием растворов, следует
помнить, что масса растворенного
вещества остается неизменной, т.е.
m(Х) = const. Изменяется только масса
растворителя и, соответственно, масса
раствора.
Пример 9. К 50 мл раствора H2SO4
(ω1 = 48%, ρ = 1,38 г/мл) добавили 950 мл
воды. Определить массовую долю H2SO4
в полученном растворе.
Решение:
ω2(H2SO4) =
m2(р-ра) = m1(р-ра) + m(H2O)
m(H2O) = V(H2O)·ρ(H2O) = 950·1 =
950 г
m1(р-ра) = V1(р-ра)·ρ(р-ра) =
50·1,38 = 69 г
m1(H2SO4) = m1(р-ра)
ω1(H2SO4) = 69·0,48 = 33,12 г
ω2(H2SO4) =
= 0,032 или 3,2%
Ответ: ω(H2SO4) в новом
растворе 0,032 или 3,2%.
Пример 10. Какой объем воды необходимо
добавить к 100 мл раствора азотной кислоты
(ρ = 1,1 г/мл, ω1 = 20%), чтобы получить
раствор HNO3 с ω2 = 5%?
Решение:
V(H2O) =
m(H2O) = m2(р-ра) – m1(р-ра)
m1(р-ра) = V1(р-ра)·ρ(р-ра) =
100·1,1 = 110 г
Масса искомого раствора определяется
по формуле:
m2(р-ра) =
m(HNO3) = m1(р-ра)·ω1(р-ра)
= 110·0,2 = 22 г.
Отсюда масса нового раствора:
m2(р-ра) =
= 440 г
Масса и объем добавленной воды будут
равны
m(H2O) = 440 – 110 = 330 г V(H2O) =
=
330 мл
Ответ: следует добавить 330 мл воды.
Пример 11. Из 200 мл раствора сульфата
меди (ρ = 1,1 г/мл, ω1 = 8%)
выпарили
100 мл воды. Определить ω(CuSO4)
в полученном растворе.
Решение:
ω2(CuSO4) =
При концентрировании растворов масса
растворенного вещества, как и при
разбавлении, остается неизменной, т.е.
m(CuSO4) = const.
m(CuSO4) = m1(р-ра)·ω1(р-ра)
= 220·0,08 = 17,6 г
Масса раствора после упаривания
уменьшилась на 100 г:
m(H2O) = V(H2O)·ρ(H2O) = 100·1
= 100 г
Масса исходного раствора
m1(р-ра) = V1(р-ра)·ρ(р-ра) =
200·1,1 = 220 г
Следовательно, m2(р-ра) = 220 – 100 =
120 г
Отсюда ω2(CuSO4) =
= 0,147 или 14,7%
Ответ: ω(CuSO4) в полученном
растворе равна 0,147 или 14,7%.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Смесь, состоящая из частиц растворителя, растворяемого вещества и продуктов их взаимодействия, называется раствором. Это гомогенные структуры однородной консистенции, состоящие из двух либо нескольких компонентов. Решение задач на растворы – определение их концентрации, степени растворимости веществ, условий протекания растворообразующих процессов.
Задачи на растворы по химии
Чистое вещество либо смесь нескольких компонентов, попадая в растворитель, могут проявлять свойства:
- хорошей растворимости;
- малой растворимости;
- быть нерастворимыми.
При растворении в воде образуются многочисленные атомно-молекулярные связи. Их количество зависит от коэффициента растворимости – химической величины, которая рассчитывается путем деления массы растворяемого вещества на массу растворителя.
Кроме этого, в задачах могут присутствовать массовая доля вещества, растворенного в соответствующем растворителе.
Как решать задачи с процентными растворами
Растворы с выраженной концентрацией активного (растворенного) вещества носят название процентных. В задачах по химии ставятся цели определить содержание массы растворенного вещества, массы образовавшегося либо первоначального раствора, процентного содержания вещества до или после растворения.
Растворы, о которых идет речь в задачах по химии, обладают общими свойствами:
- они однородны;
- смешивание компонентов происходит за малый отрезок времени, как и изменение их концентрации;
- в результате смешивания двух (или более) растворов с различной концентрацией, происходит не только увеличение общей массы и объема раствора, но и усреднение процентного содержания растворенного вещества.
Поэтому существуют общие принципы их решения. Так, увеличение концентрации происходит в результате упаривания (испарения растворителя), а уменьшение – разбавления. В результате смешения может наблюдаться как увеличение, так и уменьшение, в зависимости от конкретных условий задачи.
В любом случае характеристики начального и конечного продуктов будут различаться, поэтому важно, данные в условии сведения не перепутать. Для этого применяется их нумерация.
Чтобы грамотно составить алгоритм решения, часто бывает полезно использовать уравнение химической реакции относительно активного вещества либо кислоты.
Концентрация растворов и способы ее выражения
На бытовом уровне понятие концентрации раствора выражается в отношении массы растворенного вещества к массе раствора, выраженном в процентах. Однако правомерно более широкое определение, охватывающее различные способы выражения концентрации.
Концентрация раствора – количественный показатель состава активного вещества в растворе, выраженное в определенных единицах и заключенное в единице массы или объема. Выражается в долях, процентах, массовых долях, молярности, мольных долях, титрах. Из них чаще применяются молярность и мольная доля.
1. О массовой доле ((omega)) идет речь в задачах, когда можно составить соотношение масс растворенного компонента и всего раствора. Для ее выражения существует формула:
(omega=M_{в-ва}div M_{р-ра})
Выражается она в процентах либо долевых частях единицы.
2. Молярность (по-другому – молярная концентрация) или (С) показывает сколько молей растворяемого компонента содержится в литре раствора. Ее формула имеет вид:
(С=ndiv V)
где (n) – это растворенное вещество в молях. Исходя из его значения, раствор может быть одномолярным (содержит 1 моль в 1 литре), децимолярным (0,1 моля в 1 л), сантимолярным (0,01 моль) и т.д.
3. Концентрация моляльная (обозначается (С_х)) – моляльность – показатель количества (n) молей растворенного компонента в 1 кг растворителя ((M_{р-ля})).
(C_x=ndiv M_{р-ля})
4. Для определения содержания (в граммах) вещества в 1 л раствора применяется понятие «титр» ((Т)).
(T=M_{в-ва}div V_{р-ра})
5. Под растворимостью ((S)) понимают максимальную массу растворяемого вещества, способного раствориться в 100 г растворителя:
(S=(M_{в-ва}div M_{р-ля})times100 {})
6. Коэффициент растворимости ((K_s)) – показатель, который определяется отношением массы вещества к массе растворителя при условии получения насыщенного раствора при обозначенной температуре:
(K_s=M_{в-ва}div M_{р-ля})
Решение задач на упаривание растворов
Выпаривание раствора происходит в результате испарения воды, что ведет за собой уменьшение общего объема и массы. В то же время масса растворенного вещества остается без изменений. Существуют случаи, когда, кроме растворителя, испаряется растворенное вещество, если оно обладает повышенной летучестью.
Пример. Водный раствор аммиака
Рассмотрим пример решения задачи на упаривание.
Условие: В наличии 800 г раствора с 15%-ной концентрацией определенного вещества. Нужно увеличить его массовую долю на 5%. Сколько г воды должно испариться?
Этапы решения:
- Какова масса вещества в первичном растворе?
(M_в=omega_вtimes M_р=0,15×800=120)г, где (M_в) – масса вещества, (M_р) – масса раствора
Найденное значение останется постоянным, поскольку при выпаривании изменения массы растворенного вещества не происходит. Значит M’=120г
2. (M_р=M_вdivomega_в= 120÷0.2=600)г
3. Теперь можно найти массу испаренной воды:
(M{исп;в}=M_р-M’=800-600=200)г
Решение задач на разбавление растворов
В результате процесса разбавления масса того вещества, которое растворено, не меняется в отличие от массы всего раствора и растворителя.
Задача
Масса имеющегося раствора NaCl 200г, его концентрация – 15%. К раствору добавлено 40г воды. Определить массовую долю NaCl в конце реакции.
Решение
1. Определение массы раствора в конце процесса:
(M’=M_{р-ра}+M_{добH2O}=240)г
2. Определение массы NaCl в начале процесса:
(M_{NaCl}=(omega_{NaCl}times M_р)div100%=15%times200гdiv100%=30 {})г
В конечном растворе (M’_ {NaCl}=M_{NaCl})
3. Определение массовой доли NaCl в конце процесса:
(omega’_{NaCl}=M_{NaCl}div M’_рtimes100%=12,5%)
Решение задач на концентрирование растворов
Повышение концентрации происходит при добавлении вещества в раствор. При этом конечная масса растворенного вещества равна сумме первоначального содержимого и того, который добавлен.
Задача. Имеется 180 г раствора с 8%-ной концентрацией соли (формула NaCl). В этот раствор всыпали еще 20 г поваренной соли. Какая массовая доля NaCl получилась в конце реакции?
Решение
1. Определение окончательной массы раствора:
(M’_р=M_р+M_{доб}=200)г
2. Определение конечной массы NaCl:
M’=M+Mдоб
Следовательно, нужно найти (M) – массу в начале процесса.
(M=(omega_{NaCl}times M_р)÷100%=14,4)г
Тогда (M’=14,4г+20г=34,4)г
3. Определение массовой доли NaCl в конечном продукте:
(omega’=M’_{NaCl}div M’_рtimes100%=17,2%)
Решение задач на смешение растворов
Смешение растворов с различной концентрацией растворенного вещества происходит с соблюдением «конверта Пирсона». Это – диагональная модель, при которой нельзя складывать массовые доли, а можно – лишь массы растворенных компонентов и растворов.
Задача
Дано два раствора с массами (M) и (M_1). Массовые доли растворенного вещества обозначим соответственно (ω) и (ω_1). В конечном продукте аналогичная величина – (ω_3). Необходимо приготовить третий раствор с отличной от имеющихся концентраций.
Решение
1. Определение общей массы растворенного вещества:
(M_1omega_1+M_2omega_2=omega_3(M_1+M_2))
2. Математические действия:
(M_1(omega_1-omega_3)=M_2=(omega_3-omega_2))
(M_1div M_2=(omega_3-omega_2)div(omega_1-omega_3))
Следовательно, согласно этому математическому выражению, и нужно взять соотношение растворов.
Задачи на определение процентной концентрации раствора
Задача 1
Какая процентная концентрация раствора (KNO_3), если нормальная равна (0,2) моль/л. Плотность равна (1) г/мл.
Решение:
1. Определение массы раствора объемом (1000) мл:
(M=rhotimes V=1times1000=1000)г
2. Составление и решение следующей пропорции:
(20,0)г (KNO_3) – (1000) г раствора
(Х_г) – (100) г раствора
(Х=2,02) г или (ω=2,02%)
Задача 2
Нужно приготовить (300) г 25%-ного раствора соли, имея 60%-ный и 10%-ный. Сколько нужно взять таких компонентов (m1 и m2)?
Для решения применим правило Креста:
1. Определение веса одной из 50-ти частей образуемого раствора:
(300div5=6)
2. Определение массы каждой части (m_1) и (m_2):
(m_1=6times15=90)
(m_2=6times35=210)
Задача 3
Используя 250г 45%-ного раствора соли, нужно понизить его концентрацию до 10%. Сколько воды необходимо использовать?
Концентрация соли в воде, используемой в качестве добавки, равна 0.
По методу креста образуется 45 частей раствора:
Решение
1. Масса одной части первичного раствора равна: (250div10=25)г
2. Определение массы воды, что необходима: (25times35=875)г
С целью проверки можно выполнить следующие действия:
1. Определение массы конечного продукта-раствора:
(875+25=1125г)
2. Для исходного раствора действует пропорция:
В 250г 40%-ного р-ра содержится Хг соли
в 100 г – 45г
Отсюда Х=112,5 г соли
3. Определение конечной концентрации раствора:
1125 г раствора – 112,5 соли
100г – Х
Х=10г или 10%
Следовательно, нужно взять 875 г воды.
Решать задачи на растворы – интересное занятие! Знание основных закономерностей будет полезно с теоретической и практической точек зрения. Однако бывают случаи, когда нужно быстро сдать контрольную либо перепроверить собственные решения. Тогда можно обратиться на сайт ФениксХелп.
При подготовке к экзамену в форме ЕГЭ задание 27 у обучающихся возникают вопросы по решению задач на смешивание и разбавление растворов. Эти задачи решают как на уроках математики, так и на уроках химии. Решение каждой задачи рассмотрено разными способами. Ученик может выбрать любой способ решения. Алгебраический способ решения задач на смешивание растворов учит детей строить цепочку логических рассуждений. «Конверт Пирсона» — это механический способ, который позволяет рационально проводить вычисления при решении задач на ЕГЭ.
Задачи на смешивание и разбавление растворов (по массе) можно разделить на следующие типы:
1. Задачи, связанные со смешиванием растворов, решаются по формуле:
W3,
где w3 — массовая доля растворенного вещества в конечном растворе;
m1(р.в.) — масса растворенного вещества в растворе с большей концентрацией;
m2(р.в.) — масса растворенного вещества в растворе с меньшей концентрацией;
m1(р-ра) — масса раствора с большей массовой долей растворенного вещества;
m2(р-ра) — масса раствора с меньшей массовой долей растворенного вещества.
2. Задачи на разбавление раствора, решаются по формуле:
3. Задачи на выпаривание раствора, решаются по формуле:
Для решение задач на смешивание растворов можно вывести формулу:
w3
w3 · ( m1 + m2 ) = w1·m1 + w2·m2
w3· m1+ w3· m2 = w1·m1 + w2·m2
m1· w3 – m1· w1= m2· w2- m2· w3
m1 (w3 – w1) = m2 (w2- w3)
=
,
где m1 и m2 массы исходных растворов,
w1 и w2 — соответствующие им массовые доли растворенного вещества;
m3 — масса конечного раствора;
w3 — массовая доля растворенного вещества в конечном растворе.
Таким образом: отношение массы первого раствора к массе второго равно отношению разности массовых долей второго раствора и смеси к разности массовых долей смеси и первого раствора.
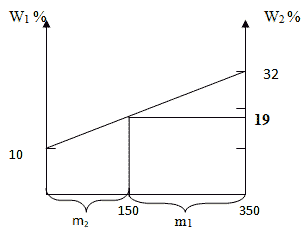
Задача 1. Смешали 200 г раствора с массовой долей некоторого вещества 10 % и 150 г раствора с массовой долей этого вещества 32 %. Вычислите массовую долю растворённого вещества в полученном растворе.
350·w3 =68; w3 = 0,19 или 19%
Cпособ 2. Решим задачу, путем последовательных вычислений:
m1 (р. в.) =200г · 0,1= 20 г
m2 (р. в.) =150г · 0,32= 48 г
m3 (р. в.)= 20+48 = 68г; m3 (р-ра) = 200+150 =350 г
W = 0,19 или 19%
Ответ: массовая доля растворенного вещества в полученном растворе равна 19 %.
Способ 3. Алгебраический: пусть, х массовая доля полученного раствора;
Масса вещества в первом растворе: 200г · 0,1;
Масса вещества во втором растворе: 150г · 0,32
Масса вещества в полученном растворе: х · (200г+150г); составим уравнение:
200 · 0,1 +150 · 0,32= х · (200+150);
20 +48 = 200х +150х
68 = 350х
х=0,19 или 19%
Ответ: массовая доля растворенного вещества в полученном растворе равна 19 %
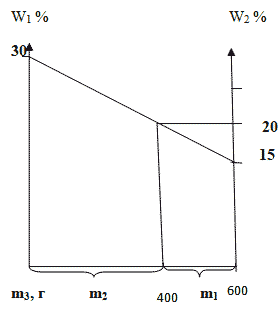
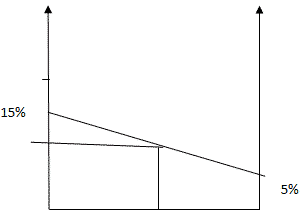
Способ 4. Графический метод
Отрезок прямой (основание графика) представляет собой массу смеси, а на осях ординат откладывают точки, соответствующие массовым долям растворенного вещества в исходных растворах. Соединив прямой точки на осях ординат, получают прямую, которая отображает функциональную зависимость массовой доли растворенного вещества в смеси от массы смешанных растворов в обратной пропорциональной зависимости. Данный способ является наглядным и дает приближенное решение.
Задача 2. Смешали 30 %-й раствор серной кислоты с 15%-ным раствором этой же кислоты и получили 600 г 20 %-го раствора.
Вычислите массу каждого раствора, необходимую для получения.
Способ 1. Решение с помощью «конверта Пирсона».
Составим диагональную схему правила смешивания для двух растворов.
Способ 2. Алгебраический
Пусть Х г – масса первого раствора; (600-х) г – масса второго раствора;
Масса вещества в первом растворе:0,3х;
Масса вещества во втором растворе: 0,15 · (600-х)
Масса вещества в полученном растворе: 0,2·600г; составим уравнение:
0,3х + 0,15 · (600-х) = 0,2·600
0,3х +90 – 0,15х = 120
0,15х = 30
Х=200 (масса первого раствора); 600-200=400 г – масса второго раствора
Способ 3. Алгебраический. Система уравнений
Пусть х г – масса первого раствора, у г – масса второго раствора. Система уравнений имеет вид:
Способ 4. Графический
Ответ: для приготовления 600 г 10 %-го раствора серной кислоты необходимо взять 200г 30 %-го раствора серной кислоты и 400г 20%-го раствора этой же кислоты.
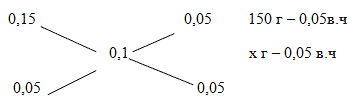
Задача 3. К 150 г 15% раствора карбоната натрия добавили 5% раствор карбоната натрия. Какое количество 5% раствора соли надо добавить, чтобы получить 10% раствор соли?
Способ 2. Решение с помощью «конверта Пирсона».
Составим диагональную схему правила смешивания для двух р-ов.
m2 (р-ра) == 150 г
Способ 3. Алгебраический
пусть Х г – масса второго раствора; (150+х) г – масса полученного раствора;
Масса вещества в первом растворе:0,15 · 150 = 22,5;
Масса вещества во втором растворе: 0,05х
Масса вещества в полученном растворе: 0,1 · (150+х); составим уравнение:
22,5 +0,05х = 0,1 · (150+х)
22,5 + 0,05х = 15 +0,1х
22,5-15= 0,1х-0,05х
7,5=0,05х
Х= 150 г
Способ 4. Алгебраический. Система уравнений
Пусть х г – масса второго раствора, у г – масса полученного раствора. Система уравнений имеет вид:
Графический способ
Ответ: чтобы получить 10% раствор соли надо добавить 150 г 5% раствора соли.
Задачи
1. Определите массовую долю кислоты в растворе, который получили смешиванием 200 г раствора с массовой долей кислоты 15% и 400г раствора с массовой долей кислоты 24% ?
2. Какие массы растворов хлороводорода с массовыми долями 12% и 28% нужно смешать для получения 480г раствора с массовой долей 22% ?
3. Сколько воды добавили к 300 граммам 30% раствора серной кислоты для получения 10% раствора серной кислоты?
4. К раствору массой 160г с неизвестной массовой долей соли добавили 80г воды. Вычислите массовую долю соли в исходном растворе, если после разбавления она равна 20%.
Литература
-
Ерыгин Д.П., Шишкин Е.А. Методика решения задач по химии׃ Учеб. пособие для студентов пед. ин-тов по биол. и хим. спец.- М.׃ Просвещение, 1989. – 176с.