← Молярная и молекулярная масса
- Относительная молекулярная масса Si: 28.0855
- Молярная масса Si: 28.0855 г/моль (0.02809 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| Si (кремний) | 1 | 28.0855 | 28.0855 |
| 28.0855 |
Расчёт молярной и относительной молекулярной массы Si
- Mr[Si] = Ar[Si] = 28.0855 = 28.0855
- Молярная масса (в кг/моль) = Mr[Si] : 1000 = 28.0855 : 1000 = 0.02809 кг/моль
Электронная конфигурация атома кремния
Калькулятор массы
Химическая формула соединения
Рассчитать
Поделитесь информацией с друзьями
Скачать перечень калькуляторов
Относительные молекулярные массы других соединений
Ga [69.723]
O3W [231.8382]
Калькулятор молекулярной массы

Не следует путать с кремнём — горной породой.
| Кремний | |||
|---|---|---|---|
| ← Алюминий | Фосфор → | |||
|
|||
| Внешний вид простого вещества | |||
|
Поликристаллический кремний (99,9 %) |
|||
| Свойства атома | |||
| Название, символ, номер | Кремний/Silicium (Si), 14 | ||
| Группа, период, блок |
14 (устар. 4), 3, p-элемент |
||
| Атомная масса (молярная масса) |
[28,086][комм 1][1] а. е. м. (г/моль) | ||
| Электронная конфигурация |
[Ne] 3s23p2 — 1s22s22p63s23p2 [Ne] 3s23p3 (гибридизация) |
||
| Радиус атома | 132 пм | ||
| Химические свойства | |||
| Ковалентный радиус | 111 пм | ||
| Радиус иона | 42 (+4e), 271 (−4e) пм | ||
| Электроотрицательность | 1,90 (шкала Полинга) | ||
| Электродный потенциал | 0 | ||
| Степени окисления | −4, 0, +2; +4 | ||
| Энергия ионизации (первый электрон) |
786,0 (8,15) кДж/моль (эВ) | ||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) | 2,33 г/см³ | ||
| Температура плавления | 1414,85 °C (1688 K) | ||
| Температура кипения | 2349,85 °C (2623 K) | ||
| Уд. теплота плавления | 50,6 кДж/моль | ||
| Уд. теплота испарения | 383 кДж/моль | ||
| Молярная теплоёмкость | 20,16[2] Дж/(K·моль) | ||
| Молярный объём | 12,1 см³/моль | ||
| Кристаллическая решётка простого вещества | |||
| Структура решётки | Кубическая, алмазная | ||
| Параметры решётки | 5,4307 Å | ||
| Температура Дебая | 645 ± 5[3] K | ||
| Прочие характеристики | |||
| Теплопроводность | (300 K) 149 Вт/(м·К) | ||
| Номер CAS | 7440-21-3 | ||
| Эмиссионный спектр | |||
|
|
Кре́мний (химический символ — Si, от лат. Silicium) — химический элемент 14-й группы (по устаревшей классификации — главной подгруппы четвёртой группы, IVA), третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 14.
Простое вещество кремний представляется в различных модификациях. В аморфной форме — это коричневый порошок, в кристаллической — тёмно-серый, слегка блестящий полуметалл, являющийся вторым по распространённости химическим элементом в земной коре (после кислорода).
Имеет очень важное значение для современной электроники.
История открытия[править | править код]
Существование кремния было предсказано Йёнсом Якобом Берцелиусом в 1810 году. Позже, в 1823 году он выделил аморфный кремний путём восстановления фторида SiF4 калием, подробно описал его химические свойства.
Впервые в чистом виде кремний был выделен в 1811 году французскими учёными Жозефом Луи Гей-Люссаком и Луи Жаком Тенаром.
Происхождение названия[править | править код]
В 1823 году шведский химик Йёнс Якоб Берцелиус действием металлического калия на фтористый кремний SiF4 получил чистый элементарный кремний. Новому элементу было дано название «силиций» (от лат. silex — кремень). Русское название «кремний» введено в 1834 году российским химиком Германом Ивановичем Гессом.
Нахождение в природе[править | править код]
Содержание кремния в земной коре составляет по разным данным 27,6—29,5 % по массе. Таким образом, по распространённости в земной коре кремний занимает второе место после кислорода. Концентрация в морской воде 3 мг/л[4].
В земной коре кремний встречается только в связанном виде. Чаще всего в природе кремний встречается в виде кремнезёма — соединений на основе диоксида кремния (IV) SiO2 (около 12 % массы земной коры). Основные минералы и горные породы, образуемые диоксидом кремния, — это песок (речной и кварцевый), кварц и кварциты, кремень, полевые шпаты.
Вторую по распространённости в природе группу соединений кремния составляют силикаты и алюмосиликаты.
Отмечены единичные факты нахождения чистого кремния в самородном виде[5].
Изотопы и их применение[править | править код]
Кремний состоит из стабильных изотопов 28Si (92,23 %), 29Si (4,67 %) и 30Si (3,10 %). Остальные изотопы являются радиоактивными.
Ядро 29Si (как и протон) имеет ядерный спин I = 1/2 и всё шире используется в спектроскопии ЯМР. 31Si, образующийся при действии нейтронов на 30Si, имеет период полураспада равный 2,62 ч. Его можно определить по характеристическому β-излучению, и он очень удобен для количественного определения кремния методом нейтронно-активационного анализа. Радиоактивный нуклид 32Si имеет самый большой период полураспада (~170 лет) и является мягким (низкоэнергетическим) β-излучателем[6].
Физические свойства[править | править код]
Кристаллическая структура[править | править код]
Кристаллическая структура кремния.
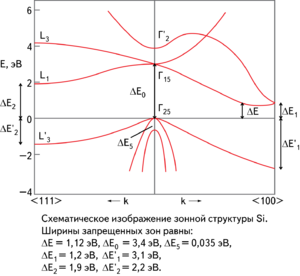
Схематическое изображение зонной структуры кремния[7]
Подвижность электронов и дырок в кремнии в зависимости от концентрации легирующей примеси при 300 К
Кристаллическая решётка кремния кубическая гранецентрированная типа алмаза, параметр а = 0,54307 нм (при высоких давлениях получены и другие полиморфные модификации кремния), из-за большей длины связи между атомами Si—Si по сравнению с длиной связи С—С твёрдость кремния значительно меньше, чем алмаза. Кремний хрупок, только при нагревании выше 800 °C он становится пластичным веществом.
Оптические свойства[править | править код]
Прозрачен для инфракрасного излучения с длиной волны в диапазоне от 1 до 9 микрометров[8].
Электрофизические свойства[править | править код]
Элементарный кремний в монокристаллической форме является непрямозонным полупроводником. Ширина запрещённой зоны при комнатной температуре составляет 1,12 эВ, а при Т = 0 К — 1,21 эВ[9]. Концентрация собственных носителей заряда в кремнии при нормальных условиях составляет около 1,5⋅1010 см−3[10].
На электрофизические свойства кристаллического кремния большое влияние оказывают содержащиеся в нём примеси. Для получения кристаллов кремния с дырочной проводимостью в кремний вводят атомы элементов III группы, таких, как бор, алюминий, галлий, индий. Для получения кристаллов кремния с электронной проводимостью в кремний вводят атомы элементов V группы, таких, как фосфор, мышьяк, сурьма.
При создании электронных приборов на основе кремния используется преимущественно приповерхностный слой монокристалла (толщиной до десятков мкм), поэтому качество поверхности кристалла может оказывать существенное влияние на электрофизические свойства кремния и, соответственно, на свойства созданного электронного прибора. При изготовлении некоторых приборов используется технология, модифицирующая поверхность монокристалла, например, обработка поверхности кремния различными химическими реагентами и её облучение.
- Некоторые электрофизические параметры монокристаллического кремния при нормальных условиях
- Диэлектрическая проницаемость: 12[2]
- Подвижность электронов: 1200—1450 см²/(В·c).
- Подвижность дырок: 500 см²/(В·c).
- Ширина запрещённой зоны 1,21 эВ при 0 К.
- Время жизни свободных электронов: 5 нс — 10 мс.
- Длина свободного пробега электронов: порядка 1 мм.
- Длина свободного пробега дырок: порядка 0,2—0,6 мм.
- Собственная концентрация носителей заряда: 5,81⋅1015 м−3 (при 300 K).
Химические свойства[править | править код]
Гибридизация[править | править код]
Схема ковалентных связей в кристаллическом кремнии
Подобно атомам углерода, для атомов кремния является характерным состояние sp3-гибридизации орбиталей, поэтому чистый кристаллический кремний образует алмазоподобную кубическую кристаллическую решётку с координационным числом 4, в которой кремний четырёхвалентен и связан с соседними атомами кремния ковалентными связями. В соединениях кремний обычно также проявляет себя как четырёхвалентный элемент со степенями окисления +4 или −4. Известны двухвалентные соединения кремния, например, монооксид кремния — SiO.
Химическая инертность кремния[править | править код]
При нормальных условиях кремний химически малоактивен и активно реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния 
.
Такая химическая инертность кремния связана с пассивацией поверхности слоем диоксида кремния нанометровой толщины, немедленно образующегося в присутствии кислорода, воздуха или воды (водяных паров).
Реакция с галогенами[править | править код]
При нагревании до температуры свыше 400—500 °C кремний реагирует с хлором, бромом и иодом — с образованием соответствующих легко летучих тетрагалогенидов 

Реакция с кислородом[править | править код]
При нагревании до температуры свыше 400—500 °C кремний реагирует с кислородом с образованием диоксида SiO2:
.
Процесс сопровождается увеличением толщины слоя диоксида на поверхности, скорость процесса окисления лимитируется диффузией атомарного кислорода сквозь плёнку диоксида.
Получение монооксида кремния[править | править код]
При восстановлении SiO2 кремнием при температурах свыше 1200 °C образуется оксид кремния (II) — SiO:
.
Этот процесс постоянно происходит при производстве выращивании монокристаллов кремния методами Чохральского, направленной кристаллизации, потому что в них используются тигли из диоксида кремния, как наименее загрязняющего кремний материала.
Получение силанов[править | править код]
С водородом кремний непосредственно не реагирует. Соединения кремния с водородом — силаны с общей формулой 

Образующийся в этой реакции силан 



Реакция с азотом и бором[править | править код]
С азотом и бором кремний реагирует при температуре около 1000 °C, образуя соответственно нитрид Si3N4 и термически и химически стойкие бориды разного состава SiB3, SiB6 и SiB12.
Получение карборунда[править | править код]
При температурах свыше 1000 °C можно получить соединение кремния и его ближайшего аналога по таблице Менделеева — углерода — карбид кремния SiC (карборунд), который характеризуется высокой твёрдостью и низкой химической активностью:
.
Карборунд широко используется как абразивный материал. При этом расплав кремния (1415 °C) может длительное время контактировать с углеродом в виде крупных кусков плотноспечённого мелкозернистого графита изостатического прессования, практически не растворяя и никак не взаимодействуя с последним.
Растворимость некоторых металлов в кремнии[править | править код]
Нижележащие элементы 4-й группы (Ge, Sn, Pb) неограниченно растворимы в кремнии и многие другие металлы.
Силициды[править | править код]
При нагревании кремния с металлами могут образовываться их соединения — силициды:
.
Силициды можно подразделить на две группы: ионно-ковалентные (силициды щелочных, щёлочноземельных металлов и магния типа Ca2Si, Mg2Si и др.) и металлоподобные (силициды переходных металлов). Силициды активных металлов разлагаются под действием кислот, силициды переходных металлов химически стойки и под действием кислот не разлагаются.
Металлоподобные силициды имеют высокие температуры плавления (до 2000 °C). Наиболее часто образуются металлоподобные силициды составов MeSi, Me3Si2, Me2Si3, Me5Si3 и MeSi2. Металлоподобные силициды химически инертны, устойчивы к действию кислорода даже при высоких температурах.
С железом кремний образует эвтектическую смесь, что позволяет спекать (сплавлять) эти материалы для образования ферросилициевой керамики при температурах, заметно меньших, чем температуры плавления железа и кремния.
Некоторые кремнийорганические соединения[править | править код]
Для кремния характерно образование кремнийорганических соединений, в которых атомы кремния соединены в длинные цепочки за счёт мостиковых атомов кислорода 






Пример реакции получения:
.
Травление кислотами[править | править код]
Для травления кремния наиболее широко используют смесь плавиковой и азотной кислот. Некоторые специальные травители предусматривают добавку хромового ангидрида и иных веществ. При травлении кислотный травильный раствор быстро разогревается до температуры кипения, при этом скорость травления многократно возрастает.
,
,
.
Травление щелочами[править | править код]
Для травления кремния могут использоваться водные растворы щелочей. Травление кремния в щелочных растворах начинается при температуре раствора более 60 °C.
,
.
Получение[править | править код]
Свободный кремний получается при прокаливании мелкого белого песка (диоксида кремния) с магнием:
,
при этом образуется аморфный кремний, имеющий вид бурого порошка[11].
В промышленности кремний технической чистоты получают, восстанавливая расплав SiO2 коксом при температуре около 1800 °C в рудотермических печах шахтного типа. Чистота полученного таким образом кремния может достигать 99,9 % (основные примеси — углерод, металлы).
Возможна дальнейшая очистка кремния от примесей.
- Очистка в лабораторных условиях может быть проведена путём предварительного получения силицида магния Mg2Si. Далее из силицида магния с помощью соляной или уксусной кислот получают газообразный моносилан SiH4. Моносилан очищают ректификацией, сорбционными и др. методами, а затем разлагают на кремний и водород при температуре около 1000 °C.
- Очистка кремния в промышленных масштабах осуществляется путём непосредственного хлорирования кремния. При этом образуются соединения состава SiCl4, SiHCl3 и SiH2Cl2. Их различными способами очищают от примесей (как правило, перегонкой и диспропорционированием) и на заключительном этапе восстанавливают чистым водородом при температурах от 900 до 1100 °C.
- Разрабатываются более дешёвые, чистые и эффективные промышленные технологии очистки кремния. На 2010 год к таковым можно отнести технологии очистки кремния с использованием фтора (вместо хлора); технологии, предусматривающие дистилляцию монооксида кремния; технологии, основанные на вытравливании примесей, концентрирующихся на межкристаллитных границах.
Содержание примесей в доочищенном кремнии может быть снижено до 10−8—10−6 % по массе. Более подробно вопросы получения сверхчистого кремния рассмотрены в статье Поликристаллический кремний.
Способ получения кремния в чистом виде разработан Николаем Николаевичем Бекетовым.
В России технический кремний производится «ОК Русал» на заводах в г. Каменск-Уральский (Свердловская область) и г. Шелехов (Иркутская область).
Применение[править | править код]
Технический кремний находит следующие применения:
- сырьё для металлургических производств: компонент некоторых сплавов (бронзы, алюминиевых литейных сплавов силумины);
- раскислитель (при выплавке чугуна и сталей); модификатор свойств металлов или легирующий элемент (например, добавка определённого количества кремния при производстве трансформаторных сталей уменьшает коэрцитивную силу готового ферромагнитного материала) и т. п.;
- сырьё для производства более чистого поликристаллического кремния и очищенного металлургического кремния (в литературе называется «umg-Si»);
- сырьё для производства кремнийорганических материалов, силанов;
- иногда кремний технической чистоты и его сплав с железом (ферросилиций) используется для производства водорода в полевых условиях;
- для производства солнечных батарей;
- антиблок (антиадгезивная добавка) в промышленности пластмасс.
Сверхчистый кремний преимущественно используется для производства различных дискретных электронных приборов (транзисторов, полупроводниковых диодов) и микросхем.
Чистый кремний, отходы сверхчистого кремния, очищенный металлургический кремний в виде поликристаллического кремния являются основным сырьевым материалом для солнечной энергетики.
Монокристаллический кремний — помимо электроники и солнечной энергетики, используется для изготовления оптических элементов, работающих в инфракрасном диапазоне и зеркал газовых лазеров.
Соединения металлов с кремнием — силициды — являются широко употребляемыми в промышленности (например, электронной и атомной) материалами с сочетанием полезных химических, электрических и ядерных свойств (устойчивость к окислению, нейтронам и др.). Силициды ряда химических элементов являются важными термоэлектрическими материалами.
Соединения кремния служат основой для производства стекла и цемента. Производством стекла и цемента занимается силикатная промышленность, также производящая другие силикатные материалы — силикатную керамику — кирпич, фарфор, фаянс и изделия из них.
Широко известен силикатный клей, применяемый в строительстве как вяжущее средство, а в пиротехнике и в быту для склеивания бумаги и картона.
Получили широкое распространение силиконовые масла и силиконы — материалы на основе кремнийорганических соединений.
Биологическая роль[править | править код]
Для некоторых организмов кремний является важным биогенным элементом. Он входит в состав опорных образований у растений и скелетных — у животных. В больших количествах кремний концентрируют морские организмы — диатомовые водоросли, радиолярии, губки. Относительно других видов наземных растений большие количества кремния содержатся в хвощах (род Equisetum), злаках, в основном, подсемейства Бамбуковые (Bambusoideae) и видах рода Рис (Orýza), в том числе в культурном рисе.
Он также входит в клеточные стенки некоторых организмов и является активным центром более десятка изученных ферментов, ответственных за связывание диатомового кремнезёма y некоторых ракообразных.
Кремний встречается во многих растениях в виде элемента, который необходим для правильного развития, но не было доказано, что он необходим для развития всех видов. Обычно его присутствие повышает устойчивость к вредителям, особенно грибам, препятствует их проникновению в ткани растений, насыщенных кремнезёмом. Точно так же, в случае животных, потребность в кремнии была показана для шестилучевых губок, но, хотя это происходит в телах всех животных, это, как правило, не оказывается необходимым для них. У позвоночных накопление кремния происходит в относительно больших количествах в волосах и перьях (например, овечья шерсть содержит 0,02—0,08 % 
В организме человека[править | править код]
Доказано, что кремний имеет важное значение для здоровья человека, в частности, для ногтей, волос, костей и кожи[12]. Исследования показывают, что женщины в пременопаузе с более высоким потреблением биодоступного кремния имеют более высокую плотность костной ткани, а также, что добавки кремния может увеличить объём и плотность кости у пациентов с остеопорозом[13].
Потребность организма человека — около 20—30 мг кремния в день. Беременным женщинам, людям после хирургических операций на костях и пожилым людям требуется более высокая доза, так как количество этого элемента в органах уменьшается с возрастом. Это происходит главным образом в соединительной ткани, из которой строятся сухожилия, слизистые оболочки, стенки кровеносных сосудов, клапаны сердца, кожа и костно-суставная система.
Кремний способствует удалению токсичных веществ из клеток, воздействует на капилляры, повышая прочность и эластичность их стенок, увеличивает прочность костной ткани, усиливает защитные силы организма от инфекций, предотвращает преждевременное старение. Снимает раздражения и воспаления кожи, улучшая её общий вид и предотвращая вялость, уменьшает выпадение волос, ускоряет их рост, укрепляет ногти.
Поскольку кремний участвует в формировании костной ткани, обеспечивая эластичность кровеносных сосудов, участвующих в поглощении кальция из пищи и роста волос и ногтей, его дефицит в организме человека может вызвать заболевания костей, общее замедление роста, бесплодие, отсутствие развития и остеопороз.
Гигиенические аспекты[править | править код]
Диоксид кремния в нормальных условиях является твёрдым биоинертным, неразлагаемым веществом, склонным к образованию пыли, состоящей из микрочастиц с острыми кромками. Вредное действие диоксида кремния и большинства силицидов и силикатов основано на раздражающем и фиброгенном действии, на накоплении вещества в ткани лёгких, вызывающем тяжёлую болезнь — силикоз.
Для защиты органов дыхания от пылевых частиц используются противопылевые респираторы. Тем не менее, даже при использовании средств индивидуальной защиты носоглотка, горло у людей, систематически работающих в условиях запылённости соединениями кремния и особенно монооксидом кремния, имеют признаки воспалительных процессов на слизистых оболочках.
Нормы предельно допустимых концентраций по кремнию привязаны к содержанию пыли диоксида кремния в воздухе. Это связано с особенностями химии кремния:
- Чистый кремний, равно как карбид кремния, в контакте с водой или кислородом воздуха образует на поверхности непроницаемую плёнку диоксида кремния, которая пассивирует поверхность;
- Многие кремнийорганические соединения в контакте с кислородом воздуха и водяными парами окисляются или гидролизуются с образованием в конечном итоге диоксида кремния;
- Монооксид кремния (
) на воздухе способен (иногда со взрывом) доокисляться до высокодисперсного диоксида кремния.
Комментарии[править | править код]
- ↑ Указан диапазон значений атомной массы в связи с неоднородностью распространения изотопов в природе.
Примечания[править | править код]
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02. Архивировано 5 февраля 2014 года.
- ↑ 1 2 Химическая энциклопедия: в 5 т / гл. ред. Кнунянц И. Л.. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 508. — 671 с. — 100’000 экз.
- ↑ При температуре 0 — К. Баранский П. И., Клочков В. П., Потыкевич И. В. Полупроводниковая электроника. Справочник. — Киев: «Наукова думка», 1975. — 704 с. ил.
- ↑ J. P. Riley and Skirrow G. Chemical Oceanography V. 1, 1965.
- ↑ Металлический кремний в ийолитах Горячегорского массива. Архивная копия от 17 июня 2013 на Wayback Machine, Петрология обыкновенных хондритов Архивная копия от 10 января 2014 на Wayback Machine.
- ↑ Гринвуд Н. Н. Химия элементов. — 3-е изд. — 2015. — С. 312. — 607 с.
- ↑ Смит Р. Полупроводники: Пер. с англ. — М.: Мир, 1982. — 560 с, ил.
- ↑ Физическая энциклопедия : [в 5 т.] / Гл. ред. А. М. Прохоров. — М.: Советская энциклопедия (т. 1—2); Большая Российская энциклопедия (т. 3—5), 1988—1999. — ISBN 5-85270-034-7.
- ↑ Зи С. Физика полупроводниковых приборов: В 2 книгах. Кн. 1. Пер. с англ. — М.: Мир, 1984. — 456 с., ил.
- ↑ Коледов Л. А. Технологии и конструкции микросхем, микропроцессоров и микросборок: Учебное пособие // 2-е изд., испр. и доп. — СПб.: Издательство «Лань», 2007. — С. 200—201. — ISBN 978-5-8114-0766-8.
- ↑ Глинка Н. Л. Общая химия. — 24-е изд., испр. — Л.: Химия, 1985. — С. 492. — 702 с.
- ↑ Martin, Keith R. Chapter 14. Silicon: The Health Benefits of a Metalloid // Interrelations between Essential Metal Ions and Human Diseases (англ.) / Astrid Sigel; Helmut Sigel; Roland K.O. Sigel. — Springer (англ.) (рус., 2013. — Vol. 13. — P. 451—473. — (Metal Ions in Life Sciences). — ISBN 978-94-007-7499-5. — doi:10.1007/978-94-007-7500-8_14.
- ↑ Jugdaohsingh, R. Silicon and bone health (англ.) // The Journal of Nutrition, Health and Aging (англ.) (рус. : journal. — Vol. 11, no. 2. — P. 99—110. — PMID 17435952. — PMC 2658806.
Литература[править | править код]
- Самсонов. Г. В. Силициды и их использование в технике. — Киев, Издательство АН УССР, 1959. — 204 с. с илл.
Ссылки[править | править код]
- Кремний на Webelements
- Кремний в Популярной библиотеке химических элементов
- Кремний в Популярной библиотеке минералов
heraz
Вопрос по химии:
Определите атомную массу элемента кремния, если он состоит из трех изотопов: 28Si (92,3%), 29Si (4,7%) и 30Si (3,0%).Можно с даном пж буду вам очень бгадарен!))
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок – бесплатно!
Ответы и объяснения 1
pathodbt
Дано:
wSi²⁸=92.3%=0.923
wSi²⁹=4.7%=0.047
wSi³⁰=3%=0.03
найти: ArSi-?
решение:
ArSi=28·0.923+29·0.047+30·0.03=28.1
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат – это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи –
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.

Определите атомную массу элемента кремния, если он состоит из трех изотопов: 28Si (92,3%), 29Si (4,7%) и 30Si (3,0%).Можно с даном пж буду вам очень бгадарен!))
Каждый, кто уже немного продвинулся в изучении химии, сталкивается с понятием «моль». Правда, большинство сразу думает о моли, которая съела за лето шубу в шкафу, но моль в химии – это совсем другая история. И вот сейчас мы в этом разберёмся.
Итак, давайте посмотрим на какую-нибудь химическую реакцию. Например, такую:
Н2+F2=2HF
Здесь 1 молекула водорода H2 реагирует с одной молекулой фтора F2 и получается две молекулы фторида водорода. Напомню, то число молекул или атомов, вступающих в реакцию или получающихся в реакции, определяется коэффициентом, то есть цифрой, стоящей перед формулой вещества. В нашем примере перед водородом не стоит ничего, но на самом деле мы можем поставить здесь единицу, то есть нам нужна 1 молекула водорода. Перед фтором тоже не стоит ничего, значит, нам нужна 1 молекула фтора. А вот перед фторидом водорода HF стоит двойка. Это означает, что у нас получилось 2 молекула фторида водорода. То есть:
Н2 + F2 = 2HF – это то же самое, что и
1 молекула H2 + 1 молекула F2 = 2 молекулы HF.
Но вы знаете, что молекулы так малы, что мы их увидеть не можем. Как же нам считать эти молекулы, вступающие в реакцию? Для этого и ввели понятие МОЛЬ.
Моль – это количество вещества, в котором содержится столько же частиц, сколько атомов содержится в 12 граммах углерода с атомной единицей массы 12.
Это довольно мудрёное определение, но его нужно запомнить. Есть и приятный момент: в одном моле любого вещества содержится число Авогадро частиц. Вот оно, это число:
Такое число представить сложно. Вы только подумайте, миллиард – это 1 000 000 000. А в одном моле частиц 6,02*100 000 000 000 000 000 000 000! (Но чтобы не видеть по ночам кошмаров, просто запомните 6,02*10 в двадцать третьей степени).
Итак, в одном моле любого вещества содержится 6,02*10 в двадцать третьей степени частиц. Но мы же знаем, что атомы разных веществ имеют разное строение, а поэтому и разную массу. Поэтому и массы одного моля у разных веществ различаются. Чтобы разобраться в этом, давайте поедем на дачу и проведём эксперимент.
Мы точно помним, что 1 моль – это всегда одинаковое число частиц (6,02*10 в двадцать третьей степени ). Но в обычной жизни таких чисел нет, поэтому возьмём число поменьше, например, 100. Это будет наш условный экспериментальный моль. Теперь в одну кучу складываем 100 вишен, в другую кучу – 100 груш, в третью – 100 арбузов. Куча – это 1 моль. В каждую кучу мы добросовестно сложили одинаковое число частиц, верно? Но частицы эти разного вида: в одной куче вишни, в другой – груши, в третьей – арбузы. А теперь будем взвешивать. Как вы думаете, будет ли различаться масса 100 вишен, 100 груш и 100 арбузов? Конечно же, будет. При этом обратите внимание: число частиц в каждой куче одинаково, но весят эти кучи по-разному. Почему? Потому что частицы разные!
В химии всё точно так же. Если взять 1 моль водорода, 1 моль кислорода и 1 моль натрия, то масса их будет разной (вспоминаем поездку на дачу). И это важно. Но теперь возникает закономерный вопрос: а как же узнать, какова масса 1 моль водорода, 1 моль кислорода и 1 моль натрия и вообще любого вещества? Для этого вводится понятие молярная масса.
Молярная масса и есть масса 1 моля вещества.
Как её определить? Просто. Это атомная масса или молекулярная масса вещества, которую мы рассчитываем, пользуясь таблицей Менделеева. Молярная масса обозначается буквой М и выражается в г/моль (просто потому, что она показывает сколько граммов вести 1 моль). Примеры из учебника химии.
Пример 1.
Найдите массу одного моля (она же молярная масса) алюминия.
Решаем химию и смотрим в таблицу Менделеева. Видим, что атомная масса алюминия 27. Формула просто вещества алюминия – Al, то есть атом здесь один. Следовательно, молярная масса алюминия совпадает с атомной и равна 27 г/моль.
Пример 2.
Найдите молярную массу фтора.
Фтор у нас в обычных условиях – газ, поэтому молекула фтора состоит из двух атомов и выглядит так: F2. В периодической таблице находим фтор и видим, что его атомная масса 19. Следовательно, молярная масса фтора 2*19=38 г/моль.
Пример 3.
Найдите молярную массу оксида кальция.
Формула оксида кальция СаО. Опять смотрим в таблицу: атомная масса кальция 40, атомная масса кислорода 16. Молярная масса оксида кальция 40+16=56 г/моль.
Пример 4.
Найдите молярную массу оксида кремния.
Формула оксида кремния SiO2. Таблица Менделеева сообщает, что атомная масса кремния 28, кислорода – 16. Будьте внимательны, в этом вопросе подвох! В формуле оксида два атома кислорода, обязательно учтите это, чтобы ответ был верным. И он будет таким: молярная масса оксида кремния 28+16*2=60 г/моль. (16 – масса одного атома кислорода, у нас в формуле их два, поэтому мы и умножили 16 на 2!).
Пример 5.
Сложный пример от репетитора по химии. Но я рекомендую всё-таки вникнуть и разобраться, чтобы прояснить всё окончательно. Итак, ответьте, какова молярная масса серной кислоты.
Здесь придётся сосредоточиться, чтобы не запутаться. Формула серной кислоты H2SO4, то есть у нас имеется:
· 2 атома водорода
· 1 атом серы
· 4 атома кислорода.
Смотрим в периодическую таблицу и определяем атомные массы:
· атомная масса водорода – 1
· атомная масса серы – 32
· атомная масса кислорода – 16.
Переходим к расчёту:
2 атома водорода + 1 атом серы + 4 атома кислорода
2*1 + 1*32 + 4*16
В этом выражении в каждом слагаемом первый множитель – число атомов элемента, второй множитель – атомная масса. Дальше просто математика: 2*1+1*32+4*16=98. И да, молярная масса серной кислоты 98 г/моль.
Уверена, теперь вы различите моль в шкафу и моль в химии. А дальше мы будем разбираться, как взвесить на обычных весах эти моли.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.



![{displaystyle {ce {Si + O2 ->[400-500^oC] SiO2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3712273ede970550b9e372755c704da3c0a0478a)
![{displaystyle {ce {Si + SiO2 ->[t > 1200^oC] 2SiO}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f85d20ae760f3340e71107c0a23029c175322e07)

![{displaystyle {ce {Si + C ->[t > 1000^oC] SiC}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e6e18bbc6de4d9efd1c2d5d761280aeb637e774f)
![{displaystyle {ce {mSi+nMe->[t^{ce {oC}}]Me_{n}Si_{m}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9ce619a250009b575b4451c5e7e375c8cbd724d5)










