← Молярная и молекулярная масса
- Относительная молекулярная масса Kr: 83.798
- Молярная масса Kr: 83.798 г/моль (0.0838 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| Kr (криптон) | 1 | 83.798 | 83.798 |
| 83.798 |
Расчёт молярной и относительной молекулярной массы Kr
- Mr[Kr] = Ar[Kr] = 83.798 = 83.798
- Молярная масса (в кг/моль) = Mr[Kr] : 1000 = 83.798 : 1000 = 0.0838 кг/моль
Электронная конфигурация атома криптона
Калькулятор массы
Химическая формула соединения
Рассчитать
![]()
Поделитесь информацией с друзьями
![]()
Скачать перечень калькуляторов
Относительные молекулярные массы других соединений
C3O2 [68.0309]
O4SZn [161.4716]
Калькулятор молекулярной массы

| Криптон | |||
|---|---|---|---|
| ← Бром | Рубидий → | |||
|
|||
| Внешний вид простого вещества | |||

Свечение криптона в газоразрядной трубке |
|||
| Свойства атома | |||
| Название, символ, номер | Крипто́н / Krypton (Kr), 36 | ||
| Группа, период, блок |
18 (устар. 8), 4, p-элемент |
||
| Атомная масса (молярная масса) |
83,798(2)[1] а. е. м. (г/моль) | ||
| Электронная конфигурация |
[Ar] 3d104s24p6 1s22s22p63s23p63d104s24p6 |
||
| Радиус атома | 198 пм[2]; 88[3] пм | ||
| Химические свойства | |||
| Ковалентный радиус | 109 пм[2]; 116[3] пм | ||
| Радиус иона | 169[3] пм | ||
| Электроотрицательность | 3,0 (шкала Полинга) | ||
| Электродный потенциал | 0 | ||
| Степени окисления | 0, +2 | ||
| Энергия ионизации (первый электрон) |
1350,0 (13,99) кДж/моль (эВ) | ||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) | (жидкий, при −153 °C) 2,155 г/см3, при н.у. 0,003749 г/см³ | ||
| Температура плавления | 115,78 К (−157,37 °C) | ||
| Температура кипения | 119,93 К (−153,415 °C) | ||
| Уд. теплота плавления | 1,6 кДж/моль | ||
| Уд. теплота испарения | 9,05 кДж/моль | ||
| Молярная теплоёмкость | 20,79[2] Дж/(K·моль) | ||
| Молярный объём | 22,4⋅103 см³/моль | ||
| Кристаллическая решётка простого вещества | |||
| Структура решётки |
Кубическая гранецентрированая |
||
| Параметры решётки | 5,638 Å | ||
| Температура Дебая | 72 K | ||
| Прочие характеристики | |||
| Теплопроводность | (300 K) 0,0095 Вт/(м·К) | ||
| Номер CAS | 7439-90-9 | ||
| Эмиссионный спектр | |||
|
|
Крипто́н (химический символ — Kr, от лат. Krypton) — химический элемент 18-й группы (по устаревшей классификации — главной подгруппы восьмой группы, VIIIA), четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 36.
Простое вещество криптон — тяжёлый инертный одноатомный газ без цвета, вкуса и запаха.
История[править | править код]
В 1898 году Уильям Рамзай совместно со своим ассистентом Морисом Уильямом Траверсом выделил из жидкого воздуха, предварительно удалив кислород, азот и аргон, смесь, в которой спектральным методом были открыты два газа: криптон (от др.-греч. κρυπτός — «скрытый», «секретный») и ксенон («чуждый», «необычный»)[4]
Нахождение в природе[править | править код]
Содержание в атмосферном воздухе 1,14⋅10-4% по объёму, общие запасы в атмосфере 5,3⋅1012м³. В 1 м³ воздуха содержится около 1 см³ криптона.
Получение криптона из воздуха является энергоёмким процессом. Для получения единицы объёма криптона ректификацией сжиженного воздуха нужно переработать более миллиона единиц объёмов воздуха.
В литосфере Земли стабильные изотопы криптона (через цепочку распадов нестабильных нуклидов) образуются при спонтанном ядерном делении долгоживущих радиоактивных элементов (торий, уран), этот процесс обогащает атмосферу этим газом. В газах ураносодержащих минералов содержится 2,5—3,0 % криптона (по массе)[2].
В остальной части Вселенной криптон встречается в более высоких пропорциях, сравнимых с литием, галлием и скандием[5]. Соотношение криптона и водорода во Вселенной в основном постоянно. Из этого можно сделать вывод, что межзвёздное вещество богато криптоном[6]. Криптон также обнаружили в белом карлике RE 0503-289. Измеренное количество в 450 раз превышало солнечное, но причина такого высокого содержания криптона до сих пор неизвестна[7].
Определение[править | править код]
Качественно криптон обнаруживают с помощью эмиссионной спектроскопии (характеристические линии 557,03 нм и 431,96 нм). Количественно его определяют масс-спектрометрически, хроматографически, а также методами абсорбционного анализа[2].
Физические свойства[править | править код]
Криптон — инертный одноатомный газ без цвета, вкуса и запаха (при давлении 6 атмосфер приобретает острый запах, похожий на запах хлороформа[8]). Плотность при стандартных условиях 3,745 кг/м3 (в 3 раза тяжелее воздуха)[2]. При нормальном давлении криптон сжижается при температуре 119,93 К (−153,415 °C), затвердевает при 115,78 К (−157,37 °C), образуя кристаллы кубической сингонии (гранецентрированная решётка), пространственная группа Fm3m, параметры ячейки a = 0,572 нм, Z = 4. Таким образом, в жидкой фазе он существует лишь в диапазоне температур около четырёх градусов. Плотность жидкого криптона при температуре кипения составляет 2,412 г/см3, плотность твёрдого криптона при абсолютном нуле равна 3,100 г/см3[2].
Критическая температура 209,35 К, критическое давление 5,50 МПа (55,0 бар), критическая плотность 0,908 г/см3. Тройная точка криптона находится при температуре 115,78 К, его плотность при этом 2,826 г/см3[2].
Молярная теплоёмкость при постоянном давлении 20,79 Дж/(моль·К). Теплота плавления 1,6 кДж/моль, теплота испарения 9,1 кДж/моль[2].
При стандартных условиях динамическая вязкость криптона составляет 23,3 мкПа·с, теплопроводность 8,54 мВт/(м·К), коэффициент самодиффузии 7,9·10−6 м2/с[2].
Диамагнитен. Магнитная восприимчивость −2,9·10−5. Поляризуемость 2,46·10−3 нм3[2].
Энергия ионизации 13,9998 эВ (Kr0 → Kr+), 24,37 эВ (Kr+ → Kr2+)[2].
Сечение захвата тепловых нейтронов у природного криптона около 28 барн[2].
Растворимость в воде при стандартном давлении 1 бар равна 0,11 л/кг (0 °C), 0,054 л/кг (25 °C). Образует с водой клатраты состава Kr·5,75H2O, разлагающиеся при температуре выше −27,7 °C. Образует клатраты также с некоторыми органическими веществами (фенол, толуол, ацетон и др.)[2].

Заполненная криптоном газоразрядная трубка
Химические свойства[править | править код]
Криптон химически инертен. В жёстких условиях реагирует со фтором, образуя дифторид криптона. Относительно недавно было получено первое соединение со связями Kr−O (Kr(OTeF5)2)[9].
В 1965 году было заявлено о получении соединений состава KrF4, KrO3·H2O и BaKrO4. Позже их существование было опровергнуто[10].
В 2003 году в Финляндии было получено первое криптонорганическое соединение со связью C−Kr (HKrC≡CH — гидрокриптоацетилен) путём УФ фотолиза твёрдой смеси криптона и ацетилена на криптонной матрице при температуре 8 К[11].
Изотопы[править | править код]
На данный момент известны 32 изотопа криптона и ещё 10 возбуждённых изомерных состояний некоторых его нуклидов. В природе криптон представлен пятью стабильными нуклидами и одним слаборадиоактивным (период полураспада 2 · 1021 лет): 78Kr (изотопная распространённость 0,35 %), 80Kr (2,28 %), 82Kr (11,58 %), 83Kr (11,49 %), 84Kr (57,00 %), 86Kr (17,30 %)[12].
Получение[править | править код]
Получается как побочный продукт в виде криптоно-ксеноновой смеси в процессе разделения воздуха на промышленных установках.
В процессе разделения воздуха методом низкотемпературной ректификации производится постоянный отбор фракции жидкого кислорода, содержащей жидкие углеводороды, криптон и ксенон (отбор фракции кислорода с углеводородами необходим для обеспечения взрывобезопасности).
Для извлечения криптона и ксенона из отбираемой фракции удаляют углеводороды в каталитических печах и направляют в дополнительную ректификационную колонну для удаления кислорода, после обогащения Kr+Xe смеси до 98—99 % её повторно очищают в каталитических печах от углеводородов, а затем в блоке адсорберов, заполненных силикагелем (или другим адсорбентом).
После очистки смеси газов от остатков углеводородов и влаги её закачивают в баллоны для транспортировки на установку разделения Kr и Xe (это связано с тем, что не на каждом предприятии, эксплуатирующем воздухоразделительные установки, существует установка разделения Kr и Xe).
Дальнейший процесс разделения Kr и Xe на чистые компоненты происходит по следующей цепочке: удаление остатков углеводородов на контактной каталитической печи, заполненной окисью меди при температуре 300—400 °C; очистка от влаги в адсорбере, заполненном цеолитом; охлаждение в теплообменнике; многостадийное разделение в нескольких ректификационных колоннах.
Процесс разделения смеси криптона и ксенона может вестись как непрерывно, так и циклично, по мере накопления сырья (смеси) для переработки.
Применение[править | править код]
- Производство сверхмощных эксимерных лазеров (Kr-F).
- Криптон используется для заполнения ламп накаливания, увеличивая срок службы нити накала[13].
- Как теплоизолятор и шумоизолятор в стеклопакетах[14][15].
- Фториды криптона предложены в качестве окислителей ракетного топлива.
- В период между 1960 и 1983 годом длина волны оранжевой линии спектра излучения 86Kr служила для определения метра[16].
- Рабочее тело для электроракетных двигателей.
- Единственным ЯМР-активным из стабильных изотопов криптона является 83Kr. Гиперполяризованный 83Kr использовался в экспериментах на крысах при магнитно-резонансной томографии при исследовании лёгких[17].
Биологическая роль[править | править код]
Воздействие криптона на живые организмы изучено плохо. Исследуются возможности его использования в водолазном деле в составе дыхательных смесей и при повышенном давлении как средство для анестезии[18][19].
Физиологическое действие[править | править код]
Большое количество вдыхаемого криптона при недостаточном количестве кислорода может привести к удушью.
При вдыхании газовых смесей, содержащих криптон, при давлении более 3,5 атмосфер наблюдается наркотический эффект[19][18].
Примечания[править | править код]
- ↑ Meija J. et al. Atomic weights of the elements 2013 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2016. — Vol. 88, no. 3. — P. 265—291. — doi:10.1515/pac-2015-0305.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Легасов В. А., Соколов В. Б. Криптон // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1990. — Т. 2: Даффа — Меди. — С. 523. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5.
- ↑ 1 2 3 Size of krypton in several environments (англ.). www.webelements.com. Дата обращения: август 2009. Архивировано 4 сентября 2009 года.
- ↑ Криптон: история открытия элемента. www.chem.msu.su. Дата обращения: 13 мая 2020. Архивировано 17 февраля 2020 года.
- ↑ A. G. W. Cameron. Abundances of the Elements in the Solar System (англ.) // Space Science Reviews. — 1973-09. — Vol. 15, iss. 1. — P. 121–146. — ISSN 0038-6308. — doi:10.1007/BF00172440. Архивировано 5 августа 2020 года.
- ↑ Stefan I. B. Cartledge, J. T. Lauroesch, David M. Meyer, Ulysses J. Sofia, Geoffrey C. Clayton. Interstellar Krypton Abundances: The Detection of Kiloparsec-scale Differences in Galactic Nucleosynthetic History* (англ.) // The Astrophysical Journal. — 2008 November 10. — Vol. 687, iss. 2. — P. 1043. — ISSN 0004-637X. — doi:10.1086/592132. Архивировано 27 июня 2018 года.
- ↑ Klaus Werner, Thomas Rauch, Ellen Ringat, Jeffrey W. Kruk. FIRST DETECTION OF KRYPTON AND XENON IN A WHITE DWARF (англ.) // The Astrophysical Journal. — 2012-06-13. — Vol. 753, iss. 1. — P. L7. — ISSN 2041-8213 2041-8205, 2041-8213. — doi:10.1088/2041-8205/753/1/l7.
- ↑ О чём пишут научно-популярные журналы мира // Наука и жизнь. — М., 1989. — № 6. — С. 66.
- ↑ Four Decades of Fluorine Chemistry at McMaster. Архивная копия от 7 июня 2009 на Wayback Machine (англ.)
- ↑ Успехи химии. — 1974. — Т. 43, № 12, стр. 2179
- ↑ Khriachtchev L. et al. A Gate to Organokrypton Chemistry: HKrCCH (англ.) // Journal of the American Chemical Society. — 2003. — Vol. 125, no. 23. — P. 6876—6877. — ISSN 0002-7863. — doi:10.1021/ja0355269. [исправить]
- ↑ Данные приведены по Audi G., Bersillon O., Blachot J., Wapstra A. H. The NUBASE evaluation of nuclear and decay properties // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — doi:10.1016/j.nuclphysa.2003.11.001. — Bibcode: 2003NuPhA.729….3A.

- ↑ Криптон // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- ↑ Стеклопакет с аргоном или криптоном: что лучше? Архивировано из оригинала 18 апреля 2021 года.
- ↑ Choosing your windows. Energy rating of thermal insulation glass improved.
- ↑ Метр // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- ↑ Cleveland Z. I. et al. Hyperpolarized 83Kr MRI of lungs (англ.) // Journal of Magnetic Resonance. — 2008. — Vol. 195, iss. 2. — P. 232–237. — ISSN 1090-7807. — doi:10.1016/j.jmr.2008.09.020.
- ↑ 1 2 Куссмауль А. Р. Биологическое действие криптона на животных и человека в условиях повышенного давления Архивная копия от 6 октября 2011 на Wayback Machine. — Автореферат диссертации на соискание учёной степени кандидата биологических наук. — М., 2007;
- ↑ 1 2 Куссмауль А. Р. Физиологические эффекты газовых смесей, содержащих криптон и ксенон Архивная копия от 6 августа 2017 на Wayback Machine. Диссертация на соискание учёной степени кандидата биологических наук. — М., 2007. — 191 с.
Литература[править | править код]
- Легасов В. А., Соколов В. Б. Криптон // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1990. — Т. 2: Даффа — Меди. — С. 523. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5.
Ссылки[править | править код]
- Физические демонстрационные опыты с криптоном в программе «Галилео» (на сайте YouTube)
- Криптон на Webelements
- Криптон в Популярной библиотеке химических элементов
Криптон, свойства атома, химические и физические свойства.
Kr 36 Криптон
83,798(2) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6
Криптон — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 36. Расположен в 18-й группе (по старой классификации — главной подгруппе восьмой группы), четвертом периоде периодической системы.
Атом и молекула криптона. Формула криптона. Строение атома криптона
Изотопы и модификации криптона
Свойства криптона (таблица): температура, плотность, давление и пр.
Физические свойства криптона
Химические свойства криптона. Взаимодействие криптона. Химические реакции с криптоном
Получение криптона
Применение криптона
Таблица химических элементов Д.И. Менделеева
Атом и молекула криптона. Формула криптона. Строение атома криптона:
Криптон (лат. Krypton, от греч. κρυπτός – «скрытый», «секретный») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Kr и атомным номером 36. Расположен в 18-й группе (по старой классификации – главной подгруппе восьмой группы), четвертом периоде периодической системы.
Криптон – неметалл. Относится к группе инертных (благородных) газов.
Криптон обозначается символом Kr.
Как простое вещество криптон при нормальных условиях представляет собой инертный одноатомный газ без цвета, вкуса и запаха.
Молекула криптона одноатомна.
Химическая формула криптона Kr.
Электронная конфигурация атома криптона 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6. Потенциал ионизации (первый электрон) атома криптона равен 1350,76 кДж/моль (13,9996053(20) эВ).
Строение атома криптона. Атом криптона состоит из положительно заряженного ядра (+36), вокруг которого по четырем оболочкам движется 36 электронов. При этом 28 электронов находятся на внутреннем уровне, а 8 электронов – на внешнем. Поскольку криптон расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома криптона на 4s-орбитали находятся два спаренных электрона, на 4p-орбитали находятся шесть спаренных электрона. В свою очередь ядро атома криптона состоит из 36 протонов и 48 нейтронов. Криптон относится к элементам p-семейства.
Радиус атома криптона (вычисленный) составляет 88 пм.
Атомная масса атома криптона составляет 83,798(2) а. е. м.
Содержание криптона в земной коре составляет 1,5×10-8 %, в морской воде и океане – 2,1×10-8 %.
Криптон – химически инертный химический элемент.
Изотопы и модификации криптона:
Свойства криптона (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Криптон |
| 102 | Прежнее название | |
| 103 | Латинское название | Krypton |
| 104 | Английское название | Krypton |
| 105 | Символ | Kr |
| 106 | Атомный номер (номер в таблице) | 36 |
| 107 | Тип | Неметалл |
| 108 | Группа | Инертный (благородный) газ |
| 109 | Открыт | Уильям Рамзай и Моррис Уильям Траверс, Великобритания, 1898 г. |
| 110 | Год открытия | 1898 г. |
| 111 | Внешний вид и пр. | Инертный газ без цвета, вкуса и запаха |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0,003 % |
| 119 | Содержание в земной коре (по массе) | 1,5·10-8 % |
| 120 | Содержание в морях и океанах (по массе) | 2,1·10-8 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 4,0·10-6 % |
| 122 | Содержание в Солнце (по массе) | |
| 123 | Содержание в метеоритах (по массе) | |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 83,798(2) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 |
| 203 | Электронная оболочка | K2 L8 M18 N8 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 88 пм |
| 205 | Эмпирический радиус атома | |
| 206 | Ковалентный радиус* | 116 пм |
| 207 | Радиус иона (кристаллический) | |
| 208 | Радиус Ван-дер-Ваальса | 202 пм |
| 209 | Электроны, Протоны, Нейтроны | 36 электронов, 36 протонов, 48 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа в периодической таблице | 18-ая группа (по старой классификации – главная подгруппа 8-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | 0, +1, +2 |
| 302 | Валентность | 0 |
| 303 | Электроотрицательность | 3,0 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 1350,76 кДж/моль (13,9996053(20) эВ) |
| 305 | Электродный потенциал | 0 В |
| 306 | Энергия сродства атома к электрону | -96(20) кДж/моль (-1,0(2) эВ) – предположительно |
| 400 | Физические свойства | |
| 401 | Плотность* | 0,003749 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – газ), 2,413 г/см3 (при температуре кипения -153,415 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления | -157,37 °C (115,78 K, -251,27 °F) |
| 403 | Температура кипения* | -153,415 °C (119,93 K, -244,147 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл) | 1,64 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 9,08 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость* | 20,95 Дж/(K·моль) |
| 411 | Молярный объём | 22,34613 см³/моль |
| 412 | Теплопроводность | 9,43·10-3 Вт/(м·К) (при стандартных условиях),
9,5·10-3 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная
|
| 513 | Параметры решётки | 5,638 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 72 К |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-90-9 |
Примечание:
206* Ковалентный радиус криптона согласно [1] и [3] составляет 116±4 пм и 109 пм соответственно.
401* Плотность криптона согласно [3] и [4] составляет 2,155 г/см3 (при -153 °C/-153,2 °C и иных стандартных условиях, состояние вещества – жидкость) и 0,003708 г/см3 (при 20°C и иных стандартных условиях, состояние вещества – газ).
403* Температура кипения криптона согласно [4] составляет -153,22 °С (119,93 K, -243,8 °F).
408* Удельная теплота испарения (энтальпия кипения ΔHкип) криптона согласно [3] и [4] составляет 9,05 кДж/моль.
410* Молярная теплоёмкость криптона согласно [3] составляет 20,79 Дж/(K·моль).
Физические свойства криптона:
Химические свойства криптона. Взаимодействие криптона. Химические реакции с криптоном:
Получение криптона:
Применение криптона:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Krypton
- https://de.wikipedia.org/wiki/Krypton
- https://ru.wikipedia.org/wiki/Криптон
- http://chemister.ru/Database/properties.php?dbid=1&id=246
- https://chemicalstudy.ru/kripton-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
криптон атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле криптона криптон
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности
2 391
| Криптон | |
|---|---|
| Инертный газ без цвета, вкуса и запаха | |

Газовый разряд в криптоне |
|
| Название, символ, номер | Криптон / Krypton (Kr), 36 |
| Атомная масса (молярная масса) |
83,798(2) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d10 4s2 4p6 |
| Радиус атома | ? (88) пм |
| Ковалентный радиус | 116 пм |
| Радиус иона | 169 пм |
| Электроотрицательность | 3,0 (шкала Полинга) |
| Электродный потенциал | 0 |
| Степени окисления | +2 (с фтором) |
| Энергия ионизации (первый электрон) |
1350,0 (13,99) кДж/моль (эВ) |
| Плотность (при н. у.) | (жидкий, при −153 °C) 2,155 г/см3, при н.у. 0,003749 г/см³ |
| Температура плавления | 115,78 К (−157,37 °C) |
| Температура кипения | 119,93 К (−153,415 °C) |
| Уд. теплота плавления | 1,6 кДж/моль |
| Уд. теплота испарения | 9,05 кДж/моль |
| Молярная теплоёмкость | 20,79 Дж/(K·моль) |
| Молярный объём | 32,2 см³/моль |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 5,638 Å |
| Температура Дебая | 72 K |
| Теплопроводность | (300 K) 0,0095 Вт/(м·К) |
| Номер CAS | 7439-90-9 |
Криптон — химический элемент с атомным номером 36. Принадлежит к 18-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VIII группы, или к группе VIIIA), находится в четвёртом периоде таблицы. Атомная масса элемента 83,798(2) а. е. м.. Обозначается символом Kr (от лат. Krypton). Простое вещество криптон — инертный одноатомный газ без цвета, вкуса и запаха.
Содержание
- 1 История
- 2 Нахождение в природе
- 3 Определение
- 4 Физические свойства
- 5 Химические свойства
- 6 Изотопы
- 7 Получение
- 8 Применение
- 9 Биологическая роль
- 9.1 Физиологическое действие
История
В 1898 году английский учёный Уильям Рамзай выделил из жидкого воздуха, предварительно удалив кислород, азот и аргон, смесь, в которой спектральным методом были открыты два газа: криптон (от греч. κρυπτός — «скрытый», «секретный») и ксенон («чуждый», «необычный»).
Нахождение в природе
Содержание в атмосферном воздухе 1,14⋅10-4% по объёму, общие запасы в атмосфере 5,3⋅1012м³. В 1 м³ воздуха содержится около 1 см³ криптона.
Получение криптона из воздуха является энергоёмким процессом. Для получения единицы объёма криптона ректификацией сжиженного воздуха нужно переработать более миллиона единиц объёмов воздуха.
В литосфере Земли стабильные изотопы криптона (через цепочку распадов нестабильных нуклидов) образуются при спонтанном ядерном делении долгоживущих радиоактивных элементов (торий, уран), этот процесс обогащает атмосферу этим газом. В газах ураносодержащих минералов содержится 2,5—3,0 % криптона (по массе).
Определение
Качественно криптон обнаруживают с помощью эмиссионной спектроскопии (характеристические линии 557,03 нм и 431,96 нм). Количественно его определяют масс-спектрометрически, хроматографически, а также методами абсорбционного анализа.
Физические свойства
Криптон — инертный одноатомный газ без цвета, вкуса и запаха (при давлении 6 атмосфер приобретает острый запах, похожий на запах хлороформа). Плотность при стандартных условиях 3,745 кг/м3 (в 3 раза тяжелее воздуха). При нормальном давлении криптон сжижается при температуре 119,93 К (−153,415 °C), затвердевает при 115,78 К (−157,37 °C), образуя кристаллы кубической сингонии (гранецентрированная решётка), пространственная группа Fm3m, параметры ячейки a = 0,572 нм, Z = 4. Таким образом, в жидкой фазе он существует лишь в диапазоне температур около четырёх градусов. Плотность жидкого криптона при температуре кипения составляет 2,412 г/см3, плотность твёрдого криптона при абсолютном нуле равна 3,100 г/см3.
Критическая температура 209,35 К, критическое давление 5,50 МПа (55,0 бар), критическая плотность 0,908 г/см3. Тройная точка криптона находится при температуре 115,78 К, его плотность при этом 2,826 г/см3.
Молярная теплоёмкость при постоянном давлении 20,79 Дж/(моль·К). Теплота плавления 1,6 кДж/моль, теплота испарения 9,1 кДж/моль.
При стандартных условиях динамическая вязкость криптона составляет 23,3 мкПа·с, теплопроводность 8,54 мВт/(м·К), коэффициент самодиффузии 7,9·10−6 м2/с.
Диамагнитен. Магнитная восприимчивость −2,9·10−5. Поляризуемость 2,46·10−3 нм3.
Энергия ионизации 13,9998 эВ (Kr0 → Kr+), 24,37 эВ (Kr+ → Kr2+).
Сечение захвата тепловых нейтронов у природного криптона около 28 барн.
Растворимость в воде при стандартном давлении 1 бар равна 0,11 л/кг (0 °C), 0,054 л/кг (25 °C). Образует с водой клатраты состава Kr·5,75H2O, разлагающиеся при температуре выше −27,7 °C. Образует клатраты также с некоторыми органическими веществами (фенол, толуол, ацетон и др.).

Заполненная криптоном газоразрядная трубка
Химические свойства
Криптон химически инертен. В жёстких условиях реагирует со фтором, образуя дифторид криптона. Относительно недавно было получено первое соединение со связями Kr−O (Kr(OTeF5)2).
В 1965 году было заявлено о получении соединений состава KrF4, KrO3·H2O и BaKrO4. Позже их существование было опровергнуто.
В 2003 году в Финляндии было получено первое соединение со связью C−Kr (HKrC≡CH — гидрокриптоацетилен) путём фотолиза криптона и ацетилена на криптонной матрице.
Изотопы
Основная статья: Изотопы криптона
На данный момент известны 31 изотоп криптона и ещё 10 возбуждённых изомерных состояний некоторых его нуклидов. В природе криптон представлен пятью стабильными нуклидами и одним слаборадиоактивным: 78Kr (изотопная распространённость 0,35 %), 80Kr (2,28 %), 82Kr (11,58 %), 83Kr (11,49 %), 84Kr (57,00 %), 86Kr (17,30 %).
Получение
Получается как побочный продукт в виде криптоно-ксеноновой смеси в процессе разделения воздуха на промышленных установках.
В процессе разделения воздуха методом низкотемпературной ректификации производится постоянный отбор фракции жидкого кислорода, содержащей жидкие углеводороды, криптон и ксенон (отбор фракции кислорода с углеводородами необходим для обеспечения взрывобезопасности).
Для извлечения Kr и Xe из отбираемой фракции удаляют углеводороды в каталитических печах при t=500—600 °C и направляют в дополнительную ректификационную колонну для удаления кислорода, после обогащения Kr+Xe смеси до 98—99 % её повторно очищают в каталитических печах от углеводородов, а затем в блоке адсорберов, заполненных силикагелем (или другим адсорбентом).
После очистки смеси газов от остатков углеводородов и влаги её закачивают в баллоны для транспортировки на установку разделения Kr и Xe (это связано с тем, что не на каждом предприятии, эксплуатирующем воздухоразделительные установки, существует установка разделения Kr и Xe).
Дальнейший процесс разделения Kr и Xe на чистые компоненты происходит по следующей цепочке: удаление остатков углеводородов на контактной каталитической печи, заполненной окисью меди при температуре 300—400 °C, очистка от влаги в адсорбере, заполненном цеолитом, охлаждение в теплообменнике, подача на разделение в ректификационной колонне № 1, где из кубового пространства (нижняя часть ректификационной колонны) колонны отбирается жидкий Xe и направляется в колонну № 3, где он доочищается от примеси Kr, а затем выкачивается при помощи мембранного компрессора в баллоны. Газообразный Kr отбирается из-под крышки конденсатора колонны № 1 и направляется в колонну № 2, где он очищается от остатков азота, кислорода, аргона (температура их кипения значительно ниже температуры кипения криптона). Из кубового пространства колонны № 2 отбирается чистый криптон и закачивается мембранным компрессором в баллоны.
Процесс разделения смеси криптона и ксенона может вестись как непрерывно, так и циклично, по мере накопления сырья (смеси) для переработки.
Применение
- Производство сверхмощных эксимерных лазеров (Kr-F).
- Криптон используется для заполнения ламп накаливания, увеличивая срок службы нити накала.
- Как теплоизолятор и шумоизолятор в стеклопакетах.
- Фториды криптона предложены в качестве окислителей ракетного топлива.
- В период между 1960 и 1983 годом длина волны оранжевой линии спектра излучения 86Kr служила для определения метра.
- Рабочее тело для электроракетных двигателей.
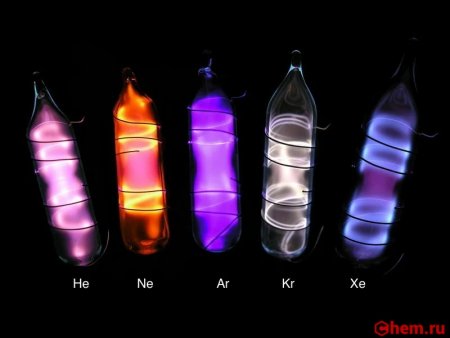
Сравнение свечения разных газов
Биологическая роль
Воздействие криптона на живые организмы изучено плохо. Исследуются возможности его использования в водолазном деле в составе дыхательных смесей и при повышенном давлении как средство для анестезии.
Физиологическое действие
Большое количество вдыхаемого криптона при недостаточном количестве кислорода может привести к удушью.
При вдыхании газовых смесей, содержащих криптон, при давлении более 3,5 атмосфер наблюдается наркотический эффект.
Molar mass of Kr = 83.798 g/mol
Convert grams krypton to moles
or
moles krypton to grams
Percent composition by element
Element: Krypton
Symbol: Kr
Atomic Mass: 83.798
# of Atoms: 1
Mass Percent: 100.000%
Calculate the
molecular weight of a chemical compound
More information
on molar mass and molecular weight
In chemistry, the formula weight is a quantity computed by multiplying the atomic weight (in atomic mass units) of each element in a chemical formula by the number of atoms of that element present in the formula, then adding all of these products together.
Using the chemical formula of the compound and the periodic table of elements, we can add up the atomic weights and calculate molecular weight of the substance.
Formula weights are especially useful in determining the relative weights of reagents and products in a chemical reaction. These relative weights computed from the chemical equation are sometimes called equation weights.
The atomic weights used on this site come from NIST, the National Institute of Standards and Technology. We use the most common isotopes. This is how to calculate molar mass (average molecular weight), which is based on isotropically weighted averages. This is not the same as molecular mass, which is the mass of a single molecule of well-defined isotopes. For bulk stoichiometric calculations, we are usually determining molar mass, which may also be called standard atomic weight or average atomic mass.
A common request on this site is to convert grams to moles. To complete this calculation, you have to know what substance you are trying to convert. The reason is that the molar mass of the substance affects the conversion. This site explains how to find molar mass.
If the formula used in calculating molar mass is the molecular formula, the formula weight computed is the molecular weight. The percentage by weight of any atom or group of atoms in a compound can be computed by dividing the total weight of the atom (or group of atoms) in the formula by the formula weight and multiplying by 100.
Finding molar mass starts with units of grams per mole (g/mol). When calculating molecular weight of a chemical compound, it tells us how many grams are in one mole of that substance. The formula weight is simply the weight in atomic mass units of all the atoms in a given formula.



