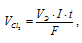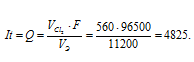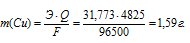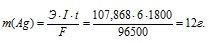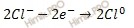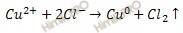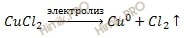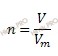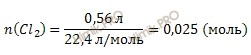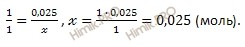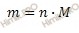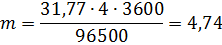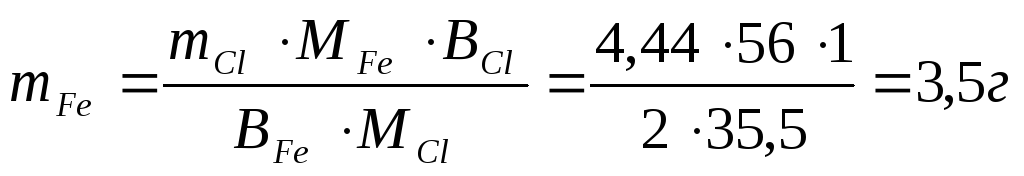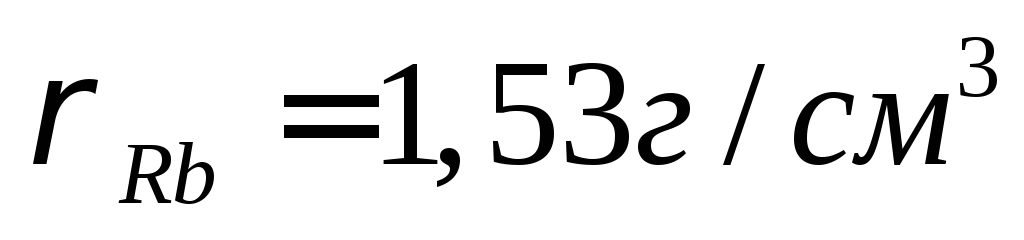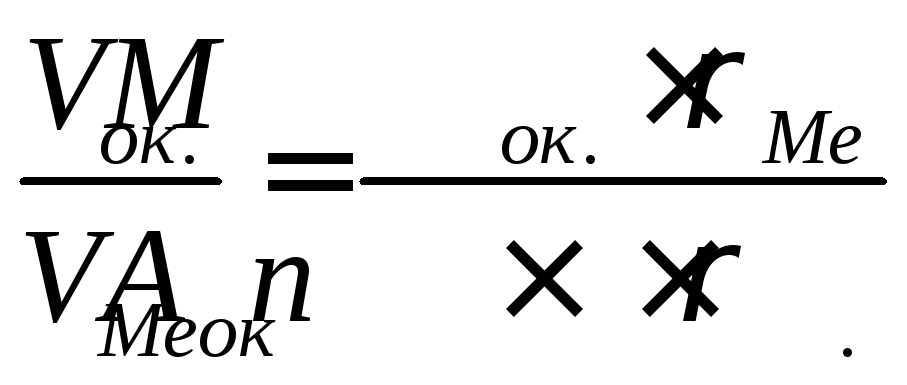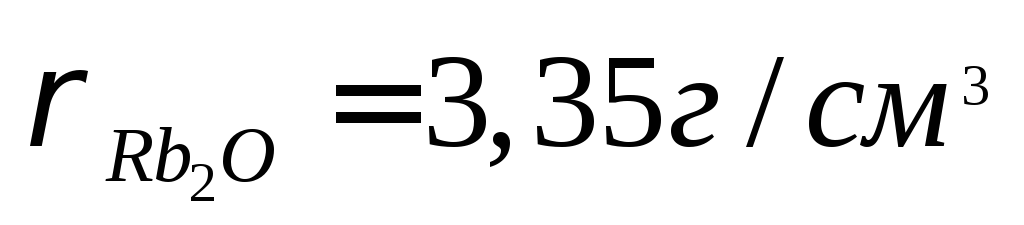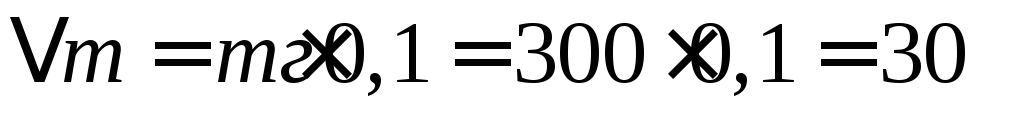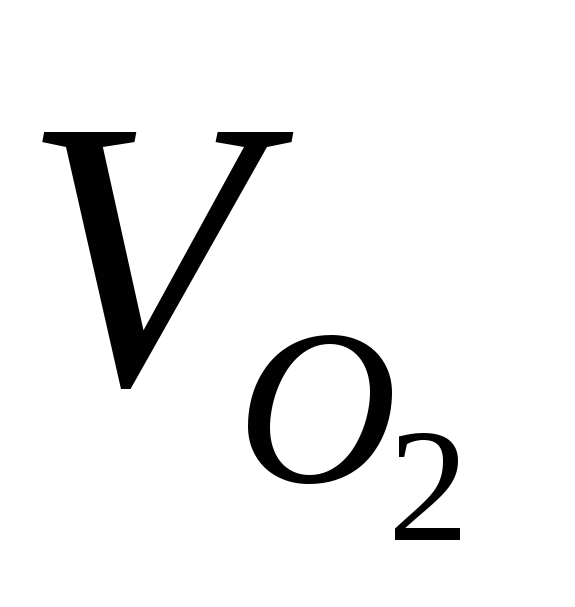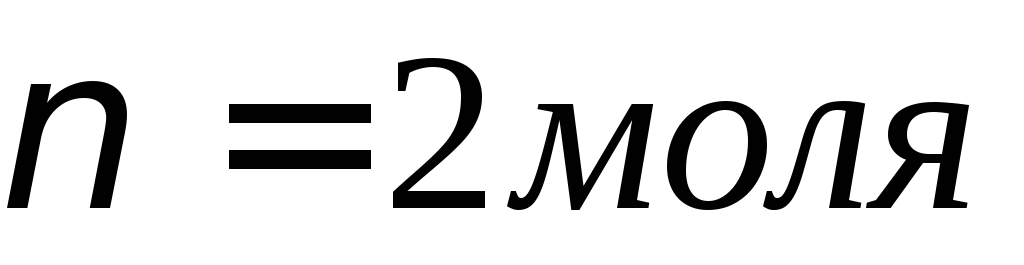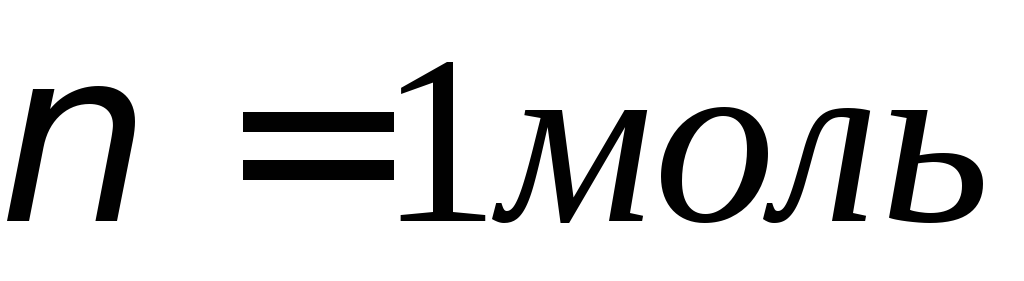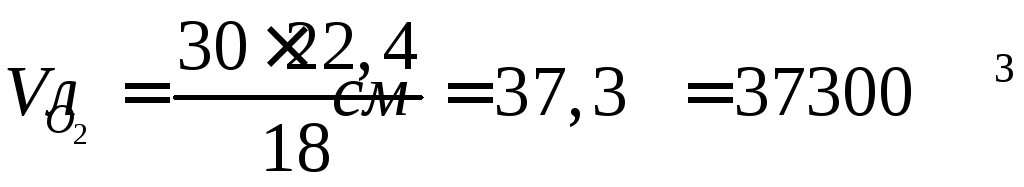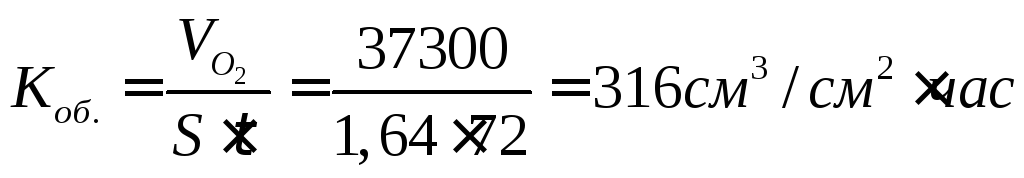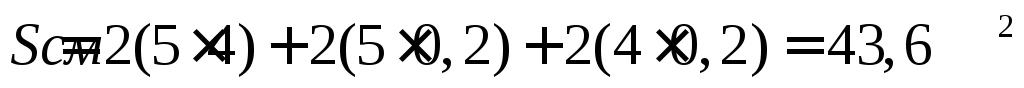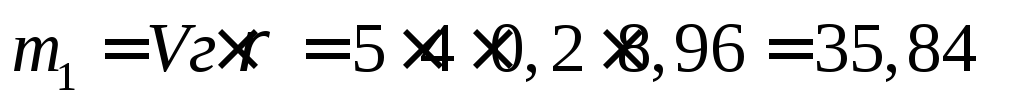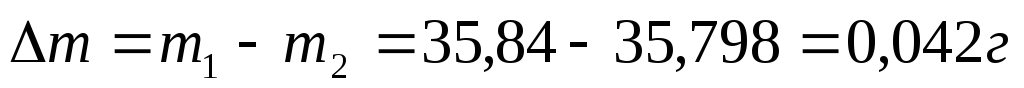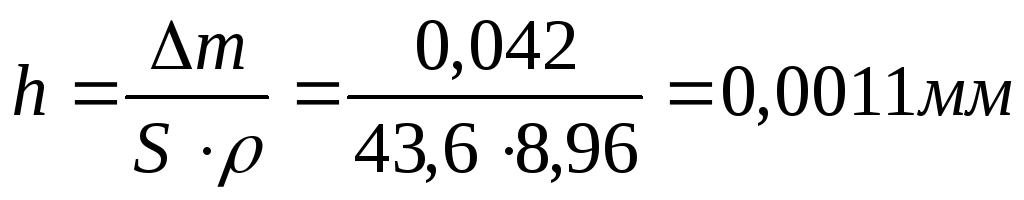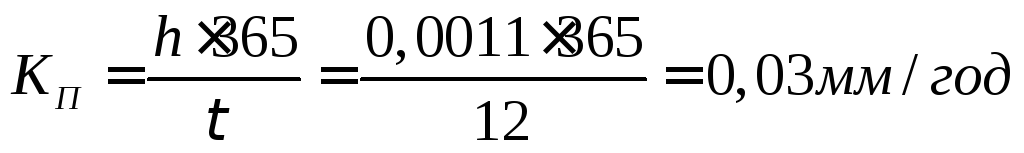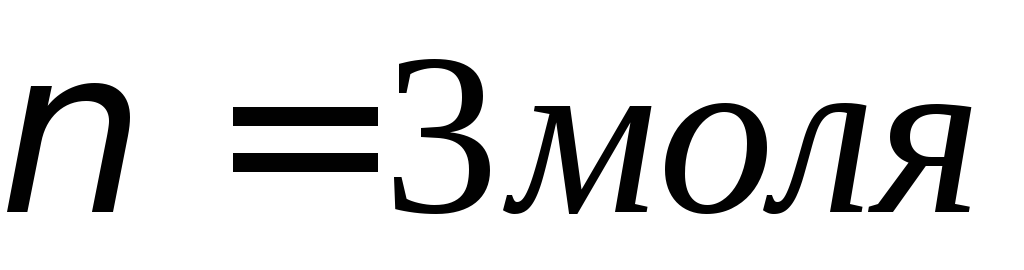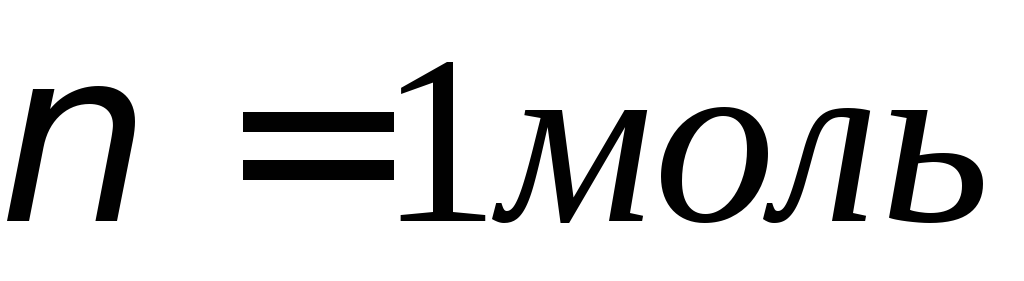Содержание
- Вычисление массы и объема веществ, образующихся при электролизе
- Решение задач по химии на электролиз вещества
- Как рассчитать массу металла, выделившегося на электроде при электролизе его соли
- Примеры решения задач
Вычисление массы и объема веществ, образующихся при электролизе
Решение задач по химии на электролиз вещества
Задание 261.
Электролиз раствора К2SO4 проводили при силе тока 5 А в течение 3 ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде? Ответ: 5,03 г; 6,267 л; 3,133 л.
Решение:
Стандартный электродный потенциал системы К + + 1 
2Н2О + 2 
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2Н2О — 4 
поскольку, отвечающий этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал (+2,01 В), характеризующий систему: 2SO4 2- — 2 
Массу разложившейся воды находим из уравнения Фарадея, имея в виду, что 3 ч = 10800 с и МЭ(Н2О) = 9 г/моль, получим:
m(H2O) = МЭ(В) . I . t/F = 9 . 5 . 10800/96500 = 5,036 г.
При вычислении объёмов выделившихся газов представим уравнение Фарадея в следующем виде:
V = VЭ . I . t/F
Здесь V – объём выделившегося газа, л; m(B) – масса выделившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея , 96500.
Поскольку при нормальных условиях эквивалентный объём водорода равен 11,2 л/моль, а кислорода – 5,6 л/моль, получим:
V(H2) = (11,2 . 5 . 10800)/96500 = 6,267 л;
V(О2) = (5,6 . 5 . 10800)/96500 = 3,133 л;
Ответ: m(H 2 O) 5,03 г; V(H2) = 6,267 л; V(О2) =3,133 л.
Задание 262.
При электролизе соли некоторого металла в течение 1,5 ч при силе тока 1,8 А на катоде выделилось 1,75 г этого металла. Вычислите эквивалентную массу металла. Ответ: 17.37 г/моль.
Решение:
Эквивалентную массу металла рассчитаем из уравнения Фарадея относительно эквивалентной массы вещества, подставив в него данные из задачи, получим:
m(В) = МЭ(В) . I . t/F;
МЭ(Ме) = m(В) . F/(I . t) = (1,75 . 96500)/(1,8 . 60 . 60 . 1,5) = 17,37 г/моль.
Здесь m(B) – масса выделившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Ответ: 17.37 г/моль.
Задание 263.
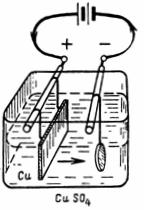
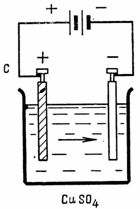
При электролизе раствора СuSO4 на аноде выделилось 168 см 3 газа (н.у.). Составьте электронные уравнения процессов, происходящих на электродах, и вычислите, какая масса меди выделилась на катоде. Ответ:0,953г.
Решение:
Стандартный электродный потенциал системы Cu 2+ + 2 
Cu 2+ + 2 
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2Н2О — 4 
поскольку, отвечающий этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал (+2,01 В), характеризующий систему: 2SO4 2- — 2 = 2S2O8 2- . Ионы SO4 2- , движущиеся при этом к аноду, будут накапливаться в анодном пространстве.
Эквивалентный объём кислорода равен 5,6 л/моль. Тогда количество эквивалентов выделившегося кислорода равно:
Так как (О2) = (Cu), то можно рассчитать массу выделившейся меди при электролизе сульфата меди, получим:
m(Cu) = (Cu) . MЭ(Cu) = 0,03 . 31,77 = 0,953 г.
Ответ: m(Cu) = 0,953 г.
Задание 264.
Электролиз раствора Na2SO4 проводили в течение 5 ч при силе тока 7 А. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде? Ответ: 11,75 г; 14,62 л; 7,31 л.
Решение:
Стандартный электродный потенциал системы Na + +1 
2Н2О + 2 
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2Н2О — 4 
поскольку, отвечающий этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал (+2,01 В), характеризующий систему: 2SO4 2- — 2 = 2S2O8 2- . Ионы SO4 2- , движущиеся при этом к аноду, будут накапливаться в анодном пространстве.
Массу разложившейся воды находим из уравнения Фарадея, имея в виду, что 5 ч = 18000 с и МЭ(Н2О) = 9 г/моль, получим:
m(H2O) = МЭ(В) . I . t/F = 9 . 7 . 18000/96500 = 11,75 г.
При вычислении объёмов выделившихся газов представим уравнение Фарадея в следующем виде:
V = VЭ . I . t/F
Здесь V – объём выделившегося газа, л; m(B) – масса выде m(H 2 O) = 11,75 г; V(H2) = 14,62 л;V(О2) = 7,31 л.лившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500.
Поскольку при нормальных условиях эквивалентный объём водорода равен 11,2 л/моль, а кислорода – 5,6 л/моль, получим:
V(H2) = (11,2 . 7 . 10800)/96500 = 14,62 л;
V(О2) = (5,6 . 7 . 10800)/96500 = 7,31 л
Ответ: V(H2) = 14,62 л; V(О2) = 7,31 л.
Источник
Задача 696.
Никель в ряду напряжений стоит до водорода. Объяснить, почему возможно электролитическое выделение никеля из водных растворов его солей.
Решение:
Никель имеет стандартный электродный потенциал равный -0,250 В, что больше, чем электродный потенциал водородного электрода в нейтральной среде (-0,41 В), но меньше, чем для водородного электрода в кислой среде, то в зависимости от рН раствора, плотно-сти тока, концентрации ионов металла, возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. На-пример, если рН раствора соли будет близка нейтральной, то разряжаться будет никель, так как его потенциал значительно положительнее потенциала водородного электрода (-0,41 В), а если раствор соли имеет кислую среду, то разряжаться будет водород, так как его потенциал (0,00 В) значительно положительнее потенциала металла (-0,250 В).
Задача 697.
Неочищенная медь содержит примеси серебра и цинка. Что произойдет с этими примесями при электролитическом рафиниронии меди?
Решение:
При электролитическом рафинировании меди применяют сульфат меди – наиболее дешёвая и распространённая соль меди. Неочищенные примеси в металлической меди, состоящие из цинка и серебра можно разделить на две группы: Zn – металл, имеющий значительно более отрицательный электродный потенциал (-0,763 В), чем медь (+0,337 В). Поэтому он анодно растворяется вместе с медью, но не осаждается на катоде, а накапливается в электролите у катодного пространства. В связи с этим электролит нужно периодически очищать от цинка.
Ag – благородный металл, не претерпевает анодного растворения, и в ходе процесса электролиза оседает у анода, образуя вместе с другими примесями анодный шлам, который можно извлечь.
Задача 698.
При электролизе раствора CuCl2 на аноде выделилось 560 мл газа (условия нормальные). Найти массу меди, выделившейся на катоде.
Решение:
Для расчета количества электричества используем формулу:
Теперь рассчитаем массу меди, выделившейся на катоде по формуле:
Здесь Э – эквивалентная масса меди равная 31,773г/моль; F – постоянная Фарадея (96500 Кл/моль), т.е. количество электричества, необходимое для осуществления превращения одного эквивалента вещества; t – время, с; I – сила тока; VЭ – эквивалентный объём газа, для хлора он равен 11200 мл/моль; V – объём выделившегося газа, m – масса выделившегося вещества.
Ответ: 1,59г.
Задача 699.
Вычислить массу серебра, выделившегося на катоде при пропускании тока силой 6 А через раствор нитрата серебра в течение 30 мин.
Решение:
Схема электрохимического процесса: Ag+ — 1 
Здесь Э – эквивалентная масса серебра; F – постоянная Фарадея (96500 Кл/моль), т. е. количество электричества, необходимое для осуществления превращения одного эквивалента вещества; t – время, с; I – сила тока; m – масса выделившегося вещества.
Источник
Примеры решения задач
Пример 13.1. Сколько граммов никеля выделится на катоде при пропускании через раствор сернокислого никеля NiSO4 тока силой 5 А в течение 10 мин? Привести схемы электродных процессов, протекающих при электролизе с инертным анодом. Определить продукты электролиза.
Решение. В водном растворе сульфат никеля (II) диссоциирует: NiSO4 = Ni 2+ + SO4 2– . Стандартный электродный потенциал никеля (–0,250 В) выше значения потенциала восстановления ионов водорода из воды (–0,41 В). Поэтому на катоде будет происходить разряд ионов Ni 2+ и выделение металлического никеля. При электролизе сернокислых солей на инертном аноде происходит электрохимическое окисление воды с выделением кислорода.
На катоде: Ni 2+ + 2ē = Ni На аноде: 2Н2О – 4ē = 4Н + + О2
Продукты электролиза – Ni и О2,
Масса вещества, выделившегося на электроде при электролизе, определяется по законам Фарадея, математическое выражение которых имеет вид:
m = 
где m – масса вещества, выделившегося на электроде, г; М эк – молярная масса эквивалентов этого вещества, г/моль; Q – количество электричества, прошедшего через электролит, Кл; F – постоянная Фарадея, равная 96500 Кл/моль∙экв.
Q = I ∙ t, где I – сила тока, А; t – время, электролиза, с. Подставляя в формулу (1) вместо Q его значение, получаем m
Молярная масса эквивалентов никеля (молярная масса атомов никеля – 58,71 г/моль) равняется 58,71 / 2 = 29,36 г/моль. Подставляя это значение, а также силу тока и время электролиза (в секундах) в формулу m 
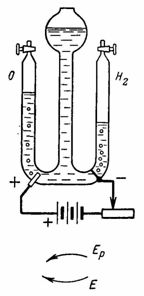
Пример 13.2. Сколько времени нужно пропускать через раствор кислоты ток силой 10 А, чтобы получить 5,6 л водорода (при н.у.)?
Решение. Продукт электролиза представляет собой газообразное вещество, поэтому для решения воспользуемся уравнением V газа 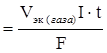
Так как 1 моль эквивалентов водорода занимает при нормальных условиях объем 11,2 л, то искомое количество времени прохождения тока: t 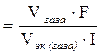

Пример 13.3. При проведении электролиза водного раствора хлорида двухвалентного металла затрачено 3561 Кл электричества. В результате процесса на катоде выделилось 2,19 г этого металла. Определить металл, водный раствор хлорида которого подвергли электролизу. Привести схему электродных процессов. Определить продукты электролиза.
Решение.Находим молярную массу эквивалентов металла: Мэк 
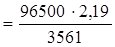
Катод (−) Sn 2+ , Н2О Анод (+) С1 – , Н2О
Катодный процесс: Sn 2+ + 2ē = Sn Анодный процесс: 2С1 – –2ē = С12
Продукты электролиза – Sn и С12.
Пример 13.4.При электролизе раствора CuSO4 на угольном аноде выделилось 350 мл кислорода при нормальных условиях. Сколько граммов меди выделилось на катоде? Привести уравнения электродных процессов, определить продукты электролиза.
Решение. В водном растворе сульфат меди (II) диссоциирует по схеме: CuSO4 = Cu 2+ + SO4 2− . Электродный потенциал меди (+0,337 В) значительно больше потенциала восстановления ионов водорода из воды (–0,41 В). Поэтому на катоде происходит процесс восстановления ионов Cu 2+ . При электролизе водных растворов сульфат-анионы не окисляются на аноде. На нем происходит окисление воды.
На катоде: Cu 2+ + 2ē = Сu На аноде: 2Н2О – 4ē = 4Н + + О2.
Продукты электролиза – Сu и О2.
Один моль эквивалентов кислорода при н.у. занимает объем 5,6 л. Следовательно, 350 мл составляют 0,35 / 5,6 = 0,0625 моль. Столько же молей эквивалентов выделилось на катоде. Отсюда, масса меди
m = 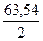
Пример 13.5.Будут ли, и в какой последовательности, восстанавливаться на катоде одновременно присутствующие в растворе (в равных концентрациях) ионы А1 3+ , Ni 2+ , Sn 2+ , Au 3+ и Mg 2+ ? Напряжение достаточно для выделения любого металла.
Решение. На катоде сначала восстанавливаются катионы, имеющие большее значение электродного потенциала (таблица стандартных элекродных потенциалов). Поэтому, в первую очередь, на катоде будут восстанавливаться ионы Au 3+ (+1,498 В), далее Sn 2+ (–0,136 В) и, наконец, Ni 2+ (–0,250 В). Ионы А1 3+ (–1,662 В) и Mg 2+ (–2,363 В), имеющие значения электродного потенциала значительно отрицательнее потенциала восстановления ионов Н + из воды
(–0,41 В), при электролизе водных растворов не восстанавливаются на катоде. При электролизе их солей протекает восстановление молекул воды:
Задачи
№ 13.1. Водный раствор, содержащий смесь нитратов серебра, калия, цинка с одинаковыми концентрациями, подвергли электролизу. Указать значение молярной массы вещества, которое будет восстанавливаться на катоде в первую очередь. Привести уравнения электродных процессов, происходящих на графитовых электродах для всех солей.
№ 13.2. При электролизе водных растворов каких из приведенных ниже веществ на катоде выделяется только металл: хлорид бария, хлорид меди (II), иодид калия, нитрат серебра, сульфид натрия? Привести соответствующие уравнения электродных процессов.
№ 13.3. При электролизе водных растворов каких из приведенных ниже веществ на катоде выделяется только водород: хлорид калия, хлорид никеля (II), бромид кальция, нитрат серебра, иодид натрия? Привести соответствующие уравнения электродных процессов.
№ 13.4. Среди приведенных ниже соединений указать вещества, продукты электролиза которых одинаковы как для растворов, так и для расплавов: фторид серебра, хлорид меди (II), иодид калия, гидроксид натрия. Привести соответствующие уравнения электродных процессов.
№ 13.5. Сколько граммов меди выделилось на катоде при электролизе раствора CuSO4 в течение 40 мин при силе тока 1,2 А? Привести уравнения электродных процессов. (Ответ: 0,948 г).
№ 13.6. Для выделения 1,75 г некоторого металла из раствора его соли потребовалось пропускать ток силой 1,8 А в течение 1,5 ч. Вычислить молярную массу эквивалентов металла. (Ответ: 17,37 г/моль).
№ 13.7. При электролизе раствора CuCl2 на аноде выделилось 560 мл газа (условия нормальные). Найти массу меди, выделившейся на катоде. Привести уравнения электродных процессов. (Ответ: 1,59 г).
№ 13.8.При электролизе в течение 1 ч водного раствора нитрата висмута Bi(NO3)3 на катоде выделилось 14 г висмута. Выход по току составляет 94 %. Вычислить силу тока. (Ответ: 5,73 А).
№ 13.9.Через электролизеры с водными растворами нитрата ртути (II) и нитрата серебра пропустили одинаковое количество электричества. При этом выделилась ртуть массой 401,2 г. Чему равна масса выделившегося серебра? Привести уравнения электродных процессов. (Ответ: 432 г).
№ 13.10.При электролизе водного раствора SnCl2 на аноде выделилось
4,48 л хлора (условия нормальные). Найти массу выделившегося на катоде олова. Привести уравнения электродных процессов. (Ответ: 23,74 г).
№ 13.11.Сколько минут следует пропускать ток силой 0,5 А через раствор нитрата серебра для выделения 0,27 г серебра? Привести уравнения электродных процессов. (Ответ: 8 мин).
№ 13.12. При какой силе тока можно получить на катоде 0,5 г никеля, подвергая электролизу раствор сульфата никеля в течение 25 мин? (Ответ: 1,1 А).
№ 13.13.Раствор содержит ионы Fe 3+ , Cu 2+ , Sn 2+ в одинаковой концентрации. В какой последовательности эти ионы будут выделяться при электролизе, если напряжение достаточно для выделения любого металла? Ответ обосновать.
№ 13.14.При электролизе раствора AgNO3 в течение 50 мин при силе тока
3 А на катоде выделилось 9,6 г серебра. Определить выход серебра в процентах от теоретически возможного. Привести уравнения электродных процессов. (Ответ: 95,4 %).
№ 13.15.Какие вещества и в каком объеме можно получить при нормальных условиях на нерастворимом аноде при электролизе водного раствора КОН, если пропустить ток силой 13,4 А в течение 2 ч? Привести уравнения электродных процессов. (Ответ: 1,2 л; 5,6 л).
№ 13.16.Сколько времени потребуется для выделения на катоде 4 г вещества при электролизе расплава хлорида кальция при токе силой 1А? Привести уравнения электродных процессов. (Ответ: 5,36 ч).
№ 13.17. Через водный раствор сульфата цинка пропущено 8407 Кл электричества. При этом на катоде выделилось 1,9 г цинка. Рассчитать катодный выход цинка по току. Привести уравнения электродных процессов.
№ 13.18.Вычислить объем кислорода (нормальные условия), выделившегося у анода при электролизе водного раствора сульфата меди, если сила тока составляла 5 А, а продолжительность электролиза 1 ч. (Ответ: 1,04 л).
№ 13.19.Вычислить количество электричества, которое необходимо пропустить через раствор хлорида натрия, чтобы получить 1 т гидроксида натрия. Привести схемы электродных процессов. (Ответ: 2412,5×10 9 Кл).
№ 13.20. При электролизе водного раствора СuCl2 с медным анодом масса анода уменьшилась на 1,4 г. Определить расход электричества при этом, если выход по току составляет 73 %. Составить уравнения электродных процессов, определить продукты электролиза. (Ответ: 5825 Кл).
Источник
Как рассчитать массу металла, выделившегося на электроде при электролизе его соли
Задача 696.
Никель в ряду напряжений стоит до водорода. Объяснить, почему возможно электролитическое выделение никеля из водных растворов его солей.
Решение:
Никель имеет стандартный электродный потенциал равный -0,250 В, что больше, чем электродный потенциал водородного электрода в нейтральной среде (-0,41 В), но меньше, чем для водородного электрода в кислой среде, то в зависимости от рН раствора, плотно-сти тока, концентрации ионов металла, возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. На-пример, если рН раствора соли будет близка нейтральной, то разряжаться будет никель, так как его потенциал значительно положительнее потенциала водородного электрода (-0,41 В), а если раствор соли имеет кислую среду, то разряжаться будет водород, так как его потенциал (0,00 В) значительно положительнее потенциала металла (-0,250 В).
Задача 697.
Неочищенная медь содержит примеси серебра и цинка. Что произойдет с этими примесями при электролитическом рафиниронии меди?
Решение:
При электролитическом рафинировании меди применяют сульфат меди – наиболее дешёвая и распространённая соль меди. Неочищенные примеси в металлической меди, состоящие из цинка и серебра можно разделить на две группы: Zn – металл, имеющий значительно более отрицательный электродный потенциал (-0,763 В), чем медь (+0,337 В). Поэтому он анодно растворяется вместе с медью, но не осаждается на катоде, а накапливается в электролите у катодного пространства. В связи с этим электролит нужно периодически очищать от цинка.
Ag – благородный металл, не претерпевает анодного растворения, и в ходе процесса электролиза оседает у анода, образуя вместе с другими примесями анодный шлам, который можно извлечь.
Задача 698.
При электролизе раствора CuCl2 на аноде выделилось 560 мл газа (условия нормальные). Найти массу меди, выделившейся на катоде.
Решение:
Для расчета количества электричества используем формулу:
Получим
Теперь рассчитаем массу меди, выделившейся на катоде по формуле:
Здесь Э – эквивалентная масса меди равная 31,773г/моль; F – постоянная Фарадея (96500 Кл/моль), т.е. количество электричества, необходимое для осуществления превращения одного эквивалента вещества; t – время, с; I – сила тока; VЭ – эквивалентный объём газа, для хлора он равен 11200 мл/моль; V – объём выделившегося газа, m – масса выделившегося вещества.
Ответ: 1,59г.
Задача 699.
Вычислить массу серебра, выделившегося на катоде при пропускании тока силой 6 А через раствор нитрата серебра в течение 30 мин.
Решение:
Схема электрохимического процесса: Ag+ – 1
Здесь Э – эквивалентная масса серебра; F – постоянная Фарадея (96500 Кл/моль), т. е. количество электричества, необходимое для осуществления превращения одного эквивалента вещества; t – время, с; I – сила тока; m – масса выделившегося вещества.
Ответ: 12 г
На катоде выделилось
При пропускании тока силой 2 A в течение времени 1 час 20 минут 25 секунд через водный раствор металл (II) хлорида на катоде выделилось 3,269 грамм металла. Рассчитайте атомную массу металла.
Решение задачи
Первый закон Фарадея:
количество вещества, выделившегося или растворившегося на электродах, прямо пропорционально количеству прошедшего через раствор электричества.
Согласно первому закону Фарадея:
Где:
m (А) — масса вещества А, окисленного или восстановленного на электроде (г);
М(1/z,А) — молярная масса эквивалента вещества А (г/моль);
I — сила тока (А);
t — продолжительность электролиза (с);
F – число Фарадея, (F ≈ 96500 Кл/моль).
Из формулы выразим вычислить молярную массу эквивалента вещества А (г/моль):
Учитывая, что на катоде выделилось в течение 1 часа 20 минут 25 секунд – это 4 825 секунд, вычислим молярную массу эквивалента металла:
М(1/z,А) = 96500 ⋅ 3,269 / 2 ⋅ 4 825 = 32,69 (г/моль).
Найдем молярную массу двухвалентного металла (Me) по формуле:
Рассчитаем молярную массу металла по формуле:
Где:
М – молярная масса,
В – валентность,
Э – эквивалентная масса,
n – число атомов элемента в соединении.
Получаем:
M (Мe) = 2 ∙ 32,69 = 65,38 (г/моль).
Напомню, что молярная масса вещества, имеющего атомную или металлическую структуру, численно равна относительной атомной массе.
Следовательно, на катоде выделился металл – цинк (Zn).
Ответ:
атомная масса металла равна 65,38.
Содержание
- Расчет массы меди, выделившейся на катоде при электролизе её соли
- Вычисление массы меди, зная выход по току и напряжение электролизера
- Масса меди на катоде при при электролизе раствора CuSO4
- Какой заряд проходит через раствор сульфата меди (CuSO4) за время t
- Химик.ПРО – решение задач по химии бесплатно
- Электролиз. Пример 1.Какая масса меди выделится на катоде при электролизе раствора CuSO4 в течение 1 ч
- Как рассчитать массу металла, выделившегося на электроде при электролизе его соли
- Как рассчитать массу выделившейся меди при электролизе
- Расчет массы меди, выделившейся на катоде при электролизе её соли
- Вычисление массы меди, зная выход по току и напряжение электролизера
- Масса меди на катоде при при электролизе раствора CuSO4
- Какой заряд проходит через раствор сульфата меди (CuSO4) за время t
- 14. Электролиз Примеры решения задач
- 15. Коррозия металлов Примеры решения задач
Расчет массы меди, выделившейся на катоде при электролизе её соли
Вычисление массы меди, зная выход по току и напряжение электролизера
Задача 115.
При электролизе водного раствора Cu2Cl2 с использованием графитовых электродов израсходовано 1000 кВт•час электроэнергии. Составить схему электролиза и вычислить количество полученной меди, если выход по току составляет 90%, напряжение электролизера 7 В.
Дано:
k(Cu) = 6,588 • 10 -7 кг/Кл;
U = 7 B;
W = 1000 кВт•час = 3600000000 Вт•с = 3,6 • 109 В•А•с;
h = 90% или 0,9;
m(Cu) = ?
Решение:
Масса вещества, выделившегося при электролизе, прямо пропорциональна количеству электрического тока, пропущенного через электролит.
К.п.д. установки (h) равно:
где q-заряд, прошедший через ванну; U — напряжение электролизера; W — количество, израсходованной электроэнергии . Масса выделившейся меди m = kq.
m(Cu) = [(6,588 • 10 -7 кг/Кл)•(3,6 • 109 В•А•с)•0,9]/7 B = 304,93 кг.
Ответ: m(Cu) = 304,93 кг.
Масса меди на катоде при при электролизе раствора CuSO4
Пример 116.
Какая масса меди выделится на катоде при электролизе раствора CuSO4 в течение 1,5 ч при силе тока 3 А?
Решение:
Масу меди рассчитаем по формуле Фарадея:
m — масса вещества, окисленного или восстановленного на электроде, г; MЭ(А) — эквивалентная масса вещества; I — сила тока, А; t — продолжительность электролиза, с; F — число Фарадея равно 96500 Кл/моль. Эквивалентная масса меди в CuSO4 равна:
63,54//2 = 31,77 г/моль.
Массу меди рассчитаем, подставив в формулу соответствующие значения МЭ(Cu) = 31,77; I = 3 А; t = 70 • 60 = 4200 с; = 96500 Кл/моль:
m(Cu) = МЭ(Cu)It/F = (31,77 • 3• 4200)/96500 = 4,148 г.
Ответ: m(Cu) = 4,148 г.
Какой заряд проходит через раствор сульфата меди (CuSO4) за время t
Задача 117.
Какой заряд проходит через раствор сульфата меди (CuSO4) за время t = 20с, если ток за это время равномерно возрастает от I1 = 0 до I2 = 3А? Какая масса меди выделяется при этом на катоде? Электрохимический эквивалент меди k = 3,3 • 10 -7 кг/Кл.
Решение:
1. Рассчитаем средний ток, получим:
I = (I1 + I2)/2.
2. Рассчитаем заряд, протекший через раствор, получим:
3.Рассчитаем массу меди, выделившейся на катоде, получим:
m(Cu) = k(I1 + I2)t/2 = [(3,3 • 10-7 кг/Кл) • 20 c]/2 = 0,0000099 кг или 9,9 мг.
Ответ: m(Cu) = 9,9 мг.
Источник
Химик.ПРО – решение задач по химии бесплатно
При электролизе раствора хлорида меди (II) (CuCl2) на аноде выделилось 560 мл газа (условия нормальные). Найдите массу меди, выделившейся на катоде.
По условию задачи протекает электролиз раствора хлорида меди (CuCl2). Рассмотрим механизм электролиза раствора хлорида меди (CuCl2), учитывая, что раствор соли хлорида меди (CuCl2), образован малоактивным металлом (Cu) и бескислородным кислотным остатком (Cl — ).
Запишем уравнение диссоциации электролита:
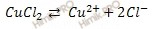
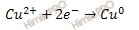
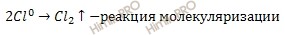
На основании ионно-молекулярное уравнения составим молекулярное уравнение электролиза раствора хлорида меди (CuCl2):
Электролиз – окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита и сопровождающийся разложением расплавленного или растворенного вещества или воды.
Найдем химическое количество газа (хлора), который выделился на аноде при электролизе. Для этого будем использовать формулу нахождения химического количества вещества через объем:
По уравнению реакции электролиза раствора хлорида меди (CuCl2) найдем, сколько меди (Cu) (в молях) выделилось на катоде:
Учитывая, что молярная масса меди (Cu) равна 63,5 г/моль, вычислим массу меди (Cu), выделившейся на катоде, по формуле, устанавливающей связь между массой и количеством вещества:
m (Cu) = 0,025 моль ∙ 63,5 г/моль = 1,588 (г).
Ответ: масса меди = 1,588 грамм.
Источник
Электролиз. Пример 1.Какая масса меди выделится на катоде при электролизе раствора CuSO4 в течение 1 ч



Пример 1.Какая масса меди выделится на катоде при электролизе раствора CuSO4 в течение 1 ч. при силе тока 4А?
Решение. Согласно законам Фарадея
где т — масса вещества, окисленного или восстановленного на электроде; Э — молярная масса эквивалента вещества; I — сила тока, A; t — продолжительность электролиза, с.
Молярная масса эквивалентов меди в CuSO4 равна 63,54 : 2 = =31,77 г/моль. Подставив в формулу (1) значения Э = 31,77, I = 4 А, t= 60 ∙ 60 = 3600 с, получим
Пример 2.Вычислите молярную массу эквивалента металла, зная, что при электролизе раствора хлорида этого металла затрачено 3880 Кл электричества и на катоде выделяется 11,742 г металла.
Решение. Подставляя в формулу (1) числовые значения, получаем
Э = 11,742 ∙ 96500/3880 = 29,35 г/моль,
где m = 11,742 г; It = Q = 3880 Кл.
Пример 3.Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода (н.у.)?
Решение. Из формулы (1)
Так как дан объем водорода, то отношение т/Э заменяем отношением VH; /VЭ(Н 
I = VH 
Объем эквивалентной массы водорода при н.у. равен половине молярного объема 22,4/2 = 11,2 л. Подставив в приведенную формулу значения VН 
I = 1,4∙96,500/(11.2∙6025) = 2А
Пример 4.Какая масса гидроксида калия образовалась у катода при электролизе раствора K2SO4, если на аноде выделилось 11,2 л кислорода (н.у.)?
Решение. Объем эквивалентной массы кислорода (н.у.) 22,4/4 = = 5,6 л. Следовательно, 11,2 л содержат две молярные массы эквивалента кислорода. Столько же эквивалентных масс КОН образовалось у катода, или 56,11 ∙ 2 = 112,22 г (56,11 г/моль — молярная и эквивалентная масса КОН).
8.3.Коррозия металлов
При решении задач этого раздела см. табл. 8.
Коррозия — это самопроизвольно протекающий процесс разрушения металлов в результате их химического или электрохимического взаимодействия с окружающей средой.
При электрохимической коррозии на поверхности металлаодновременно протекают два процесса: анодный — окисление металла
Ме°-пе=Ме п+ и катодный — восстановление ионов водорода
или молекул кислорода, растворенного в воде,
Ионы или молекулы, которые восстанавливаются на катоде, называют деполяризаторами. При атмосферной коррозии — коррозии во влажном воздухе при комнатной температуре — деполяризатором является кислород [1].
Пример 1.Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворах? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение. Цинк имеет более отрицательный потенциал (-0,763 В), чем кадмий (-0,403 В), поэтому он является анодом, а кадмий катодом.
Zn°-2e — =Zn 2+ катодный процесс:
в кислой среде 2Н + + 2е — = Н2
в нейтральной среде ½ О2 + Н2О + 2е — = 2ОН —
Так как ионы Zn 2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии будет Zn(OH)2.
Источник
Задача 696.
Никель в ряду напряжений стоит до водорода. Объяснить, почему возможно электролитическое выделение никеля из водных растворов его солей.
Решение:
Никель имеет стандартный электродный потенциал равный -0,250 В, что больше, чем электродный потенциал водородного электрода в нейтральной среде (-0,41 В), но меньше, чем для водородного электрода в кислой среде, то в зависимости от рН раствора, плотно-сти тока, концентрации ионов металла, возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. На-пример, если рН раствора соли будет близка нейтральной, то разряжаться будет никель, так как его потенциал значительно положительнее потенциала водородного электрода (-0,41 В), а если раствор соли имеет кислую среду, то разряжаться будет водород, так как его потенциал (0,00 В) значительно положительнее потенциала металла (-0,250 В).
Задача 697.
Неочищенная медь содержит примеси серебра и цинка. Что произойдет с этими примесями при электролитическом рафиниронии меди?
Решение:
При электролитическом рафинировании меди применяют сульфат меди – наиболее дешёвая и распространённая соль меди. Неочищенные примеси в металлической меди, состоящие из цинка и серебра можно разделить на две группы: Zn – металл, имеющий значительно более отрицательный электродный потенциал (-0,763 В), чем медь (+0,337 В). Поэтому он анодно растворяется вместе с медью, но не осаждается на катоде, а накапливается в электролите у катодного пространства. В связи с этим электролит нужно периодически очищать от цинка.
Ag – благородный металл, не претерпевает анодного растворения, и в ходе процесса электролиза оседает у анода, образуя вместе с другими примесями анодный шлам, который можно извлечь.
Задача 698.
При электролизе раствора CuCl2 на аноде выделилось 560 мл газа (условия нормальные). Найти массу меди, выделившейся на катоде.
Решение:
Для расчета количества электричества используем формулу:
Теперь рассчитаем массу меди, выделившейся на катоде по формуле:
Здесь Э – эквивалентная масса меди равная 31,773г/моль; F – постоянная Фарадея (96500 Кл/моль), т.е. количество электричества, необходимое для осуществления превращения одного эквивалента вещества; t – время, с; I – сила тока; VЭ – эквивалентный объём газа, для хлора он равен 11200 мл/моль; V – объём выделившегося газа, m – масса выделившегося вещества.
Ответ: 1,59г.
Задача 699.
Вычислить массу серебра, выделившегося на катоде при пропускании тока силой 6 А через раствор нитрата серебра в течение 30 мин.
Решение:
Схема электрохимического процесса: Ag+ — 1 
Здесь Э – эквивалентная масса серебра; F – постоянная Фарадея (96500 Кл/моль), т. е. количество электричества, необходимое для осуществления превращения одного эквивалента вещества; t – время, с; I – сила тока; m – масса выделившегося вещества.
Источник
Как рассчитать массу выделившейся меди при электролизе

Электролиз можно производить только постоянным током. При электролизе на отрицательном электроде (катоде) выделяется водород или металл, содержащийся в соли. Если положительный электрод (анод) выполнен из металла (обычно того же, что и в соли), то положительный электрод при электролизе растворяется. Если анод нерастворим (например, угольный), то содержание металла в электролите при электролизе уменьшается.
Количество вещества, выделяющегося при электролизе на катоде, пропорционально количеству электричества, которое протекло через электролит.
Количество вещества, выделенное одним кулоном электричества, называется электрохимическим эквивалентом A, поэтому G=A•Q; G=A•I•t,
где G – количество выделенного вещества; Q – количество электричества; I – электрический ток; t – время.
Каждый металл имеет свой электрохимический эквивалент A.
1. Сколько меди выделится из медного купороса (CuSO4) (рис. 1) током I=10 А за 30 мин. Электрохимический эквивалент меди A=0,329 мг/A•сек.
G = A•I•t = 0,329•10•30•60 = 5922 мг =5,922 г.
На предмете, подвешенном к катоду, выделится 5,9 г чистой меди.
2. Допустимая плотность тока при электролитическом меднении •=0,4 А/дм2. Площадь катода, которая должна покрыться медью, S=2,5 дм2. Какой ток необходим для электролиза и сколько меди выделится на катоде за 1 ч (рис. 2 ).
I=••S =0,4-2,5=l A; G=A•Q=A•I•t=0,329•1•60•60=1184,4 мг.
3. Окисленная вода (например, слабый раствор серной кислоты H2SO4) при электролизе разлагается на водород и кислород. Электроды могут быть угольные, оловянные, медные и т. д., но лучше всего из платины. Сколько кислорода выделится на аноде и сколько водорода выделится на катоде за 1/4 ч при токе 1,5 А. Количество электричества 1 А•сек выделяет 0,058 см3 кислорода и 0,116 см3 водорода (рис. 3 ).
На катоде выделится Gа=A•I•t=0,058•1,5•15•60=78,3 см3 кислорода.
На аноде выделится Gк=A•I•t=0,1162•1,5•15•60=156,8 см3 водорода.
Смесь водорода и кислорода в такой пропорции называется гремучим газом, который при поджигании взрывается с образованием воды.
4. Кислород и водород для лабораторных опытов получают при помощи электролиза воды (окисленной серной кислотой) (рис. 4 ). Платиновые электроды впаяны в стекло. Установим с помощью сопротивления ток I=0,5 А. (В качестве источника тока используется батарея из трех сухих элементов по 1,9 В.) Сколько водорода и кислорода выделится через 30 мин.
Рис. 4 . Рисунок к примеру 4
В правом сосуде выделится Gк=А•I•t=0,1162•0,5•30•60=104,58 см3 водорода.
В левом сосуде выделится Ga=A•l•t=0,058•0,5•30•60=52,2 см3 кислорода (газы выталкивают воду в средний сосуд).
5. Преобразовательная установка (двигатель-генератор) обеспечивает ток для получения электролитической (чистой) меди. За 8 ч необходимо получать 20 кг меди. Какой ток должен обеспечить генератор• Электрохимический эквивалент меди равен A=0,329 мг/А•сек.
Так как G=A•I•t, то I=G/(A•t)=20000000/(0,329•8•3600)=20000000/9475,2=2110,7 А.
6. Нужно отхромировать 200 фар, из которых на каждую требуется 3 г хрома. Какой ток необходим, чтобы эта работа была выполнена за 10 ч (электрохимический эквивалент хрома A=0,18 мг/А•сек).
7. Алюминий получают путем электролиза раствора каолиновой глины и криолита в ваннах при рабочем напряжении ванны 7 В и токе 5000 А. Аноды изготовляются угольными, а ванна – стальной с угольными блоками (рис. 5 ).
Рис. 5 .Рисунок к примеру 5
Ванны для получения алюминия соединяются последовательно для увеличения рабочего напряжения (например, 40 ванн). Для получения 1 кг алюминия требуется примерно 0,7 кг угольных анодов и 25–30 кВт•ч электроэнергии. По приведенным данным определить мощность генератора, расход электроэнергии за 10 ч работы и вес полученного алюминия.
Мощность генератора при работе на 40 ванн P=U•I=40•7•5000=1400000 Вт =1400 кВт.
Электрическая энергия, расходуемая за 10 ч, A=P•t=1400 кВт 10 ч=14000 кВт•ч.
Количество полученного алюминия G=14000 : 25=560 кг.
Исходя из теоретического электрохимического эквивалента, количество полученного алюминия должно быть равно:
Gт=A•I•t=0,093•5000•40•10•3600=0,093•7200000000 мг=669,6 кг.
Коэффициент полезного действия электролитической установки равен: кпд=G/Gт =560/669,6=0,83=83%.
Если Вам понравилась эта статья, поделитесь ссылкой на неё в социальных сетях. Это сильно поможет развитию нашего сайта!
Не пропустите обновления, подпишитесь на наши соцсети:
Расчет массы меди, выделившейся на катоде при электролизе её соли
Вычисление массы меди, зная выход по току и напряжение электролизера
Задача 115.
При электролизе водного раствора Cu2Cl2 с использованием графитовых электродов израсходовано 1000 кВт•час электроэнергии. Составить схему электролиза и вычислить количество полученной меди, если выход по току составляет 90%, напряжение электролизера 7 В.
Дано:
k(Cu) = 6,588 • 10 -7 кг/Кл;
U = 7 B;
W = 1000 кВт•час = 3600000000 Вт•с = 3,6 • 109 В•А•с;
h = 90% или 0,9;
m(Cu) = ?
Решение:
Масса вещества, выделившегося при электролизе, прямо пропорциональна количеству электрического тока, пропущенного через электролит.
К.п.д. установки (h) равно:
где q-заряд, прошедший через ванну; U — напряжение электролизера; W — количество, израсходованной электроэнергии . Масса выделившейся меди m = kq.
m(Cu) = [(6,588 • 10 -7 кг/Кл)•(3,6 • 109 В•А•с)•0,9]/7 B = 304,93 кг.
Ответ: m(Cu) = 304,93 кг.
Масса меди на катоде при при электролизе раствора CuSO4
Пример 116.
Какая масса меди выделится на катоде при электролизе раствора CuSO4 в течение 1,5 ч при силе тока 3 А?
Решение:
Масу меди рассчитаем по формуле Фарадея:
m — масса вещества, окисленного или восстановленного на электроде, г; MЭ(А) — эквивалентная масса вещества; I — сила тока, А; t — продолжительность электролиза, с; F — число Фарадея равно 96500 Кл/моль. Эквивалентная масса меди в CuSO4 равна:
63,54//2 = 31,77 г/моль.
Массу меди рассчитаем, подставив в формулу соответствующие значения МЭ(Cu) = 31,77; I = 3 А; t = 70 • 60 = 4200 с; = 96500 Кл/моль:
m(Cu) = МЭ(Cu)It/F = (31,77 • 3• 4200)/96500 = 4,148 г.
Ответ: m(Cu) = 4,148 г.
Какой заряд проходит через раствор сульфата меди (CuSO4) за время t
Задача 117.
Какой заряд проходит через раствор сульфата меди (CuSO4) за время t = 20с, если ток за это время равномерно возрастает от I1 = 0 до I2 = 3А? Какая масса меди выделяется при этом на катоде? Электрохимический эквивалент меди k = 3,3 • 10 -7 кг/Кл.
Решение:
1. Рассчитаем средний ток, получим:
I = (I1 + I2)/2.
2. Рассчитаем заряд, протекший через раствор, получим:
3.Рассчитаем массу меди, выделившейся на катоде, получим:
m(Cu) = k(I1 + I2)t/2 = [(3,3 • 10-7 кг/Кл) • 20 c]/2 = 0,0000099 кг или 9,9 мг.
Ответ: m(Cu) = 9,9 мг.
14. Электролиз Примеры решения задач
Пример 1. При рафинировании меди ток силой в 50 А выделил — за 5 ч чистую медь массой 281 г. Какому выходу по току это соответствует?
Решение. По законам Фарадея можно рассчитать теоретическое значение массы выделившейся меди:
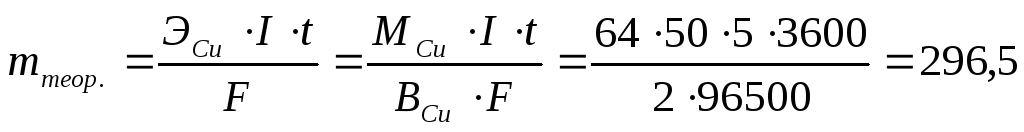
Выход по току находим по формуле:
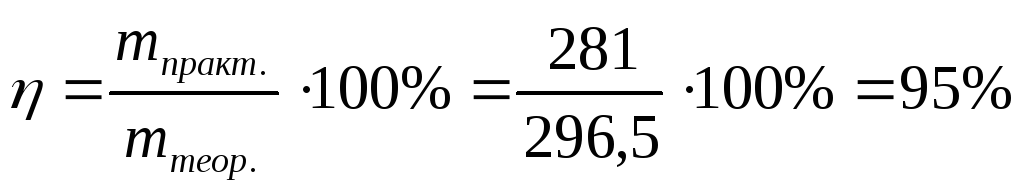
Пример 2. Через раствор, содержащий ионы Pb 2+ , в течение 5 мин. пропускался ток постоянной силы. За это время масса катода увеличилась на 1,24 г. Какова сила тока, который был использован для электролиза?
Решение. Поскольку нет дополнительных сведений, считаем выход по току 100%-ным. Тогда для расчета силы тока можно воспользоваться законом Фарадея:
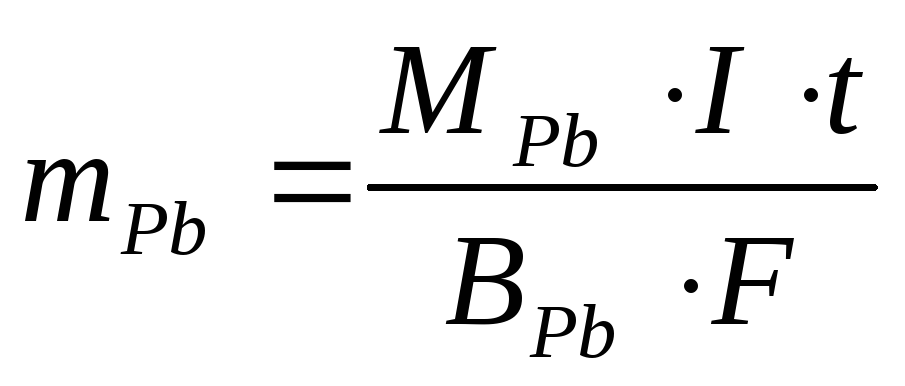
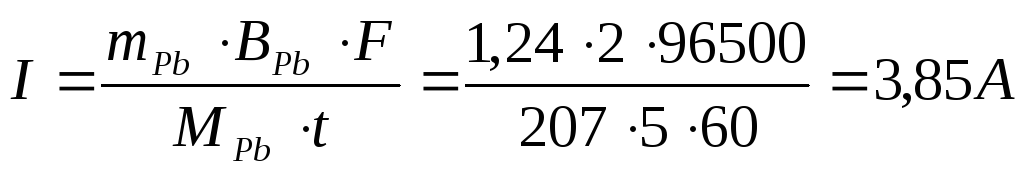
Пример 3. Ток последовательно проходит через два электролизера, в которых содержатся водные растворы: а) NiSO4; б) FeCl2. Какие количества металлов выделятся на катодах, если известно, что у анода второго электролизера выделилось 1,4 л хлора?
Решение. Воспользуемся законом эквивалентов для расчета массы железа, выделившегося на катоде второго электролизера:
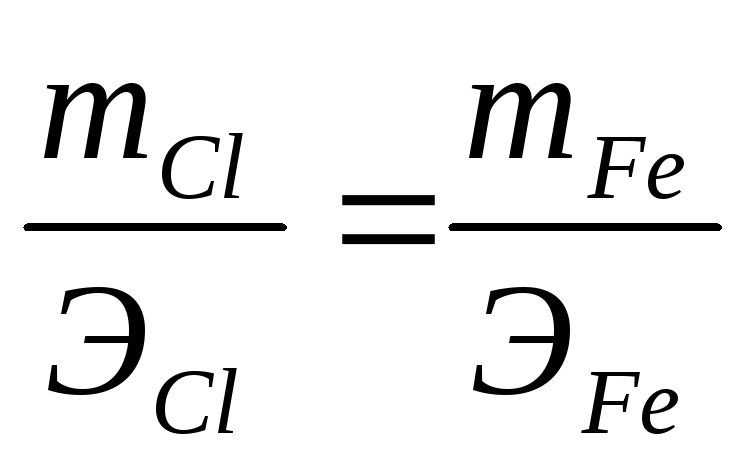
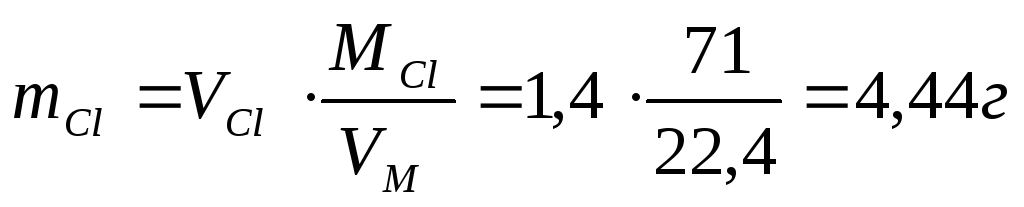

Какими свойствами будут обладать оксидные пленки на металлах рубидии Rb и марганце Mn, образующих соответствующие оксиды R2O, MnO, Mn2O3, Mn3O4?
Для определения свойств оксидных пленок воспользуемся формулой Бедворса – Пиллинга:
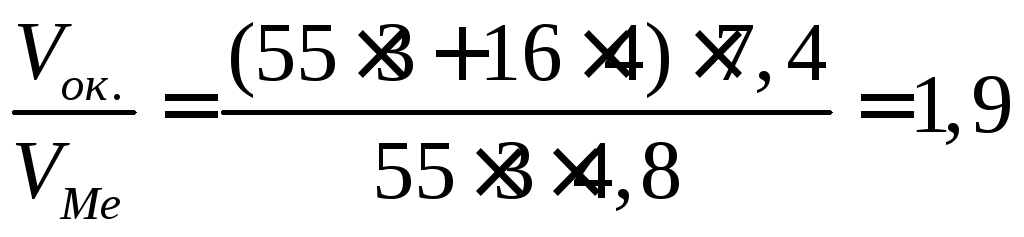
Все оксидные пленки, образующиеся на марганце, являются сплошными и защитными, т.к. 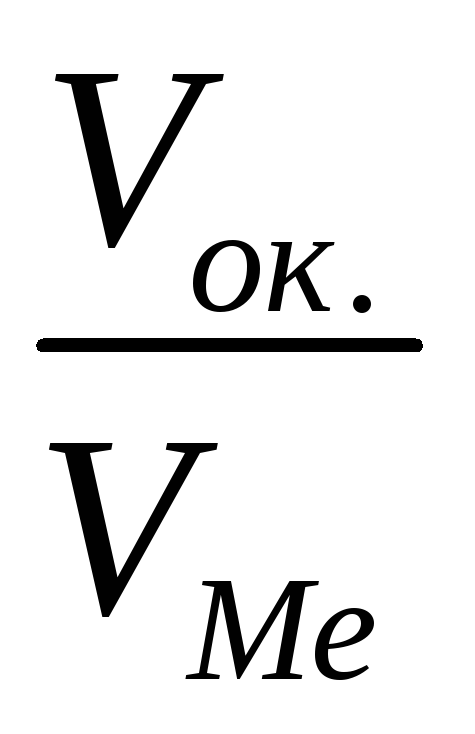
При коррозии бериллиевой пластины весом 300г и поверхностью 164мм , на воздухе прокорродировало 10% от массы бериллия в течение трех суток. Вычислите объемный показатель коррозии, считая, что продуктом коррозии является оксид бериллия, а внешние условия нормальными.
Вычислим убыль массы бериллиевой пластины, т.е. сколько граммов бериллия прокородировало:
Составим уравнение реакции взаимодействия бериллия с кислородом и найдем из него объем поглощенного кислорода:
30г
Вычислим объемный показатель, учитывая, что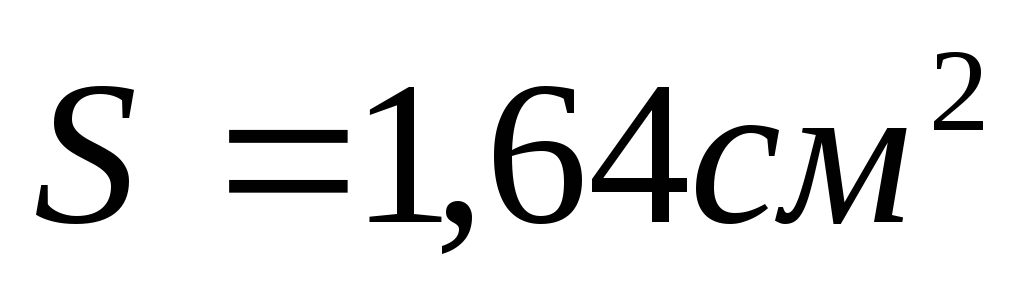
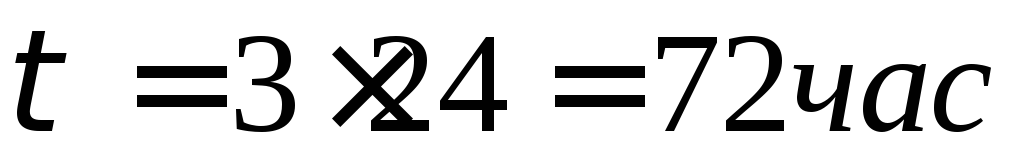
Оценить коррозионную стойкость меди на воздухе при высокой температуре. Медная пластина размером 50х40х2мм после 12 суток окисления и снятия продукта коррозии весила 35,798 г.
Вычислим площадь поверхности медной пластины:
Вычислим массу пластины до начала коррозии 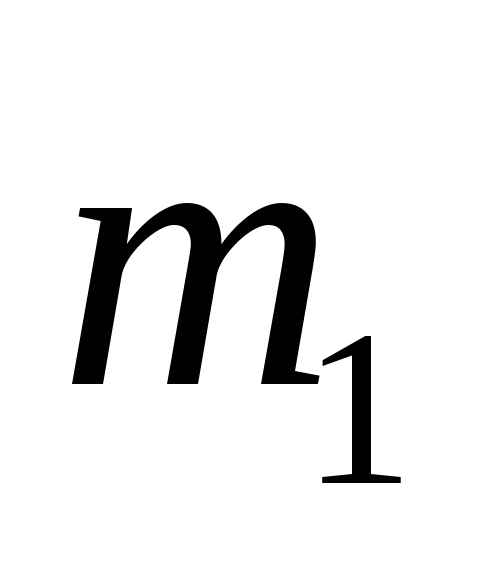
Вычислим убыль массы медной пластины:
Вычислим глубину коррозии:
Вычислим глубинный показатель:
По десятибалльной шкале коррозионной стойкости металлов определяем, что в данных условиях меди соответствует 4 балла, и она относится к стойким металлам.
Оценить коррозионную стойкость марганцевого стержня радиусом 1,5 мм и длиной 100 мм при температуре 1200 о С в атмосфере азота в течение 20 суток, если при этом поглотилось 250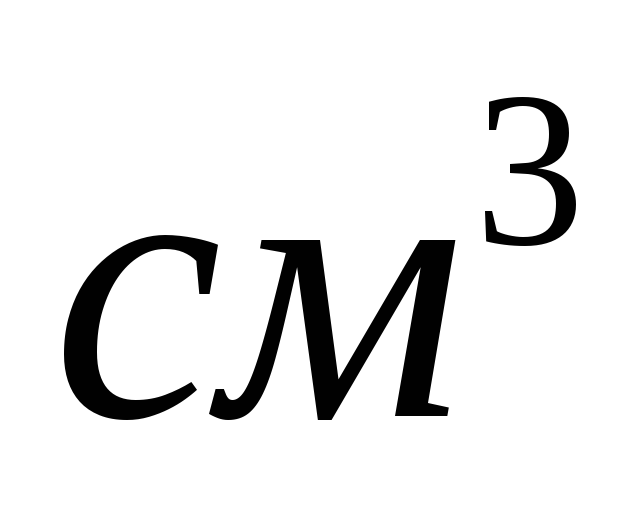
Вычислим объем поглощенного азота при нормальных условиях:
Вычислим по уравнению реакции массу прореагировавшего марганца:
Вычислим площадь поверхности стержня:
Вычислим глубину коррозии:
Вычислим глубинный показатель коррозии:
По десятибалльной шкале коррозионной стойкости металлов определяем, что марганцу в данных условиях соответствует 6 баллов, и он относится к пониженностойким металлам.
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Источник
ЭЛЕКТРОЛИТОВ
Электролизом
называются процессы, происходящие на
электродах под действием электрического
тока, подаваемого от внешнего источника.
При электролизе происходит превращение
электрической энергии в химическую.
Электролиз
подчиняется законам Фарадея и уравнениям
кинетики электродных процессов. По
первому закону Фарадея масса вещества
m,
образующегося при электролизе, прямо
пропорциональна количеству пошедшего
через раствор электричества Q:
m
= kQ,
где
k
– электрохимический эквивалент, который
равен количеству вещества, образующегося
при пропускании через электролит одного
кулона или одного ампер-часа электричества.
При
пропускании через электролит количества
электричества, равного постоянной
Фарадея F
= 96500 Кл (или 26,8 Ач),
выделяется одна молярная масса эквивалента
(МЭ)
вещества:
,
,
,
.
На
практике вследствие побочных процессов
на электродах масса вещества (mфакт.)
может быть больше или меньше, чем
рассчитанная по закону Фарадея (mтеор.)
Для характеристики отклонения от закона
Фарадея количества вещества, выделяющегося
на электродах, введено понятие “выход
по току” (Вт), выраженное в процентах:
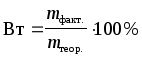
Пример
1.
Определите массу цинка, которая выделится
на катоде при электролизе раствора
сульфата цинка в течение 1 ч при токе
26,8 А, если выход цинка по току равен 50
%.
Решение.
Согласно
закону Фарадея
.
Масса
моля эквивалентов цинка в ZnSO4
равна
МЭ
= 65,38 : 2 = 32,69 г; t
= 3600 с.
mZn
= 32,69
26,8
3600/96500 = 32,69 г.
Так как выход по
току цинка составляет 50 %, то практически
на катоде выделится цинка
mZn(прак)
= 32,69
50/100 = 16,345 г.
Пример
2. Сколько
граммов КОН
образовалось у катода при электролизе
раствора К2SO4,
если на аноде выделилось 11,2 л кислорода,
при н. у.?
Решение.
Объем
моля эквивалентов кислорода (н.у.) равен
22,4/4 = 5,6 л.
Следовательно,
11,2 л кислорода составляют 2 моля
эквивалентов. Столько же, т. е. 2 моля
эквивалентов КОН,
образовалось
у катода, или 56,112
= 112,22 г (56,11 г – масса моля эквивалента
КОН).
Пример
3.
Какие реакции протекают на электродах
при электролизе раствора сульфата
цинка: а)
с графитовым анодом; б)
с цинковым анодом? Как изменится
количество цинка в растворе в обоих
случаях, если через раствор пропускать
ток силой 26,8 А в течение 2 часов? Выход
по току на катоде 50 %, на аноде 100 %.
Решение.
В водном растворе сульфата цинка на
катоде могут протекать реакции:
Zn2+
+ 2e
Zn,
E0
= – 0,76 В,
2Н2О
+ 2е
Н2
+ 2ОН–,
Е0
= – 0,414 В.
Стандартный
потенциал цинкового электрода
отрицательнее, чем водородного, однако
поляризация водородного электрода
больше, поэтому происходит одновременное
выделение водорода и цинка, по 50 %.
На
цинковом аноде
происходит только растворение цинка:
Zn
– 2е
Zn2+,
так как потенциал выделения кислорода
=
+0,814 В больше.
На
графитовом аноде
будет выделяться кислород, так как ионы
SO4-2
в этих условиях не окисляются Н2О
– 2е
½О2
+ 2Н+.
Таким
образом, в электролизере с цинковым
анодом на катоде осаждается цинк и
выделяется водород, а на аноде растворяется
цинк. В электролизере с графитовым
анодом на катоде осаждается цинк и
выделяется водород, а на аноде выделяется
кислород.
По
закону Фарадея при пропускании 26,8 Ач
электричества (1 F) на электродах испытывает
превращение 1 моль эквивалентов вещества.
Так как выход цинка на катоде 50 %, то на
нем выделится 0,5 моля эквивалентов цинка
и количество цинка в электролите
уменьшится также на 0,5 моля эквивалентов.
На
цинковом аноде при 100%-м выходе по току
растворяется 1 моль эквивалентов цинка,
а осаждается 0,5 моля, следовательно, в
растворе количество цинка увеличилось
на 0,5 моля эквивалентов.
Пример
4.
Вычислите стандартную ЭДС поляризации
при электролизе водного раствора NaCl
с платиновым анодом.
Решение.
Электродные
процессы описываются уравнениями:
на
катоде:
2Н2О
+ 2е
Н2
+ 2ОН–
Е0
= –0,83 В;
на
аноде:
2С1–
– 2е
С12
Е0
= + 1,36 В.
ЭДС
поляризации направлена противоположно
ЭДС гальванического элемента:
(–)
Н2,
2ОН–
2Н2О
2С1–
С12
(+).
Еполяр.
= ЕА
– ЕК
,
где
ЕА
и ЕК
– потенциалы анода и катода.
Следовательно,
Еполяр.
= 1,36 – (–0,83) = 2,19 В.
Пример
5.
Рассчитайте теоретический потенциал
разложения водного раствора NiSO4
при электролизе на платиновых электродах.
Решение.
Чтобы
электролиз шел непрерывно, необходимо
к электродам приложить разность
потенциалов, превышающую ЭДС поляризации.
Теоретический потенциал разложения
электролита равен ЭДС поляризации, его
вычисляют по разности потенциалов анода
и катода:
Еразл.
= ЕА
– ЕК.
на
аноде:
Н2О
– 2е
1/2О2
+ 2Н+
Е0
= 1,23 В;
на
катоде:
Ni2+
+ 2е
Ni
Е0
= –0,25 В.
Теоретический
потенциал разложения NiSO4
равен
Еразл.
= 1,23 – ( –0,25) = 1,479 В.
Пример
6.
Рассчитайте толщину никелевого покрытия
на изделии и изменение толщины никелевого
анода при электрохимическом никелировании
в течение 1 ч, если плотность тока на
катоде составляет 100 А/м2
и на аноде 50 А/м2,
а выход по току на катоде равен 0,8, на
аноде – 0,9. Плотность никеля 8,9 г/см3.
Решение.
Количество
электричества, прошедшее через единицу
поверхности электродов qS,
равно на катоде 100 Ач/м2
и на аноде 50 Ач/м2.
По закону Фарадея на единицу поверхности
катода выделилось никеля
mNi,к
= qSMЭ(Ni)
/ 26,8,
где
MЭ(Ni)
– масса 1 моль эквивалентов никеля –
58,71 / 2 = 29,35 г;
– выход
по току никеля;
26,8
– число Фарадея, Ач.
mNi,к
= 10029,350,8
/ 26,8 = 95 г/м2.
С
единицы поверхности анода растворилось
никеля
mNi,а
= 5029,350,9
/ 26,8 = 50 г/м2.
Толщина
покрытия на катоде
lNi,к
= mNi,к
/ dNi
= 95 / (8,910-6)
= 1,0710-5
м = 10,7 мкм.
Изменение
толщины никелевого анода
lNi,а=
mNi,к
/ dNi
= 50 / (8,910-6)
= 5,610-6
м = 5,6 мкм.
ЗАДАЧИ
-
При
пропускании тока 2А в течение 1 ч 14 мин
24 с через водный раствор хлорида металла
(II) на одном из графитовых электродов
выделился металл массой 2,94 г. Чему равна
атомная масса, если выход по току
100
%, и что это за металл? Напишите уравнения
реакций, протекающих на электродах.
-
Через
раствор сульфата кадмия пропущено 25
Ач
электричества. При этом на катоде
выделился кадмий массой 42,5 г. Напишите
уравнения реакций, протекающих на
электродах, рассчитайте выход по току
кадмия. -
Через
раствор сульфата металла (II) пропустили
420 Кл электричества. При этом на катоде
выделился металл массой 0,196 г. Выход
металла по току на катоде 80 %. Определите
металл и составьте уравнения реакций,
протекающих на электродах: а) для
графитовых электродов, б) для металлических
электродов -
Через
раствор сульфата железа (II) пропускали
ток 13,4 А в течение 1 ч. Определите массу
железа, которая выделилась на катоде,
если выход по току был равен 70 %. Напишите
уравнения реакций, протекающих на
электродах. -
При
электролизе сульфата натрия получили
при н.у. Н2
объемом 448 л. Напишите уравнения реакций,
протекающих на нерастворимых аноде и
катоде, и рассчитайте, сколько времени
протекал электролиз, если сила тока
была 100 А. -
Электролиз
раствора K2SO4
проводили с нерастворимыми электродами
при токе 2,68 А в течение 1 ч. Составьте
уравнения процессов, происходящих на
электродах, вычислите объем выделяющихся
при н.у. на электродах веществ. -
При
электролизе раствора сульфата меди на
аноде выделился кислород объемом 560
мл, измеренный при н.у. Сколько граммов
меди выделилось на катоде? -
Электролиз
раствора сульфата цинка проводили с
нерастворимыми анодами в течение 6,7 ч,
в результате чего выделился кислород
объемом 5,60 л, измеренный при н.у. Вычислите
силу тока и массу осажденного цинка
при выходе его по току 70 %. -
Напишите
уравнения реакций, протекающих на
нерастворимых электродах при электролизе
водного раствора КОН.
Какие вещества и в каком объеме можно
получить при н.у., если пропустить ток
13,4 А в течение 2 ч? -
Сколько
граммов Н2SO4
образуется около нерастворимого анода
при электролизе раствора Na2SO4,
если на аноде выделяется кислород
объемом 1,12 л, измеренный при н.у. Вычислите
массу вещества, выделяющегося на катоде. -
Сколько
граммов NaОН
образовалось у катода при электролизе
раствора сульфата натрия, если на аноде
выделился кислород объемом 5,6 л,
измеренный при н.у.? -
Напишите
уравнения реакций, протекающих на
графитовых электродах при электролизе:
а) расплава хлорида магния, б) раствора
хлорида магния. Сколько времени
необходимо вести электролиз при силе
тока 2 А, чтобы на катоде выделилось
вещество массой 2,43 г (для реакций а и
б)? -
Напишите
уравнения реакций, протекающих на
электродах при электролизе водного
раствора сульфата кадмия: а) с графитовым
анодом, б) с кадмиевым анодом. Если через
раствор пропускать ток 134 А в течение
2 ч, то как изменится количество кадмия
в растворе в обоих случаях, если выход
по току кадмия на катод равен 80 %, а на
аноде – 100 %? -
Напишите
уравнения реакций, протекающих на
графитовом электроде при электролизе
а) расплава хлорида кальция, б) раствора
хлорида кальция. Сколько времени
необходимо вести электролиз при токе
1 А, чтобы на катоде выделилось вещество
массой 4 г (для случаев а и б). -
Напишите
уравнения реакций, протекающих на
электродах при электролизе водного
раствора сульфата никеля: а) электроды
никелевые, б) электроды нерастворимые.
Каким должен быть ток, чтобы за 10 ч на
катоде выделился никель массой 47 г при
выходе его по току 80 %? -
При
электролизе раствора бромида меди (II)
(нерастворимые электроды) на одном из
электродов выделилась медь массой
0,635 г. Сколько граммов брома выделилось
на другом электроде, если выход по току
брома 90 %? Составьте уравнения реакций,
протекающих на электродах. -
Составьте
уравнения реакций, происходящих на
электродах при электролизе: а) раствора
KCl,
б) расплава KCl.
Рассчитайте массу веществ, выделившихся
на катоде и аноде в случаях а) и б) при
прохождении тока 26,8 А в течение 10 ч. -
Сколько
времени необходимо для электрохимического
сверления в никеле отверстия площадью
1 см2
и длиной 1 см при токе 10 А и выходе по
току 50 %? Плотность никеля 8,91 г/см3. -
Сколько
времени необходимо для электролитического
меднения пластины площадью 10 см2
при толщине осадка 10-5
м и токе 0,1 А? Плотность меди 8,96 г/см3. -
Сколько
времени необходимо для электролитического
никелирования изделия площадью 10 см2
при толщине осадка 210-5
м и токе 0,1 А, выходе по току 100 %? -
Сколько
времени необходимо для электролитического
цинкования изделия площадью 10 см2
при толщине осадка 10-5
м , токе 0,1 А, выходе по току 50 %? Плотность
цинка 7,14 г/см3.
Напишите уравнения катодных реакций. -
Вычислите
стандартную электродвижущую силу
поляризации при электролизе водных
растворов NaCl,
FeCl2,
NiCl2
c платиновым анодом. -
Рассчитайте
теоретический потенциал разложения
водных растворов ZnSO4,
AgNO3,
Cu(NO3)2
при электролизе их с графитовыми
электродами. Анодный процесс выражается
реакцией
2Н2О
– 4е = О2
+ 4Н+;
Е0
= 1,229 В.
-
При
токе силой 2 А в течение 40 мин выделилось
на катоде 4,542 г некоторого металла.
Вычислите электрохимический эквивалент
этого металла в г/(Ач). -
Рассчитайте
теоретический потенциал разложения
водных растворов Fe2(SO4)3,
NiSO4,
МnSO4
при электролизе их с платиновым анодом.
Анодный процесс выразится реакцией
2Н2О
– 4е = О2
+ 4Н+;
Е0
= 1,229 В.
-
При
пропускании через раствор электролита
2 Ач
электричества на аноде окислилось
1,196 г сульфид-иона. Определите
электрохимический и химический
эквивалент серы. -
Найдите
толщину отложившегося при электролизе
на железной проволоке слоя олова
(плотность олова 7298 кг/м3),
если длина проволоки 2 м, а диаметр ее
0,0004 м. Ток силой 2,5 А в течение 30 мин
пропускали через раствор SnCl2.
Выход по току равен 93 %. -
Для
получения 1м3
хлора при электролизе водного раствора
хлорида магния было пропущено через
раствор 2423 Ач
электричества. Вычислите выход по току.
(Дайте полную схему электролиза раствора
МgСl2
с применением графитовых электродов.) -
Вычислите
время, в течение которого должен быть
пропущен ток в 1,5 А через раствор
цинковой соли, чтобы покрыть металлическую
пластинку слоем цинка толщиной 2,510-5
м, если общая площадь поверхности
пластинки 0,1 м2,
а выход по току 90,5 % (плотность цинка
7133 кг/м3). -
Железный
предмет общей площадью 0,08 м2
помещен
в качестве катода в раствор соли никеля.
Какова толщина отложившегося слоя
никеля? Плотность никеля – 8910 кг/м3.
Ток силой 3,15 А пропускали в течение 42
мин. -
При
рафинировании меди током 25 А за 4 ч
выделяется 112 г меди. Рассчитайте выход
по току. -
Через
раствор соли Ni(NО3)2
в течение 2,45 ч пропускали ток силой
3,5 А. Определите, на сколько граммов за
это время уменьшилась масса никелевого
анода. -
Через
раствор сульфата цинка пропускали ток
в течение 30 мин. При этом выделилось
0,25 г цинка. Амперметр показывал 0,4 А.
Какова ошибка в показаниях амперметра? -
Определите
силу тока, необходимую для процесса
электролиза расплава хлорида магния
в течение 10 ч при выходе по току 85 %,
чтобы получить 0,5 кг металлического
магния?
508. В
электрическом производстве NaOH
используются хлорные электролизеры
диафрагменного типа. За сутки с
электролизера было получено 54501 л
раствора NaOH,
содержащего 138 г/л NaOH
при силе тока 22 кА. Сколько щелочи было
получено фактически, и каков выход по
току? F
= 96485 Кл/моль = 26,8 А
NaOH
А·ч/моль.
509. В
цехе электрического получения алюминия
серия из 150 непрерывно работающих
алюминиевых электролизеров нагрузкой
145 кА выдала за месяц (30 суток) работы
4700 тонн металла чистоты 99,5%. Среднее
напряжение на серии электролизеров
составило 695 В. Каковы выход по току и
удельный расход электроэнергии для
получения алюминия. Суммарный
электрохимический процесс: 4Al2O3
+ 7C
= 8Al
+ 5CO2
+
2CO.
510. Для
получения алюминия используют процесс
электролиза расплава боксита Al2O3
в криолите при 950 0С.
Привести реакцию разложения Al2O3
при электролизе (с использованием
платиновых анодов). Рассчитать
теоретическое значение напряжения
разложения боксито-криолитового
расплава, если термодинамические
параметры системы в этом процессе имеют
значения: H
= +1641,23
кДж/моль; S
= +
349,45 кДж/моль·К.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #