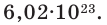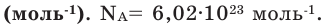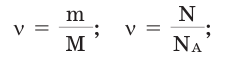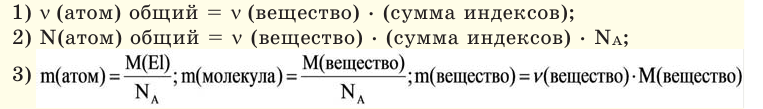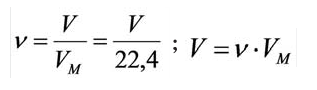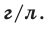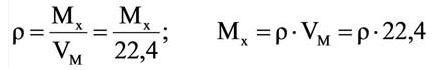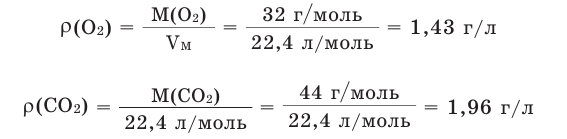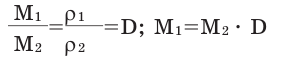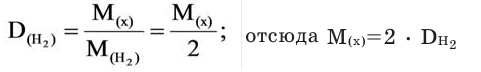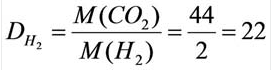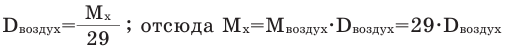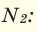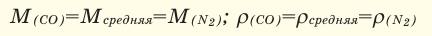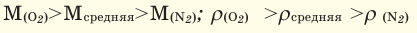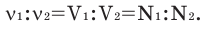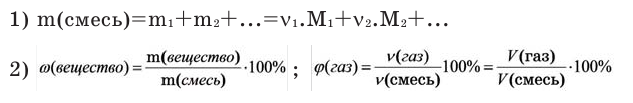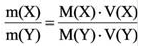Содержание:
Количество вещества:
В чём разница между понятиями «масса» и «количество»
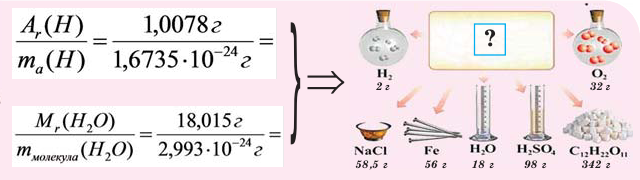
Если мы будем производить подобные расчеты, соответствующие этому заданию, для простых веществ, образованных различными элементами, то всякий раз получим одно и то же число —
Например, в 1 моле водородного газа содержится 

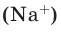

Количество частиц, содержащихся в 1 моле химических веществ ( 
Количество вещества можно вычислить по следующей формуле:
Здесь 
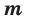
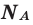
Молярная масса
Молярной массой называют массу 1 моля вещества, выраженного в граммах. Молярная масса обозначается
буквой М, единицей измерения является г/моль.
При выражении молярной массы вещества в граммах, она численно бывает равна его относительной молекулярной массе (если состоит из молекул). Для сравнения запишем (таблица 1):
Как видно из сравнений, молярная масса веществ по своей единице отличается от относительной молекулярной массы. То есть молярная масса – измеряемая величина.
Как видно из вышесказанного, понятие молярная масса применяется как к химическим элементам, так и к простым и сложным веществам с молекулярным и немолекулярным строением.
На основе количества вещества (моль) можно производить следующие вычисления. Если известно мольное количество вещества:
Закон Авогадро и молярный объём газов
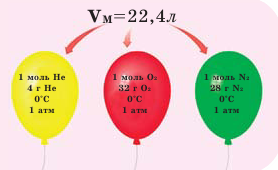
Обратите внимание на рисунки. Почему, несмотря на разные массы газов, они занимают одинаковый объём?
В начале XIX века итальянский ученый Авогадро, проведя наблюдения над свойствами газов в различных условиях и проанализировав открытые прежде законы о газах (Бойля-Мариотта, Гей-Люссака и др.) в 1811 году сформулировал новый закон о газах. Закон Авогадро звучит следующим образом: в равных объемах различных газов при одинаковых условиях (одинаковых температуре и давлении) содержится одинаковое число молекул.
Итальянский ученый. В 1811 году им был открыт закон о газах, который впоследствии был назван его именем.
Мы уже знаем, что 1 моль любого вещества содержит 
Было вычислено, что при нормальных условиях объем 1 моля любого газа или смеси газов составляет примерно 22,4 л. Объем 1 моля газа при нормальных условиях (н.у.) называют молярным объемом данного газа, выраженным знаком 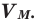
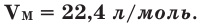
Здесь 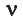
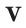
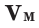
На основе закона Авогадро и молярного объёма газов можно вычислить плотность газов при нормальных условиях и относительную плотность одного газа по отношению к другому газу. Плотность обозначается буквой 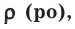
измерения –
Нормальные условия означают: температура 0°С, 1 атм давления 1атм — 101,3 кПа
Для вычисления плотности какого-либо газа X в нормальных условиях (н.у.), следует его молярную массу разделить на молярный объем:
Например, вычислим плотности кислорода и углекислого газа при нормальных условиях:
Плотность твёрдых и жидких веществ при н.у. вычисляется по формуле 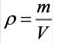
Для того, чтобы определить, масса какого из газов с одинаковыми объемами и при одинаковых условиях бывает тяжелее, пользуются понятием относительной плотности. Отношение плотностей различных газов при одинаковых условиях равно отношению их молярных масс. Относительная плотность обозначается буквой D и не имеет единицы измерения. Формула относительной плотности следующая:
Относительную плотность газов в большинстве случаев вычисляют по самому легкому газу – водороду и воздуху:
В таком случае, относительная плотность углекислого газа по водороду вычисляется следующим образом:
Так как средняя молярная масса воздуха, состоящего из смеси газов, примерно равна 29 г/моль, то формула его относительной плотности следующая:
Способы вычисления средней молярной массы газовой смеси
Здесь: 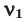
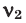
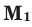
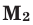

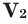
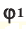
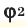
Среднюю молярную массу 1 моля смеси из двух различных газов можно вычислить по следующей формуле: 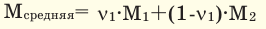
При смешивании газов с одинаковыми молярными массами, которые при одинаковом давлении не вступают друг с другом в реакцию, плотность газовой смеси (при н.у.), а также их средняя молярная масса остаются неизменными. Например, при смешивании 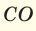
При смешивании газов с различными молярными массами, при одинаковом давлении, средняя молярная масса (при н.у.) и плотность полученной газовой смеси приобретают значение между молярными массами и плотностями смешиваемых газов. Например, при смешивании 
При добавлении газа с большей молярной массой в тот или иной газ при постоянном давлении плотность газовой смеси увеличивается, а при добавлении газа с меньшей молярной массой — уменьшается.
Закон объемных отношений
В химических реакциях соотношение объемов, вступающих в реакцию, и полученных газов равно соотношению их коэффициентов. Например:
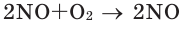
Численное соотношение объемов, молей и молекул газов равно друг другу.
Можно производить следующие вычисления по смесям:
3) Массовое соотношение двух газов:
- Физические и химические явления
- Растворы в химии
- Периодический закон Д. И. Менделеева
- Химические связи
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
- Химическая формула
- Относительная атомная и относительная молекулярная масса
Как определить молярную массу газа
Что такое молярная масса? Это масса одного моля вещества, то есть такого его количества, в котором содержится столько же атомов, сколько в 12 граммах углерода. Молярную массу сложного вещества вычисляют, складывая молярные массы входящих в него элементов. Например, NaCl – хорошо знакомая всем нам поваренная соль. Какова ее молярная масса? Заглянув в Таблицу Менделеева, получите ответ: 23 + 35,5 = 58,5. Часто ставится задача определить молярную массу газа. Как это можно сделать?

Инструкция
Зная формулу газа, его молярную массу можно вычислить путем элементарного подсчета. Возьмите углекислый газ. Его формула – СО2. Значит его молярная масса такова: 12 + 32 (молярная масса кислорода с учетом индекса «2») = 44.
Ну а если вам надо вычислить молярную массу неизвестного нам газа, находящегося в каком-то замкнутом объеме, например, герметично закрытом баллоне? Тут нам на помощь придет универсальное уравнение Менделеева–Клапейрона, описывающее состояние «идеального газа». Разумеется, ни один газ не удовлетворяет условиям «идеального», но при давлении и температуре, несущественно отличающихся от нормальных, это уравнение очень удобно для расчетов. А полученная при вычислениях погрешность весьма незначительна и ею смело можно пренебречь.
Универсальное уравнение имеет такой вид: PV = MRT/m, гдеР – давление газа в Паскалях;
V – его объем в кубических метрах;
M – фактическая масса газа;
m – его молярная масса;
R – универсальная газовая постоянная;
Т – температура газа в градусах Кельвина.
Вы увидите, что молярная масса вычисляется по формуле MRT/PV. Например, надо найти молярную массу газа, если известно, что 3 килограмма этого газа находятся в герметичной емкости объемом 1,7 кубических метра при давлении 100000 Па и температуре 27 градусов по Цельсию.
Подставьте известные значения в эту формулу, разумеется, не забыв сначала преобразовать в одну систему величин. Иначе выйдет полная несуразица. 3,0*8,31*300/170000=0,04399 кг/моль.
Ну а поскольку молярная масса вещества измеряется в граммах на моль, умножьте полученный результат на 1000 и получите ответ: молярная масса газа, находящегося при таких условиях, равна 43,99 грамма/моль или с учетом округления – 44 грамма/моль. То есть это тот же самый углекислый газ.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Молярная масса газа
Расчеты
Молярная масса вещества или масса 1-го моля вещества равняется массе вещества к количеству моль этого вещества.
Применив уравнение состояния идеального газа, можно высчитать молярную массу газа (М), зная его параметры: массу (m), молярный объем (V), давление (Р) и абсолютную температуру (Т).
PV = (m/M) T,
pV = mRT / M,
M = mRT/(PV)
R — газовая постоянная, которая равняется 8,314 Дж/K·моль — молярная масса.
1 моль газа при норм. условиях (температуре 273 К, давлении 1 атм) занимает объем 22,4 л.
Осуществить быстрые расчеты молярной массы будет совсем несложно воспользовавшись онлайн калькулятором.
Молярная масса газа онлайн
Молярная масса — это масса одного моля любого химического вещества. Данный термин является ключевым в учебных вычислениях, поэтому калькулятор молярной массы газа наверняка пригодится школьникам и студентам.
Количество вещества и его масса
В химии количество вещества вычисляется в молях. 1 моль абсолютно любого вещества включает в себя ровно 6,02·10^23 структурных единиц. Это число было предсказано в 1811 году Амадео Авогадро и определено как количество атомов, которые содержатся в 12 г чистого углерода. Сам итальянский химик не имел понятия даже о порядке этого числа, и знал только, что оно невообразимо большое. Численно это значение было подсчитано в 1908 году австрийским физиком Иоганном Лошмидтом, но и через сотню лет химики периодически уточняют значение числа Авогадро.
Молярная масса — масса 1 моля химического вещества, которую легко подсчитать при помощи периодической таблицы. Для простого расчета требуется найти атомные массы элементов, входящих в состав соединения. Например, 1 моль простого вещества углерода имеет массу 12 г, а 1 моль сложного этанола — 46,07 г. Соответственно, 2 моля этих веществ будут иметь массу 24 г и 92,14 г. Для газообразных веществ понятие моля характеризуется одной существенной особенностью: 1 моль любого газа при нормальных условиях имеет один и тот же объем в размере 22,4 литра. Нормальными условиями считаются температура 0 градусов Цельсия и давление 1 атмосфера.
Молярный объем и молярная масса газа
Не сразу понятно, почему объем 1 моля любого газа при нормальных условиях всегда одинаков, ведь газы имеют разную массу. Сложно сравнить одноатомный гелий с химической формулой He и, например, иприт, формула которого выглядит как C₄H₈Cl₂S. Как такие разные газы могут занимать одинаковый объем? Дело в том, что абсолютно все газы можно представить в виде математической модели идеального газа, в которой расстояние между атомами и молекулами не учитывается.
Вся суть в крайне слабой связи структурных единиц, поэтому модель идеального газа пренебрегает размерами молекул. Таким образом, для подсчета объема газа важно именно количество молекул, а не их размер, а в одном моле любого вещества всегда присутствует одно и то же количество. Понимая, что газы имеют одинаковое количество вещества при одинаковой температуре и давлении становится понятно, что и объем газов будет также одинаков.
Зная объем газа легко определить его количество вещества по простой формуле:
n = V / 22,4,
где n — количество вещества, а V — объем газообразного вещества при нормальных условиях.
Например, зная, что 0,5 грамма некоторого газа в нормальных условиях занимает объем в размере 1 л, то понятно, что n = 1 / 22,4 = 0,0446 моль. Следовательно, молярная масса такого газа составит 0,5 / 0,0446 = 11,21 г/моль.
Обычно требуется определить молярную массу газа в произвольных, а не нормальных условиях. Для таких вычислений используется уравнение Менделеева-Клапейрона, из которого выделяется молярная масса:
M = m × R × T / (P × V)
Зная значения массы, температуры, давления и объема газа, легко определить его молярную массу. Обычно в уравнение идеального газа давление подставляется в паскалях, температура — в Кельвинах, а объем — в литрах. В этом случае газовая постоянная R = 8,31 Дж/Моль × К. Для удобства использования более привычных градусов Цельсия и атмосфер в калькулятор заложено пересчитанное значение универсальной газовой постоянной.
Для использования калькулятора вам требуется знать всего 4 величины.
Рассмотрим небольшой пример
Вычисление молярной массы в произвольных условиях
Определим молярную массу газа, 0,625 грамм которого занимают 300 кубических сантиметров при температуре 25 градусов Цельсия и давлении в 2 атмосферы. Введем данные в соответствующие ячейки и получим, что молярная масса газа равна 25,47 г/моль.
Вычисление молярной массы при нормальных условиях
Давайте проверим вычисления, которые мы приводили выше для газа массой 0,5 грамм и объемом 1 л. Переведем литры в кубические сантиметры и заполним соответствующие ячейки с учетом нормальных условий (P = 1, C = 0). Напомним, что в одном литре содержится 1 000 кубических сантиметров. В итоге получим, что молярная масса такого газа равна 11,2008 г/моль, что практически полностью совпадает с предыдущим результатом. Такой расчет даже точнее, чем грубая оценка молярной массы через объем газа.
Заключение
Молярная масса газа — важная величина, без которой не обходятся никакие химические расчеты газообразных веществ. Наш калькулятор пригодится школьникам и студентам младших курсов для решения задач по элементарной химии.
1 МОЛЬ любого газа при нормальных условиях (н. у. ) занимает объем 22,4 л. Значит, если вы знаете объем газа, например 44,8 л, тогда можно найти, что вы имеете 44,8/22,4=2моль газа.
количества вещества n=m/M, где m — масса вещества, M — молярная масса вещества. Отсюда m=n*M
Тогда зная молярную массу молекулы (например М (СО2)=44) получаем m=2*44=88 г
***
По закону Авогадро, количество газообразного вещества можно определить на основании его объёма: = V / Vm, где V — объём газа (при нормальных условиях) , Vm — молярный объём газа при Н. У. , равный 22,4 л/моль.
SvetlanaМудрец (10994)
9 лет назад
Да, пожалуйста… главное тут, если вы знаете, что это газ, то вспоминаете про любимое число 22,4 и находите МОЛИ вашего газа, а дальше по стандартной схеме)))