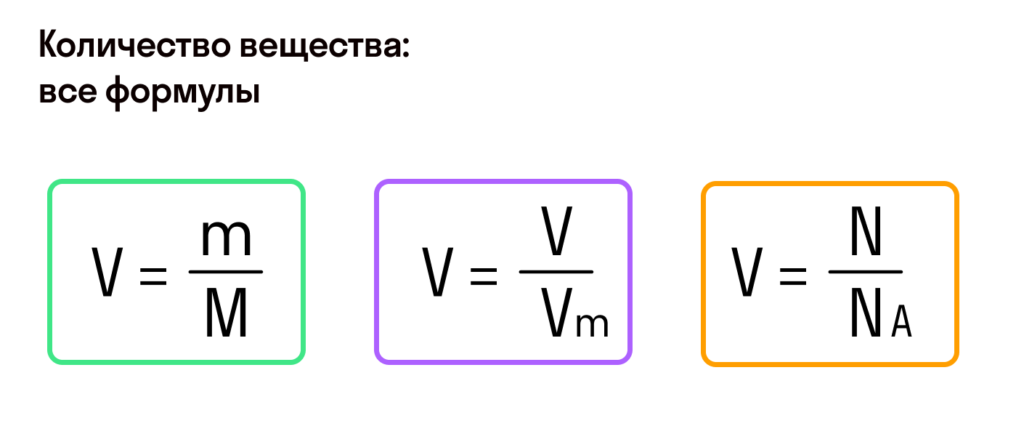
Основные формулы молекулярной физики
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
В кодификаторе ЕГЭ нет тем, непосредственно относящихся к содержанию данного листка. Однако без этого вводного материала дальнейшее изучение молекулярной физики невозможно.
Введём основные величины молекулярной физики и соотношения между ними.
— масса вещества,
— объём вещества,
— плотность вещества (масса единицы объёма). Отсюда
— число частиц вещества (атомов или молекул).
— масса частицы вещества. Тогда
— концентрация вещества (число частиц в единице объёма),
. Отсюда
Что получится, если умножить на
? Произведение массы частицы на число частиц в единице объёма даст массу единицы объёма, т. е. плотность. Формально:
Итак,
Массы и размеры частиц невообразимо малы по нашим обычным меркам. Например, масса атома водорода порядка г, размер атома порядка
см. Из-за столь малых значений масс и размеров число частиц в макроскопическом теле огромно.
Оперировать столь грандиозными числами, как число частиц, неудобно. Поэтому для измерения количества вещества используют специальную единицу — моль.
Один моль — это количество вещества, в котором содержится столько же атомов или молекул, сколько атомов содержится в граммах углерода. А в
граммах углерода содержится примерно
атомов. Стало быть, в одном моле вещества содержится
частиц. Это число называется постоянной Авогадро:
моль
.
Количество вещества обозначается . Это число молей данного вещества.
Что получится, если умножить на
? Число молей, умноженное на число частиц в моле, даст общее число частиц:
Масса одного моля вещества называется молярной массой этого вещества и обозначается (
= кг/моль). Ясно, что
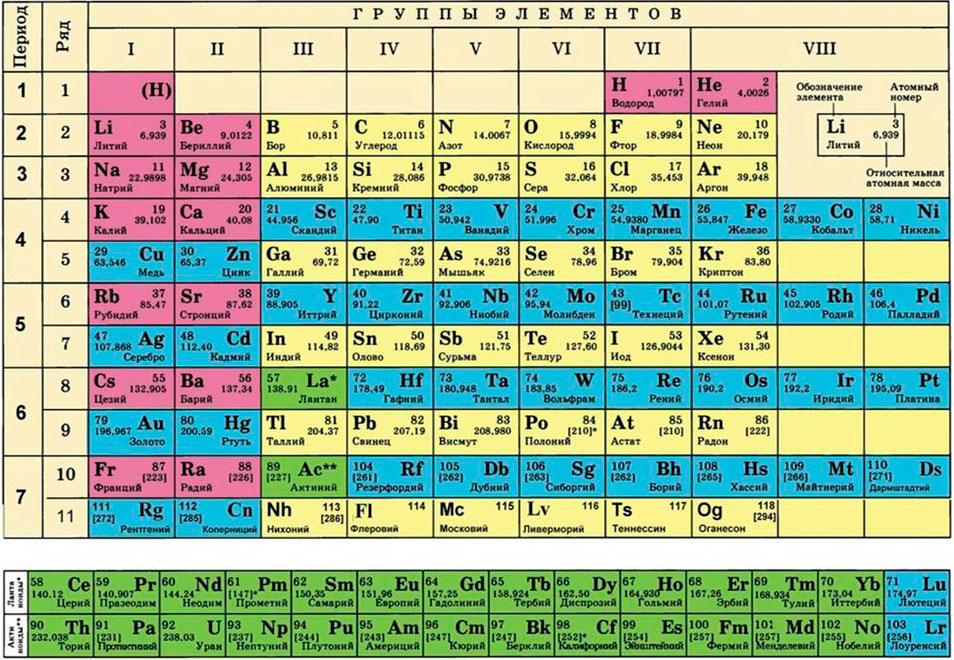
Как найти молярную массу химического элемента? Оказывается, для этого достаточно заглянуть в таблицу Менделеева! Нужно просто взять атомную массу (число нуклонов) данного элемента — это будет его молярная масса, выраженная в г/моль. Например, для алюминия
, поэтому молярная масса алюминия равна
г/моль или
кг/моль.
Почему так получается? Очень просто. Молярная масса углерода равна г/моль по определению. В то же время ядро атома углерода содержит
нуклонов. Выходит, что каждый нуклон вносит в молярную массу
г/моль. Поэтому молярная масса химического элемента с атомной массой
оказывается равной
г/моль.
Молярная масса вещества, молекула которого состоит из нескольких атомов, получается простым суммированием молярных масс. Так, молярная масса углекислого газа равна
г/моль
кг/моль.
Будьте внимательны с молярными массами некоторых газов! Так, молярная масса газообразного водорода равна г/моль, поскольку его молекула состоит из двух атомов
. То же касается часто встречающихся в задачах азота и кислорода
Вместе с тем, наиболее частый персонаж задач — гелий
— является одноатомным газом и имеет молярную массу
г/моль, предписанную таблицей Менделеева.
Ещё раз предостережение: при расчётах не забывайте переводить молярную массу в кг/моль! Если ваш ответ отличается от правильного на три порядка, то вы наверняка сделали именно эту, очень распространённую ошибку 🙂
Что получится, если умножить на
? Масса частицы, умноженная на число частиц в моле, даст массу моля, т. е. молярную массу:
Благодарим за то, что пользуйтесь нашими публикациями.
Информация на странице «Основные формулы молекулярной физики» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
08.05.2023
И молекулярная физика, и термодинамика изучают свойства вещества, но при этом пользуются разными методами.
Молекулярная физика рассматривает свойства вещества с точки зрения его внутренней структуры (движение молекул вещества, их взаимодействие).
Термодинамика не рассматривает внутреннюю структуру вещества, а интересуется его энергией, передачей энергии. Так, она рассматривает как за счёт тепла, полученного при сгорании топлива, можно получить работу (работа тепловой машины). О термодинамике будем говорить позднее, а пока речь пойдёт о молекулярной физике, которую ещё называют молекулярно-кинетической теорией или статистической физикой.
Молекулярная физика говорит о том, что любое вещество состоит из молекул. Металлы, имеющие кристаллическое строение,
состоят из атомов, но атомы можно считать одноатомными молекулами. Молекулы вещества находятся в непрерывном хаотическом движении (обладают кинетической энергией) и взаимодействуют друг с другом – одновременно притягиваются и отталкиваются (обладают потенциальной энергией взаимодействия).
На рисунке показан график зависимости силы взаимодействия молекул от расстояния между ними. Пунктирные линии относятся к силам притяжения и отталкивания, сплошная линия даёт результирующую силу взаимодействия молекул. При
эта сила равна нулю, что соответствует наиболее устойчивому состоянию молекул (наименьшему значению потенциальной энергии их взаимодействия).
Агрегатные состояния вещества определяются соотношением потенциальной и кинетической энергий молекул.
В газах молекулы находятся далеко друг от друга, их потенциальная энергия мала, а кинетическая велика., то есть
В кристаллических телах молекулы (атомы) располагаются вплотную друг к другу, их потенциальная энергия взаимодействия очень велика. Они обладают и кинетической энергией, совершая колебания около своих положений равновесия, но для них
В жидкостях, плотность которых меньше плотности твёрдых тел, молекулы и колеблются около положений равновесия, и время от времени совершают и поступательное движение. Кинетическая и потенциальная энергии молекул жидкости соизмеримы между собой
Так как молекулярная физика говорит о молекулах, то надо ввести понятия, связанные с молекулой – это масса молекулы, концентрация молекул и другие.
Один кг (или грамм) очень крупные для молекулы единицы массы, поэтому в молекулярной физике за единичную массу приняли 1/12 часть массы атома углерода (раньше единичную массу связывали с атомом водорода, кислорода):
Количество единичных масс в атоме назвали относительной атомной массой или просто атомной массой А, а количество единичных масс в молекуле – молекулярной массой М. Тогда молекула углерода содержит 12 единичных масс, так как
Для водорода А = 1, для кислорода А = 16 и так далее (см. таблицу Менделеева).
Молекулярная масса М складывается из атомных масс А. Так,
Атомная и молекулярная массы – безразмерные величины.
Единицей количества вещества в молекулярной физике является моль. Моль – это количество вещества, в котором содержится число молекул (атомов), равное числу атомов в 0,012 кг изотопа углерода.
Таким образом, молярная масса углерода равна 0,012 кг/моль.
Масса моля водорода (молярная масса водорода):
Молярная масса воды:
то есть если взять 0,018 кг воды, то это будет моль воды.
Моль любого вещества содержит одинаковое количество молекул, названное числом Авогадро
Объём моля для твёрдых и жидких тел находится путём деления молярной массы вещества на его плотность:
Объём моля любого газа при нормальных условиях равен
Задачи
Подписывайтесь на канал и сообщите о нём своим друзьям, одноклассникам. Здесь непременно найдёте много полезного для себя.
Посмотрите занятия 32 и 33.
Ссылки на другие занятия даны в Занятии 1.
Моля́рная ма́сса — характеристика вещества, отношение массы вещества к его количеству. Численно равна массе одного моля вещества, то есть массе вещества, содержащего число частиц, равное числу Авогадро. Молярная масса, выраженная в г/моль, численно совпадает с молекулярной массой, выраженной в а. е. м., и относительной молекулярной массой. Однако надо чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и отличаются по размерности[1].
Например, молярная масса кислорода как элемента 


Молярные массы сложных молекул можно определить, суммируя молярные массы входящих в них элементов. Например, молярная масса воды 
В Международной системе единиц (СИ) единицей измерения молярной массы является килограмм на моль (русское обозначение: кг/моль; международное: kg/mol), но из-за того, что когда молярная масса выражена в г/моль, её численное значение совпадает с относительной молекулярной массой, исторически сложилось, что молярную массу, как правило, выражают в г/моль.
Молярную массу в формулах обычно обозначают заглавной буквой 
Молярная масса некоторых веществ и смесей[править | править код]
| Элемент, вещество или смесь | Молярная масса, г/моль |
|---|---|

|
14 |

|
28 |

|
40 |

|
1 |

|
2 |

|
18 |

|
4 |
| Воздух | 29 |

|
16 |

|
32 |

|
12 |

|
44 |

|
32 |

|
7 |

|
20 |

|
108 |

|
96 |
Округлённые до целого числа молярные массы некоторых веществ и смесей приведены в таблице.
Средняя молярная масса[править | править код]
Средняя молярная масса 


так как 
Если состав вещества задан через массовые доли 
Средняя молярная масса важна для смесей газов, так как входит в термодинамические уравнения состояния газовых смесей.
Например, молярная масса воздуха 
г/моль.
Более точный расчет средней молярной массы сухого воздуха дает 28,97 г/моль[3].
Для высокомолекулярных веществ, состоящих из молекул с разной молярной массой, например, полимеров, иногда указывают среднюю молярную массу или диапазон молярных масс.
Примечания[править | править код]
- ↑ Дерябина Г. И., Кантария Г. В. 2.2. Моль, молярная масса. Органическая химия: веб-учебник. Дата обращения: 26 июня 2017. Архивировано 29 июля 2012 года.
- ↑ 1 2 Нащокин В. В. Техническая термодинамика и теплопередача. Учебное пособие для вузов. / Под ред. проф. В. С. Силецкого. — 2-е изд. — М.: Высшая школа, 1969. — Т. 3. — С. 224. — 560 с.
- ↑ The Engineering ToolBox Molecular Mass of Air Архивная копия от 4 декабря 2020 на Wayback Machine
Литература[править | править код]
Глинка Н. Л. Общая химия: Учеб. пособие для вузов /Под ред. А. И. Ермакова. — 30-е изд., испр. — М.: ИНТЕГРАЛ-ПРЕСС, 2005. — 728 с.: ил. — ISBN 5-89602-017-1.
Моль — условное количество вещества
Добавлено: 3 октября 2021 в 12:58

Химия — наука, изучающая взаимодействие веществ на атомном и молекулярном уровнях. Эти процессы значительно отличаются от привычного нам макроуровня и поэтому требуют специфических подходов, в том числе к «подсчету» и «взвешиванию».
Школьный курс химии включает понятия «моль» и «молярной массы». Они кажутся сложными, но если разобраться, то вы без труда поймете сущность этих понятий и научитесь ими пользоваться при решении задач.
Моль
Понятие «моль» попытаемся разобрать и, самое главное, понять на примере всем знакомой реакции взаимодействия кислорода и водорода. Когда одна молекула O2 соединяется с двумя молекулами H2, получается две молекулы H2O:
- O2 + 2H2 = 2H2O
То есть, чтобы максимально полно провести химическую реакцию, мы должны взять на каждую молекулу кислорода две молекулы водорода. Итак, у нас есть 100 г кислорода.
Сколько понадобится водорода для протекания процесса? И тут возникает первый вопрос: сколько молекул в 100 г кислорода? Наверное, миллиарды или даже миллиарды миллиардов? И сколько их в 100 г водорода? Уж точно в не в 2 раза меньше.
Как вообще подсчитать молекулы, ведь они бывают совершенно разными, «тяжелыми» и «легкими». Этими вопросами задавались и люди, закладывавшие основу современной химической науки.
Был найден простой выход, который помогает легко и изящно решить проблему. Химики решили взять за единицу измерения не одну молекулу, а определенное их количество, причем очень большое. Таким образом эта единица измерения приводит микроуровень к макроуровню. Она называется «моль».
Моль — это количество вещества из 6,02214076⋅1023 атомов или молекул. Оно не имеет физического смысла и изначально было привязано к массе определенного количества (12 граммов) углерода-12, но позже переопределено, как и многие другие единицы системы СИ.
В школьных расчетах количество структурных единиц в моле, которое также называется постоянной Авогадро, обычно округляют до 6,022⋅1023 и обозначают NA.
С этой величиной связано другое химическое понятие — «количество вещества», то есть количество структурных единиц в определенной его порции. Оно обозначается буквой ν (ню).
Примеры
В стакане содержится 2 моль воды. Сколько молекул воды находится в стакане?
- N = ν⋅ NA =2 ⋅ 6,022⋅1023 = 12,044⋅1023 молекул воды.
Также можно решить обратную задачу. Сколько молей вещества составляют 24,088⋅1023 молекул воды?
- ν⋅ = N / NA = 24,088⋅1023 / 6,022⋅1023 = 4 моля.
Что называется молярной массой
Итак, мы поняли, что моль — условное количество вещества, выбранное для удобства химиков. Это даже не миллиарды миллиардов, как мы предположили ранее, а миллиарды триллионов, что никак не облегчает задачу подсчета этих структурных единиц.
Как же все-таки узнать, сколько атомов или молекул в 100 граммах того или иного вещества? Теперь хорошо бы связать количество вещества и его массу, ведь это не одно и то же. Нам поможет «молярная масса» — 1 моль вещества или 6,022⋅1023 структурных единиц этого вещества.
Итак, масса вещества равна массе порции вещества m к количеству молекул ν в его порции:
- М = m / ν.
Вооружившись этим знанием, мы можем переводить граммы в число молекул и наоборот. При этом следует учесть, что молярная масса численно идентична молекулярной массе (то есть массе молекулы), выраженной в атомных единицах массы, и относительной молекулярной массе.
Пример
Найдем массу 5 моль воды.
Чтобы решить эту задачу, обратимся к формуле молярной массы и выразим из нее массу:
- m = М ⋅ ν
В этой формуле мы знаем количество вещества ν = 5 моль, а молярную массу сложной молекулы нужно определить, как сумму молярных масс составляющих ее химических элементов:
- M (H2O) = 2 ⋅M (H) + M (O)
Где взять молярные массы кислорода и водорода (в соединение входит два атома водорода, поэтому его молярную массу умножаем на 2)?
Для этого нам понадобится таблица Менделеева и значение «относительной атомной массы», которая, как мы уже знаем, идентична молекулярной. Это значение приведено для каждого химического элемента и для водорода равно 1,00797 (то есть близко к 1), для углерода — близко к 6, для кислорода — около 16.
Подставим соответствующие значения в исходную формулу и получим:
- M (H2O) = 2 ⋅M (H) + M (O) = 2 ⋅ 1 + 16 = 18 г/моль.
То есть вес 1 моль воды составляет 18 граммов. Теперь можем подсчитать массу 5 моль воды:
- m = М ⋅ ν = 18 ⋅ 5 = 90 г.
Аналогичным образом мы можем подсчитать количество вещества, которое содержится в определенном образце заданной массы. Для примера возьмем оксид алюминия Al2O3 и узнаем, сколько моль в 400 граммах этого вещества. Для этого выразим количество вещества через молярную массу и подставим исходные данные:
- ν = m / М = 400 / (2 ⋅ М (Al) + 3 ⋅ (O)) = 400 / (2 ⋅ 75 + 3 ⋅ 16) = 400 / (150 + 48) = 400 / 198 ≈ 2,02 моль.
Занимайтесь на курсах ЕГЭ и ОГЭ в паре TwoStu и получите максимум баллов на экзамене:

Эксперт по подготовке к ЕГЭ, ОГЭ и ВПР
Задать вопрос
Закончил Московский физико-технический институт (Физтех) по специальности прикладная физика и математика. Магистр физико-математических наук. Преподавательский стаж более 13 лет. Соучредитель курсов ЕГЭ и ОГЭ в паре TwoStu.
Читайте также:
Обновлено: 20.05.2023
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль .
Моль – это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро
Постоянная Авогадро N A определяется как число атомов, содержащееся в 12 г изотопа 12 С:
Таким образом, 1 моль любого вещества содержит 6,02 • 10 23 частиц этого вещества.
1 моль железа содержит 6,02 • 10 23 атомов Fe.
1 моль серы содержит 6,02 • 10 23 атомов S.
2 моль серы содержит 12,04 • 10 23 атомов S.
0,5 моль серы содержит 3,01 • 10 23 атомов S.
Исходя из этого, любое количество вещества можно выразить определенным числом молей ν ( ню ). Например, в образце вещества содержится 12,04 • 10 23 молекул. Следовательно, количество вещества в этом образце составляет:
где N – число частиц данного вещества;
N а – число частиц, которое содержит 1 моль вещества (постоянная Авогадро).
Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества.
Эта величина, равная отношению массы m вещества к количеству вещества ν , имеет размерность кг/моль или г/моль . Молярная масса, выраженная в г/моль, численно равна относительной относительной молекулярной массе M r (для веществ атомного строения – относительной атомной массе A r ).
Например, молярная масса метана CH 4 определяется следующим образом:
M(CH 4 )=16 г/моль, т.е. 16 г CH 4 содержат 6,02 • 10 23 молекул.
Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν , по формуле:
Моль
Моль — это количество вещества из 6,02214076⋅10 23 атомов или молекул. Оно не имеет физического смысла и изначально было привязано к массе определенного количества (12 граммов) углерода-12, но позже переопределено, как и многие другие единицы системы СИ. В школьных расчетах количество структурных единиц в моле, которое также называется постоянной Авогадро, обычно округляют до 6,022⋅10 23 и обозначают NA.
Примеры
В стакане содержится 2 моль воды. Сколько молекул воды находится в стакане?
N = ν⋅ NA =2 ⋅ 6,022⋅10 23 = 12,044⋅10 23 молекул воды.
Также можно решить обратную задачу. Сколько молей вещества составляют 24,088⋅10 23 молекул воды?
ν⋅ = N / NA = 24,088⋅10 23 / 6,022⋅10 23 = 4 моля.
Моль и молярная масса: простое объяснение с примерами
Молярная масса
Итак, молярная масса равна массе порции вещества m к количеству молекул ν в его порции:
Вооружившись этим знанием, мы можем переводить граммы в число молекул и наоборот. При этом следует учесть, что молярная масса численно идентична молекулярной массе (то есть массе молекулы), выраженной в атомных единицах массы, и относительной молекулярной массе.
Пример
Найдем массу 5 моль воды.
Чтобы решить эту задачу, обратимся к формуле молярной массы и выразим из нее массу:
В этой формуле мы знаем количество вещества ν = 5 моль, а молярную массу сложной молекулы нужно определить, как сумму молярных масс составляющих ее химических элементов:
Моль и молярная масса: простое объяснение с примерами
Где взять молярные массы кислорода и водорода (в соединение входит два атома водорода, поэтому его молярную массу умножаем на 2)?
M (H2O) = 2 ⋅M (H) + M (O) = 2 ⋅ 1 + 16 = 18 г/моль.
То есть масса 1 моль воды составляет 18 граммов. Теперь можем подсчитать массу 5 моль воды:
m = М ⋅ ν = 18 ⋅ 5 = 90 г.
Аналогичным образом мы можем подсчитать количество вещества, которое содержится в определенном образце заданной массы. Для примера возьмем оксид алюминия Al2O3 и узнаем, сколько моль в 400 граммах этого вещества. Для этого выразим количество вещества через молярную массу и подставим исходные данные:
ν = m / М = 400 / (2 ⋅ М (Al) + 3 ⋅ (O)) = 400 / (2 ⋅ 75 + 3 ⋅ 16) = 400 / (150 + 48) = 400 / 198 ≈ 2,02 моль.
Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.
Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·10 23 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·10 23 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12 C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·10 23 ).
Молярная масса вещества
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
- Молярная масса формула M=m/n
- Количество вещества формула n=m/M
- Число молекул формула N =NA·n
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:
Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·10 23 ; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·10 23 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·10 23 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает
с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·10 23 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
- n = m / M = 8г / 32г/моль = 0,25 моль
- N = NA × n = 6,022·10 23 × 0,25 = 1,505·10 23 молекул
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·10 23 молекул/моль, что равно 2,99·10 26 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
На предыдущих двух вступительных уроках в курс молекулярной физики речь шла об основных положениях МКТ. Сейчас же мы подробнее остановимся на первом положении (все тела состоят из маленьких частиц), а именно поговорим о численных оценках некого тела, некой порции вещества. Введём понятие массы молекулы, количества вещества, молярной массы и относительной атомной и молекулярной массы.
Читайте также:
- Детский сад проект архикад
- Связь педагогики с другими науками взаимосвязь педагогической науки и практики кратко
- Как устроены телескопы рефрактор и рефлектор кратко
- Что такое азот в биологии 6 класс определение кратко
- В чем состоит особенность энергии информации и социальных объектов как предметов труда кратко