Многие опыты показывают, что размер молекулы очень мал. Линейный размер молекулы или атома можно найти различными способами. Например, с помощью электронного микроскопа, получены фотографии некоторых крупных молекул, а с помощью ионного проектора (ионного микроскопа) можно не только изучить строение кристаллов, но определить расстояние между отдельными атомами в молекуле.
Используя достижения современной экспериментальной техники, удалось определить линейные размеры простых атомов и молекул, которые составляют около 10-8 см. Линейные размеры сложных атомов и молекул намного больше. Например, размер молекулы белка составляет 43*10-8 см.
Для характеристики атомов используют представление об атомных радиусах, которые дают возможность приближённо оценить межатомные расстояния в молекулах, жидкостях или твёрдых телах, так как атомы по своим размерам не имеют чётких границ. То есть атомный радиус – это сфера, в которой заключена основная часть электронной плотности атома (не менее 90…95%).
Размер молекулы настолько мал, что представить его можно только с помощью сравнений. Например, молекула воды во столько раз меньше крупного яблока, во сколько раз яблоко меньше земного шара.
Моль вещества
Массы отдельных молекул и атомов очень малы, поэтому в расчётах удобнее использовать не абсолютные значения масс, а относительные.
Относительная молекулярная масса (или относительная атомная масса) вещества Мr – это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
Мr = (m0) : (m0C / 12)
где m0 – масса молекулы (или атома) данного вещества, m0C – масса атома углерода.
Относительная молекулярная (или атомная) масса вещества показывает, во сколько раз масса молекулы вещества больше 1/12 массы изотопа углерода С12. Относительная молекулярная (атомная) масса выражается в атомных единицах массы.
Атомная единица массы – это 1/12 массы изотопа углерода С12. Точные измерения показали, что атомная единица массы составляет 1,660*10-27 кг, то есть
1 а.е.м. = 1,660 * 10-27 кг
Относительная молекулярная масса вещества может быть вычислена путём сложения относительных атомных масс элементов, входящих в состав молекулы вещества. Относительная атомная масса химических элементов указана в периодической системе химических элементов Д.И. Менделеева.
В периодической системе Д.И. Менделеева для каждого элемента указана атомная масса, которая измеряется в атомных единицах массы (а.е.м.). Например, атомная масса магния равна 24,305 а.е.м., то есть магний в два раза тяжелее углерода, так как атомная масса углерода равна 12 а.е.м. (это следует из того, что 1 а.е.м. = 1/12 массы изотопа углерода, который составляет большую часть атома углерода).
Зачем измерять массу молекул и атомов в а.е.м., если есть граммы и килограммы? Конечно, можно использовать и эти единицы измерения, но это будет очень неудобно для записи (слишком много чисел придётся использовать для того, чтобы записать массу). Чтобы найти массу элемента в килограммах, нужно атомную массу элемента умножить на 1 а.е.м. Атомная масса находится по таблице Менделеева (записана справа от буквенного обозначения элемента). Например, вес атома магния в килограммах будет:
m0Mg = 24,305 * 1 a.e.м. = 24,305 * 1,660 * 10-27 = 40,3463 * 10-27 кг
Массу молекулы можно вычислить путём сложения масс элементов, которые входят в состав молекулы. Например, масса молекулы воды (Н2О) будет равна:
m0Н2О = 2 * m0H + m0O = 2 * 1,00794 + 15,9994 = 18,0153 a.e.м. = 29,905 * 10-27 кг
Количество вещества принято считать пропорциональным числу частиц. Количество вещества – это физическая величина, характеризующая относительное число молекул и атомов в теле. Единица количества вещества называется молем (моль).
Моль равен количеству вещества системы, в которой содержится столько же молекул, сколько содержится атомов в 0,012 кг углерода С12. То есть, если у нас есть система с каким-либо веществом, и в этой системе столько же молекул этого вещества, сколько атомов в 0,012 кг углерода, то мы можем сказать, что в этой системе у нас 1 моль вещества.
Постоянная Авогадро
Количество вещества ν равно отношению числа молекул в данном теле к числу атомов в 0,012 кг углерода, то есть количеству молекул в 1 моле вещества.
ν = N / NA
где N – количество молекул в данном теле, NA – количество молекул в 1 моле вещества, из которого состоит тело.
NA – это постоянная Авогадро. Количество вещества измеряется в молях.
Постоянная Авогадро – это количество молекул или атомов в 1 моле вещества. Эта постоянная получила своё название в честь итальянского химика и физика Амедео Авогадро (1776 – 1856).
В 1 моле любого вещества содержится одинаковое количество частиц.
NA = 6,02 * 1023 моль-1
Молярная масса – это масса вещества, взятого в количестве одного моля:
μ = m0 * NA
где m0 – масса молекулы.
Молярная масса выражается в килограммах на моль (кг/моль = кг*моль-1).
Молярная масса связана с относительной молекулярной массой соотношением:
μ = 10-3 * Mr [кг*моль-1]
Масса любого количества вещества m равна произведению массы одной молекулы m0 на количество молекул:
m = m0N = m0NAν = μν
Количество вещества равно отношению массы вещества к его молярной массе:
ν = m / μ
Массу одной молекулы вещества можно найти, если известны молярная масса и постоянная Авогадро:
m0 = m / N = m / νNA = μ / NA
Более точное определение массы атомов и молекул достигается при использовании масс-спректрометра – прибора, в котором происходит разделение пучком заряженных частиц в пространстве в зависимости от их массы заряда при помощи электрических и магнитных полей.
Для примера найдём молярную массу атома магния. Как мы выяснили выше, масса атома магния равна m0Mg = 40,3463 * 10-27кг. Тогда молярная масса будет:
μ = m0Mg * NA = 40,3463 * 10-27 * 6,02 * 1023 = 2,4288 * 10-2 кг/моль
То есть в одном моле «помещается» 2,4288 * 10-2 кг магния. Ну или примерно 24,28 грамм.
Как видим, молярная масса (в граммах) практически равна атомной массе, указанной для элемента в таблице Менделеева. Поэтому когда указывают атомную массу, то обычно делают так:
Атомная масса магния равна 24,305 а.е.м. (г/моль).
Можете посчитать молярную массу для различных элементов и убедиться в правоте этого утверждения. Для расчёта молярной массы можно использовать простой калькулятор, который находится внизу страницы:
Основные положения МКТ. Масса и размер молекул. Количество вещества. Молекулярная физика
- Подробности
- Обновлено 07.10.2018 21:04
- Просмотров: 1191
МКТ – это просто!
«Ничто не существует, кроме атомов и пустого пространства …» – Демокрит
«Любое тело может делиться до бесконечности» – Аристотель
Основные положения молекулярно-кинетической теории (МКТ)
Цель МКТ – это объяснение строения и свойств различных макроскопических тел и тепловых явлений, в них протекающих, движением и взаимодействием частиц, из которых состоят тела.
Макроскопические тела – это большие тела, состоящие из огромного числа молекул.
Тепловые явления – явления, связанные с нагреванием и охлаждением тел.
Основные утверждения МКТ
1. Вещество состоит из частиц (молекул и атомов).
2. Между частицами есть промежутки.
3. Частицы беспорядочно и непрерывно движутся.
4. Частицы взаимодействуют друг с другом (притягиваются и отталкиваются).
Подтверждение МКТ:
1. экспериментальное
– механическое дробление вещества; растворение вещества в воде; сжатие и расширение газов; испарение; деформация тел; диффузия; опыт Бригмана: в сосуд заливается масло, сверху на масло давит поршень, при давлении 10 000 атм масло начинает просачиваться сквозь стенки стального сосуда;
– диффузия; броуновское движение частиц в жидкости под ударами молекул;
– плохая сжимаемость твердых и жидких тел; значительные усилия для разрыва твердых тел; слияние капель жидкости;
2. прямое
– фотографирование, определение размеров частиц.

Броуновское движение
Броуновское движение – это тепловое движение взвешенных частиц в жидкости (или газе).
Броуновское движение стало доказательством непрерывного и хаотичного (теплового) движения молекул вещества.
– открыто английским ботаником Р. Броуном в 1827 г.
– дано теоретическое объяснение на основе МКТ А. Эйнштейном в 1905 г.
– экспериментально подтверждено французским физиком Ж. Перреном.
Масса и размеры молекул
Размеры частиц
Диаметр любого атома составляет около ![]() см.
см.

Число молекул в веществе

где V – объем вещества, Vo – объем одной молекулы
Масса одной молекулы

где m – масса вещества,
N – число молекул в веществе
Единица измерения массы в СИ: [m]= 1 кг
В атомной физике массу обычно измеряют в атомных единицах массы (а.е.м.).
Условно принято считать за 1 а.е.м. :

Относительная молекулярная масса вещества
Для удобства расчетов вводится величина – относительная молекулярная масса вещества.
Массу молекулы любого вещества можно сравнить с 1/12 массы молекулы углерода.

где числитель – это масса молекулы, а знаменатель – 1/12 массы атома углерода
![]() – это величина безразмерная, т.е. не имеет единиц измерения
– это величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса химического элемента

где числитель – это масса атома, а знаменатель – 1/12 массы атома углерода
![]() – величина безразмерная, т.е. не имеет единиц измерения
– величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса каждого химического элемента дана в таблице Менделеева.
Другой способ определения относительной молекулярной массы вещества
Относительная молекулярная масса вещества равна сумме относительных атомных масс химических элементов, входящих в состав молекулы вещества.
Относительную атомную массу любого химического элемента берем из таблицы Менделеева!)
Количество вещества
Количество вещества (ν) определяет относительное число молекул в теле.

где N – число молекул в теле, а Na – постоянная Авогадро
Единица измерения количества вещества в системе СИ: [ν]= 1 моль
1 моль – это количество вещества, в котором содержится столько молекул (или атомов), сколько атомов содержится в углероде массой 0,012 кг.
Запомни!
В 1 моле любого вещества содержится одинаковое число атомов или молекул!
Но!
Одинаковые количества вещества для разных веществ имеют разную массу!
Постоянная Авогадро
Число атомов в 1 моле любого вещества называют числом Авогадро или постоянной Авогадро:

Молярная масса
Молярная масса (M) – это масса вещества, взятого в одном моле, или иначе – это масса одного моля вещества.

где
![]() – масса молекулы
– масса молекулы
![]() – постоянная Авогадро
– постоянная Авогадро
Единица измерения молярной массы: [M]=1 кг/моль.
Формулы для решения задач
Эти формулы получаются в результате подстановки вышерассмотренных формул.
Масса любого количества вещества

и формула для 7 класса

Количество вещества
![]()
Число молекул в веществе

Молярная масса

Масса одной молекулы

Связь между относительной молекулярной массой и молярной массой

Молекулярная физика. Термодинамика – Класс!ная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. —
Взаимодействие молекул. Строение твердых тел, жидкостей и газов. —
Идеальный газ. Основное уравнение МКТ. —
Температура. Тепловое равновесие. Абсолютная шкала температур. —
Уравнение состояния идеального газа. —
Изопроцессы. Газовые законы. —
Взаимные превращения жидкостей и газов. Влажность воздуха. —
Твердые тела. Кристаллические тела. Аморфные тела.
Масса и размер молекул


4.2
Средняя оценка: 4.2
Всего получено оценок: 78.
4.2
Средняя оценка: 4.2
Всего получено оценок: 78.
Молекулярно-кинетическая теория основывается на положении, что все вещества состоят из мельчайших неделимых частиц — молекул. Важнейшим вопросом при этом является вопрос о размерах и массе одной молекулы. Кратко познакомимся с этой темой.
Доказательства существования молекул
Идея о том, что все тела состоят из мельчайших неделимых частиц, высказывалась еще в античности. В эпоху Возрождения эта точка зрения стала находить все больше подтверждений. При этом появилась разница между понятиями «атом» — неделимая мельчайшая частица элемента, — и «молекула» — мельчайшая частица вещества, сохраняющая свойства всего вещества, которая состоит из одного или нескольких атомов.

Первыми косвенными доказательствами существования молекул являются распространение запахов веществ и явление постепенного смешивания жидкостей.
Более серьезным доказательством молекул является закон постоянных отношений Д. Дальтона, согласно которому отношение масс веществ, участвующих в химических реакциях, всегда имеет постоянные целые пропорции. Это возможно лишь только если допустить, что молекулы всех веществ состоят из определенного целого числа атомов.
Наконец, еще одним доказательством небесконечности делимости веществ является конечное растекание масла по поверхности воды. Если бы вещество делилось неограниченно, капля масла бы всегда растекалась на всю возможную поверхность. А реально такому растеканию есть предел.
Размеры молекул
Из последнего опыта можно оценить средний размер молекулы масла. Исходя из того, что масло перестает растекаться тогда, когда его слой имеет толщину в одну молекулу, и зная объем капли, по площади растекания можно оценить толщину слоя, а значит, и размер молекулы.
Расчеты дают величины порядка $1…3×10^{-9}м$.
Более точно размер молекул был определен в опыте Ж. Перрена, использующем параметры броуновского движения в 1908 г. Одновременно в этом опыте была определено значение важной физической константы — постоянной Авогадро, то есть количества молекул, содержащихся в одном моле вещества.
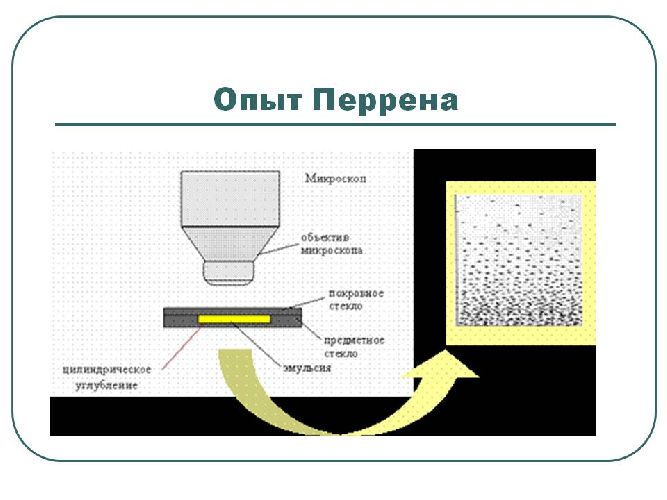
Наконец, с изобретением электронного микроскопа стало возможным оценить размеры молекул разных веществ непосредственно. Электронный микроскоп обладает увеличением до $10^8$ раз, поэтому он может различить молекулы и даже отдельные атомы. Например, размер молекулы воды оказался равен примерно $3×10^{-10}$м, и она имеет структуру равнобедренного треугольника с углом в вершине (атоме кислорода) 105⁰.
Наименьшие размеры имеют одноатомные молекулы инертных газов. Например, размер молекулы (фактически, одного атома) гелия составляет около $3×10^{-11}$м. Наибольшие размеры имеют молекулы биополимеров: белков и ДНК. Например, молекула ДНК человека представляет собой «клубок», свернутый в несколько «уровней упаковки» и состоящий из спиралевидной нити толщиной $2×10^{-9}$м и длиной несколько сантиметров.
Масса молекул
После того, как в опыте Ж. Перрена было получено значение числа Авогадро (оно равно $6.02×10^{23}$), стало возможным использовать его для определения массы молекулы любого вещества. Она равна отношению молярной массы к числу Авогадро. Например, зная, что молярная масса воды равна $1.8×10^{-2}$ кг, можно вычислить, что масса молекулы воды составляет $3×10^{-26}$ кг.
Молярная масса определялась, исходя из веса веществ химических реакций, с учетом закона постоянных отношений Д. Дальтона.

Что мы узнали?
Размеры молекул начинаются от долей нанометров. Наименьшие размеры у простых молекул, наибольшие — у биополимеров. Впервые достаточно точные цифры были получены в опыте Ж. Перрена в 1908 г. Одновременно было определено значение постоянной Авогадро. По этим же данным стало возможным оценить и массы молекул.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 78.
А какая ваша оценка?
Данная тема будет посвящена решению задач на определение
массы молекул и количества вещества.
Задача 1. Вычислите массу одной молекулы кислорода.
РЕШЕНИЕ
Как известно, в одном моле любого вещества содержится одно и
то же число молекул — число Авогадро
Если обозначить молярную массу вещества через M, то массу одной молекулы можно определить, как
отношение молярной массы вещества и числа Авогадро
Молярная масса молекулы кислорода
Тогда масса 1 молекулы кислорода равна
Ответ: масса одной молекулы кислорода
равна 5,3 ∙ 10−26 кг.
Задача 2. Молярная масса водорода 2 г/моль, а воды —
18 г/моль. Определите отношение числа молекул в 3 г водорода к числу молекул в
9 г воды.
|
ДАНО: |
РЕШЕНИЕ Число молекул в заданной порции любого вещества можно Тогда число молекул водорода в данной порции: Число молекул воды в данной порции: Тогда |
|
|
Ответ: молекул водорода в 3 раза
больше, чем молекул воды.
Задача 3. Из открытого стакана за 5 суток полностью
испарилось 50 г воды. Сколько молекул в среднем вылетало с поверхности
воды за 1 с?
|
ДАНО: |
СИ |
РЕШЕНИЕ Пусть в стакане содержалось N Число молекул воды в данной порции: Тогда искомое число молекул |
|
|
Ответ: в среднем с поверхности воды за
1 с вылетало 3,9 ∙ 1018 молекул.
Задача 4. Определите число молекул, содержащихся в 36
см3 ртути.
|
ДАНО: |
РЕШЕНИЕ Известно, что число молекул в одном моле любого вещества Для определения числа молекул ртути в заданной порции, необходимо |
|
|
Ответ: в 36 см3 ртути содержится 14,7
∙ 1023 молекул.
Задача 5. В озеро, имеющее среднюю глубину 10 м и
площадь поверхности 20 км2, бросили кристаллик поваренной соли
массой 0,01 г. Сколько молекул этой соли оказалось бы в наперстке воды объемом
2 см3, зачерпнутой из озера, если полагать, что соль, растворившись,
равномерно распределилась по всему объему воды в озере?
|
ДАНО: |
СИ |
РЕШЕНИЕ Запишем формулу, по которой можно рассчитать число молекул соли Масса соли в данной порции раствора: Тогда число молекул соли в данной порции раствора: Химическая формула соли NaCl Тогда молярная масса соли равна |
|
|
Ответ: в наперстке оказалось бы
порядка 1 млн. молекул соли.
Каждому человеку известно, что окружающие нас тела состоят из атомов и молекул. Они имеют разную форму и структуру. При решении задач по химии и физике часто требуется найти массу молекулы. Рассмотрим в данной статье несколько теоретических методов решения данной задачи.
Общие сведения
Прежде чем рассматривать, как найти массу молекулы, следует познакомиться с самим понятием. Далее приведем несколько примеров.
Молекулой принято называть совокупность атомов, которые объединены друг с другом тем или иным видом химической связи. Также они должны и могут рассматриваться, как единое целое в различных физико-химических процессах. Эти связи могут носить ионный, ковалентный, металлический или вандерваальсовский характер.
Всем известная молекула воды имеет химическую формулу H2O. Атом кислорода в ней соединен с помощью полярных ковалентных связей с двумя атомами водорода. Такое строение обуславливает многие физические и химические свойства жидкой воды, льда и пара.
Природный газ метан – это еще один яркий представитель молекулярного вещества. Его частицы образованы атомом углерода и четырьмя атомами водорода (CH4). В пространстве молекулы имеют форму тетраэдра с углеродом в центре.

Воздух – сложная смесь газов, которая главным образом состоит из молекул кислорода O2 и азота N2. Оба типа соединены прочными двойными и тройными ковалентными неполярными связями, что обуславливает их высокую химическую инертность.
Определение массы молекулы через ее молярную массу
В периодической таблице химических элементов содержится большое количество информации, среди которой имеются атомные единицы массы (а.е.м.). Например, атом водорода имеет а.е.м., равную 1, а атом кислорода – 16. Каждая из этих цифр показывает массу в граммах, которую будет иметь система, содержащая 1 моль атомов соответствующего элемента. Напомним, что единица измерения количества вещества 1 моль представляет собой количество частиц в системе, соответствующее числу Авогадро NA, оно равно 6,02*1023.
Когда рассматривают молекулу, то пользуются понятием не а.е.м., а молекулярной массой. Последняя представляет собой простую сумму а.е.м. для атомов, входящих в состав молекулы. Например, молярная масса для H2O будет равна 18 г/моль, а для O2 – 32 г/моль. Имея общее понятие, далее можно перейти к расчетам.
Молярную массу M просто использовать для вычисления массы молекулы m1. Для этого следует воспользоваться простой формулой:
m1 = M/NA.
В некоторых задачах может быть дана масса системы m и количество вещества в ней n. В таком случае масса одной молекулы вычисляется так:
m1 = m/(n*NA).
Идеальный газ

Этим понятием называется такой газ, молекулы которого хаотично движутся в разных направлениях с большими скоростями, друг с другом не взаимодействуют. Расстояния между ними намного превышают их собственные размеры. Для такой модели оказывается справедливым следующее выражение:
P*V = n*R*T.
Оно носит название закона Менделеева-Клапейрона. Как видно, уравнение связывает между собой давление P, объем V, абсолютную температуру T и количество вещества n. В формуле R – газовая константа, численно равная 8,314. Записанный закон называется универсальным, потому что он не зависит от химического состава системы.
Если известны три термодинамических параметра – T, P, V и значение m системы, то масса молекулы идеального газа m1 не сложно определить по следующей формуле:
m1 = m*R*T/(NA*P*V).
Это выражение также можно записать через плотность ρ газа и постоянную Больцмана kB:
m1 = ρ*kB*T/P.
Пример задачи
Известно, что плотность некоторого газа составляет 1,225 кг/м3 при атмосферном давлении 101325 Па и температуре 15 oC. Чему равна масса молекулы? О каком газе идет речь?
Поскольку нам даны давление, плотность и температура системы, то можно воспользоваться полученной в предыдущем пункте формулой, чтобы определить массу одной молекулы. Имеем:
m1 = ρ*kB*T/P;
m1 = 1,225*1,38*10-23*288,15/101325 = 4,807*10-26 кг.
Чтобы ответить на второй вопрос задачи, найдем молярную массу M газа:
M = m1*NA;
M = 4,807*10-26*6,02*1023 = 0,029 кг/моль.

Полученное значение молярной массы соответствует газу воздуху.
