Лучший ответ
Lord Saddler
Мыслитель
(8028)
14 лет назад
m0(молекулы воды) = M / Na = 18/6,02*10^23 = 3*10^-23 г
Источник: физическая химия
Остальные ответы
Леонид Фурсов
Высший разум
(788288)
14 лет назад
Разделите массу 1 моля водяного пара на чило Авагадро и получите массу молекулы воды ( пара).
Источник: физика
Трифон Жарков
Профи
(892)
14 лет назад
Формула Mr(H2O) = 2Ar(H) + Ar(O). где Ar-атомная масса (см. Таблицу Менделеева)
JoKa Fern Lowd
Просветленный
(22753)
14 лет назад
массе одной молекулы умножить на количество молекул
Жизнь на Земле невозможна без перехода воды в пар. Он присутствует в атмосфере всегда, в том или ином количестве. В некоторых ситуациях, человеку необходимо знать количество пара, содержащегося в воздухе, в текущий момент.
Чтобы это сделать, нужно знать массу водяного пара. Формула расчета, понятие о молярной и молекулярной массе, ее зависимость от давления и температуры, обо всем этом рассказывается в статье.
Содержание
- Что это такое?
- Молекулярная
- Молярная
- Удельная
- Какие факторы влияют на параметр?
- Как зависит от давления и температуры?
- Как найти массу паров воды в воздухе?
- Пример расчета
- Где в быту используются знания?
- Заключение
Что это такое?
Масса водного пара, находящегося в одном кубометре воздуха, носит название абсолютной влажности воздуха. В физике различают молярную и молекулярную массы веществ.
Молекулярная

Вода является составным веществом, одна её молекула содержит две молекулы водорода и одну молекулу воды.
Различают относительную молекулярную и абсолютную молекулярную массу. Относительная молекулярная масса – это единица, не имеющая размерности, и отображающая отношение массы атома или молекулы к 112 массы атома углерода (¹²С).
Абсолютная молекулярная – это значение атома или молекулы вещества, выраженная в атомных единицах массы (а.е.м.). Значение а.е.м, принимаемое для расчетов, берут из периодической таблицы Менделеева.
Рассчитывают молекулярную массу пара следующим образом:
- Ar (воды) = 2 x Ar (водорода) + Ar (кислорода).
- Возьмем из таблицы Менделеева значения атомных величин водорода и кислорода, округлим их до целых чисел, и подставив значения в формулу, получим:
- Ar (пара) = Ar (воды) = 2 x Ar (1,0) + Ar (16,0) = 18,0.
- Итог: абсолютная молярная масса водяного пара равна 18,0 (а.е.м).
Молярная
Молярная масса воды – это молекулярный вес её 1 моль. Учитывая, что пар – одно из состояний воды, значит его молярная величина, равна молярной массе воды. Этот вид физических измерений не зависит от каких-либо других факторов и является величиной постоянной.
Рассчитывается величина путем деления молекулярной величины вещества на единицу его количества.
Молярная масса вещества, состоящего из различных атомов других веществ, может незначительно отличаться от молекулярной величины, если какой-либо из элементов, входящих в его состав имеет нестабильное состояние.
Зная молекулярную массу, довольно легко определить его молярное значение: Mr (пара) = Ar (пара) : 1000 = 0,018 Кгмоль.
Удельная

Удельное отношение показывает содержание весовых единиц в единице объема, поэтому такого понятия, как «удельная масса вещества» в физике не существует, однако есть понятие удельного веса.
Удельный вес вещества – величина, указывающая, сколько его килограммов содержится в одном кубометре объема. По-другому, удельный вес называется плотностью, и измеряется в КДжКг.
Какие факторы влияют на параметр?
На этот параметр оказывает влияние только один фактор – суммарная атомная масса двух молекул водорода и одной кислорода. На удельный вес водяного пара значительно влияют его температура и давление, под которым он находится в единице объема.
Как зависит от давления и температуры?
Учитывая молекулярную сущность термина «масса пара», можно сказать, что ни от давления, ни от температуры она не зависит. От указанных параметров зависит только его удельный вес.
При повышении давления, удельный вес возрастает:
- при давлении в 6 Бар, 1 м³ будет весить 3170 г.;
- 10 Бар – вес 5150 г.;
- 25 Бар – уже 12500 г.
Похожие изменения происходят с удельным весом пара воды и при повышении температуры – он становится больше.
Существует небольшая таблица зависимости веса пара от давления и температуры:
| Давление пара, Кгссм² | Температура, ˚С | Вес 1 м³ пара, Кг |
| 1,0 | 99,1 | 0,580 |
| 1,2 | 104,2 | 0,688 |
| 1,6 | 112,7 | 0,901 |
| 2,0 | 119,6 | 1,11 |
| 3,0 | 132,8 | 1,62 |
| 4,0 | 151,0 | 2,12 |
Как найти массу паров воды в воздухе?

Шаг 1. Переведем формулу для поиска массы: m = РV*M/R*T.
Шаг 2. Для определения давления пара Р, применяется формула вычисления относительной влажности воздуха φ: φ = P/Pн. Давление будет: P = Pн*φ.
Шаг 3. Для получения корректных значений, необходимо все используемые значения перевести в одну систему единиц – температуру в значения по шкале Кельвина, а проценты относительной влажности в единичные доли.
Шаг 4. Выражение из шага №2, необходимо подставить в формулу из шага №1: m = Pн*φ*V*M/R*T. Проведя математические действия, получают искомое значение в килограммах.
Пример расчета
Определить вес водяного пара в 1 кубометре воздуха при нормальном атмосферном давлении, температуре 26˚С и относительной влажности 61%. Давление пара при 26˚С, составляет 3168 Па:
- Выпишем данные: V = 1 м³; T = 26˚С; φ = 61%; Pн = 3168 Па; m — ?
- Переведем величины: 26˚С = 299 К, и 61% = 0,61.
- Подставим данные в формулу из шага №4 инструкции: m = Pн*φ*V*M/R*T = 0,61*3168*1*0,018 8,31*299 = 0,0138 Кг.
Получаем ответ: Вес водяного пара в 1 кубометре воздуха при нормальном атмосферном давлении, температуре 26˚С, и относительной влажности 61%, составляет 0,0138 кг.
Определение массы водяных паров, видео-инструкция:
Где в быту используются знания?
Водяной пар широко используется в промышленности и других областях деятельности человека:
- Добыча и переработка нефти – его закачивают в скважины для повышения их продуктивности путем снижения вязкости нефти. Им прогревают трубопроводы, резервуары. На НПЗ он применяется для увеличения количества отбора светлых нефтепродуктов (бензин, керосин).
- Производство электроэнергии – применяют в ТЭЦ для вращения паровых турбин, а после отработки, в виде горячей воды закачивают в системы ГВС и отопления.
- Химическая промышленность – им разогревают гальванические ванны, используют его для ускорения процесса синтеза некоторых материалов.
- Деревообработка и производство бумаги – при его помощи разогревают дерево перед различными типами обработки: «раскрутка» ствола при производстве шпона, разделка дерева для получения целлюлозы и бумаги.
- Строительство – сушат железобетонные изделия, прогревают инертные материалы, увеличивают прочность газобетона сушкой паром в автоклавах.
- ЖКХ – разморозка трубопроводов, канализации и других конструкций в зимний период.
- Пищевая промышленность – стерилизация и пастеризация продуктов, их размораживание и варка.
- Судоходство и другие отрасли транспорта – использование в паровых турбинах и в системах парового пожаротушения.
Множественное применение нашел пар и в быту – приготовление еды в пароварках, парилки в банях, глажка одежды. Измерение его веса в быту вряд ли будет иметь место, но знание этого процесса никому не помешает.
Заключение
Подводя итог, можно сделать вывод – знание веса пара воды необходимо при расчетах паропроводов в системах энергетики, конструкций, работающих в других отраслях промышленности.
Необходимы такие знания и при расчете некоторых типов бытовых приборов. Несложные по своей сути, такие расчеты вполне по силам любому грамотному человеку.
Решение.
Определим массы молекул водорода и водяного пара:
[ {{m}_{0}}=frac{M}{{{N}_{A}}} (1). ]
NА = 6,02∙1023 моль-1 – число Авогадро, М(Н2) = 2∙10-3 кг/моль, М(Н2О) = 18∙10-3 кг/моль.
m0(Н2) = 0,33∙10-26 кг, m0(Н2О) = 2,99∙10-26 кг.
При нормальных условиях Т = 273 К.
Наиболее вероятная скорость определяется по формуле:
[ {{upsilon }_{B}}=sqrt{frac{2cdot Rcdot T}{M}} (2). ]
υВ(Н2) = 1506,2 м/с, υВ(Н2О) = 502,1 м/с.
Средняя арифметическая скорость определяется по формуле:
[ {{upsilon }_{CA}}=sqrt{frac{8cdot Rcdot T}{pi cdot M}} (3). ]
υСА (Н2)= 1699,9 м/с, υСА (Н2О)= 566,66 м/с.
Средняя квадратическая скорость определяется по формуле:
[ {{upsilon }_{K}}=sqrt{frac{3cdot Rcdot T}{M}} (4). ]
υк(Н2)= 1844,7 м/с, υк (Н2О)= 614,9 м/с.
Вычислите массу одной молекулы водяного пара
Получи верный ответ на вопрос 🏆 «Вычислите массу одной молекулы водяного пара …» по предмету 📕 Химия, используя встроенную систему поиска. Наша обширная база готовых ответов поможет тебе получить необходимые сведения!
Найти готовые ответы
Главная » Химия » Вычислите массу одной молекулы водяного пара
Молярная масса водяного пара
Молярная масса водяного пара
Он не имеет ни цвета, ни вкуса, ни запаха. Вода – это наиболее распространенное вещество в природе. Помимо существования в виде газа, она также может находиться в жидком или твердом (лед) состоянии, каждое из которых определяется температурой и давлением (рис. 1).
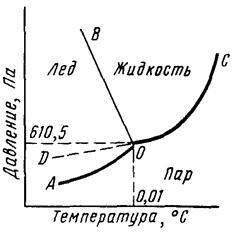
Рис. 1. Диаграмма состояния воды.
Кривая АО соответствует равновесию в системе лед-пар, DO – равновесию в системе переохлажденная вода-пар, кривая OC – равновесию в системе вода-пар, а кривая OB – равновесию в системе лед-вода. В точке О все кривые пересекаются. Эта точка называется тройной точкой и отвечает равновесию в системе лед-вода-пар.
Брутто-формула водяного пара совпадает с брутто-формулой воды и имеет вид 2O. Как известно, молекулярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Mr(H2O) = 2×Ar(H) + Ar(O);
Mr(H2O) = 2×1 + 16 = 2 + 16 = 18.
Молярная масса (М) – это масса 1 моль вещества. Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
M = NA × m (1 молекулы) = NA × Mr × 1 а.е.м. = (NA ×1 а.е.м.) × Mr = × Mr.
Это означает, что молярная масса водяного пара равна 18 г/моль.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |