Загрузить PDF
Загрузить PDF
В атомах одного и того же элемента число протонов неизменно, в то время как число нейтронов может меняться. Зная, сколько нейтронов содержится в конкретном атоме, вы сможете определить, является ли он обычным атомом или изотопом, который будет иметь меньшее или большее количество нейтронов.[1]
Определить количество нейтронов в атоме — довольно просто. Все, что вам нужно сделать для расчета количества нейтронов в атоме или изотопе, — это следовать нашим инструкциям и держать под рукой периодическую таблицу.
-
1
Найдите элемент в периодической таблице. Для примера мы будем рассматривать осмий (Os), который находится в шестом периоде (шестой ряд сверху).
-
2
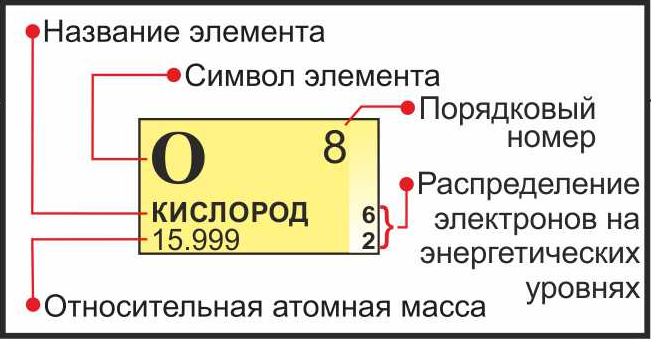
Найдите атомный номер элемента. Это, как правило, наиболее заметное число в ячейке элемента и обычно находится над его символом (в варианте периодической системы, которую мы используем в нашем примере, других номеров и нет). Атомный номер — это количество протонов в одном атоме этого элемента. Для осмия это число 76, то есть в одном атоме осмия содержится 76 протонов.
- Число протонов неизменно, именно оно и делает элемент элементом.
-
3
Найдите атомную массу элемента. Это число обычно находится под символом элемента. Обратите внимание, что в варианте периодической системы в нашем примере атомная масса не приведена (это не всегда так; во многих вариантах периодической системы атомная масса указана). Атомная масса осмия — 190,23.
-
4
Округлите атомную массу до ближайшего целого числа. В нашем примере 190,23 округляется до 190.
- Атомная масса — среднее число изотопов конкретного элемента, обычно она не выражается целым числом.
-
5
Вычтите атомный номер из атомной массы. Поскольку абсолютная часть атомной массы приходится на протоны и нейтроны, вычитание числа протонов (то есть атомного номера, который равен числу протонов) из атомной массы дает число нейтронов в атоме. Цифры после десятичной запятой относятся к очень малой массе электронов в атоме. В нашем примере: 190 (атомный вес) – 76 (число протонов) = 114 (число нейтронов).
-
6
Запомните формулу. Чтобы найти число нейтронов в будущем, просто используйте эту формулу:
-
N = M – n
- N = количество нейтронов
- M = атомная масса
- n = атомный номер
Реклама
-
N = M – n
-
1
Найдите элемент в периодической таблице. В качестве примера мы будем рассматривать изотоп углерода 14С. Поскольку неизотопный углерод 14С есть просто углерод С, найдите углерод в периодической таблице (второй период или второй ряд сверху).
-
2
Найдите атомный номер элемента. Это, как правило, наиболее заметное число в ячейке элемента и обычно находится над его символом (в варианте периодической системы, которую мы используем в нашем примере, других номеров и нет). Атомный номер – это количество протонов в одном атоме этого элемента. Углерод находится под номером 6, то есть один атом углерода имеет шесть протонов.
-
3
Найдите атомную массу. В случае изотопов делать это очень просто, так как они названы в соответствии с их атомной массой. В нашем случае у углерода 14С атомная масса равна 14. Теперь мы знаем атомную массу изотопа; последующий процесс расчета такой же, как и для определения числа нейтронов в атомах (не изотопах).
-
4
Вычтите атомный номер из атомной массы. Поскольку абсолютная часть атомной массы приходится на протоны и нейтроны, вычитание числа протонов (то есть атомного номера, который равен числу протонов) из атомной массы дает число нейтронов в атоме. В нашем примере: 14 (атомная масса) – 6 (число протонов) = 8 (число нейтронов).
-
5
Запомните формулу. Чтобы найти число нейтронов в будущем, просто используйте эту формулу:
-
N = M – n
- N = количество нейтронов
- M = атомная масса
- n = атомный номер
Реклама
-
N = M – n
Советы
- Протоны и нейтроны составляют практически абсолютную массу элементов, в то время как электроны и прочие частицы составляют крайне незначительную массу (эта масса стремится к нулю). Так как один протон имеет примерно ту же массу, что и один нейтрон, а атомное число представляет собой число протонов, то можно просто вычесть число протонов от общей массы.
- Осмий — металл в твердом состоянии при комнатной температуре, получил свое название от греческого слова «osme» — запах.
- Если вы не уверены, что значит какое-то число в периодической таблице, запомните: таблица, как правило, строится вокруг атомного номера (то есть числа протонов), который начинается с 1 (водород) и растет на одну единицу слева направо, заканчиваясь на 118 (Оганесон). Это потому, что число протонов в атоме определяет сам элемент и такое число — наиболее легкий способ систематизации элементов (например, атом с 2 протонами — всегда гелий, так же, как и атом с 79 протонами — всегда золото).
Реклама
Об этой статье
Эту страницу просматривали 193 114 раз.
Была ли эта статья полезной?
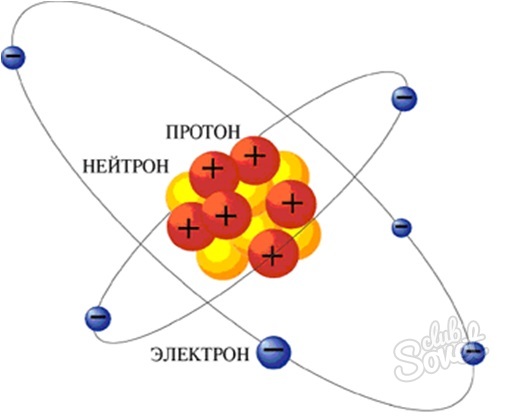
Atoms make up all matter. Everything with mass and volume, big or small, contains atoms. Amazingly enough, the tiny atoms contain even smaller particles. Protons, neutrons and electrons are the three main components of all atoms. The number and arrangement of these three unimaginably small particles determines the properties and behavior of the atoms that contain them.
TL;DR (Too Long; Didn’t Read)
To find the number of neutrons in an isotope, subtract the number of protons from the atomic mass of the isotope. The atomic number of the element equals the number of protons. Calculating the number of neutrons then becomes atomic mass of the isotope minus the atomic number of the element equals the number of neutrons. For uranium-235, atomic number 92, the number of neutrons is 235-92=143, or 143 neutrons.
Particles in Atoms
Almost all atoms contain three main particles: protons, neutrons and electrons. Protons and neutrons make up the nucleus, or center, of the atom. Electrons, much smaller than the protons and neutrons, circle the nucleus, zipping around at the speed of light. Protons have a positive charge, neutrons have no charge, and electrons have a negative charge. In a neutral atom, the number of protons equals the number of electrons, but the number of neutrons doesn’t always equal the number of protons.
Identifying Atoms
The number of protons in an atom determines which kind of element the atom forms. Hydrogen, first element on the periodic table, has only one proton. Helium, second on the periodic table, has two protons. Gold, number 79 on the periodic table, has 79 protons. The Periodic Table of Elements shows the elements in order of the number of protons in the atoms.
Isotopes of Atoms
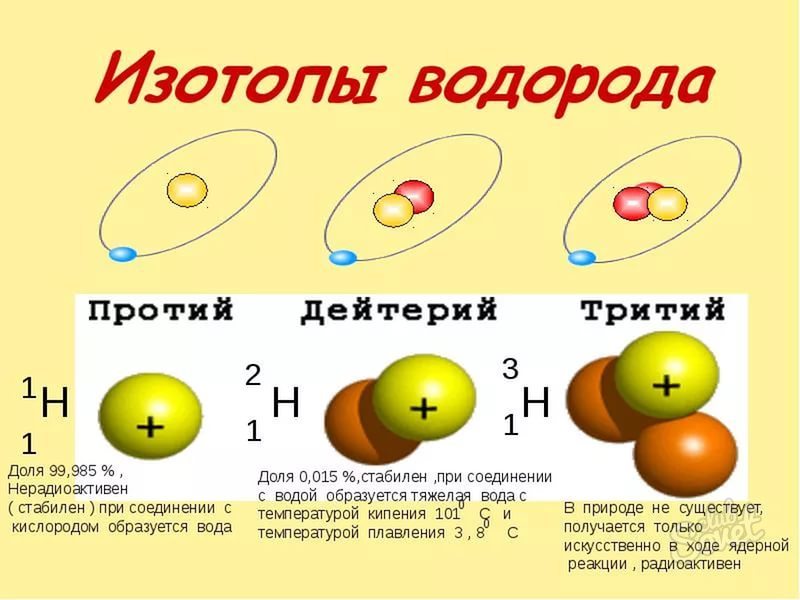
An isotope of an element means atoms with the same atomic number but different mass numbers. So, isotopes of an element have a different number of neutrons. Hydrogen has three isotopes. Hydrogen, the most common form of the atom, has one proton and one electron. Deuterium, one isotope of hydrogen, still only has one proton and one electron, but also has one neutron. Tritium, another isotope of hydrogen, still only has one proton and one electron but has two neutrons.
Calculating Neutrons
The mass of an atom consists of the combined masses of the protons and neutrons. The mass of the electrons is negligible in the overall mass of the atom. Protons measure about one atomic mass unit and neutrons measure only slightly more than one atomic mass unit. To find the number of neutrons in the atom, subtract the atomic number from the atomic mass.
The atomic number and the average atomic mass can be found on the periodic table. The mass of different isotopes is often written as part of the name of the isotope, however. Uranium-235 means the element uranium, atomic number 92, has 92 protons and an atomic mass of 235. On the other hand, uranium-238 has a mass of 238 but still has only 92 protons. An alternate method of writing an isotope shows the atomic mass as a superscript and the atomic number as a subscript. Uranium-235 could also be written as 23592 U where U is the standard abbreviation for uranium.
Using the hydrogen isotopes as examples, the “normal” atom of hydrogen has an atomic mass of 1, and the atomic number is 1, meaning the atom only has one proton. Using the formula, the atomic mass of 1 minus the atomic number, or number of protons, of 1 gives the equation 1-1=0, so the hydrogen atom has 0 neutrons. On the other hand, tritium, an isotope of hydrogen, has an atomic mass of 3 but the atomic number of hydrogen remains 1 because the atom only has one proton. Using the equation, atomic mass minus atomic number equals the number of neutrons, gives 3-1=2, so tritium has 2 neutrons.
Another common element, carbon, also has several isotopes. The normal carbon atom, atomic number 6, has an atomic mass of 12. Using the formula, atomic mass minus atomic number equals number of neutrons, shows 12-6=6, so the carbon-12 atom has 6 neutrons. Carbon-14, used for radioactive age dating of fossils under 10,000 years old, still has 6 protons but has an atomic mass of 14. Calculating the number of neutrons uses the same formula, so 14-6=8, so carbon-14 has 8 neutrons in its nucleus.
Атомы составляют всю материю. Все с массой и объемом, большим или маленьким, содержит атомы. Удивительно, но крошечные атомы содержат еще более мелкие частицы. Протоны, нейтроны и электроны являются тремя основными компонентами всех атомов. Количество и расположение этих трех невообразимо маленьких частиц определяет свойства и поведение атомов, которые их содержат.
TL; DR (слишком долго; не читал)
Чтобы найти число нейтронов в изотопе, вычтите количество протонов из атомной массы изотопа. Атомный номер элемента равен количеству протонов. Расчет количества нейтронов затем становится атомной массой изотопа минус атомный номер элемента равен числу нейтронов. Для урана-235 с атомным номером 92 число нейтронов составляет 235-92 = 143 или 143 нейтрона.
Частицы в атомах
Почти все атомы содержат три основные частицы: протоны, нейтроны и электроны. Протоны и нейтроны составляют ядро или центр атома. Электроны, намного меньшие, чем протоны и нейтроны, окружают ядро, перемещаясь со скоростью света. Протоны имеют положительный заряд, нейтроны не имеют заряда, а электроны имеют отрицательный заряд. В нейтральном атоме число протонов равно количеству электронов, но число нейтронов не всегда равно количеству протонов.
Идентификация атомов
Количество протонов в атоме определяет, какой тип элемента образует атом. Водород, первый элемент периодической таблицы, имеет только один протон. Гелий, второй в периодической таблице, имеет два протона. Золото, номер 79 в периодической таблице, имеет 79 протонов. Периодическая таблица элементов показывает элементы в порядке количества протонов в атомах.
Изотопы атомов
Изотоп элемента означает атомы с одинаковым атомным номером, но разными массовыми числами. Итак, изотопы элемента имеют разное количество нейтронов. Водород имеет три изотопа. Водород, наиболее распространенная форма атома, имеет один протон и один электрон. Дейтерий, один изотоп водорода, все еще имеет только один протон и один электрон, но также имеет один нейтрон. Тритий, другой изотоп водорода, все еще имеет только один протон и один электрон, но имеет два нейтрона.
Расчет нейтронов
Масса атома состоит из объединенных масс протонов и нейтронов. Масса электронов ничтожна в общей массе атома. Протоны измеряют примерно одну атомную единицу массы, а нейтроны измеряют лишь немного больше, чем одна атомная единица массы. Чтобы найти число нейтронов в атоме, вычтите атомный номер из атомной массы.
Атомный номер и среднюю атомную массу можно найти в периодической таблице. Однако масса различных изотопов часто пишется как часть названия изотопа. Уран-235 означает, что элемент уран с атомным номером 92 имеет 92 протона и атомную массу 235. С другой стороны, уран-238 имеет массу 238, но все еще имеет только 92 протона. Альтернативный метод написания изотопа показывает атомную массу как верхний индекс и атомный номер как нижний индекс. Уран-235 также может быть записан как 235 92 U, где U – стандартное сокращение для урана.
Используя в качестве примера изотопы водорода, «нормальный» атом водорода имеет атомную массу 1, а атомный номер равен 1, что означает, что атом имеет только один протон. Используя формулу, атомная масса 1 минус атомное число или число протонов, равное 1, дает уравнение 1-1 = 0, поэтому атом водорода имеет 0 нейтронов. С другой стороны, тритий, изотоп водорода, имеет атомную массу 3, но атомное число водорода остается 1, потому что атом имеет только один протон. Используя уравнение, атомная масса минус атомное число равно числу нейтронов, дает 3-1 = 2, поэтому у трития есть 2 нейтрона.
Другой общий элемент, углерод, также имеет несколько изотопов. Нормальный атом углерода, атомный номер 6, имеет атомную массу 12. Используя формулу, атомная масса минус атомное число равно числу нейтронов, показывает 12-6 = 6, поэтому атом углерода-12 имеет 6 нейтронов. Углерод-14, используемый для датирования радиоактивного возраста окаменелостей в возрасте до 10 000 лет, все еще имеет 6 протонов, но имеет атомную массу 14. Для расчета количества нейтронов используется та же формула, поэтому 14-6 = 8, поэтому углерод-14 имеет 8 нейтронов в его ядре.
Для того чтобы это сделать вам нужно знать 3 вещи:
- Как определить число протонов и нейтронов в атоме?
- Как определить общее число электронов в атоме?
- Что такое изотоп.
Вкратце напомню.
Число протонов и электронов в атоме одинаково и равно порядковому номеру элемента в периодической таблице.
Число нейтронов вычисляется по формуле:
N = A — Z
Где N — число нейтронов, A — атомная масса элемента (в целых числах), Z — заряд ядра атома (число протонов) или порядковый номер атома в периодической таблице Менделеева.
Что такое изотоп?
Изотопы это разновидности атомов химического элемента, которые имеют одинаковый заряд ядра (порядковый номер в таблице), но разные массовые числа.
Проще говоря, у изотопов в ядре атома одинаковое число протонов, но разное число нейтронов.
Таким образом, число протонов и электронов у изотопов такое же, как и у обычных атомов, разница лишь в количестве нейтронов.
Примеры
Сколько электронов, протонов и нейтронов содержит атом изотопа титана 50Ti?
Титан имеет порядковый номер 22. Значит в ядре содержится 22 протона, а в атоме 22 электрона.
Число нейтронов: N = 50 – 22 = 28 нейтронов.
Сколько электронов содержит нейтральный атом изотопа полония?
В данном случае нам даже не нужно знать массовое число изотопа, т.к. речь идет только об электронах. Порядковый номер полония 84, значит в ядре атома 84 протона, а в атоме 84 электрона.
Определите число протнов, нейтронов и электронов для изотопа 55Mn.
Порядковый номер марганца 25. Значит в ядре атома 25 протонов, а в атоме 25 электронов.
Найдем число нейтронов: N = 55 – 25 = 30 нейтронов.
Определите число протонов изотопа калия.
В этом случае массовое число изотопа не имеет значения, т.к. речь идет о протонах, число которых у изотопов одинаково. Калий имеет порядковый номер в таблице 19, значит у любого изотопа калия будет 19 протонов.
Похожие вопросы:
– Какие атомы имеют одинаковое число нейтронов?
– Как определить общее число электронов в атоме?
Как найти нейтроны
Под запросом “Как найти нейтроны” понимается метод поиска числа нейтронов в атоме. Нейтрон – это тяжелая частица, которая не имеет электрического заряда и вместе с протоном составляет атомное ядро элемента. Число нейтронов в атоме определяется с помощью таблицы Менделеева.
1
Как найти нейтроны – ищем число нейтронов в атомах
- Берем таблицу Менделеева и находим нужный элемент.
- Как вы знаете, химические элементы расположены не случайным образом. Порядковый номер элемента соответствует числу протонов, находящихся в одном атоме элемента – атомному номеру. Вот он нам и нужен. Это самое крупное число в ячейке, его нетрудно обнаружить, так как элементы следуют друг за другом практически по порядку (по возрастанию).
- Запоминаем атомный номер.
- Находим массу атома. Это значение также располагается в ячейке элемента периодической системы, чье количество нейтронов мы ищем. Как правило, масса записана более мелким шрифтом, чем номер атома, в виде десятичной дроби. У более сложных элементов заключена в квадратные скобки.
- Для расчетов атомную массу округляем до целого числа.
- Так как ядро атома состоит из нейтронов и протонов, то путем вычитания из массы атома протонов (атомного номера), мы получим величину содержания нейтронов в атоме данного элемента.
2
Как найти нейтроны – пример
- Например, нам нужно найти, сколько нейтронов находится в атоме Циркония.
- Будем использовать формулу: N = M – n, где:
М – атомная масса, n – атомный номер (число протонов), N – число нейтронов.
- Находим Цирконий в таблице Менделеева, для химических расчетов она всегда должна быть под рукой.
- Его атомная масса равна 91,22, округляем до 91.
- Атомный номер равен 40.
- Получаем, что в атоме Циркония находится 51 (N = 91 – 40) нейтрон.
3
Как найти нейтроны – находим сколько нейтронов у изотопов
- Изотопы – это разновидности одного и того же элемента, но имеющие различную массу атомов. Но атомный номер, который мы научились искать выше, у них совпадает.
- Нужно знать, что все изотопы определенного элемента помещаются в одну ячейку в таблице Менделеева.
- Раз атомный номер у изотопов одного и того же элемента совпадает, значит нам нужно лишь найти атомную массу для расчета величины нейтронов.
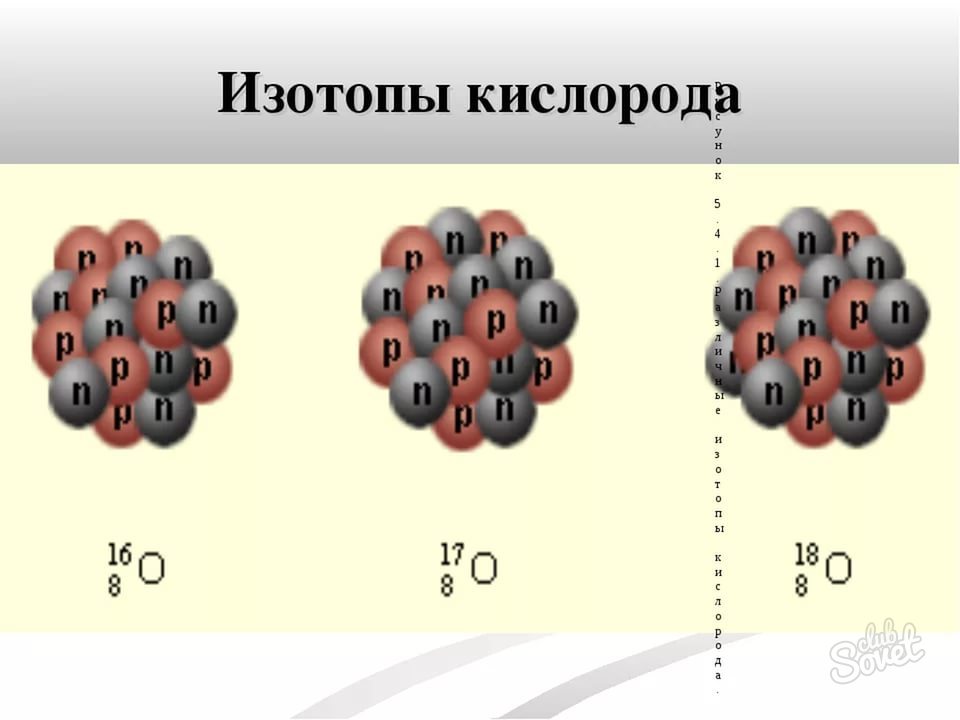
- Атомную массу изотопа найти очень просто – она заключена в самом названии изотопа. Например, О-16, О-17, О-18 – изотопы кислорода с атомной массой 16, 17 и 18 соответственно. Иногда атомную массу записывают как верхний индекс слева от символа хим. элемента.
- Таким образом, нам известны все составляющие для формулы. Нам не составит труда вычислить, какое количество нейтронов находится в изотопе.
4
Как найти нейтроны – пример, изотоп О-17
- Атомный номер всех изотопов кислорода, как и самого элемента равен 8.
- Атомная масса указана в названии изотопа – она равна 17.
- Вычисляем по формуле N = M – n, что количество нейтронов в атоме изотопа О-17 равно 9 (17 – 8).
Теперь вы знаете, как рассчитать число нейтронов в атоме любого элемента и изотопа. Конечно, для расчетов вам всегда понадобится иметь под рукой периодическую таблицу Менделеева.