В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса – Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса – Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль – единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) – число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль – международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов – вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается “ню”).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса – M
Молярная масса – масса одного моля вещества, выражается в “г/моль” (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы – массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl – 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково – 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика – лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем – объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как – VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. – константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор – Cl2.


Моль (количество вещества) – самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи – выполнена 🙂

Относительная плотность и газы – D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): “Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества”

Относительная плотность и водный раствор – ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении – так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам “как к числам”, то не запутаетесь.
В ходе ваших действий “грамм” и “грамм” должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 🙂
К примеру, даны масса раствора HCl – 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля – ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах – его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
как найти массу и количество молекул
Ученик
(213),
на голосовании
10 лет назад
Голосование за лучший ответ
Елена Новиченко
Мыслитель
(7497)
10 лет назад
1. находим молекулярную массу воды: 16*1+1*2=18
2. молярная масса = 18 г/моль
3. масса 1 моля воды = 18 г
4. В 1 моле вещества содержится число Авогадро молекул 6,022*10 в 23 степени.
5. Чтобы найти массу одной молекулы, надо молярную массу разделить на число Авогадро, приблизительно будет 2,99*10 в минус 23 степени грамма.
Для более точного расчета молярной массы возьмите атомные веса из таблицы Менделеева с точностью до 4 знака.
Удачи!! !
Решение задач на количество вещества,
массу и объем
Ключевые слова: решение задач на количество вещества, решение задач по химии на массу и объем, какое количества вещества содержится, какое число молекул содержится, определите объем (н.у.), определите массу, какова масса порции, определите молярную массу, назовите вещество, найдите молярную массу, определите абсолютную массу молекулы, сколько атомов содержится, определите относительную плотность.
ФОРМУЛЫ ДЛЯ РЕШЕНИЯ ЗАДАЧ
Количество вещества характеризует число структурных единиц (атомов, молекул, ионов), которое содержится в определенном образце данного вещества. Единицей измерения количества вещества является моль. Количество вещества (ν) связано с числом структурных единиц (N) в образце вещества, его массой (m) и объемом (V) — для газообразных веществ при н. у. — следующими уравнениями:
 в которых
в которых
Vm = 22,4 л/моль (мл/ммоль, м3/кмоль) при н.у.,
Na = 6,02 • 1023 (постоянная Авогадро),
а молярная масса (М) численно равна относительной молекулярной массе вещества:

Наличие подобной взаимосвязи позволяет, зная одну из величин (количество вещества, массу, объем, число структурных величин) определить все другие величины.
РЕШЕНИЯ ПРОСТЫХ ЗАДАЧ
Задача № 1.
Какое количество вещества содержится в 33 г оксида углерода (IV)?

Ответ: ν(СО2) = 0,75 моль.
Задача № 2.
Какое число молекул содержится в 2,5 моль кислорода?

Ответ: N(O2) = 1,505 • 1024.
Задача № 3.
Определите объем (н. у.), который займут 0,25 моль водорода.

Задача № 4.
Какую массу будет иметь порция оксида серы (IV), объем которой 13,44 л (н. у.)?

Задача № 5.
Имеется 3 моль кислорода О2 при н.у. Определите массу кислорода, его объем, а также число имеющихся молекул кислорода.
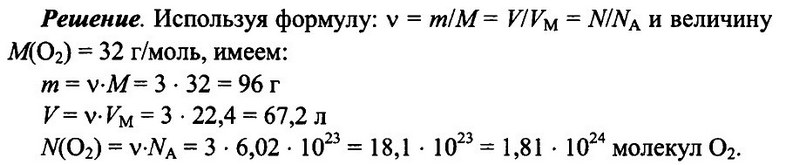
Ответ: m = 96 г; V = 67.2 л; N(O2) = 1,81 • 1024.
Задача № 6.
Имеется 10 г водорода Н2. Определите количество водорода, его объем при н.у., а также число имеющихся молекул водорода.
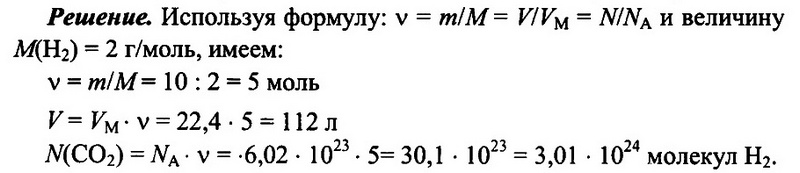
Ответ: 5 моль; 112 л; 3,01 • 1024.
Задача № 7.
Имеется 56 л хлора Сl2 при н.у. Определите количество вещества хлора, его массу и число имеющихся молекул хлора.

Ответ: 2,5 моль; 177,5 г; 1,5 • 1024.
Задача № 8.
Имеется 2,4 • 1023 молекул оксида углерода (IV) СO2. Определите количество вещества углекислого газа, его массу, а также объем (н.у.) углекислого газа.
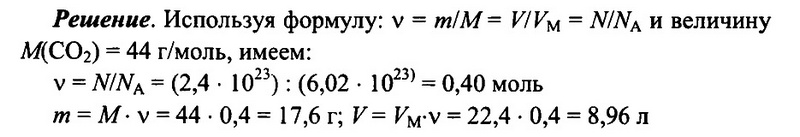
Ответ: 0,4 моль; 17,6 г; 8,96 л.
Задача № 9.
Какова масса порции оксида азота (IV), содержащей 4,816 • 1023 молекул? Каков ее объем (н. у.)?

Задача № 10.
Масса порции простого вещества, содержащей 1,806 • 1024 молекул, равна 6 г. Определите молярную массу данного вещества и назовите его.

Внимание! В данном конспекте рассматриваются задачи обычной сложности. Чтобы перейти к конспекту решения сложных задач на количественные характеристики и задачи с кратким ответом нажмите на кнопку ниже…
Сложные задачи на количество …
Решение задач на количество вещества, массу и объем. Выберите дальнейшие действия:
- Перейти дальше: Решение задач с долей вещества в смеси, в соединении
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
Формулы молекулярной физики
Формула концентрации молекул
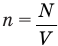
Здесь n — концентрация  , N — количество молекул (безразмерное), V — объем
, N — количество молекул (безразмерное), V — объем  .
.
Формула плотности
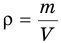
Здесь 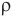 — плотность вещества
— плотность вещества 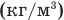 , m — масса вещества (кг), V — объем
, m — масса вещества (кг), V — объем  .
.
Формула относительной молекулярной массы
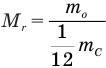
Здесь 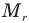 — относительная молекулярная масса (безразмерная),
— относительная молекулярная масса (безразмерная), 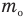 — масса одной молекулы (кг),
— масса одной молекулы (кг), 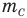 — масса атома углерода (кг).
— масса атома углерода (кг).
Формула количества вещества (количества молей)
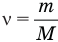
Здесь v — количество вещества (количество молей) (моль), m — масса вещества (кг), М — молярная масса (кг/моль).
Формулы массы одной молекулы
Здесь 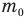 — масса одной молекулы (кг), т — масса вещества (кг), N — количество молекул (безразмерное), М — молярная масса (кг/моль),
— масса одной молекулы (кг), т — масса вещества (кг), N — количество молекул (безразмерное), М — молярная масса (кг/моль), 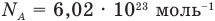 — число Авогадро,
— число Авогадро, 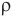 — плотность вещества
— плотность вещества 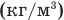 , n — концентрация молекул
, n — концентрация молекул  .
.
Формулы количества молекул
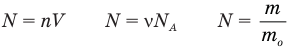
Здесь A — количество молекул (безразмерное), п — концентрация молекул  , V— объем
, V— объем  , v — количество вещества (количество молей) (моль),
, v — количество вещества (количество молей) (моль), 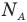 — число Авогадро
— число Авогадро 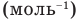 , m — масса вещества (кг),
, m — масса вещества (кг), 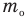 — масса одной молекулы.
— масса одной молекулы.
Формулы средней квадратичной скорости молекул
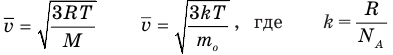
Здесь 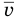 — средняя квадратичная скорость молекул (м/с), R = 8,31 Дж/(моль • К) — молярная газовая постоянная, Т — абсолютная температура (К), М — молярная масса (кг/моль),
— средняя квадратичная скорость молекул (м/с), R = 8,31 Дж/(моль • К) — молярная газовая постоянная, Т — абсолютная температура (К), М — молярная масса (кг/моль), 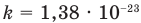 Дж/К — постоянная Больцмана,
Дж/К — постоянная Больцмана, 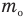 — масса одной молекулы (кг).
— масса одной молекулы (кг).
Основное уравнение кинетической теории идеального газа

Здесь р — давление газа (Па), 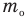 — масса одной молекулы (кг), n — концентрация молекул
— масса одной молекулы (кг), n — концентрация молекул  ,
, 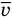 — средняя квадратичная скорость молекул (м/с),
— средняя квадратичная скорость молекул (м/с), 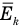 — средняя кинетическая энергия молекул (Дж).
— средняя кинетическая энергия молекул (Дж).
Формула средней кинетической энергии молекул
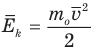
Здесь 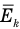 — средняя кинетическая энергия молекул (Дж),
— средняя кинетическая энергия молекул (Дж), 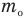 — масса одной молекулы (кг),
— масса одной молекулы (кг), 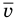 — средняя квадратичная скорость молекул (м/с).
— средняя квадратичная скорость молекул (м/с).
Связь шкал Цельсия и Кельвина
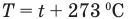
Здесь Т — абсолютная температура (К), t — температура по шкале Цельсия.
Связь средней кинетической энергии молекул идеального газа с абсолютной температурой
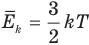
Здесь 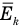 — средняя кинетическая энергия молекул (Дж), k — постоянная Больцмана (Дж/К), Т — абсолютная температура (К).
— средняя кинетическая энергия молекул (Дж), k — постоянная Больцмана (Дж/К), Т — абсолютная температура (К).
У равнение состояния идеального газа — уравнение Клапейрона — Менделеева
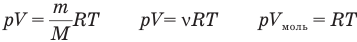
Здесь р — давление газа (Па), V — объем  , т — масса газа (кг), М — молярная масса (кг/моль), R — молярная газовая постоянная (ДжДмоль • К), Т — абсолютная температура (К), v — количество вещества (количество молей) (моль),
, т — масса газа (кг), М — молярная масса (кг/моль), R — молярная газовая постоянная (ДжДмоль • К), Т — абсолютная температура (К), v — количество вещества (количество молей) (моль), 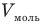 — объем моля
— объем моля 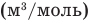 .
.
Объединенный газовый закон — уравнение Клапейрона
при 
Здесь 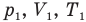 — давление (Па), объем
— давление (Па), объем  и абсолютная температура (К) газа в первом состоянии,
и абсолютная температура (К) газа в первом состоянии, 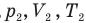 — давление (Па), объем
— давление (Па), объем  и абсолютная температура (К) газа во втором состоянии.
и абсолютная температура (К) газа во втором состоянии.
Закон Бойля — Мариотта (изотермический процесс)
при 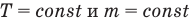
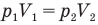
Здесь Т — абсолютная температура газа (К), m — масса газа (кг), 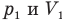 — давление (Па) и объем газа
— давление (Па) и объем газа  в первом состоянии,
в первом состоянии, 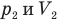 — давление (Па) и объем
— давление (Па) и объем  газа во втором состоянии.
газа во втором состоянии.
Закон Гей-Люссака (изобарный процесс)
при 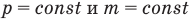
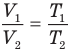
Здесь р — давление газа (Па), m — масса газа (кг), 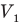 и
и 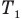 — объем
— объем  и абсолютная температура (К) газа в первом состоянии,
и абсолютная температура (К) газа в первом состоянии, 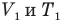 — объем
— объем  и абсолютная температура (К) газа во втором состоянии.
и абсолютная температура (К) газа во втором состоянии.
Закон Шарля
при 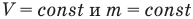
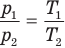
Здесь V — объем газа  , m — масса газа (кг),
, m — масса газа (кг), 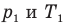 — давление (Па) и абсолютная температура (К) газа в первом состоянии,
— давление (Па) и абсолютная температура (К) газа в первом состоянии, 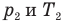 — давление (Па) и абсолютная температура (К) газа во втором состоянии.
— давление (Па) и абсолютная температура (К) газа во втором состоянии.
Связь давления идеального газа с концентрацией его молекул и температурой
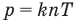
Здесь р — давление газа (Па), к — постоянная Больцмана (Дж/К), п — концентрация молекул газа  , абсолютная температура Т (К).
, абсолютная температура Т (К).
Формулы относительной влажности
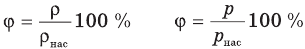
Здесь 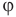 — относительная влажность (безразмерная или в %), р — плотность водяного пара в воздухе при данной температуре
— относительная влажность (безразмерная или в %), р — плотность водяного пара в воздухе при данной температуре 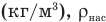 — плотность насыщенного водяного пара при той же температуре
— плотность насыщенного водяного пара при той же температуре 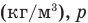 — давление водяного пара в воздухе при данной температуре (Па),
— давление водяного пара в воздухе при данной температуре (Па), 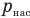 — давление насыщенного водяного пара в воздухе при той же температуре (Па).
— давление насыщенного водяного пара в воздухе при той же температуре (Па).
Работа при изобарном изменении объема газа
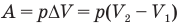
Здесь А — работа (Дж), р — давление газа (Па), 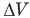 — изменение объема газа
— изменение объема газа 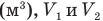 — соответственно начальный и конечный объемы газа
— соответственно начальный и конечный объемы газа  .
.
Внутренняя энергия идеального одноатомного газа
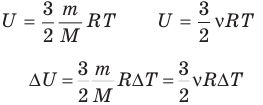
Здесь U — внутренняя энергия газа (Дж), m — масса газа (кг), М — молярная масса газа (кг/моль), R — молярная газовая постоянная (Дж/(моль • К), Т — абсолютная температура (К), v — количество вещества или число молей (моль), 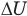 — изменение внутренней энергии (Дж),
— изменение внутренней энергии (Дж), 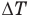 — изменение температуры (К).
— изменение температуры (К).
Первый закон термодинамики
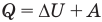
Здесь Q — количество теплоты, переданное термодинамической системе (Дж), 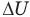 — изменение внутренней энергии системы (Дж), А — работа против внешних сил (Дж)
— изменение внутренней энергии системы (Дж), А — работа против внешних сил (Дж)
Применение первого закона термодинамики к термодинамическим процессам
к изотермическому: при 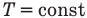
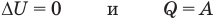
к изохорному: при V = const
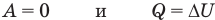
к изобарному: при р = const
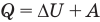
к адиабатному: при Q = 0

Здесь Т — абсолютная температура (К), 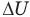 — изменение внутренней энергии (Дж), Q — количество теплоты (Дж), А — работа (Дж), V — объем
— изменение внутренней энергии (Дж), Q — количество теплоты (Дж), А — работа (Дж), V — объем 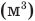 , р — давление (Па).
, р — давление (Па).
Формулы количества теплоты при нагревании или охлаждении тел
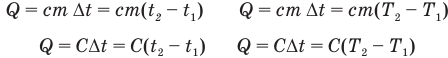
Здесь Q — количество теплоты, переданное телу при нагревании или отданное им при охлаждении (Дж), с — удельная теплоемкость вещества (Дж/(кг • К), т — масса тела (кг), 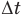 — изменение температуры тела по шкале Цельсия,
— изменение температуры тела по шкале Цельсия, 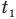 и
и 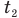 — температуры тела в начале и в конце процесса передачи теплоты по шкале Цельсия,
— температуры тела в начале и в конце процесса передачи теплоты по шкале Цельсия, 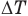 — изменение абсолютной температуры тела (К),
— изменение абсолютной температуры тела (К), 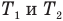 — абсолютные температуры тела в начале и в конце процесса передачи теплоты (К),
— абсолютные температуры тела в начале и в конце процесса передачи теплоты (К), 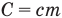 — теплоемкость тела (Дж/К).
— теплоемкость тела (Дж/К).
Формула количества теплоты при плавлении или кристаллизации
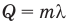
Здесь Q — количество теплоты (Дж), т — масса тела (кг), 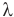 — удельная теплота плавления вещества (Дж/кг).
— удельная теплота плавления вещества (Дж/кг).
Формула количества теплоты при парообразовании или конденсации
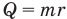
Здесь Q — количество теплоты (Дж), m — масса тела (кг), r — удельная теплота парообразования (Дж/кг).
Формула количества теплоты при сгорании топлива
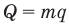
Здесь Q — количество выделившейся теплоты, m — масса топлива (кг), q — удельная теплота сгорания (Дж/кг).
Коэффициент полезного действия теплового двигателя
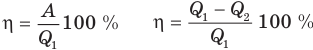
Здесь 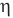 — коэффициент полезного действия (безразмерный или в %),
— коэффициент полезного действия (безразмерный или в %), 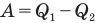 — работа, совершенная двигателем (Дж),
— работа, совершенная двигателем (Дж), 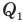 — количество теплоты, полученное рабочим веществом от нагревателя (Дж),
— количество теплоты, полученное рабочим веществом от нагревателя (Дж), 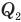 — количество теплоты, отданное рабочим веществом холодильнику (Дж).
— количество теплоты, отданное рабочим веществом холодильнику (Дж).
Коэффициент полезного действия идеального теплового двигателя
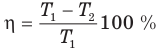
Здесь 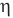 — коэффициент полезного действия идеального теплового двигателя (безразмерный или в %),
— коэффициент полезного действия идеального теплового двигателя (безразмерный или в %), 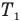 — абсолютная температура нагревателя (К),
— абсолютная температура нагревателя (К), 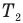 — абсолютная температура холодильника(К).
— абсолютная температура холодильника(К).
Эта теория со страницы подробного решения задач по физике, там расположена теория и подробное решения задач по всем темам физики:
Задачи по физике с решением
Возможно вам будут полезны эти страницы:

Молекулярно-кинетическая теория (МКТ) — раздел молекулярной физики, изучающий свойства вещества на основе представлений об их молекулярном строении и определенных законах взаимодействия между атомами (молекулами), из которых состоит вещество.
Основные положения МКТ
? Все вещества состоят из молекул
Это было подтверждено с помощью фотографий, полученных с использованием электронного микроскопа.
? Между молекулами есть промежутки
Существование промежутков доказывают разные объемы жидкостей до смешивания и после нее. Так, объем смеси воды и спирта меньше суммы объемов воды и спирта до их смешивания.
При нагревании промежутки между молекулами увеличиваются, а при охлаждении уменьшаются. Исключение составляет вода и резина. У воды промежутки между молекулами при охлаждении увеличиваются. У резины промежутки между молекулами при нагревании уменьшаются.
? Молекулы движутся
Движение молекул доказывает существование явления диффузии.
Определение
Диффузия — перемешивание веществ без постороннего воздействия.
Чем быстрее молекулы движутся, тем выше температура вещества. И наоборот. Поэтому скорость диффузии зависит от температуры вещества.
Броуновское движение — тепловое движение частиц под действием молекул вещества, в котором эти частицы взвешены.
?Молекулы взаимодействуют
Доказательством служит склеивание двух плоских стекол, смоченных водой. На расстоянии, сравнимых с размерами молекул, заметнее проявляется притяжение. При уменьшении расстояний заметнее проявляется отталкивание.
Свойства твердых, жидких и газообразных веществ
|
Агрегатное состояние вещества |
Сохраняет объем |
Сохраняет форму |
Особые свойства |
|
Твердое тело |
+ |
+ |
– |
|
Жидкость |
+ |
– |
Текучесть |
|
Газ |
– |
– |
Летучесть |
Строение твердых, жидких и газообразных веществ
|
Твердое тело |
Жидкость |
Газ |
|
|
Строение |
|
|
|
|
Расстояние между молекулами |
Сравнимо с размером молекул |
Чуть больше, чем в твердом состоянии |
Многократно превышает размеры молекул |
|
Характер движения |
Колебательное |
Скачкообразное |
Хаотическое |
|
Скорости молекул |
Малы |
Скорее малы |
Огромны |
|
Взаимодействие между молекулами |
Наибольшее |
Меньше, чем у твердых тел |
Наименьшее |
Важно! Химический состав молекул не зависит от агрегатного состояния.
Микроскопические параметры вещества
К микроскопическим параметрам вещества относят параметры одной частицы этого вещества.
Относительная атомная масса
Определение
Относительная атомная масса — значение массы атома, выраженное в атомных единицах массы (а.е.м.).
Относительная атомная масса обозначается Ar. Это безразмерная величина, определяющаяся как отношение массы атома данного элемента к 1⁄12 массе нейтрального атома изотопа углерода 12C:
Ar=m0112m0C
m0 — масса одного атома, m0С — масса атома углерода.
Внимание! Относительную атомную массу можно узнать из таблицы Менделеева.
Пример №1. Определить по таблице Менделеева относительную атомную массу хлора.
В таблице Менделеева относительная атомная масса указывается под названием химического элемента:

Видно, что Ar = 35,453 а.е.м. При решении задач это значение обычно округляют до 35,5 а.е.м.
Относительная молекулярная масса
Определение
Относительная молекулярная масса — масса молекулы, выраженная в а.е.м.
Относительная молекулярная масса обозначается Mr. Это безразмерная величина, равная сумме относительных масс атомов, входящих в состав молекулы:
Mr=∑Ar
Пример №2. Определить относительную молекулярную массу озона.
В молекуле озона содержится 3 атома кислорода. Следовательно:
Mr=3Ar=16·3=48 (а.е.м.)
Количество вещества
Определение
Количество вещества — физическая величина, отображающая количество молекул (атомов) в веществе.
Количество вещества обозначается как ν («ню»). Единица измерения — моль.
Моль — количество вещества, в котором содержится столько же молекул (атомов), сколько содержится атомов в 12 г углерода.
Количество вещества определяется формулой:
ν=NNA
N — количество молекул (атомов) в веществе, NA — количество частиц в одном моле вещества (постоянная Авогадро).
Единица измерения постоянной Авогадро — 1/моль, или моль–1. В 1 моле содержится 6∙1023 частиц вещества. Именно столько атомов содержит 1 моль (или 12 г) углерода.
Пример №3. В баллоне находится 3∙1025 молекул газа. Определите количество вещества в баллоне.
ν=NNA=3·10256·1023=0,5∙102=50 (моль)
Молярная масса
Определение
Молярная масса — масса одного моля вещества.
Молярная масса обозначается как M. Единица измерения — килограмм на моль (кг/моль, но можно использовать и грамм на моль!). Численно молярная масса равна произведению относительной молекулярной массы на 10–3 (только для килограмма!):
M=Mr•10−3
Пример №4. Определить молярную массу озона.
Относительная молекулярная масса озона равна 48 а.е.м. Поэтому:
M=Mr•10−3=48•10−3 (кгмоль)
Масса молекулы
Масса молекулы — масса одной молекулы вещества, выраженная в килограммах (кг).
Масса молекулы обозначается как m0. Численно она равна отношению молярной массы к количеству частиц вещества в одном моле (или отношению массы вещества к количеству частиц, содержащихся в нем):
m0=MNA=mN
Отсюда отношение количества молекул к постоянной Авогадро равно отношению массы вещества к его молярной массе. Следовательно, количество вещества можно определить также формулой:
ν=mM
Пример №5. Определить массу одной молекулы озона.
m0=MNA=486•1023=8•10−23 (кг)
Плотность, масса вещества и концентрация частиц
Определение
Плотность вещества — масса одного кубического метра вещества.
Плотность вещества обозначается как ρ. Единица измерения — килограммы на кубический метр (кг/м3). Численно плотность равна отношению массы вещества к объему, который оно занимает:
ρ=mV
m — масса вещества, которое занимает объем V.
Определение
Концентрация частиц — физическая величина, равная отношению числа частиц к объему, который они занимают.
Концентрация частиц обозначается как n. Единица измерения — 1/м3. Определяется формулой:
n=NV
Поэтому плотность можно выразить через объем, равный отношению числа частиц к концентрации этих частиц:
ρ=mV=mnN
При делении массы вещества на количество содержащихся в нем частиц мы получим массу одной частицы — m0. Поэтому плотность вещества также равна:
ρ=mnN=m0n
Отсюда концентрация вещества также равна:
n=ρm0
Масса вещества определяется произведением плотности вещества на его объем (или количеством вещества на молярную массу):
m=ρV=νM
Пример №6. Определить массу 5 молей озона.
m=νM=5•48•10−3=240•10−3=0,24 (кг)
Через массу вещества можно также выразить количество этого вещества:
ν=mM=ρVM
Количество атомов и молекул
Количество молекул N определяется произведением количества вещества на число частиц в одном моле или произведением концентрации частиц на объем вещества:
Nмол=νNA=nV
Количество атомов в веществе выражается формулой:
Nатом=kNмол
k — количество атомов в одной молекуле.
Пример №7. В баллоне находится 4 моль газа. Сколько примерно молекул газа находится в баллоне?
Nмол=νNA=4∙6∙1023=24∙1023 (молекул)
Подсказки к задачам
Если двухатомный газ перешел в одноатомное состояние, то 1 моль газа превращается в 2 моля:
ν2 = 2ν1
Но молярная масса при этом уменьшается вдвое:
M2 = 0,5M1
Чтобы перевести плотность из г/см3 в кг/м3, нужно умножить ее значение в г/см3 на 1000:
1 г/см3∙1000 = 1 кг/м3
Если 1 каплю масла объемом V вылить в воду, и она растечется, образовав пленку толщиной в 1 молекулу и площадью S, то диаметр молекулы d будет равен:
d=VS
Объем капли можно вычислить по формуле:
V=mρ
Площадь пятна:
S=πR2=πD24
Задание EF18524
Расстояние между молекулами вещества много больше размеров самих молекул. Двигаясь во всех направлениях, молекулы быстро распределяются по всему сосуду. В каком состоянии находится вещество?
Ответ:
а) в газообразном
б) в жидком
в) в твёрдом
г) в газообразном или жидком
Алгоритм решения
- Выделить из описания параметры, характер которых может указывать на вид агрегатного состояния вещества.
- Установить, какому агрегатному состоянию соответствуют указанные значения этих параметров.
Решение
В условиях задачи обозначается:
- расстояние между молекулами вещества;
- характер движения молекул;
- свойство вещества, связанное с характером заполнения им сосуда.
Если расстояние между молекулами намного больше размеров самих молекул, то вещество находится в газообразном состоянии. Это подтверждают хаотичное движение молекул и способность вещества заполнять весь предоставленный ему объем.
Ответ: а
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18208
Молекулы газов находятся в среднем на больших расстояниях друг от друга по сравнению с их размерами, силы взаимодействия между ними незначительны. Этим можно объяснить следующие свойства газов.
А. Газ не сохраняет своей формы.
Б. Газ не сохраняет своего объёма.
В. Газ имеет большую сжимаемость.
Какое(-ие) из утверждений правильно(-ы)?
Алгоритм решения
- Установить, как влияет большое расстояние между молекулами на свойства газов.
- Выбрать правильные варианты ответов и записать их в алфавитном порядке.
Решение
Так как между молекулами газа большое расстояние, они слабо взаимодействуют друг с другом. Практически полное отсутствие сил притяжения позволяет двигаться им хаотически, что способствует быстрому заполнению газом объема сосуда. Причем неважно, какой объем и какую форму имеет сосуд. Следовательно, верными ответами можно считать как А, так и Б.
Теперь проверим последний вариант. Газы действительно обладают большой сжимаемостью. Это можно объяснить тем, что отталкиваются молекулы при расстояниях, которые меньше размеров самих молекул. Но в газах это расстояние намного больше. Поэтому, прежде чем возникнет отталкивание, газ можно будет легко сжать в несколько раз. Следовательно, ответ В тоже верен.
Ответ: АБВ
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 4.8k