Валентина Вавилова(Серкова)
Гений
(62183)
10 лет назад
Масса молекулы ( атома) определяется по формуле
m0=M / Na. ( m0-масса молекулы (атома) , М-молярная масса ( атома водорода) =0,001кг/моль, Na-постоянная Авогадро=6,02*10^23 ( 1 / моль) .
m0=0,001 / 6,02*10^23=1,66*10^27кг. ( это атома, молекулы в 2 раза больше, так как Н2.)
Арагами
Мудрец
(15832)
10 лет назад
Масса атома водорода = масса протона + масса электрона
Масса атома водорода = 1,6726485(86)·10^-27 кг + 9,10938291(40)·10^−31 кг = 1,674 10^-27 кг
Алексей Бараев
Гений
(69534)
10 лет назад
Ядро атома составляет более 99.9% массы атома. Ядро атома водорода состоит из одного протона.
Масса протона 1,007 276 атомных единиц массы, что составит 1,672 621 * 10^(-27) кг.
Можно пойти другим путем. Масса протона равна массе 1836,153 электронов, таким образом масса АТОМА водорода будет равна массе 1837,153 электронов.
Загрузить PDF
Загрузить PDF
Атомной массой называется сумма масс всех протонов, нейтронов и электронов, из которых состоит тот или иной атом или молекула.[1]
По сравнению с протонами и нейтронами масса электронов очень мала, поэтому она не учитывается в расчетах.[2]
Хотя это и некорректно с формальной точки зрения, нередко данный термин используется для обозначения средней атомной массы всех изотопов элемента. На самом деле это относительная атомная масса, называемая также атомным весом элемента.[3]
Атомный вес – это среднее значение атомных масс всех изотопов элемента, встречающихся в природе. Химики должны различать эти два типа атомной массы при выполнении своей работы – неправильное значение атомной массы может, к примеру, привести к неправильному результату для выхода продукта реакции.
-

1
Изучите как записывается атомная масса. Атомная масса, то есть масса данного атома или молекулы, может быть выражена в стандартных единицах системы СИ – граммах, килограммах и так далее. Однако в связи с тем, что атомные массы, выраженные в этих единицах, чрезвычайно малы, их часто записывают в унифицированных атомных единицах массы, или сокращенно а.е.м. – атомные единицы массы. Одна атомная единица массы равна 1/12 массы стандартного изотопа углерод-12.[4]
- Атомная единица массы характеризует массу одного моля данного элемента в граммах. Эта величина очень полезна при практических расчетах, поскольку с ее помощью можно легко перевести массу заданного количества атомов или молекул данного вещества в моли, и наоборот.
-

2
Найдите атомную массу в периодической таблице Менделеева. В большинстве стандартных таблиц Менделеева содержатся атомные массы (атомные веса) каждого элемента. Как правило, они приведены в виде числа в нижней части ячейки с элементом, под буквами, обозначающими химический элемент. Обычно это не целое число, а десятичная дробь.
- Обратите внимание, что все относительные атомные массы, указанные в таблице Менделеева, для каждого элемента являются средними значениями. У химических элементов есть различные изотопы – химические разновидности, имеющие разные массы из-за дополнительных или отсутствующих нейтронов в атомном ядре.[5]
Следовательно, относительные атомные массы, перечисленные в периодической таблице, могут использоваться как среднее значение для атомов определенного элемента, но не как масса одного атома данного элемента. - Относительные атомные массы, приведенные в периодической таблице, используются для расчета молярных масс атомов и молекул. Атомные массы, выраженные в а.е.м. (как в таблице Менделеева), по существу безразмерны. Однако просто умножив атомную массу на 1 г/моль, мы получаем полезную характеристику элемента – массу (в граммах) одного моля атомов этого элемента.
- Обратите внимание, что все относительные атомные массы, указанные в таблице Менделеева, для каждого элемента являются средними значениями. У химических элементов есть различные изотопы – химические разновидности, имеющие разные массы из-за дополнительных или отсутствующих нейтронов в атомном ядре.[5]
-

3
Помните о том, что в периодической таблице приведены средние атомные массы элементов. Как было отмечено ранее, относительные атомные массы, указанные для каждого элемента в периодической системе, являются средними значениями масс всех изотопов атома. Это среднее значение ценно для многих практических целей: к примеру, оно используется при расчете молярной массы молекул, состоящих из нескольких атомов. Однако когда вы имеете дело с отдельными атомами, этого значения, как правило, бывает недостаточно.
- Поскольку средняя атомная масса представляет собой усредненное значение для нескольких изотопов, величина, указанная в таблице Менделеева не является точным значением атомной массы любого единичного атома.
- Атомные массы отдельных атомов необходимо рассчитывать с учетом точного числа протонов и нейтронов в единичном атоме.
Реклама
-

1
Найдите атомный номер данного элемента или его изотопа. Атомный номер – это количество протонов в атомах элемента, оно никогда не изменяется.[6]
Например, все атомы водорода, причем только они, имеют один протон. Атомный номер натрия равен 11, поскольку в его ядре одиннадцать протонов, тогда как атомный номер кислорода составляет восемь, так как в его ядре восемь протонов. Вы можете найти атомный номер любого элемента в периодической таблице Менделеева – практически во всех ее стандартных вариантах этот номер указан над буквенным обозначением химического элемента. Атомный номер всегда является положительным целым числом.- Предположим, нас интересует атом углерода. В атомах углерода всегда шесть протонов, поэтому мы знаем, что его атомный номер равен 6. Кроме того, мы видим, что в периодической системе, в верхней части ячейки с углеродом (C) находится цифра “6”, указывающая на то, что атомный номер углерода равен шести.
- Обратите внимание, что атомный номер элемента не связан однозначно с его относительной атомной массой в периодической системе. Хотя, особенно для элементов в верхней части таблицы, может показаться, что атомная масса элемента вдвое больше его атомного номера, она никогда не рассчитывается умножением атомного номера на два.
-

2
Найдите число нейтронов в ядре. Количество нейтронов может быть различным для разных атомов одного и того же элемента. Когда два атома одного элемента с одинаковым количеством протонов имеют разное количество нейтронов, они являются разными изотопами этого элемента. В отличие от количества протонов, которое никогда не меняется, число нейтронов в атомах определенного элемента может зачастую меняться, поэтому средняя атомная масса элемента записывается в виде десятичной дроби со значением, лежащим между двумя соседними целыми числами.
- Количество нейтронов можно определить по обозначению изотопа элемента. Например, углерод-14 представляет собой радиоактивный изотоп углерода-12, встречающийся в природе. Часто номер изотопа указывается в виде надстрочного числа, стоящего перед символом элемента: 14C. Количество нейтронов находится путем вычитания числа протонов из номера изотопа: 14 – 6 = 8 нейтронов.
- Допустим, что интересующий нас атом углерода имеет шесть нейтронов (12C). Это наиболее распространенный изотоп углерода, насчитывающий около 99% всех атомов данного элемента.[7]
Однако около 1% атомов углерода имеют 7 нейтронов (13C). Другие виды атомов углерода имеют больше 7 или меньше 6 нейтронов и существуют в очень малых количествах.
-

3
Сложите количество протонов и нейтронов. Это и будет атомной массой данного атома. Не обращайте внимания на количество электронов, которые окружают ядро – их суммарная масса чрезвычайно мала, поэтому они практически не влияют на ваши расчеты.
- Наш атом углерода имеет 6 протонов + 6 нейтронов = 12. Таким образом, атомная масса данного атома углерода равна 12. Если бы это был изотоп “углерод-13”, то мы бы знали, что у него есть 6 протонов + 7 нейтронов = атомная масса 13.
- В действительности атомная масса углерода-13 составляет 13,003355[8]
, причем это значение является более точным, поскольку было определено экспериментальным путем. - Атомная масса очень близка к номеру изотопа. Для удобства вычислений номер изотопа часто полагают равным атомной массе. Экспериментально определенные значения атомной массы немного превышают номер изотопа из-за очень малого вклада со стороны электронов.
Реклама
-

1
Определите, какие изотопы содержатся в образце. Химики часто определяют соотношение изотопов в конкретном образце с помощью специального прибора под названием масс-спектрометр. Однако при обучении эти данные будут предоставлены вам в условиях заданий, контрольных и так далее в виде значений, взятых из научной литературы.
- В нашем случае допустим, что мы имеем дело с двумя изотопами: углеродом-12 и углеродом-13.
-

2
Определите относительное содержание каждого изотопа в образце. Для каждого элемента различные изотопы встречаются в разных соотношениях. Эти соотношения почти всегда выражают в процентах. Некоторые изотопы встречаются очень часто, тогда как другие очень редки – временами настолько, что их с трудом можно обнаружить. Эти величины можно определить с помощью масс-спектрометрии или найти в справочнике.
- Допустим, что концентрация углерода-12 равна 99%, а углерода-13 – 1%. Другие изотопы углерода действительно существуют, но в количествах настолько малых, что в данном случае ими можно пренебречь.
-

3
Умножьте атомную массу каждого изотопа на его концентрацию в образце. Умножьте атомную массу каждого изотопа на его процентное содержание (выраженное в виде десятичной дроби). Чтобы перевести проценты в десятичную дробь, просто разделите их на 100. Полученные концентрации в сумме всегда должны давать 1.
- Наш образец содержит углерод-12 и углерод-13. Если углерод-12 составляет 99% образца, а углерод-13 – 1%, то необходимо умножить 12 (атомная масса углерода-12) на 0,99 и 13 (атомная масса углерода-13) на 0,01.
- В справочниках даются процентные соотношения, основанные на известных количествах всех изотопов того или иного элемента. Большинство учебников по химии содержат эту информацию в виде таблицы в конце книги. Для изучаемого образца относительные концентрации изотопов можно также определить с помощью масс-спектрометра.
-

4
Сложите полученные результаты. Просуммируйте результаты умножения, которые вы получили в предыдущем шаге. В результате этой операции вы найдете относительную атомную массу вашего элемента – среднее значение атомных масс изотопов рассматриваемого элемента. Когда рассматривается элемент в целом, а не конкретный изотоп данного элемента, используется именно эта величина.
- В нашем примере 12 x 0,99 = 11,88 для углерода-12, и 13 x 0,01 = 0,13 для углерода-13. Относительная атомная масса в нашем случае составляет 11,88 + 0,13 = 12,01.
Реклама
Советы
- Некоторые изотопы менее стабильны, чем другие: они распадаются на атомы элементов с меньшим количеством протонов и нейтронов в ядре с выделением частиц, входящих в состав атомного ядра. Такие изотопы называют радиоактивными.
Реклама
Что вам понадобится
- Справочник по химии
- Калькулятор
Об этой статье
Эту страницу просматривали 136 503 раза.
Была ли эта статья полезной?
Как определить массу атома
Для того чтобы определить массу атома, найдите молярную массу одноатомного вещества, используя таблицу Менделеева. Затем эту массу поделите на число Авогадро (6,022•10^(23)). Это и будет масса атома, в тех единицах, в которых измерялась молярная масса. Масса атома газа находится через его объем, который легко измерить.

Вам понадобится
- Для определения массы атома вещества возьмите таблицу Менделеева, рулетку или линейку, манометр, термометр.
Инструкция
Определение массы атома твердого тела или жидкости Для определения массы атома вещества, определите его природу (из каких атомов оно состоит). В таблице Менделеева найдите ячейку, в которой описывается соответствующий элемент. Найдите массу одного моля этого вещества в граммах на моль, которая находится в этой ячейке (это число соответствует массе атома в атомных единицах массы). Поделите молярную массу вещества на 6,022•10^(23) (число Авогадро), результатом будет масса атома данного вещества в граммах. Можно определить массу атома и другим способом. Для этого атомную массу вещества в атомных единицах массы взятую в таблице Менделеева умножьте на число 1,66•10^(-24). Получите массу одного атома в граммах.
Определение массы атома газа В том случае, если в сосуде есть газ неизвестной природы, определите его массу в граммах, взвесив пустой сосуд и сосуд с газом, и найдите разность их масс. После этого измерьте объем сосуда с помощью линейки или рулетки, с последующим произведением расчетов или другими методами. Результат выразите в кубических метрах. Манометром измерьте давление газа внутри сосуда в паскалях, и измерьте его температуру термометром. Если шкала термометра проградуирована в градусах Цельсия, определите значение температуры в Кельвинах. Для этого к значению температуры на шкале термометра прибавьте число 273.
Для определения массы молекулы газа массу данного объема газа умножьте на его температуру и число 8,31. Результат поделите на произведение давления газа, его объема и числа Авогадро 6,022•10^(23) (m0=m•8,31•T/(P•V•NА)). Результатом будет масса молекулы газа в граммах. В том случае, если известно, что молекула газа двухатомная (газ не инертный) получившееся число поделите на 2. Помножив результат на 1,66•10^(-24) можно получить его атомную массу в атомных единицах массы, и определить химическую формулу газа.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
В уроке 2 «Относительная атомная масса химических элементов» из курса «Химия для чайников» рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается.

Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.
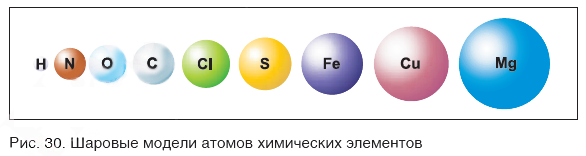
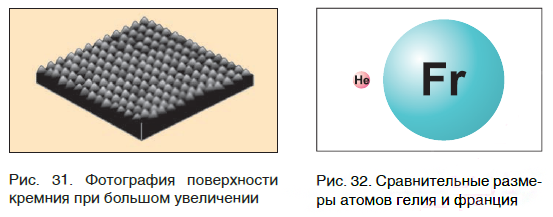
На заметку: В конце XX в. у ученых появились более совершенные микроскопы, позволяющие достигать увеличения в несколько десятков миллионов раз. Они называются туннельными микроскопами. На рисунке 31 показана фотография поверхности кремния. На ней отчетливо видны отдельные атомы, расположенные на поверхности этого вещества.
Размеры и масса атомов
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода. Его масса равна 0,0000000000000000000000000016735 кг. Самым маленьким является атом гелия He. Диаметр этого атома равен приблизительно 0,00000000098 м. Записывать и читать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10−27 кг и 9,8·10−10 м. Атомы большинства химических элементов по своим размерам значительно больше атома гелия. Самый большой из них — атом элемента франция Fr. Его диаметр в 7 раз больше диаметра атома гелия (рис. 32).
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом ma и выражается в единицах массы СИ (кг). Так, например, масса атома углерода равна: ma(С) = 19,94·10−27 кг, а атома кислорода — ma(О) = 26,56·10−27 кг. Масса атома самого тяжелого из существующих на Земле элементов — урана U — почти в 237 раз больше массы атома водорода.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.

В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода (рис. 33). Она получила название атомной единицы массы (а. е. м.). Ее международное обозначение — u (от английского слова «unit» — единица):
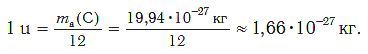
Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10−27 кг.
Относительная атомная масса
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента — это физическая величина, которая показывает, во сколько раз масса атома данного химического элемента больше 1/12 части массы атома углерода.
Относительная атомная масса обозначается символами Ar (А — первая буква английского слова «atomic» —атомный, r — первая буква английского слова «relative», что значит относительный), следовательно:
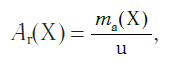
где Х — символ данного элемента.
Например, относительная атомная масса водорода:
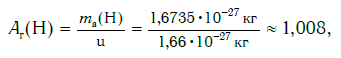
а кислорода:
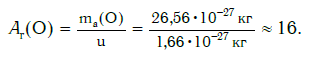
Как видите, относительная атомная масса показывает, во сколько раз масса атома данного элемента больше атомной единицы массы u.
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными до целых значениями этих величин (см. урок 1).
Внимание! Очень часто относительную атомную массу называют просто атомной массой. Однако следует отличать атомную массу — величину относительную (например, Ar(О) = 16) — от массы атома — величины, выражаемой в единицах массы — килограммах (ma(O) = 26,56·10−27 кг) или атомных единицах массы (ma(O) = 16·u).
Пример. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны: Ar(Hg) = 201 и Ar(Ca) = 40.
Масса атома ртути равна: ma(Hg) = Ar(Hg)·u (кг).
Масса атома кальция равна: ma(Са) = Ar(Са)·u (кг).
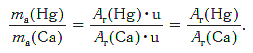
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс. Следовательно, отношение масс атомов ртути и кальция равно:
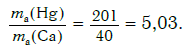
Ответ: в 5,03 раза.
Краткие выводы урока:
- Атомная единица массы представляет собой 1/12 часть массы атома углерода.
- Относительная атомная масса химического элемента равна отношению массы его атома к 1/12 части массы атома углерода.
- Относительная атомная масса химического элемента является величиной безразмерной и показывает, во сколько раз масса атома данного элемента больше атомной единицы массы.
Надеюсь урок 2 «Относительная атомная масса химических элементов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Масса атома обозначается символом
ma
и может выражаться в единицах массы: килограммах или граммах.
Массы атомов малы. Так, масса атома водорода равна
ma(H)=1,67⋅10−24г
, а масса атома углерода —
ma(C)=19,94⋅10−24г
. Использовать такие числа неудобно, поэтому в химии применяется относительная атомная масса
Ar
.
Относительная атомная масса — это отношение массы атома к атомной единице массы.
В качестве атомной единицы массы (а. е. м.) выбрана (1/12) часть массы атома углерода. Эта единица обозначается буквой (u) (от английского «unit» — единица):
.
Относительная атомная масса — безразмерная величина, которая показывает, во сколько раз масса атома больше атомной единицы массы.
Относительные атомные массы химических элементов приведены в Периодической таблице. В расчётах обычно используют их значения, округлённые до целых.
Пример:
в Периодической таблице приведено значение относительной атомной массы магния — (24,305). Округлённое значение — (24). Значение атомной массы углерода — (12,011), а её округлённое значение — (12).
Исключение — относительная атомная масса хлора:
Ar(Cl)=
(35,5).
Значения относительных атомных масс некоторых элементов
| Элемент | H | He | Li | C | N | O | F | Ne | Na | Mg | Al | P | S | Cl | Ar | Ca | Fe | Cu | Zn |
|
Ar |
1 |
4 |
7 |
12 |
14 |
16 |
19 |
20 |
23 |
24 |
27 |
31 |
32 |
35,5 |
40 |
40 |
56 |
64 |
65 |
Относительная молекулярная масса
Mr
— это отношение массы молекулы или формульной единицы к атомной единице массы.
,
Относительная молекулярная масса показывает, во сколько раз масса молекулы или формульной единицы больше атомной единицы массы. Это тоже безразмерная величина. Она равна сумме относительных атомных масс всех химических элементов с учётом индексов в формуле вещества.
Пример:
относительная молекулярная масса углекислого газа:
.
Относительная молекулярная масса фосфата натрия:
.
Относительная молекулярная масса сульфата алюминия:
.
