Ученик
(70),
закрыт
12 лет назад
Валентина Вавилова(Серкова)
Гений
(62183)
12 лет назад
Из формулы молярной массы: М=m0*Na ( m0- масса молекулы, М-молярная масса меди=
=64*10^(-3)кг/моль, Na-постоянная Авогадро=6,02*10^23(1/моль) , выразим массу молекулы.
m0=M / Na.
m0=64*10^(-3) / 6,02*10^23=10,6*10^(-26)кг.
m0=1,06*10^(-25)кг. ( 1,06*10^(-22)грамма).
ХимияПомощь с учебойЗадачи
Аяулым Д.
26 декабря 2019 · 5,0 K
По таблице Менделеева находим мольную массу меди 63,55 кг/кмоль.
Значит в бруске массой 25 кг содержится 25/63,55 = 0,3934 кмоль или 393,4 моль.
1 моль меди имеет массу 63,55 г и содекржит в себе число Авогадро атомов (6,02*10^23). Значит масса 1 молекулы меди равна
63,55/6,02*10^23 = 1,06*10^-22 г.
4,0 K
Комментировать ответ…Комментировать…
Содержание
- Молярная масса меди
- Молярная масса меди
- Примеры решения задач
- Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
- Общая характеристика меди
- История открытия Медь Cuprum
- Медный век
- Изотопы меди
- Молярная масса меди:
- Определение в сложных веществах
- Кратко теория
- Расчёты в смеси
- Инструкция по использованию калькулятора
- Применение в химических задачах
- Атом и молекула меди. Формула меди. Строение атома меди:
Молярная масса меди
Молярная масса меди
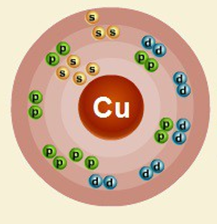
Порядковый номер – 29. Строение атома показано на рис. 1. Металл d-семейства.
Рис. 1. Схема строения атома меди.
В обычных условиях медь представляет собой вещество красного цвета с гранецентрированной кубической решеткой. Характеризуется исключительной пластичностью и превосходит другие металлы по теплопроводности и электрической проводимости. Плотность 8,94 г/см 3 . Температура плавления 1084,5 o C, кипения 2540 o C.
Молярная масса меди равна 63,546 г/моль. Данное значение показывает отношение массы вещества (m) е число моль данного вещества (n), обозначается M и может быть рассчитано по формуле:
Иными словами, молярная масса вещества – это масса 1 моль данного вещества, выраженная в г/моль или ккмоль.
Медь не может существовать в виде газа, только в форме твердого вещества, поэтому для нахождения значения его молярной массы нельзя использовать величину молярного объема или производить расчеты по формуле Менделеева-Клапейрона.
Примеры решения задач
| Задание | Напишите уравнения реакций, с помощью которых можно осуществить следующие реакции: |
Ответ При растворении оксида меди (II) в разбавленной серной кислоте образуются сульфат меди (II) и вода:
Медь из сульфата меди (II) можно получить гидрометаллургическим методом:
При температуре свыше 337 o C медь взаимодействует с кислородом с образованием оксида меди (II):
Оксид меди (II) растворяется в разбавленной азотной кислоте с образованием нитрата меди (II) и воды:
| Задание | В водный раствор хлорида меди (II) опустили медные электроды по 20 г каждый и подключили их к источнику постоянного тока. Через некоторое время катод вынули и растворили при нагревании в концентрированной серной кислоте, а затем добавили в раствор избыток гидроксида натрия, в результате чего выпал осадок массой 49 г. Определите массу анода после электролиза. |
| Решение | Запишем уравнения реакций: |
катод: Cu 2+ +2e→ Cu 0 ; (1)
анод: Cu 0 — 2e→ Cu 2+ . (2)
Рассчитаем количество вещества гидроксида меди (II) (осадка) (молярная масса равна 98г/моль):
n (Cu(OH)2) = 49 / 98 = 0,5 моль.
Определим количество вещества и массу меди (катода) по окончании реакции (молярная масса – 64 г/моль):
mfinal(Cu)= 0,5 × 64 = 32г.
Найдем массу меди, осажденной на катоде:
m(Cu) = 32 – 20 = 12 г.
Вычислим массу анода по окончании реакции. Масса анода уменьшилась ровно настолько, насколько увеличилась масса катода:
Источник
Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
При растворении оксида меди (II) в разбавленной серной кислоте образуются сульфат меди (II) и вода:
Медь из сульфата меди (II) можно получить гидрометаллургическим методом:
При температуре свыше 337 o C медь взаимодействует с кислородом с образованием оксида меди (II):
Оксид меди (II) растворяется в разбавленной азотной кислоте с образованием нитрата меди (II) и воды:
| Решение | Запишем уравнения реакций: |
Рассчитаем количество вещества гидроксида меди (II) (осадка) (молярная масса равна 98г/моль):
Определим количество вещества и массу меди (катода) по окончании реакции (молярная масса – 64 г/моль):
Найдем массу меди, осажденной на катоде:
Вычислим массу анода по окончании реакции. Масса анода уменьшилась ровно настолько, насколько увеличилась масса катода:
Общая характеристика меди
Общее содержание меди в земной коре сравнительно невелико [0,01% (масс.)], однако она чаще чем другие металлы, встречается в самородном состоянии, причем самородки меди достигают значительной величины.
Важнейшими минералами, входящими в состав медных руд, являются: халькозин, или медный блеск Cu2S; халькопирит, или медный колчедан CuFeS2; малахит (CuOH)2CO3.
Чистая медь – тягучий вязкий металл светло-розового цвета (рис. 1), легко прокатываемый в тонкие листы. Она очень хорошо проводит теплоту и электрический ток, уступая в этом отношении только серебру. В сухом воздухе медь почти не изменяется, так как образующаяся на её поверхности тончайшая пленка оксидов (придающая меди боле темный цвет) служит хорошей защитой от дальнейшего окисления. Но в присутствии влаги и диоксида углерода поверхность меди покрывается зеленоватым налетом карбоната гидроксомеди (CuOH)2CO3.
История открытия Медь Cuprum
Открытие элемента Cuprum — один из первых металлов, хорошо освоенных человеком из-за доступности для получения из руды и малой температуры плавления. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Одни из самых древних изделий из меди, а также шлак — свидетельство выплавки её из руд — найдены на территории Турции, при раскопках поселения Чатал-Гююк.
Медный век
значительное распространение получили медные предметы, следует во всемирной истории за каменным веком. Несмотря на мягкость меди, медные орудия труда по сравнению с каменными дают значительный выигрыш в скорости рубки, строгания, сверления и распилки древесины, а на обработку кости затрачивается примерно такое же время, как для каменных орудий.
В древности медь применялась также в виде сплава с оловом — бронзы — для изготовления оружия и т. п., бронзовый век пришёл на смену медному. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. На смену бронзовому веку относительно орудий труда пришёл железный век.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
На Кипре уже в 3 тысячелетии до нашей эры существовали медные рудники и производилась выплавка меди.
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, в Сибири, на Алтае, на территории Украины.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. Много меди шло на изготовление колоколов. Из бронзы были отлиты такие произведения литейного искусства, как Царь-пушка (1586 г.), Царь-колокол (1735 г.), Медный всадник (1782 г.), в Японии была отлита статуя Большого Будды (храм Тодай-дзи) (752 г.).
С открытием электричества в XVIII—XIX вв. большие объёмы меди стали идти на производство проводов и других связанных с ним изделий. И хотя в XX в. провода часто стали делать из алюминия, медь не потеряла значения в электротехнике.
Изотопы меди
Известно, что в природе медь может находиться в виде двух стабильных изотопов 63 Cu (69,1%) и 65 Cu (30,9%). Их массовые числа равны 63 и 65 соответственно. Ядро атома изотопа меди 63 Cu содержит двадцать девять протонов и тридцать четыре нейтрона, а изотоп 65 Cu – столько же протонов и тридцать шесть нейтронов.
Существуют искусственные нестабильные изотопы меди с массовыми числами от 52-х до 80-ти, а также семь изомерных состояний ядер, среди которых наиболее долгоживущим является изотоп 67 Cu с периодом полураспада равным 62 часа.
Молярная масса меди:
Молярная масса – это характеристика вещества, отношение массы вещества к его количеству.
В Международной системе единиц (СИ) единицей измерения молярной массы является килограмм на моль (русское обозначение: кг/моль; международное: kg/mol). Исторически сложилось, что молярную массу, как правило, выражают в г/моль.
Молярная масса численно равна массе одного моля вещества, то есть массе вещества, содержащего число частиц, равное числу Авогадро (NA = 6,022 140 76⋅10 23 моль −1 ).
Молярная масса, выраженная в г/моль, численно совпадает с молекулярной массой (абсолютной молекулярной массой), выраженной в а. е. м., и относительной молекулярной массой.
В свою очередь, молекулярная масса – масса молекулы. Различают абсолютную молекулярную массу (обычно выражается в атомных единицах массы, а. е. м.) и относительную молекулярную массу – безразмерную величину, равную отношению массы молекулы к 1/12 массы атома углерода 12 C.
Молярную массу обозначают M.
Молярная масса меди (M (Cu)) составляет 63,546(3) г/моль.
Необходимо иметь в виду, что молярные массы химических элементов и простых веществ, которые они образуют – не одно и то же. Например, молярная масса кислорода как химического элемента (атома) ≈ 16 г/моль, а вещества (O2) ≈ 32 г/моль.
Определение в сложных веществах
Для простых веществ, состоящих из одного атома, параметр считается так же, как для элемента. Молярная масса углерода всегда равна 12. Этот показатель справедлив и для натрия. Как простое вещество, этот мягкий серебристо-белый металл содержит в себе 23 г/моль, а купрум (так на латинском обозначается медь) — 63,5 г/моль. Газ также может состоять из одного элемента, например, гелий, искомый параметр которого 4 г/моль.
Но существуют и газы, которые образованы двумя молекулами (водород, азот, кислород, хлор, фтор и другие) или тремя (озон). Для них нужно не забывать умножать атомную массу на число молекул. Для сложных веществ параметр можно рассчитать аналогичным образом:
- В H2O содержится два атома водорода и один кислорода, результат считается как 2 * 1 + 16. Итоговое значение молярной массы воды равно 18. Этот параметр для углекислого газа CO2 равен 44 (сумма массы углерода 12 и двух атомов кислорода 32), а для сернистого газа SO2 — 64 г/моль.
- Органическое вещество метан, формула которого CH4, состоит из одного атома углерода и четырёх водорода, следовательно, ему свойственно значение 16. А у этана, содержащего на одну группу CH2 больше, масса равняется 30 г/моль.
- В аммиаке NH3 — 17 г/моль.
- В соляной кислоте HCl содержится 36,5 г/моль (обычно атомную массу хлора считают как 35,5, тогда как для многих других элементов её чаще округляют до целого значения). В хорошо известной калиевой щёлочи KOH — 56 г/моль.
- В натриевой соли серной кислоты Na2SO4, как следует из химической формулы, находится 142 г/моль, а в алюминиевой (Al2 (SO4)3) — 342 г/моль. В азотнокислом серебре AgNO3 — 170 г/моль, в хлориде калия KCl — 74,5 г/моль.
- В молекуле сахара, как в быту называют сахарозу, содержится 12 атомов углерода, 22 водорода и 11 кислорода, а это значит, что его масса равна 342 г/моль. В глюкозе 6, 12 и 6 атомов углерода, водорода и кислорода соответственно, а параметр равен 180 г/моль.
Исходя из этого, формулу молярной массы можно вывести следующим образом: М (XxYy) = М (Хx) + М (Yy) = x * М (Х) + y * М (Y). Таким образом, вычислить этот параметр для любого органического или неорганического вещества совсем несложно.
Главное, иметь под рукой таблицу Менделеева, тогда никакие онлайн-калькуляторы не потребуются.
Кратко теория
(Μ или μ) — масса одного моля вещества в граммах, т.е. сколько весит N = 6,02×10 23 молекул или других частиц (N = NA — число Авогадро). Пример записи: M(H2O) = 18 г/моль
(Относительная) молекулярная масса
(Mr — для молекул и Ar — для атомов) — масса одной молекулы или другой частицы в атомных единицах массы (а.е.м.) или дальтонах (Da). Пример записи: Mr(H2O) = 2×Ar(H) + Ar(O) = 2×1 + 16 = 18 (а.е.м)
1 а.е.м. = mu = 1/12 массы нуклида углерода 12 C = 1,660×10 -24 г, где mu — унифицированная масса При этом mu×NA ≡ 10 -3 Молярная и молекулярная массы численно равны, но имеют разный смысл (и размерность). Масса одной молекулы (в граммах) находится как произведение: mu×Mr = m(молекулы). Тогда связь всех трёх масс
между собой: M = m(молекулы)×NA = mu×Mr×NA.
Расчёты в смеси
Задачу можно усложнить, попробовав посчитать этот показатель в смеси, где в разных пропорциях входят различные соединения. Идеальным примером для этого является воздух. В нем можно выделить следующие составляющие:
- 23% кислорода;
- 76% азота;
- 1% аргона.
Искомый параметр будет вычисляться следующим образом: 0,23*32+0,76*28+0,01*40. Результат равен 29,04 г/моль (можно округлить до 29).
Конечно, в воздухе содержатся и другие вещества (углекислый и инертные газы, водород и т. д. ), но их масса составляет менее десятой процента, поэтому для простоты их допускается не учитывать.
Инструкция по использованию калькулятора
Основные характеристики калькулятора:
- Понимает элементы от H до Uuh
- Поддерживает произвольную вложенность лигандов (квадратных и круглых скобок) — например «гипотетическое» вещество Li2[(H2O)2O(CH4[NH3]2)]3[CoSeMg]2
- Включения (типа кристаллогидратов) можно обозначать через: * × ∙ · ⋅ ∗
Калькулятор пока не поддерживает:
- Обозначения сокращений типа Ph, Met, Ac и тому подобные
- Устанавливаемую точность подсчёта массы (до произвольного десятичного знака)
1. Какую площадь может занять капля оливкового масла объемом 0,02 см3 при расплывании ее на поверхности воды?
2. Определите молярные массы водорода и гелия.
3. Во сколько раз число атомов в углероде массой 12 кг превышает число молекул в кислороде массой 16 кг?
4. Каково количество вещества (в молях), содержащегося в воде массой 1 г?
5. Молярная масса азота равна 0,028 кг/моль. Чему равна масса молекулы азота?
6. Определите число атомов в меди объемом 1 м3. Молярная масса меди М = 0,0635 кг/моль, ее плотность ρ = 9000 кг/м3.
7. Плотность алмаза 3500 кг/м3. Какой объем займут 1022 атомов этого вещества?
8. Под каким давлением находится газ в сосуде, если средний квадрат скорости его молекул v2 = 106 м2/с2, концентрация молекул n = 3 • 1025 м-3, масса каждой молекулы m0 = 5 • 10-26 кг?
9. В колбе объемом 1,2 л содержится 3 •1022 атомов гелия. Чему равна средняя кинетическая энергия каждого атома? Давление газа в колбе 105 Па.
10. Вычислите средний квадрат скорости движения молекул газа, если его масса m = 6 кг, объем V=4,9 м3 и давление р = 200 кПа.
Применение в химических задачах
С этим параметром связано множество других формул. Зная его, можно вычислить количество вещества (n). Для этого нужно разделить его фактическую массу на молярную (n = m / M). Чтобы узнать число частиц в нём (N), полученное значение n нужно умножить на константу Авогадро (N A). Получается 6,02*1023 (N = n * N A) Именно столько структурных единиц содержится в одном моле любого соединения или простого вещества. С другой стороны, зная показатель n, можно найти m по формуле n * M. В итоге получается ещё одна формула: M = m / n.
В учебнике может ждать такая задача: «Найдите массу 0,75 моль азота N2». Начать нужно с нахождения массы одного атома азота. По таблице Менделеева она равняется 14 г. Молекула состоит из двух атомов, следовательно, масса одного моля азота как простого вещества будет иметь значение 28, а масса 0,75 моль — 21 грамм.
Не менее распространена в мире химии физическая величина под названием молярный объём (V m). Её получают как отношение молярной массы к плотности вещества (M /ρ). Размерность этой величины — м3/моль или л/моль (кубический метр или литр на моль). В стандартных условиях для идеального газа её значение принимается за 22,41. Конечно, в реальных условиях наблюдаются отклонения от этого значения, но для решения задач ими можно пренебречь, поскольку они минимальны.
Величину для газа можно найти по формуле M = V m * ρ. Но более правильным будет вычислять её с учётом всех условий по уравнению Менделеева — Клайперона. Оно выглядит следующим образом: p * V = m * R * T / M, где p — давление, V — объём, m — масса, R — константа, равная 8,314, T — температура, M — молярная масса.
Иногда требуется найти параметр для эквивалента (MЭ). Он будет напрямую зависеть от класса соединения и его формулы. Для кислот эквивалентное число (z) соответствует количеству атомов водорода в составе (один для HCl, два для H2SO4, три для H3PO4), для щелочей — групп OH (одна для KOH, две для Ca (OH)2). Для веществ, эквивалент которых равен единице, результат не меняется, для всех остальных МЭ находится как М/ z. Исходя из этого:
- МЭ для HCl равно 36,5 г/моль (один атом водорода), для H2SO4 — 49 г/моль (два атома водорода, следовательно, массу нужно разделить на 2);
- МЭ для KOH равно 51 г/моль, для Ca (OH) 2 — 37 г/моль.
Химия может быть понятной и доступной только для тех, кто последовательно подходит к её изучению и уделяет внимание каждой теме, читая учебники или просматривая видеоуроки. Но старания стоят того, ведь эта наука невероятно важная и интересная, она может дать объяснение составу и строению любого объекта окружающей среды, а на основе этих данных можно узнать практически всё о его свойствах и научиться волшебству превращения одних веществ в другие.
Атом и молекула меди. Формула меди. Строение атома меди:
Медь (лат. Cuprum) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Cu и атомным номером 29. Расположен в 11-й группе (по старой классификации – побочной подгруппе первой группы), четвертом периоде периодической системы.
Медь – металл. Относится к группе переходных металлов. Относится к тяжёлым и цветным металлам.
Как простое вещество медь при нормальных условиях представляет собой пластичный металл золотисто-розового цвета (либо розового цвета при отсутствии оксидной плёнки). Наряду с осмием, цезием и золотом, медь – один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов.
Молекула меди одноатомна.
Химическая формула меди Cu.
Электронная конфигурация атома меди 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 . Потенциал ионизации (первый электрон) атома меди равен 745,48 кДж/моль (7,726380(4) эВ).
Строение атома меди. Атом меди состоит из положительно заряженного ядра (+29), вокруг которого по четырем оболочкам движутся 29 электронов. При этом 28 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку медь расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома меди – на s-орбитали находится один неспаренный электрон. В свою очередь ядро атома меди состоит из 29 протонов и 35 нейтронов.
Радиус атома меди (вычисленный) составляет 145 пм.
Атомная масса атома меди составляет 63,546(3) а. е. м.
Медь с давних пор широко используется человеком.
Источник
Найдите правильный ответ на вопрос ✅ «В 1 грамме меди находится примерно 10 22 молекул меди. Определите среднюю массу одной молекулы меди в кг …» по предмету 📘 Физика, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Главная » Физика » В 1 грамме меди находится примерно 10 22 молекул меди. Определите среднюю массу одной молекулы меди в кг
- Формула: CuO4S или CuSO4
- Относительная молекулярная масса CuO4S: 159.6086
- Молярная масса CuO4S: 159.6086 г/моль (0.15961 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| Cu (медь) | 1 | 63.546 | 63.546 |
| O (кислород) | 4 | 15.9994 | 63.9976 |
| S (сера) | 1 | 32.065 | 32.065 |
| 159.6086 |
Расчёт молярной и относительной молекулярной массы CuO4S
- Mr[CuO4S] = Ar[Cu] + Ar[O] * 4 + Ar[S] = 63.546 + 15.9994 * 4 + 32.065 = 159.6086
- Молярная масса (в кг/моль) = Mr[CuO4S] : 1000 = 159.6086 : 1000 = 0.15961 кг/моль
Расчёт массовых долей элементов в CuO4S
- Массовая доля меди (Cu) = 63.546 : 159.6086 * 100 = 39.814 %
- Массовая доля кислорода (O) = 63.9976 : 159.6086 * 100 = 40.097 %
- Массовая доля серы (S) = 32.065 : 159.6086 * 100 = 20.09 %