Как найти массу осадка в растворе
Вещества, образующиеся в ходе химической реакции, отличаются друг от друга по многим свойствам, в том числе растворимости. Продуктами реакции могут быть и хорошо растворимые вещества, и малорастворимые, и даже практически нерастворимые, типа хлористого серебра. В последнем случае вещество тут же выпадает в осадок. Иногда возникает необходимость вычислить его массу.

Инструкция
Первый и самый естественный путь: взвесить этот осадок. Разумеется, сначала его необходимо извлечь из раствора и высушить. Делается это путем фильтрования. Можно использовать обычную стеклянную воронку с бумажным фильтром. Если же хочется быстрее отфильтровать осадок, и добиться более полного извлечения его из раствора, лучше использовать воронку Бюхнера.
После того как осадок отделен от жидкости, его надо тщательно высушить (при использовании воронки Бюхнера, осадок уже получается достаточно сухим, поэтому процесс сушки займет немного времени), и взвесить. Разумеется, чем более точные весы у нас будут, тем более точный ответ вы получите.
Можно ли решить задачу, не прибегая к фильтрованию, сушке и взвешиванию? Конечно, можно. Вам надо лишь написать точное уравнение химической реакции и знать количество исходных веществ. Например, при взаимодействии 10 грамм хлористого натрия и 4 грамма азотнокислого серебра образовался белый осадок хлорида серебра. Требуется вычислить его массу. Напишите уравнение реакции: NaCl + AgNO3 = NaNO3 + AgCl
Подсчитайте молярные массы исходных веществ. 23 + 35,5 = 58,5 грамм/моль – молярная масса хлористого натрия, 10/58,5 = 0,171 моль – такое его количество было перед реакцией. 108 + 14 + 48 = 170 грамм/моль – молярная масса азотнокислого серебра, 4/170 = 0,024 моля – такое количество этой соли было перед реакцией.
Вы видите, что хлористый натрий находится в большом избытке. Из этого следует, что прореагировало все азотнокислое серебро (все 4 грамма), связав также 0,024 моля хлористого натрия. Так сколько же в итоге образовалось хлористого серебра? Посчитайте его молярную массу. 108 + 35,5 = 143,5 грамм/моль. Теперь произведем вычисления: 4 * 143,5 / 170 = 3,376 грамм хлористого серебра. Или, считая округленно, 3,38 грамм. Задача решена.
Видео по теме
Полезный совет
Если не требуется большая точность, можно производить округление результатов подсчета, молекулярных масс и т.п.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Концентрация раствора 0,2 моль/литр Na2Cr2O7 и 0,5 моль/л H2SO4. Затрачено 50 мл = 0,05 литра. Т.е. было взято 0,01 моль Na2Cr2O7 и 0,025 моль H2SO4. Согласно уравнению, это соответствует 0,03 молям MHSO3. Молярная масса MHSO3 = 3,12/0,03 = 104. Вычитаем массу фрагмента HSO3 из 104, получаем 23. Металл – натрий.
2Na2Cr2O7 + 6NaHSO3 + 5H2SO4 = 2Cr2(SO4)3 + 5Na2SO4 + 8H2O
С использованием арифметики уровня начальной школы, находим массу остатка.
Проблема еще в том, что сульфат натрия образует гидрат Na2SO4·10H2O, а сульфат хрома – гидраты вплоть до Cr2(SO4)3·12H2O. Остается гадать, что ожидали авторы задачи при выпаривании раствора. Возможно – безводные соли.
-
1
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 450 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов). Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Несколько миллионов. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества. Обозначается как M
Есть еще молекулярная масса — Mr
Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 гмоль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=mM
n=V22.4 (лмоль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (лмоль)
или вот еще удобная табличка:
Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
В ОГЭ и ЕГЭ по химии задач , в которых нужно было бы найти только объем массу кол-во моль нет — это обычно ЧАСТЬ решения задачи. Однако, чтобы легко решать более сложные задачи, нужно тренироваться на таких вот небольших упражнениях.
Находим количество вещества по массе
1 Какое количество вещества алюминия содержится в образце металла массой 10.8 г?2 Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
3 Определите количество моль брома, содержащееся в массе 12.8 г.
Находим массу по количеству вещества:
4. Определите массу карбоната натрия количеством вещества 0.25 моль.Объем по количеству вещества:
5. Какой объем будет иметь азот при н.у., если его количество вещества 1.34 моль?6. Какой объем занимают при н.у. 2 моль любого газа?
Ответы:/p>
- 0.4 моль
- 0.15 моль
- 0.08 моль
- 26.5 г
- 30 л
- 44.8 л
Категории:
|
Обсуждение: “Основные формулы для решения задач по химии”
(Правила комментирования)
Задачи на частичное разложение — это задачи, в которых исходное вещество распадается только частично, то есть часть исходного вещества остается. При разложении твердого вещества может образоваться новый твердый продукт, но также остается часть исходного реагента, который не разложился. Это необходимо учитывать при составлении химических реакций.
По сути, это одна из разновидностей задач на материальный баланс.
Рассмотрим несколько примеров решения задач на частичное разложение из реальных ЕГЭ по химии.
1. При нагревании образца нитрата алюминия часть вещества разложилась. При этом выделилось 10,08 л (в пересчёте на н.у.) смеси газов. Для полного растворения образовавшегося твёрдого остатка необходимо затратить 60 г 40%-ного раствора гидроксида натрия. При этом образовался тетрагидроксоалюминат натрия. Определите массу исходного образца нитрата алюминия.
Решение:
Реакция разложения нитрата алюминия:
4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
Из условия известно, что распалась только часть исходного вещества.
Количество вещества смеси газов:
nсм = V/Vm = 10,08 л/22,4 л/моль = 0,45 моль
Примем количество образовавшегося кислорода за х моль:
n(О2) = x моль
тогда количество вещества оксида азота (IV) равно 4х моль:
n(NО2) = 4x моль
Получаем уравнение:
х + 4х = 0,45
5х = 0,45
х = 0,09 моль
Количество образовавшегося оксида алюминия:
n(Al2О3) = 0,06 моль
Количество и масса разложившегося нитрата алюминия:
nразлож(Al(NО3)3) = 0,12 моль
mразлож(Al(NО3)3) = n·M = 0,12 моль · 213 г/моль = 25,56 г
С гидроксидом натрия реагирует и образовавшийся оксид алюминия, и остаток нитрата алюминия:
Al(NO3)3 + 4NaOH = Na[Al(OH)4] + 3NaNO3
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Определим массу и количество вещества гидроксида натрия:
m(NaOH) = ω(NaOH)·mр-ра(NaOH) = 0,40 ·60 г = 24 г
n(NaOH) = m(NaOH)/M(NaOH) = 24 г/40 г/моль = 0,6 моль
Определим количество гидроксида натрия, который потребуется для растворения оксида алюминия во второй реакции:
n2(NaOH) = 2n(Al2О3) = 2·0,06 моль = 0,12 моль
Тогда в первой реакции будет израсходовано:
n1(NaOH) = n(NaOH) – n2(NaOH) = 0,6 моль – 0,12 моль = 0,48 моль
Количество неразложившегося нитрата алюминия, который затем растворится в щелочи в первой реакции:
nнеразлож.(Al(NО3)3) = 1/4·n1(NaOH) = 1/4·0,48 моль = 0,12 моль
Масса этого неразложившегося нитрата алюминия:
mнеразлож.(Al(NО3)3) = nнеразлож.(Al(NО3)3)·M = 0,12 моль·213 г/моль = 25,56 г.
Масса исходного нитрата алюминия:
m(Al(NО3)3) = mразлож.(Al(NО3)3) + mнеразлож.(Al(NО3)3) = 25,56 г + 25,56 г = 51,12 г
Ответ: m(Al(NO3)3) = 51,12 г
2. При нагревании карбоната магния часть вещества разложилась. При этом выделилось 5,6 л газа и образовалось 18,4 г твёрдого остатка. Остаток растворили в 365 г соляной кислоты, при этом массовая доля кислоты в конечном растворе составила 2,9%. Вычислите массовую долю соляной кислоты в исходном растворе.
MgCO3 = MgO + CO2
MgCO3 + 2HCl = MgCl2 + CO2 + H2O
MgO + 2HCl = MgCl2 + H2O
Ответ: w(HCl) = 10%
3. При нагревании хлората калия (KClO3) в присутствии катализатора часть вещества разложилась. При этом выделилось 6,72 л (н.у.) газа и образовался твёрдый остаток массой 16 г. К остатку добавили 170 г 30%-ного раствора нитрата серебра. Определите массовую долю нитрата серебра в полученном растворе. (KClO3 и AgClO3 растворимы в воде.)
2KClO3 = 2KCl + 3O2
KCl + AgNO3 = AgCl + KNO3
Ответ: w(AgNO3) = 10,8%
4. При нагревании образца нитрата магния часть вещества разложилась. При этом выделилось 10,08 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 69,36 г. К этому остатку последовательно добавили 100 мл воды и 240 г 20%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в образовавшемся растворе.
2Mg(NO3)2 = 2MgO + 4NO2 + O2
Mg(NO3)2 + 2NaOH = Mg(OH)2 + 2NaNO3
Ответ: w(NaOH) = 3,8%
5. При нагревании образца нитрата меди(II) часть вещества разложилась. При этом образовался твёрдый остаток массой 50,8 г. К остатку добавили 150 г 20%-ного раствора гидроксида натрия. При этом образовался раствор с массой 159 г и массовой долей гидроксида натрия 13,84%. Определите объём смеси газов (в пересчёте на н.у.), выделившихся в результате частичного разложения нитрата меди(II).
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
Ответ: V(смеси газов) = 22,4 л
6. При нагревании образца нитрата серебра часть вещества разложилась. При этом образовался твёрдый остаток массой 88 г. К этому остатку добавили 200 г 20%-ного раствора соляной кислоты. При этом образовался раствор массой 205,3 г с массовой долей соляной кислоты 15,93%. Определите объём смеси газов (в пересчёте на н.у.), выделившихся в результате частичного разложения нитрата серебра.
2AgNO3 = 2Ag + 2NO2 + O2
AgNO3 + HCl = AgCl + HNO3
Ответ: V(смеси газов) = 16,8 л
7. При нагревании образца карбоната бария часть вещества разложилась. При этом выделилось 1,12 л (н.у.) газа. Масса твёрдого остатка составила 27,35 г. Этот остаток добавили к 73 г 30%-ного раствора соляной кислоты. Определите массовую долю кислоты в полученном растворе.
BaCO3 = BaO + CO2
BaCO3 + 2HCl = BaCl2 + CO2 + H2O
BaO + 2HCl = BaCl2 + H2O
Ответ: w(HCl) = 11,4%
8. При нагревании образца нитрата цинка часть вещества разложилась. При этом выделилось 5,6 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 64,8 г. Остаток полностью растворили в минимальном объёме 28%-ного раствора гидроксида натрия. Определите массовую долю нитрата натрия в полученном растворе.
2Zn(NO3)2 = 2ZnO + 4NO2 + O2
Zn(NO3)2 + 4NaOH = Na2[Zn(OH)4] + 2NaNO3
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Ответ: w(NaNO3) = 19,26%
9. При нагревании образца нитрата серебра часть вещества разложилась. При этом выделилось 6,72 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 25 г. К этому остатку последовательно добавили 50 мл воды и 18,25 г 20%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе.
2AgNO3 = 2Ag + 2NO2 + O2
AgNO3 + HCl = AgCl + HNO3
Ответ: w(HCl) = 4,2%
10. При нагревании образца нитрата меди(II) массой 94 г часть вещества разложилась. При этом выделилось 11,2 л (в пересчёте на н.у.) смеси газов. К полученному твёрдому остатку добавили 292 г 10%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе.
2Cu(NO3)2 = 2CuO + 4NO2 + O2
CuO + 2HCl = CuCl2 + H2O
Ответ: w(HCl) = 4%
11. При нагревании образца нитрата магния часть вещества разложилась. При этом образовался твёрдый остаток массой 15,4 г. Этот остаток прореагировал с 20 г 20%-ного раствора гидроксида натрия. Определите массу исходного образца нитрата магния и объём смеси газов (в пересчёте на н.у.), выделившихся при частичном разложении нитрата магния.
2Mg(NO3)2 = 2MgO + 4NO2 + O2
Mg(NO3)2 + 2NaOH = Mg(OH)2 + 2NaNO3
Ответ: m(Mg(NO3)2) = 37 г, V(смеси газов) = 11,2 л
12. При нагревании образца карбоната бария часть вещества разложилась, при этом выделилось 4,48 л (н.у.) газа. К образовавшемуся твёрдому остатку последовательно добавили 100 мл воды и 200 г 20%-ного раствора сульфата натрия. Вычислите массовую долю гидроксида натрия в полученном растворе.
BaCO3 = BaO + CO2
BaO + H2O = Ba(OH)2
Ba(OH)2 + Na2SO4 = BaSO4 + 2NaOH
Ответ: w(NaOH) = 5,6%
13. Оксид меди(II) массой 16 г нагрели в присутствии водорода объёмом 3,36 л (н.у.). При этом водород прореагировал полностью. Полученный твёрдый остаток растворили в 535,5 г 20%-ного раствора азотной кислоты, при этом наблюдали выделение бесцветного газа. Определите массовую долю азотной кислоты в образовавшемся растворе.
CuO + H2 = Cu + H2O
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
CuO + 2HNO3 = Cu(NO3)2 + H2O
Ответ: w(HNO3) = 13,84%
14. При нагревании образца нитрата железа(III) часть вещества разложилась. При этом образовалось 88,6 г твёрдого остатка. Этот остаток может прореагировать с 225 г 16%-ного раствора гидроксида натрия. Определите массу исходного образца нитрата железа(III) и объём выделившейся смеси газов (в пересчёте на н.у.).
4Fe(NO3)3 = 2Fe2O3 + 12NO2 + 3O2
Fe(NO3)3 + 3NaOH = Fe(OH)3 + 3NaNO3
Ответ: m(Fe(NO3)3) = 121 г, V(смеси газов) = 16,8 л
15. При нагревании образца гидрокарбоната натрия часть вещества разложилась. При этом выделилось 0,448 л (н.у.) углекислого газа и образовалось 4,64 г твёрдого безводного остатка. Остаток добавили к 0,15%-ному раствору гидроксида кальция. При этом в полученном растворе не осталось ионов кальция и карбонат-анионов. Определите массовую долю гидроксида натрия в конечном растворе.
2NaHCO3 = Na2CO3 + CO2 + H2O
NaHCO3 + Ca(OH)2 = CaCO3 + H2O + NaOH
Na2CO3 + Ca(OH)2 = CaCO3 + 2NaOH
Ответ: w(NaOH) = 0,11%
16. При нагревании образца карбоната кальция часть вещества разложилась. При этом выделилось 4,48 л (н.у.) углекислого газа. Масса твёрдого остатка составила 41,2 г. Этот остаток добавили к 465,5 г раствора соляной кислоты, взятой в избытке. Определите массовую долю соли в полученном растворе.
CaCO3 = CaO + CO2
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
CaO + 2HCl = CaCl2 + H2O
Ответ: w(CaCl2) = 11,2%
17. При нагревании образца нитрата магния массой 44,4 г часть вещества разложилась. При этом выделилось 13,44 л (в пересчёте на н.у.) смеси газов. К полученному твёрдому остатку добавили 124,1 г 20%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе.
2Mg(NO3)2 = 2MgO + 4NO2 + O2
MgO + 2HCl = MgCl2 + H2O
Ответ: w(HCl) = 5,1%
18. При нагревании образца нитрата меди(II) часть вещества разложилась. При этом выделилось 5,6 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 26,8 г. К этому остатку последовательно добавили 50 мл воды и 10%-ный раствор гидроксида натрия в количестве, необходимом для полного осаждения ионов меди. Определите массовую долю нитрата натрия в образовавшемся растворе.
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
Ответ: w(NaNO3) = 12,2%
19. При нагревании образца нитрата меди(II) часть вещества разложилась. При этом выделилось 2,8 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 32,2 г. К этому остатку последовательно добавили 50 мл воды и 160 г 10%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в образовавшемся растворе.
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
Ответ: w(NaOH) = 1,8%
20. При нагревании образца нитрата алюминия часть вещества разложилась. При этом выделилось 6,72 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 25,38 г. Остаток полностью растворили в необходимом для реакции минимальном объёме 24%-ного раствора гидроксида натрия. При этом образовался тетрагидроксоалюминат натрия. Определите массовую долю нитрата натрия в полученном растворе.
4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
Al(NO3)3 + 4NaOH = Na[Al(OH)4] + 3NaNO3
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Ответ: w(NaNO3) = 24,2%
21. При нагревании образца гидрокарбоната натрия часть вещества разложилась. При этом выделилось 4,48 л (н.у.) газа и образовалось 63,2 г твёрдого безводного остатка. К полученному остатку добавили минимальный объём 20%-ного раствора соляной кислоты, необходимый для полного выделения углекислого газа. Определите массовую долю хлорида натрия в конечном растворе.
2NaHCO3 = Na2CO3 + CO2 + H2O
NaHCO3 + HCl = NaCl + CO2 + H2O
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
Ответ: w(NaCl) = 26,8%
22. При нагревании образца нитрата магния часть вещества разложилась. При этом образовался твёрдый остаток массой 53,6 г. К остатку добавили 200 г 24%-ного раствора гидроксида натрия. При этом образовался раствор с массой 206,4 г и массовой долей гидроксида натрия 15,5%. Определите объём смеси газов (в пересчёте на н.у.), выделившихся в результате частичного разложения нитрата магния.
2Mg(NO3)2 = 2MgO + 4NO2 + O2
Mg(NO3)2 + 2NaOH = Mg(OH)2 + 2NaNO3
Ответ: V(смеси газов) = 33,6 л
23. При нагревании образца карбоната бария часть вещества разложилась. При этом выделилось 4,48 л (н.у.) газа и образовалось 50 г твёрдого остатка. К остатку последовательно добавили 100 мл воды и 200 г 20%-ного раствора сульфата натрия. Вычислите массовую долю гидроксида натрия в полученном растворе.
BaCO3 = BaO + CO2
BaO + H2O = Ba(OH)2
Ba(OH)2 + Na2SO4 = BaSO4 + 2NaOH
Ответ: w(NaOH) = 5,6%
25. При нагревании образца нитрата железа(III) часть вещества разложилась. В результате образовался твёрдый остаток, который разделили на две части. Первую часть массой 58 г обработали 267 г 20%-ного раствора гидроксида натрия. При этом массовая доля щёлочи в растворе уменьшилась вдвое. Вторую часть массой 29 г растворили в 126 г 10%-ного раствора азотной кислоты. Вычислите массовую долю соли в образовавшемся растворе.
4Fe(NO3)3 = 2Fe2O3 + 12NO2 + 3O2
Fe(NO3)3 + 3NaOH = Fe(OH)3 + 3NaNO3
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
Ответ: w(Fe(NO3)3) = 25%
26. При нагревании образца нитрата меди(II) часть вещества разложилась. В результате образовался твёрдый остаток, который разделили на две части. Первую часть массой 59 г обработали 127,5 г 25,1%-ного раствора гидроксида натрия. При этом образовался раствор с массовой долей щёлочи 8%. Вторую часть массой 23,6 г растворили в 245 г 10%-ного раствора серной кислоты. Вычислите массовую долю кислоты в образовавшемся растворе
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
CuO + H2SO4 = CuSO4 + H2O
Ответ: w(H2SO4) = 6,9%
27. При нагревании образца нитрата цинка часть вещества разложилась. В результате образовался твёрдый остаток, который разделили на две части. Первую часть массой 27 г обработали 87,2 г 20%-ного раствора сульфида натрия. При этом массовая доля сульфида натрия в растворе уменьшилась вдвое. Вторую часть массой 81 г добавили к 202,5 г 40%-ного раствора бромоводородной кислоты. Вычислите массовую долю бромоводородной кислоты в образовавшемся растворе.
2Zn(NO3)2 = 2ZnO + 4NO2 + O2
Zn(NO3)2 + Na2S = ZnS + 2NaNO3
ZnO + 2HBr = ZnBr2 + H2O
Ответ: w(HBr) = 11,4%
28. При нагревании образца нитрата алюминия часть вещества разложилась. В результате образовался твёрдый остаток, который разделили на две части. Первую часть массой 73,2 г добавили к 663,6 г 15%-ного раствора карбоната натрия. При этом массовая доля соды в растворе уменьшилась в полтора раза. Вторую часть массой 24,4 г растворили при нагревании в 245 г 20%-ного раствора серной кислоты. Вычислите массовую долю кислоты в образовавшемся растворе.
4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
2Al(NO3)3 + 3Na2CO3 + 3H2O = 2Al(OH)3 + 3CO2 + 6NaNO3
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
Ответ: w(H2SO4) = 7,3%
29. При нагревании образца карбоната кальция часть вещества разложилась. При этом масса карбоната кальция в образовавшемся твёрдом остатке оказалась в 1,4 раза больше массы оксида кальция. Остаток добавили к 640 г 25%-ной соляной кислоты. В результате массовая доля кислоты в растворе уменьшилась вдвое. Вычислите объём газа (в пересчёте на н.у.), выделившегося в результате частичного разложения карбоната кальция.
CaCO3 = CaO + CO2
CaO + 2HCl = CaCl2 + H2O
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
Ответ: V(CO2) = 12,544 л
ЗАДАЧИ на Вычисление массы
растворенного вещества
Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе. Элемент ЕГЭ: 4.3.1. Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе».
Расчёты с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
Раствор — это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности. Растворы состоят из растворителя (например, воды) и растворенного вещества.
Массовой долей растворенного вещества (ω) называют отношение его массы m(В) к массе раствора m(p).
ω(В) = m(В) : m(p)
Это безразмерная величина, поэтому выражается в долях единицы (изменяется от 0 до 1), но иногда выражается в процентах (тогда изменяется от 0 до 100 %).
Обозначение ω(В) аналогично обозначению ω(р. в-ва) или ω(в-ва);
обозначение m(В) аналогично обозначению m(р. в-ва) или m(в-ва);
обозначение m(р) аналогично обозначению m(р-ра),
где р-ра – сокращение слова «раствора», а р. в-ва и в-ва – сокращения слов «растворенного вещества».
Обратите внимание также на следующие обозначения:
m(в) — масса безводного вещества;
m(р-ля) — масса растворителя.
Соотношения между величинами, характеризующими раствор
Следует учитывать, что любой способ выражения содержания растворенного вещества в растворе дается в расчете на безводное вещество, даже если для приготовления раствора использован кристаллогидрат. Если для приготовления растворов используют не безводное вещество, а его кристаллогидрат, B • nH20, то масса растворителя (воды) рассчитывается по формуле: m(H20) = m(р) – m(кр.), где m(кр.) — масса кристаллогидрата, в граммах. Следует учитывать, что количество (моль) кристаллогидрата равно количеству (моль) безводного вещества, т.е. m(кр.) : М(кр.) = m(в) : М(в).
Молярная концентрация характеризует количество растворенного вещества, выраженное, в молях, содержащееся в 1 л раствора. Молярная концентрация вычисляется по формуле С = v / V, где С — молярная концентрация (измеряется в моль/л), v — количество вещества, V — объем раствора, измеренный в литрах. Часто размерность молярной концентрации обозначают символом М. Например, раствор с концентрацией 1 М (одномолярный раствор) содержит 1 моль растворенного вещества в 1л раствора, 0,1 М (децимолярный раствор) — 0,1 моль растворенного вещества в 1 л раствора и т. д.
Титр (Т) определяет массу растворенного вещества (в г), содержащуюся в 1 мл раствора: T = m / V.
Растворимость характеризует способность вещества растворяться в том или ином растворителе. Растворимость обозначается символом S, она равна концентрации насыщенного при данной температуре раствора. Чаще всего растворимость измеряют числом граммов вещества, способных раствориться в 100 г растворителя при данной температуре. Важно не путать растворимость с массовой долей вещества в растворе, так как растворимость показывает, сколько граммов растворенного вещества содержится в 100 г растворителя, а массовая доля — сколько граммов растворенного вещества содержится в 100 г раствора. Растворимость веществ зависит от температуры. Растворимость твердых веществ при повышении температуры, как правило, увеличивается, растворимость газов — уменьшается.
Приготовление растворов. Способы приготовления растворов: 1) Разбавление раствора водой; 2) Выпаривание воды из раствора; 3) Сливание двух растворов; 4) Выпадение кристаллов.
Способы приготовления растворов в задачах на Вычисление массы растворенного вещества
РЕШЕНИЯ ЗАДАЧ с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
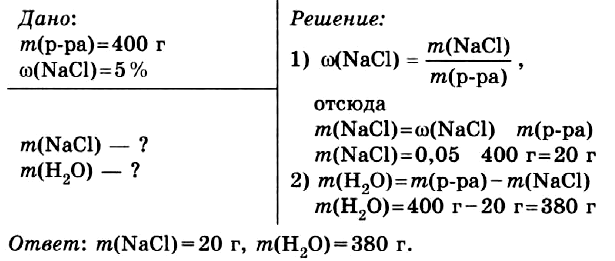
Задача № 1.
Приготовить 400 г водного раствора с массовой долей хлорида натрия в нём 5 %.
Правильный ОТВЕТ: m(NaCl) = 20 г, m(H2O) = 380 г.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 2.
Найти массовую долю растворённого вещества (в %) в растворе, полученном при смешивании 450 г воды и 50 г сахара.
Правильный ОТВЕТ: ω(сах.) = 10%.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 3.
Вычислите молярную концентрацию 4%-ного раствора поваренной соли, плотность которого равна 1,027 г/мл.
Правильный ОТВЕТ: C(NaCl) ≈ 0,7 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 4.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 5.
При 25 °С растворимость хлорида калия в воде составляет 25 г соли на 100 г воды. Вычислите массовую долю соли в насыщенном растворе и его молярную концентрацию, если плотность насыщенного раствора равна 1,132 г/мл.
Правильный ОТВЕТ: ω(KCl) = 20%, С(KCl) = 3,04 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради
Задача № 6.
Массовая доля соли в растворе, насыщенном при температуре 40 °С, равна 35%. При охлаждении 300 г этого раствора до температуры 10 °С в осадок выпадает 45 г соли. Определите растворимость соли при 10 °С.
Правильный ОТВЕТ: S10°С = 30,77 г.
Смотреть РЕШЕНИЯ заданий в тетради
Задачи с ответами
на Вычисление массы растворенного вещества
Задача № 7.
Масса нитрата калия, которую следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%, равна ______. (Записывайте ответ с точностью до десятых.)
Правильный ОТВЕТ: 3,4 г.
Задача № 8.
Плотность 10% -ного раствора хлорида калия составляет 1,063 г/мл. Определите массу (г) хлорида калия, который содержится в 750 мл такого раствора.
Правильный ОТВЕТ: 75,0 г.
Задача № 9.
Рассчитайте массовую долю (%) нитрата натрия в растворе, полученном при смешивании 250 г 10%-ного и 750 г 15%-ного растворов этой соли.
Правильный ОТВЕТ: 13,75 %.
Задача № 10.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Задача № 11.
В 125 г воды растворили 25 г азотной кислоты. Вычислите титр образовавшегося раствора, если его плотность равна 1,095 г/мл.
Правильный ОТВЕТ: T(HNO3) = 0,182 г/мл.
Задача № 12.
Титр раствора сульфата аммония равен 0,223 г/мл, а его плотность — 1,115 г/мл. Рассчитайте массовую долю сульфата аммония в данном растворе и молярную концентрацию раствора.
Правильный ОТВЕТ: ω((NH4)2SO4) = 20%, C((NH4)2SO4) = 1,689 моль/л.
(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «ЗАДАЧИ на Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии