поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,651 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,896 -
разное
16,900
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
| Радон | |
|---|---|
| Бесцветный, слегка флюоресцирующий радиоактивный газ | |
| Название, символ, номер | Радон / Radon (Rn), 86 |
| Атомная масса (молярная масса) |
222,0176 (наиболее стабильный изотоп) а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 4f14 5d10 6s2 6p6 |
| Радиус атома | 214 пм |
| Ковалентный радиус | 140—150 пм |
| Степени окисления | +2, +4, +6, +8 |
| Энергия ионизации (первый электрон) |
1036,5 (10,74) кДж/моль (эВ) |
| Плотность (при н. у.) | (газ, при 0 °C) 9,81 кг/м3 (жидк., при −62 °C) 4,4 г/см³ |
| Температура плавления | 202 K (−71,15 °C) |
| Температура кипения | 211,4 K (−61,75 °C) |
| Уд. теплота плавления | 2,7 кДж/моль |
| Уд. теплота испарения | 18,1 кДж/моль |
| Молярная теплоёмкость | 20,79 Дж/(K·моль) |
| Структура решётки | кубическая гранецентрированая |
| Теплопроводность | (300 K) (газ, при 0 °C) 0,0036 Вт/(м·К) |
| Номер CAS | 10043-92-2 |
Радон — элемент 18-й группы периодической системы химических элементов Д. И. Менделеева (по старой классификации — главной подгруппы 8-й группы), 6-го периода, с атомным номером 86. Обозначается символом Rn (лат. Radon). Простое вещество радон при нормальных условиях — бесцветный инертный газ; радиоактивен, стабильных изотопов не имеет, может представлять опасность для здоровья и жизни. При комнатной температуре является одним из самых тяжёлых газов. Наиболее стабильный изотоп (222Rn) имеет период полураспада 3,8 суток.
Содержание
- 1 История открытия и происхождение названия
- 2 Нахождение в природе
- 3 Получение
- 4 Физические свойства
- 5 Химические свойства
- 6 Применение
- 6.1 История
- 6.2 Радиационный фон помещений
- 7 Биологическое воздействие
- 8 Тестирование и снижение уровня радона
- 9 Изотопы
История открытия и происхождение названия
В 1899 году Пьер и Мария Кюри обнаружили, что газ, находившийся в контакте с радием, остаётся радиоактивным в течение месяца. Эрнест Резерфорд и Роберт Оуэнс позже в том же году отметили, что радиоактивность препаратов тория колеблется со временем. Позже Резерфорд объяснил это тем, что торий испускает, кроме α-частиц, и некое неизвестное ранее вещество, так что воздух вокруг препаратов тория постепенно становится радиоактивным. Это вещество он предложил назвать эмана́цией (от лат. emanatio «истечение») тория и дать ему символ Em. Последующие наблюдения Резерфорда в 1901 году показали, что и препараты радия также испускают некую эманацию, которая обладает радиоактивными свойствами и ведёт себя как инертный газ, однако он в этой работе отметил приоритет супругов Кюри в открытии эманации. В 1903 году французский химик Андре-Луи Дебьерн обнаружил короткоживущую эманацию актиния.
Первоначально эманацию тория называли торо́ном, эманацию радия — радо́ном, актиния — актино́ном. Было доказано, что все эманации на самом деле представляют собой радионуклиды нового элемента — инертного газа, которому отвечает атомный номер 86. Впервые его выделили в чистом виде и измерили его плотность Уильям Рамзай и Роберт Уитлоу-Грей в 1908 году, они же предложили назвать газ нитон (от лат. nitens, светящийся). В 1923 году газ получил окончательное название радон, и символ Em был сменён на Rn.
В публичной лекции 1936 года Резерфорд кратко изложил итоги их работ:
Я помогал ему [профессору по электротехнике Оуэнсу в университете МакГилл в г. Монреале в Канаде с декабря 1898 года по 26 мая 1899 года] в проведении экспериментов, и мы обнаружили некоторые очень странные явления. Оказалось, что радиоактивное воздействие окиси тория может проходить сквозь дюжину листков бумаги, положенных поверх этой окиси, но задерживается тончайшей пластинкой слюды, как будто излучается что-то, способное диффундировать сквозь поры бумаги. Тот факт, что прибор был очень чувствителен к движению воздуха, поддерживал эту диффузионную гипотезу. Затем мы провели эксперименты, в которых воздух проходил над окисью тория, а потом попадал в ионизационную камеру. Эти опыты показали, что активность может переноситься воздухом. Однако, когда поток воздуха прекращался, активность в ионизационной камере не сразу исчезала, а уменьшалась постепенно по экспоненциальному закону. Я назвал это газообразное вещество, которое может диффундировать сквозь бумагу, переноситься воздухом и в течение некоторого времени сохранять свою активность, исчезающую по характерному закону, «эманацией тория».
Я установил, что эта эманация обладает чрезвычайно своеобразным свойством делать радиоактивными тела, над которыми она проходит. Казалось, что это свойство, скорее всего, обусловлено осаждением некой материальной субстанции, а не какой-либо активностью, возникшей в самих телах под действием излучения, так как тогда количество осаждённого вещества должно увеличиваться при приложении электрического поля. В те времена многие получали неповторяющиеся и странные результаты, помещая предметы вблизи радиоактивных веществ. По-видимому, всё это могло объясняться наличием таких же эманаций, как обнаруженная нами у тория.
Прежде чем считать такое объяснение правильным, необходимо было выяснить истинную природу эманации. Это было очень трудно, так как доступное количество её всегда было очень мало.
Заслуга открытия радона как химического элемента часто приписывается также немецкому химику Фридриху Дорну. Вопросы приоритета в открытии радона рассматриваются в работе Джеймса и Вирджинии Маршалл, где показано, что первооткрывателем радона как химического элемента следует считать Резерфорда.
В 1900 году Дорн открыл изотоп радона 222Rn с периодом полураспада 3,823 дня и опубликовал статью об этом, сославшись на более раннюю работу Резерфорда. Резерфорд, сперва с Оуэнсом, а затем один в 1899 году работал с другим изотопом 220Rn (тороном), период полураспада которого около 55,6 секунды. Резерфорд не знал о работах немца, так как тот опубликовал свою работу в немецком журнале с небольшим тиражом. Резерфорд не знал немецкого. Дорн совершенно не интересовался радиоактивностью. И только в 1902 году Резерфорд и Содди экспериментально доказали, что эманация — это изотоп радона. Они сумели её охладить и превратить в жидкость с помощью новой физической установки в университете МакГилл и опубликовали статьи.
Нахождение в природе
Входит в состав радиоактивных рядов 238U, 235U и 232Th. Ядра радона постоянно возникают в природе при радиоактивном распаде материнских ядер. Равновесное содержание в земной коре 7⋅10–16% по массе. Ввиду химической инертности радон относительно легко покидает кристаллическую решётку «родительского» минерала и попадает в подземные воды, природные газы и воздух. Поскольку наиболее долгоживущим из четырёх природных изотопов радона (218, 219, 220, 222) является 222Rn, именно его содержание в этих средах максимально.
Концентрация радона в воздухе зависит, в первую очередь, от геологической обстановки (так, граниты, в которых много урана, являются активными источниками радона, в то же время над поверхностью морей радона мало), а также от погоды (во время дождя микротрещины, по которым радон поступает из почвы, заполняются водой; снежный покров также препятствует доступу радона в воздух).
Перед землетрясениями наблюдается повышение концентрации радона в воздухе, благодаря сейсмической активности. Выход радона из земли в это время называется эксхаляцией
Получение
Для получения радона через водный раствор любой соли радия-226 продувают воздух, который уносит с собой радон-222, образующийся при радиоактивном распаде радия-226. Далее воздух тщательно фильтруют для отделения микрокапель раствора, содержащего соль радия, которые могут быть захвачены током воздуха. Для получения собственно радона из смеси газов удаляют химически активные вещества (кислород, водород, водяные пары и т. д.), остаток конденсируют жидким азотом, затем из конденсата отгоняют азот и инертные газы (аргон, неон и т. д.).
В одном грамме радия-226 возникает за сутки около 0,1 мм3 радона-222.
Физические свойства
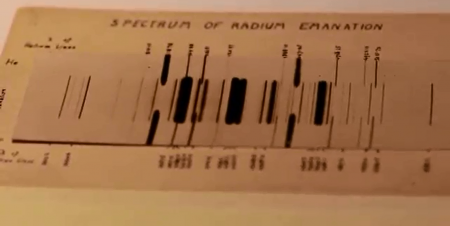
Эмиссионный спектр радона, сфотографированный Э. Резерфордом в 1908 году. Числа на краях спектра представляют собой длины волн. Средний спектр принадлежит радону, внешние спектры — гелию (добавлены для калибровки длин волн)
Радон — радиоактивный одноатомный тяжёлый газ без цвета и запаха. Растворимость в воде при комнатной температуре составляет 460 мл/л, что выше, чем растворимость более лёгких инертных газов. В органических растворителях и в жировой ткани человека растворимость радона в десятки раз выше, чем в воде. Газ хорошо просачивается сквозь полимерные плёнки. Легко адсорбируется активированным углём и силикагелем.
Собственная радиоактивность радона вызывает его флюоресценцию. Газообразный и жидкий радон флюоресцирует голубым светом, у твёрдого радона при охлаждении до азотных температур цвет флюоресценции становится сперва жёлтым, затем — красно-оранжевым.
Цвет свечения в газовом разряде у радона — синий, так как в видимой части спектра радона особо выделяются 8 линий, отвечающих длинам волн от 3982 до 5085 Å (от 398,2 нм до 508,5 нм) и лежащих главным образом в синей части спектра, однако из-за отсутствия стабильных изотопов применение его в газосветных приборах невозможно.
Плотность радона при нормальных условиях составляет 9,73 кг/м3, что примерно в 7,6 раз больше плотности воздуха.
Химические свойства
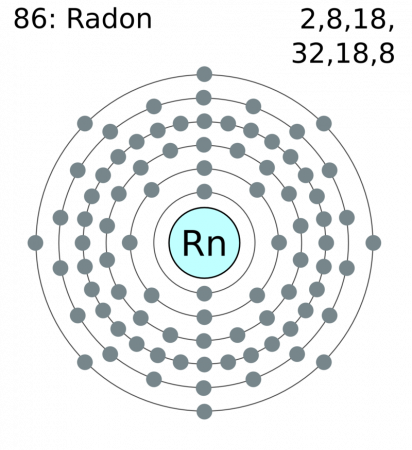
схема электронных оболочек радона
В химическом отношении радон является наиболее активным из благородных газов, так как его электроны внешних электронных оболочек имеют относительную низкую энергию ионизации.
Радон образует химические соединения с фтором. Так, дифторид радона RnF2 является белым нелетучим кристаллическим веществом.
Фториды радона могут быть получены также под действием сильных фторирующих агентов (например, фторидов галогенов: ClF3, BrF5, IF7).
Получены также соединения с катионом RnF+: RnF[SbF6], RnF[Sb2F11].
Кроме фтора, радон может образовывать бинарные соединения с кислородом; в частности, был получен триоксид радона, однако получение других оксидов радона не подтверждено.
Кроме того, радон может входить в состав различных клатратов, которые, хотя и имеют постоянный стехиометрический состав, не образуют химических связей с участием атомов радона.
Применение
Радон используют в медицине для приготовления радоновых ванн. Радон используется в сельском хозяйстве для активации кормов домашних животных, в металлургии в качестве индикатора при определении скорости газовых потоков в доменных печах, газопроводах. В геологии измерение содержания радона в воздухе и воде применяется для поиска месторождений урана и тория, а также активных тектонических разломов, на наличие которых может указывать повышенное содержание радона в приземном и подпочвенном воздухе; в гидрогеологии — для исследования взаимодействия грунтовых и речных вод.
Динамика концентрации радона в подземных водах может применяться для прогноза землетрясений.
История
Открытие радиоактивности и радона совпало с повышением интереса к биологическим эффектам радиации. Было установлено, что вода многих источников минеральных вод богата эманацией радия (так именовался радон в то время). Вслед за этим открытием последовала волна моды «на радиацию». В частности, в рекламе того времени радиоактивность минеральных вод выдавалась за главный показатель их полезности и эффективности.
Радиационный фон помещений
Радиационный фон помещений зданий (РФП) — излучение земного и космического происхождения, постоянно воздействующее на человека при его нахождении в пространстве внутри здания. РФП формируется, как естественный и технологически измененный радиационный фон; обычно причиной возникновения радиационного фона в зданиях является активность трех основных естественных долгоживущих радионуклидов: радий-226, торий-232 и калий-40, а также техногенного цезия-137 в строительных материалах и активность в воздухе короткоживущих изотопов (Т1/2<10 сут) радия и крайне редко тория. Основные составляющие радиационного фона помещений в значительной степени зависят от деятельности человека. Это вызвано, прежде всего, такими факторами, как выбор площадки для строительства, радиационных характеристик строительных материалов, конструктивных решений зданий и применяемых в них систем вентиляции. Измерения не всегда подтверждают сложившийся вывод о том, что в подвальных помещениях и на нижних этажах зданий радон скапливается в больших концентрациях, чем на верхних. Безопасной средней по площади здания плотность потока радона на поверхности грунта считается менее 80 мБк/м2с для жилых зданий и 40 мБк/м2с для малоэтажных коттеджей.
Биологическое воздействие
Радон радиотоксичен и канцерогенен. Попадая в организм человека, он способствует процессам, приводящим к раку лёгкого. Распад ядер радона и его дочерних изотопов в лёгочной ткани вызывает микроожог, поскольку вся энергия альфа-частиц поглощается практически в точке распада. Особенно опасно (повышает риск заболевания) сочетание воздействия радона и курения. По данным департамента здравоохранения США радон — второй по частоте (после курения) фактор, вызывающий рак лёгких преимущественно бронхогенного (центрального) типа. Рак лёгких, вызванный радоновым облучением, является шестой по частоте причиной смерти от рака.
Радон и его дочерние продукты обусловливают более половины всей эффективной дозы облучения, которую в среднем получает организм человека от природных и техногенных радионуклидов окружающей среды.
В настоящее время во многих странах проведен мониторинг концентрации радона в зданиях как первый этап оптимизации защиты населения.
МКРЗ установила референтный уровень объемной активности радона в жилище на уровне 300 Бк/куб.м.
Тестирование и снижение уровня радона

Цифровой измеритель уровня радона
Существуют достаточно простые тесты, позволяющие измерить уровень радона. В некоторых странах такие тесты методически проводятся в местах, где систематически наблюдаются угрозы. Устройства для измерения уровня радона имеются в продаже. Цифровые устройства для измерения радона позволяют проводить текущие измерения, производящие ежедневные, еженедельные, краткосрочные и долгосрочные отчеты с помощью цифрового дисплея. Устройства для краткосрочного первоначального тестирования уровня радона недороги, и в некоторых случаях бесплатны. Существуют строгие правила проведения краткосрочных тестов, и их соблюдение крайне важно. Комплект для измерения уровня радона включает в себя коллектор, который необходимо повесить на нижнем этаже жилого дома на период от 2х до 7 дней. Далее пользователю необходимо отправить коллектор в лабораторию для анализа. Также доступны приборы для долгосрочного (на срок до одного года) измерения уровня радона. Есть возможность измерения количества выделяемого из земли радона до начала строительства. Концентрация радона может меняться ежедневно, поэтому необходимы долгосрочные измерения средней концентрации радона в помещениях, где человек проводит значительную часть времени.
Концентрация радона подвержена естественным колебаниям из-за таких факторов, как смена погодных условий, поэтому первоначальный тест может дать неточный результат относительно средней концентрации радона. Уровень радона в воздухе максимален в наиболее холодной части дня, когда перепады давления наиболее велики. Поэтому при обнаружении высокой концентрации радона (более 4 pCi/L) оправдано проведение повторных измерений перед осуществлением более дорогостоящих мероприятий по борьбе с выделением газа. Показания в промежутке от 4 до 10 pCi/L являются показанием к проведению долгосрочного теста. Показания выше 10 pCi/L требуют только дополнительного краткосрочного теста, дабы избежать чрезмерного промедления в борьбе с выделением газа. Покупателям недвижимости рекомендуется отложить или отказаться от покупки, если продавец не смог снизить уровень радона до 4 pCi/L или менее.
Поскольку период полураспада радона составляет всего 3,8 дней, удаление или изоляция источника значительно снижает угрозу в течение нескольких недель. Также можно снизить концентрацию радона с помощью изменения вентилирования сооружения. Концентрация радона, как правило, снижается при вентиляции помещения. В хорошо проветриваемых помещениях концентрация радона имеет тенденцию выравниваться до уровня улицы (обычно 10 Бк/м3, в пределах от 1 до 100 Бк/м3).
Есть четыре основных способа снизить концентрацию радона в домах:
- Разгерметизация (всасывание почвы) за счет увеличения вентилирования между этажами
- Улучшение вентиляции помещения и предотвращение проникновения радона из подвальных помещений в жилые помещения
- Установка системы для удаления радона из подвальных помещений
- Установка систем вентиляции с положительным давлением
Согласно EPA, для уменьшения концентрации радона в первую очередь используются система труб дефлектора и вентилятор, высасывающие радон из-под дома наружу. Концентрация радона в помещении, как правило, может быть уменьшена с помощью разгерметизации и перенаправления загрязненного радоном воздуха в открытое пространство, вдалеке от окон и строительных отверстий. EPA рекомендует использовать методы, препятствующие проникновения радона в помещение. Всасывание почвы, например, предотвращает появление радона в доме, потому что радон из-под дома выпускается наружу через трубы, где он разбавляется. EPA не рекомендует использовать герметизацию без других мер, поскольку использование такого метода не приводит к значительным и последовательным снижениям уровня радона.
Система вентиляции с положительным давлением может быть объединена с теплообменником для восстановления энергии в процессе воздухообмена с воздухом извне, поскольку исключительно выведение воздуха наружу может быть недостаточным решением, так как это может привести к всасыванию воздуха в жилище. В дома, построенные над погребами, можно установить листы пластика, покрывающие пустое пространство – это будет барьером для радона. Вентиляционная труба и вентилятор используются для выведения радона из-под пласта пластика на открытый воздух. Этот способ выведения радона называется “подмембранное всасывание”, и при правильном применении оно является самым эффективным способом выведения радона в домах с погребным помещением.
Изотопы
Основная статья: Изотопы радона
Радон не имеет стабильных изотопов. Наиболее устойчив 222Rn (T1/2=3,8235 суток), входящий в природное радиоактивное семейство урана-238 (семейство урана-радия) и являющийся непосредственным продуктом распада радия-226. Иногда название «радон» относят именно к этому изотопу. В семейство тория-232 входит 220Rn (T1/2=55,6 с), иногда его называют торон (Tn). В семейство урана-235 (урана-актиния) входит 219Rn (T1/2=3,96 с), его называют актинон (An). В одну из побочных ветвей (коэффициент ветвления 2⋅10−7) семейства урана-радия входит также очень короткоживущий (T1/2=35 мс) радон-218. Все отмеченные изотопы радона испытывают альфа-распад. Этими четырьмя нуклидами исчерпывается список природных изотопов радона. Известны ещё 30 искусственных изотопов Rn с массовым числом от 195 до 228. Некоторые нейтронодефицитные изотопы радона имеют также возбуждённые метастабильные состояния; таких состояний известно 13. Преобладающие моды распада у лёгких изотопов Rn — альфа-распад, позитронный распад и электронный захват. Начиная с массового числа A=212 альфа-распад становится доминирующим. Тяжёлые изотопы радона (начиная с A=223) распадаются преимущественно посредством бета-минус-распада.
|
Периодическая система химических элементов Д. И. Менделеева |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
[06.03.2014 18:57]
Решение 4862:
Номер задачи на нашем сайте: 4862
ГДЗ из решебника:
Тема:
Глава 8. Физика атомного ядра и элементарных частиц.
§ 41. Радиоактивность.
Нашли ошибку? Сообщите в комментариях (внизу страницы)
|
Раздел: Физика Полное условие: 41.22. Определить массу m2 радона 222Rn, находящегося в радиоактивном равновесии с радием 226Ra массой m1= 1 г.Решение, ответ задачи 4862 из ГДЗ и решебников: Этот учебный материал представлен 1 способом:
|
||
| Счетчики: 4470 | Добавил: Admin |
| Всего комментариев: 2 | |
|
Порядок вывода комментариев: у меня есть решение этой задачи в Ворде. Ответ: если вас не затруднит, можете залить на любой файловый хостинг (например ,файлы mail), и дать ссылку на файл? Будем благодарны за предоставленный материал
+1 Благодарим за предоставленное решение пользователя нашего сайта andrejhorunzhij
|
|
| Добавить комментарий
Добавлять комментарии могут только зарегистрированные пользователи. [ Регистрация | Вход ] |
More information from the unit converter
How many grams radon in 1 mol?
The answer is 222.
We assume you are converting between grams radon and mole.
You can view more details on each measurement unit:
molecular weight of radon or
mol
The molecular formula for radon is Rn.
The SI base unit for amount of substance is the mole.
1 grams radon is equal to 0.0045045045045045 mole.
Note that rounding errors may occur, so always check the results.
Use this page to learn how to convert between grams radon and mole.
Type in your own numbers in the form to convert the units!
Quick conversion chart of grams radon to mol
1 grams radon to mol = 0.0045 mol
10 grams radon to mol = 0.04505 mol
50 grams radon to mol = 0.22523 mol
100 grams radon to mol = 0.45045 mol
200 grams radon to mol = 0.9009 mol
500 grams radon to mol = 2.25225 mol
1000 grams radon to mol = 4.5045 mol
Want other units?
You can do the reverse unit conversion from
moles radon to grams, or enter other units to convert below:
Common amount of substance conversions
Details on molecular weight calculations
In chemistry, the formula weight is a quantity computed by multiplying the atomic weight (in atomic mass units) of each element in a chemical formula by the number of atoms of that element present in the formula, then adding all of these products together.
Using the chemical formula of the compound and the periodic table of elements, we can add up the atomic weights and calculate molecular weight of the substance.
If the formula used in calculating molar mass is the molecular formula, the formula weight computed is the molecular weight. The percentage by weight of any atom or group of atoms in a compound can be computed by dividing the total weight of the atom (or group of atoms) in the formula by the formula weight and multiplying by 100.
The atomic weights used on this site come from NIST, the National Institute of Standards and Technology. We use the most common isotopes. This is how to calculate molar mass (average molecular weight), which is based on isotropically weighted averages. This is not the same as molecular mass, which is the mass of a single molecule of well-defined isotopes. For bulk stoichiometric calculations, we are usually determining molar mass, which may also be called standard atomic weight or average atomic mass.
Finding molar mass starts with units of grams per mole (g/mol). When calculating molecular weight of a chemical compound, it tells us how many grams are in one mole of that substance. The formula weight is simply the weight in atomic mass units of all the atoms in a given formula.
A common request on this site is to convert grams to moles. To complete this calculation, you have to know what substance you are trying to convert. The reason is that the molar mass of the substance affects the conversion. This site explains how to find molar mass.
Formula weights are especially useful in determining the relative weights of reagents and products in a chemical reaction. These relative weights computed from the chemical equation are sometimes called equation weights.
Metric conversions and more
ConvertUnits.com provides an online
conversion calculator for all types of measurement units.
You can find metric conversion tables for SI units, as well
as English units, currency, and other data. Type in unit
symbols, abbreviations, or full names for units of length,
area, mass, pressure, and other types. Examples include mm,
inch, 100 kg, US fluid ounce, 6’3″, 10 stone 4, cubic cm,
metres squared, grams, moles, feet per second, and many more!
← Молярная и молекулярная масса
- Относительная молекулярная масса Rn: 222.0176
- Молярная масса Rn: 222.0176 г/моль (0.22202 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| Rn (родон) | 1 | 222.0176 | 222.0176 |
| 222.0176 |
Расчёт молярной и относительной молекулярной массы Rn
- Mr[Rn] = Ar[Rn] = 222.0176 = 222.0176
- Молярная масса (в кг/моль) = Mr[Rn] : 1000 = 222.0176 : 1000 = 0.22202 кг/моль
Электронная конфигурация атома родона
Калькулятор массы
Химическая формула соединения
Рассчитать
![]()
Поделитесь информацией с друзьями
![]()
Скачать перечень калькуляторов
Относительные молекулярные массы других соединений
BaO3S [217.3902]
BrCu [143.45]
Калькулятор молекулярной массы


 Для просмотра в натуральную величину нажмите на картинку
Для просмотра в натуральную величину нажмите на картинку
