Анастасия
24 апреля, 10:15
-

Геруся
24 апреля, 11:54
0
M=1,25 г/см*54 см = 67,5 г
0,35=m (р. в.) / 67,5
m (р. в.) = 23,625 = m (H2SO4)
- Комментировать
- Жалоба
- Ссылка
Найди верный ответ на вопрос ✅ «Рассчитайте массу H2SO4 в растворе серной кислоты объемом 54 см с плотностью 1,25 г/см и массовой долей 35 %. …» по предмету 📙 Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
Главная » Химия » Рассчитайте массу H2SO4 в растворе серной кислоты объемом 54 см с плотностью 1,25 г/см и массовой долей 35 %.
Нахождение объема раствора серной кислоты через молярную концентрацию
Какой объем 96-процентного раствора серной кислоты (H2SO4) плотностью 1,84 г/мл потребуется для приготовления 3 литров раствора с концентрацией 2 моль/л?
Решение задачи
Найдем сколько серной кислоты (H2SO4) (в г) потребуется для приготовления 3 л раствора с молярной концентрацией 2 моль/л. Для расчета будем использовать формулу нахождения молярной концентрации раствора:
![]()
где:
CM – молярная концентрация раствора;
n – химическое количество растворенного вещества;
M – молярная масса растворенного вещества;
m – масса растворенного вещества;
V – объем раствора.
Напомню, что под молярной концентрацией понимают количество (число моль) данного вещества, содержащегося в единице объема раствора. Молярную концентрацию выражают в моль/л или используют сокращение «M».
Из вышеуказанной формулы выразим и рассчитаем массу растворенного вещества:
![]()
Учитывая, что молярная масса серной кислоты (H2SO4) равна 98 г/моль, получаем:
m (H2SO4) = 2 моль/л ∙ 98 г/моль ∙ 3 л = 588 (г).
Используя формулу нахождения массовой доли растворенного вещества:
![]()
выразим массу раствора серной кислоты (H2SO4):
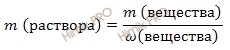
Получаем:
m (раствора H2SO4) = 588 г/ 0,96 = 612,5 (г).
Если раствор 96-процентный, то массовая доля серной кислоты (H2SO4) в нем 0,96.
Вычислим объем раствора серной кислоты (H2SO4), который потребуется для приготовления 3 л раствора с молярной концентрацией 2 моль/л. Будем использовать формулу, устанавливающую связь между объемом и массой раствора:
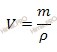
Получаем:
V (раствора H2SO4) = 612,5 г /1,84 г/мл = 332,88 (мл).
Ответ: объем раствора серной кислоты равен 332,88 мл.
Решение задач по химии на приготовление раствора определенной нормальности
Задача 421.
Сколько миллилитров 96%-ного (по массе) раствора H2SO4 (р = 1,84 г/мл) нужно взять для приготовления 1л 0,25 н. раствора?
Решение:
Определим молярную массу эквивалента H2SO4 из соотношения:

где
MЭ(В) – молярная масса эквивалента соли, г/моль; М(В) – молярная масса соли; n – коэффициент при атоме металла; A – валентность металла.
Отсюда
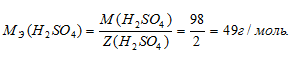
Рассчитаем массу H2SO4 в 1л 0,25 н раствора по формуле:
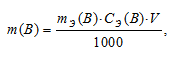
где
m(B) – масса вещества; mЭ(В) – молярная масса эквивалента вещества, г; СЭ(В) – эквива-лентная концентрация или нормальность; V – объём раствора.
Отсюда
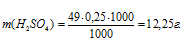
Теперь рассчитаем массу раствора, если известны массовая доля H2SO4 (96%) и масса H2SO4 (12,25 г) по формуле:

где
w(%) – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
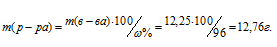
Определим объём раствора H2SO4, необходимого для приготовления 1 л 0,25 н раствора по формуле: m = pV, где p – плотность раствора, V – объём раствора.
Тогда
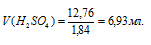
Ответ: 6,93 мл.
Задача 422.
Сколько миллилитров 0,5 М раствора H2SO4 можно приготовить из 15 мл 2,5 М раствора?
Решение:
Для нахождения массы серной кислоты, содержащейся в 15 мл 2,5 М раствора, можно определить по формуле:
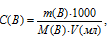
где
С(В) – молярная концентрация вещества (В), m(B) – масса растворённого вещества (В), М(В) – молярная масса вещества (В), V – объём раствора.
Тогда
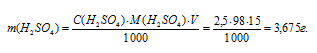
По этому же уравнению рассчитаем объём раствора, который можно приготовить из 3,675 г H2SO4:
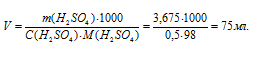
Ответ: 75мл.
Задача 423.
Какой объем 0,1 М раствора H3PO4 можно приготовить из 75 мл 0,75 н. раствора?
Решение:
Для решения задачи используем формулы:
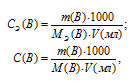
где
СЭ(В) – молярная концентрация эквивалента вещества (В);
С(В) – молярная концентрация вещества (В);
МЭ(В) – молярная масса эквивалента вещества (В);
M(B) – молярная масса вещества (В);
m(B) – масса растворённого вещества (В);
V(мл) – объём раствора.
Определим молярную массу эквивалента H3PO4 из соотношения:
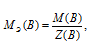
МЭ(В) – молярная масса эквивалента кислоты, г/моль; М(В) – молярная масса кислоты; Z(В) – эквивалентное число; Z(кислоты) равно числу ионов H+ в H3PO4 → 3.
Отсюда
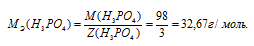
Рассчитаем массу ортофосфорной кислоты:
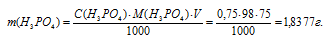
Определим объём раствора H3PO4, необходимого для приготовления раствора:
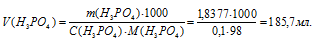
Ответ: 185,7мл.
Задача 424.
Какой объем 6,0М раствора НСI нужно взять для приготовления 25 мл 2,5М раствора НСI?
Решение:
Для нахождения массы соляной кислоты, содержащейся в 25 мл 2,5 М раствора, а также объёма 6,0 М раствора можно использовать формулу:
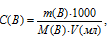
С(В) – молярная концентрация вещества (В);
M(B) – молярная масса вещества (В);
m(B) – масса растворённого вещества (В);
V(мл) – объём раствора.
Тогда
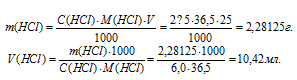
Ответ: 10,42мл.
Задача 425.
Плотность 40%-ного (по массе) раствора HNO3 равна 1,2 5г/мл. Рассчитать молярность и моляльность этого раствора.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора.
Массу HNO3, содержащуюся в 1 литре раствора, рассчитаем по формуле:

где
 – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
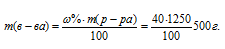
Молярную концентрацию раствора (CM) получим делением числа граммов HNO3 в 1 л раствора на молярную массу HCl (36,5 г/моль):
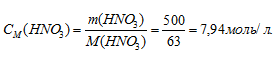
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000 г растворителя.
Находим, сколько граммов HNO3 приходится на 1000 г воды, составив пропорцию:
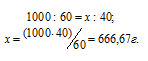
Теперь рассчитаем моляльность раствора:
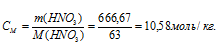
Ответ: 7,94 моль/л; 10б=,58 моль/л.
Задача 426.
Вычислить массовую долю гидроксида натрия в 9,28 н. растворе NaOН (р = 1,310г/мл).
Решение:
Найдём массу NaOН, содержащуюся в 1000 мл раствора из пропорции:
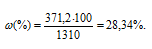
Масса 1 литра раствора NaOН (р = 1,310 г/мл) равна 1310 г (1000 . 1,310 = 1310).
Массовую долю гидроксида натрия вычислим по формуле:

где
 – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
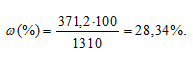
Ответ: 28,34%.
