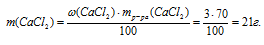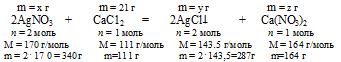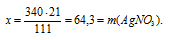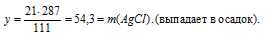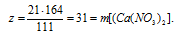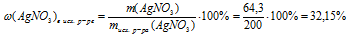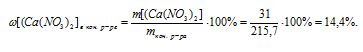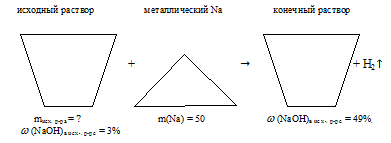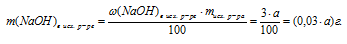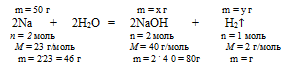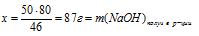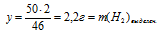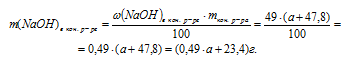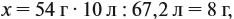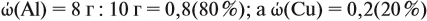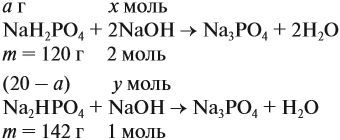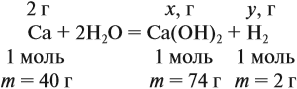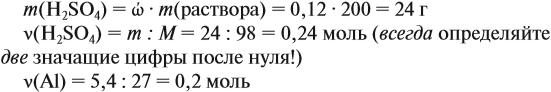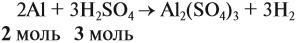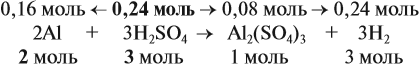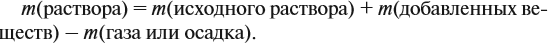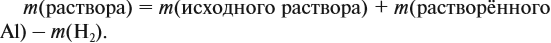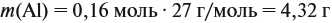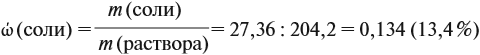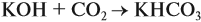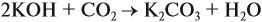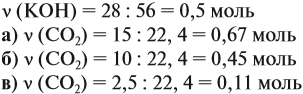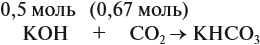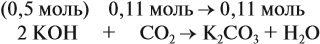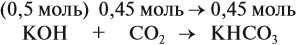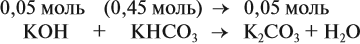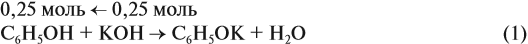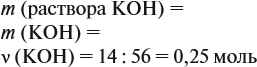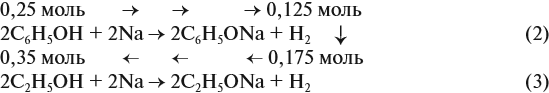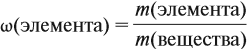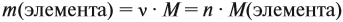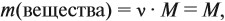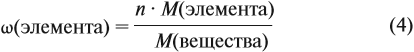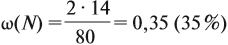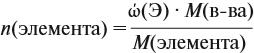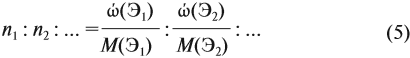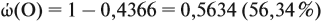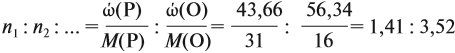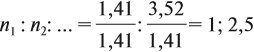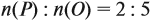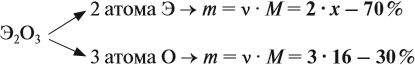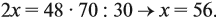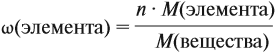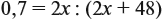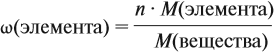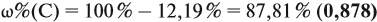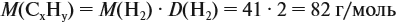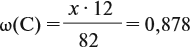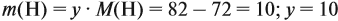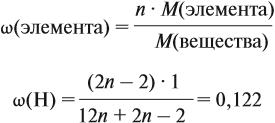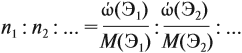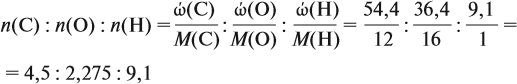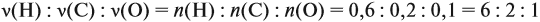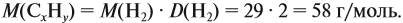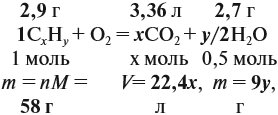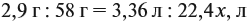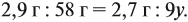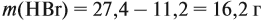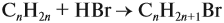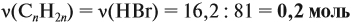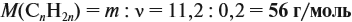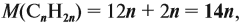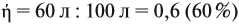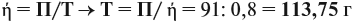ЭКЗАМЕНЫ НЕ ЗА ГОРАМИ
Подготовка к ЕГЭ по химии
Выполнение заданий высокого уровня сложности
Задачи с расчетами по уравнениям
реакций,
происходящих в растворах
При обучении школьников способам решения задач
очень большое значение придаю применению
алгоритмов. Я считаю, что вначале нужно уверенно
овладеть небольшим числом стандартных приемов,
получить представление о возможных типах задач.
Это позволит ученику выйти на творческий уровень
в своем дальнейшем химическом образовании и
самообразовании.
Одно из заданий высокого уровня сложности (оно
входит в третью часть экзаменационной
работы – задание С4) проверяет умение
производить расчеты по уравнениям реакций,
происходящих в растворах.
В учебной литературе недостаточно подробно
объясняются особенности решения таких задач.
Поэтому мы с учениками вначале разбираем все
моменты, на которые нужно обратить внимание,
записываем алгоритмы в общем виде, рассматриваем
решение задач каждого типа, затем отрабатываем
умения на самостоятельном решении целого ряда
подобных задач.
Прежде всего ученик должен усвоить понятие о
массовой доле растворенного вещества, или, иначе,
процентной концентрации раствора. Эта величина
показывает отношение массы растворенного
вещества к массе раствора:
р.в-во
= mр.в-во / mр-р.
Производные формулы:
mр.в-во = mр-р•р.в-во,
mр-р = mр.в-во / р.в-во.
Если в условии задачи указан объем раствора с
определенной плотностью, то прежде всего находят
массу раствора:
mр-р = Vр-р•р-р,
затем – массу растворенного вещества:
mр.в-во = mр-р•р.в-во.
Количество вещества находят по массе
растворенного вещества:
= mр.в-во
/ М.
Рассмотрим некоторые типы задач с расчетами по
уравнениям реакций, происходящих в растворах.
• Нахождение массовых долей веществ в
растворе после реакции.
При решении таких задач прежде всего нужно
найти количества вещества реагентов. Если задача
на избыток и недостаток, то количества вещества
продуктов реакции находят по веществу, которое
дано в недостатке.
Один из важных моментов – это нахождение
массы раствора после реакции (массы
полученного раствора, mр-р получ). Если
какое-либо вещество взаимодействует с веществом,
находящимся в растворе, то складывают массу
вещества и массу раствора; в случае, когда оба
реагирующих вещества даны в виде растворов,
складывают массы двух растворов. Если в
результате реакции образуется осадок или газ, то
из полученной суммы вычитают массу вещества,
ушедшего из раствора в виде осадка или газа:
mр-р получ = mв-во + mр-р –
mосадок (газ),
mр-р получ = mр-р1 + m
р-р2 – mосадок (газ).
При решении задач на избыток и недостаток нужно
помнить о том, что в растворе после реакции будет
находиться в растворенном виде не только продукт
реакции, но и вещество, которое было дано в
избытке.
Чтобы найти количество вещества, которое не
прореагировало – избытка, нужно от исходного
количества вещества отнять количество
прореагировавшего вещества:
изб
= исх –
прор.
Затем найти его массу и массовую долю в
растворе, полученном после реакции.
Задача 1. 4,8 г магния растворили в 200 мл
12%-го раствора серной кислоты ( = 1,05 г/мл). Найти массовую долю
соли в полученном растворе.
| Дано:
m(Mg) = 4,8 г, Vр-р(H2SO4) = 200 мл,
|
Найти: |
Р е ш е н и е
(Мg) = m / M
= 4,8 (г) / 24 (г/моль) = 0,2 моль.
mр-р(H2SO4) = Vр-р• = 200 (мл)•1,05 (г/мл) = 210
г.
mр.в-во(H2SO4) = mр-р•р.в-во = 210•0,12 =
25,2 г.
р.в-во(H2SO4)
= m/M = 25,2 (г) / 98 (г/моль) = 0,26 моль.
В недостатке – Mg. Следовательно:
(MgSO4) = 0,2
моль,
(H2) = 0,2
моль.
mр.в-во(MgSO4) = M• = 120 (г/моль)•0,2 (моль) = 24 г.
m(H2) = M• = 2 (г/моль)•0,2 (моль) = 0,4 г.
mр-р получ = mр-р(H2SO4)
+ m(Mg) – m(H2) = 210 (г) + 4,8 (г) – 0,4 (г) =
214,4 г.
р.в-во(MgSO4)
= mр.в-во(MgSO4) / mр-р получ =
24 (г) / 214,4 (г) = 0,112, или 11,2 %.
О т в е т. р.в-во(MgSO4) = 11,2 %.
Задача 2. Смешали 250 г раствора сульфата
железа(III) с концентрацией 8 % и 50 г раствора
гидроксида натрия с концентрацией 30 %. Найти
концентрацию веществ в получившемся растворе.
| Дано:
mр-р(Fe2(SO4)3)
mр-р(NaOH) = 50 г,
|
Найти: |
Р е ш е н и е
mр.в-во(Fe2(SO4)3) = mр-р•р.в-во = 250
(г)•0,08 = 20 г.
(Fe2(SO4)3)
= m/M = 20 (г) / 400 (г/моль) = 0,05 моль.
mр.в-во(NaOH) = mр-р•р.в-во = 50 (г)•0,3 = 15 г.
(NaOH) = m/M =
15 (г) / 40 (г/моль) = 0,375 моль.
В недостатке – Fe2(SO4)3.
Следовательно:
(Na2SO4)
= 0,05 (моль)•3 = 0,15 моль.
(Fe(OH)3) = 0,05
(моль)•2 = 0,1 моль.
прор(NaOH) =
0,05 (моль)•6 = 0,3 моль.
изб(NaOH) =
исх –
прор = 0,375
(моль) – 0,3 (моль) = 0,075 моль.
m(NaOH) = M• =
40 (г/моль)•0,075 (моль) = 3 г.
m(Na2SO4) = M• = 142 (г/моль)•0,15 (моль) = 21,3 г.
m(Fe(OH)3) = M• = 107 (г/моль)•0,1 (моль) = 10,7 г.
m р-р получ = mр-р(Fe2(SO4)3
+ mр-р(NaOH) – m(Fe(OH)3) = 250 (г) + 50
(г) –10,7 (г) = 289,3 г.
р.в-ва(Na2SO4)
= m / mр-р = 21,3 (г) / 289,3 (г) = 0,074, или 7,4 %.
р.в-ва(NaOH)
= m / mр-р = 3 (г) / 289,3 (г) = 0,01, или 1 %.
О т в е т. р.в-во(Na2SO4) = 7,4 %,
р.в-во(NaOH) = 1 %.
Задача 3. Карбонат кальция массой 10 г
растворили при нагревании в 150 мл
хлороводородной кислоты ( = 1,04 г/мл) с массовой долей 9 %.
Какова массовая доля хлороводорода в
получившемся растворе?
О т в е т. р.в-во(HCl) = 4,2 %.
Задача 4. 5,6 г железа растворили в 100 мл 10%-го
раствора соляной кислоты ( = 1,05 г/мл). Вычислить массовую долю
хлороводорода в полученном растворе.
О т в е т. р.в-во(HCl) = 2,9 %.
Задача 5. 5,6 г железа растворили в 200 мл
раствора соляной кислоты ( = 1,05 г/мл) с массовой долей 10 %. Найти
массовую долю соли в полученном растворе.
О т в е т. р.в-во(FeCl2) = 5,9 %.
Задача 6. Смешали 110,4 г раствора карбоната
калия с концентрацией 25 % и 111 г раствора
хлорида кальция с концентрацией 20 %. Найти
концентрацию вещества в полученном растворе.
О т в е т. р.в-во(KCl) = 14,8 %.
Задача 7. Смешали 320 г раствора сульфата
меди(II) с концентрацией 5 % и 120 г раствора
гидроксида натрия с концентрацией 10 %. Найти
концентрации веществ в полученном растворе.
О т в е т. р.в-во(Na2SO4) = 3,3 %,
р.в-во(NaOH) = 0,9 %.
• Более сложными являются задачи на
нахождение массы (или объема) вещества, которое
нужно добавить к раствору другого вещества для
того, чтобы его концентрация изменилась в
результате произошедшей реакции.
В этом случае алгоритм решения следующий:
1) нужно обозначить за x количество
добавленного вещества – реагента;
2) выразить через х количества
прореагировавшего с реагентом вещества и
полученного в результате реакции газа или
осадка;
3) найти количество растворенного вещества в
исходном растворе и его количество, оставшееся
после реакции (оставш
= 1 –
прор);
4) выразить через х массу оставшегося в
растворе вещества;
5) найти массу раствора, полученного после
реакции:
mр-р получ = mреаг + mр-р1 –
mосадок (газ);
mр-р получ = mр-р1 + mр-р2 –
m осадок (газ).
6) все данные подставить в формулу:
р.в-во2 = mоставш / mр-р получ.
7) найти количество вещества реагента, его массу
или объем.
Задача 8. Найти массу карбоната
кальция, которую следует добавить к 600 г раствора
азотной кислоты с массовой долей 31,5 %, чтобы
массовая доля кислоты уменьшилась до 10,5 %.
| Дано:
mр-р1(HNO3)
|
Найти: m(CaCO3). |
Р е ш е н и е
(СаСО3) = х
моль; (HNO3)прор
= 2х моль;
(СО2) = х
моль, m(CO2) = 44x г;
m(CaCO3) = M• = 100 (г/моль)•х (моль) = 100х г;
mр.в-во1(HNO3) = mр-р1•р.в-во1 = 600
(г)•0,315 = 189 г;
1(HNO3)
= m р.в-во /М = 189 (г) / 63 (г/моль) = 3 моль,
оставш(HNO3)
= 1 –
прор = 3 – 2х
моль,
mоставш(HNO3) = М• = 63 (г/моль)•(3 – 2х) =
(189 – 126х) г;
mр-р получ = m(CaCO3) + mр-р1(HNO3) –
m(CO2) = 100x + 600 – 44x = 600 + 56x,
р.в-во2(HNO3)
= mоставш(HNO3) / mр-р получ.
0,105 = (189 – 126х) / (600 + 56х),
х = 0,955 моль, (СаСО3)
= 0,955 моль,
m(CaCO3) = M• = 100 (г/моль)•0,955 (моль) = 95,5 г.
О т в е т. m(CaCO3) = 95,5 г.
Задача 9. Найти массу кристаллогидрата CaCl2•6H2O,
которую необходимо добавить к 47 мл 25%-го раствора
карбоната натрия ( = 1,08 г/мл), чтобы получить раствор, в
котором массовая доля карбоната натрия
составила бы 10 %.
| Дано:
Vр-р1(Na2CO3)
|
Найти: m(CaCl2•6H2O). |
Р е ш е н и е
(СaCl2•6H2O)
= x моль, (CaCl2)
= x моль,
прор(Na2CO3)
= х моль, (СаСО3)
= х моль;
m(CaCl2•6H2O) = M• = 219 (г/моль)•х (моль) = 219х г;
m(CaCO3) = M• = 100x г;
mр-р1(Na2CO3) = Vр-р1•р-р1 = 47 (мл)• 1,08
(г/мл) = 50,76 г,
mр.в-во1(Na2CO3) = mр-р1• р.в-во1 = 50,76
(г)•0,25 = 12,69 г,
1(Na2CO3)
= mр.в-во1 / M = 12,69 (г) / 106 (г/моль) = 0,12
моль,
оставш(Na2CO3)
= 1 –
прор = 0,12 – х,
mоставш(Na2CO3) = M• = 106(0,12 – x) =
12,69 – 106x;
mр-р получ = m(CaCl2•6H2O) + mр-р1(Na2CO3) –
m(CaCO3),
219x + 50,76 – 100x = 50,76 + 119x,
р.в-во2 = mоставш(Na2CO3)
/ mр-р получ,
0,1 = 12,69 – 106х / 50,76 + 119х,
х = 0,0646 моль.
m(CaCl2•6H2O) = М• = 219 (г/моль)•0,0646 (моль) = 14,14 г.
О т в е т. m(CaCl2•6H2O) = 14,4 г.
Задача 10. Какой объем 30%-го раствора
аммиака ( = 0,892
г/мл) необходимо добавить к 200 мл 40%-го раствора
соляной кислоты ( = 1,198 г/мл), чтобы массовая доля
кислоты уменьшилась вчетверо?
О т в е т. Vр-р(NH3) = 108,2 мл.
Задача 11. Какой объем углекислого газа
нужно добавить к 100 мл 20%-го раствора гидроксида
натрия ( = 4,1
г/мл), чтобы массовая доля гидроксида натрия
уменьшилась вдвое?
О т в е т. V(CO2) = 10,9 л.
Задача 12. Найти объем раствора соляной
кислоты ( = 1,05
г/мл) с массовой долей 10 %, который нужно
добавить к 350 г раствора гидроксида калия с
массовой долей 10,5 %, чтобы концентрация щелочи
составила 3 %.
О т в е т. Vр-р(HCl) = 135,6 мл.
• Внимание: растворенное вещество –
реагент!
При решении задач на растворы нужно помнить о
том, что при обычных условиях с водой реагируют
следующие вещества:
1) щелочные и щелочно-земельные металлы,
например:
2Na + 2H2O = 2NaOH + H2;
2) оксиды щелочных и щелочно-земельных металлов,
например:
СаО + Н2О = Са(ОН)2;
3) оксиды неметаллов, например:
SO3 + H2O = H2SO4;
4) многие бинарные соединения – гидриды,
карбиды, нитриды и другие, например:
KН + Н2О = KОН + Н2.
Растворение вещества-реагента в воде.
Растворенным веществом в данном случае будет
продукт взаимодействия вещества-реагента с
водой. Масса раствора будет складываться из
массы реагента и массы воды:
mр-р = mреаг + mH2O.
Если в результате реакции выделился газ, то
mр-р = mреаг + mH2O –
mгаз.
Задача 13. В каком объеме воды нужно
растворить 11,2 л оксида серы(IV), чтобы получить
раствор сернистой кислоты с массовой долей 1 %?
| Дано:
V(SO2) = 11,2 л,
|
Найти: V(H2O). |
Р е ш е н и е
(SO2) = V / VM
= 11,2 (л) / 22,4 (л/моль) = 0,5 моль, следовательно, (H2SO3) = 0,5
моль.
mр.в-во(H2SO3) = M• = 82 (г/моль)•0,5 (моль) =
41 г,
mр-р(H2SO3) = mр.в-во(H2SO3)
/ р.в-во(H2SO3)
= 41 (г) / 0,01 = 4100 г;
m(H2O) = mр-р(H2SO3) –
m(SO2),
m(SO2) = M• = 64 (г/моль)•0,5 (моль) = 32 г,
m(H2O) = 4100 (г) – 32 (г) = 4068 г,
V(H2O) = m/ = 4068 (г) / 1 (г/мл) = 4068 мл, или 4 л 68 мл.
О т в е т. V(H2O) = 4068 мл.
Задачи, в которых неизвестна масса
вещества-реагента, необходимого для образования
раствора с определенной концентрацией.
Алгоритм решения следующий:
1) принять количество растворенного реагента за
х моль;
2) согласно уравнению реакции выразить через х
количества продуктов реакции;
3) найти через х массы реагента и продуктов
реакции;
4) найти массу раствора;
5) подставить все данные в формулу для расчета
массовой доли вещества в растворе:
р.в-во(продукт)
= mр.в-во(продукт) / mр-р.
Задача 14. Найти массу гидрида лития,
которую нужно растворить в 100 мл воды, чтобы
получить раствор с массовой долей гидроксида
лития 5 %.
| Дано:
V(H2O) = 100 мл,
|
Найти: m(LiH). |
Р е ш е н и е
Пусть (LiH) = x
моль,
тогда (LiOH) = x
моль, (Н2) = х
моль.
m(LiH) = M•
= 8 (г/моль)•х (моль) = 8х (г),
m(LiOH) = M•
= 24 (г/моль)•х (моль) = 24х г,
m(H2) = M• = 2 (г/моль)•х = 2х г.
mр-р = m(LiH) + m(H2O) – m(H2),
m(H2O) = V• = 100 (мл)•1 (г/мл) = 100 г.
mр-р = 8х + 100 – 2х = 6х + 100.
р.в-во(LiOH)
= mр.в-во(LiOH) / mр-р,
0,05 = 24х / (6х + 100); 0,3х + 5 = 24х,
х = 0,21, (LiH) =
0,21 моль.
m(LiH) = M•
= 8 (г/моль)•0,21 (моль) = 1,7 г.
О т в е т. m(LiH) = 1,7 г.
Растворение вещества-реагента в растворе.
В этом случае растворяемое вещество реагирует
с водой, которая присутствует в растворе. Масса
растворенного вещества во втором растворе
складывается из массы вещества в первом растворе
и массы вещества – продукта реакции:
mр.в-во1 = mр-р1•р.в-во1,
mр.в-во2 = mр.в-во1• mр.в-во(прод.),
mр-р2 = mр-р1 + mреаг,
или mр-р2 = mр-р1 + mреаг –
mгаз.
р.в-во2
= mр.в-во2 / mр-р2.
Задача 15. К 200 г 10%-го раствора
ортофосфорной кислоты добавили 28,4 г фосфорного
ангидрида. Найти массовую долю кислоты в
получившемся растворе.
| Дано:
mр-р1(H3PO4)
m(P2O5) = 28,4 г. |
Найти: |
Р е ш е н и е
(P2O5) =
m / M = 28,4 (г) / 142 (г/моль) = 0,2 моль,
прод(Н3РО4)
= 0,2 (моль)•2 = 0,4 моль.
mпрод(Н3РО4) = М• = 98 (г/моль)•0,4 (моль) =
39,2 г,
mр.в-во1(Н3РО4) = mр-р1•р.в-во1 = 200 (г)
•0,1 = 20 г,
mр.в-во2(Н3РО4) = mр.в-во2(Н3РО4)
+ mпрод(Н3РО4) = 20 (г) + 39,2 (г) = 59,2
г;
mр-р2(Н3РО4) = mр-р1(Н3РО4)
+ mреаг(Р2О5) = 200 (г) + 28,4 (г) = 228,4
г.
р.в-во2(Н3РО4)
= mр.в-во2(Н3РО4) / mр-р2(Н3РО4)
= 59,2 (г) / 228,4 (г) = 0,2592, или 25,92 %.
О т в е т: (Н3РО4) = 25,92 %.
Задача 16. Найти массу фосфорного
ангидрида, которую необходимо добавить к 70 г 10%-го
раствора ортофосфорной кислоты, чтобы получить
40%-й раствор.
| Дано:
mр-р1(Н3РО4)
|
Найти: m(P2O5). |
Р е ш е н и е
Пусть (Р2О5)
= х моль,
тогда (Н3РО4)
= 2х моль.
mпрод(Н3РО4) = М• = 98 (г/моль)•2х
(моль) = 196х г.
mреаг(Р2О5) = М• = 142 (г/моль)•х
(моль) = 142х г,
mр.в-во1(Н3РО4) = mр-р1•р.в-во1 = 70 (г)•
0,1 = 7 г,
mр.в-во2(Н3РО4) = mр.в-во1(Н3РО4)
+ mпрод(Н3РО4) = 7 + 196х, 000000
mр-р2(Н3РО4) = mр-р1(Н3РО4)
+ mреаг(Р2О5) = 70 + 142х,
р.в-во2(Н3РО4)
= mр.в-во2(Н3РО4) / mр-р2(Н3РО4),
0,4 = (7 + 196х) / (70 + 142х),
х = 0,15, (Р2О5)
= 0,15 моль.
m(P2O5) = M• = 142 (г/моль)•0,15 (моль) = 21,3 г.
О т в е т. m(P2O5) = 21,3 г.
Задача 17. В 240 мл воды опустили 69 г натрия.
Найти массовую долю продукта в растворе.
О т в е т. прод = 39,2 %.
Задача 18. Найти массовую долю кислоты в
растворе, полученном при растворении 33,6 л
сернистого газа в 320 г 5%-го раствора сернистой
кислоты.
О т в е т. р.в-во2(Н2SО3) = 33,4 %.
Задача 19. Какую массу оксида серы(VI) нужно
растворить в 150 мл воды, чтобы получить 60%-й
раствор серной кислоты?
О т в е т. m(SO3) = 144 г.
Задача 20. Найти массу оксида серы(VI),
которую необходимо растворить в 99 г 40%-й серной
кислоты, чтобы получить 80%-й раствор.
О т в е т. m(SO3) = 93 г.
Задача 21. Какую массу оксида фосфора(V)
нужно растворить в 120 г воды, чтобы получить 40%-й
раствор ортофосфорной кислоты?
О т в е т. m(P2O5) = 49 г.
Задача 22. К 180 г 50%-го раствора
ортофосфорной кислоты добавили 42,6 г оксида
фосфора(V). Найти массовую долю кислоты в
полученном растворе.
О т в е т. р.в-во2(Н3РО4) = 66,8 %.
Задача 23. В 20 г воды растворили 3,5 г оксида
натрия. Вычислите массовую долю растворенного
вещества.
О т в е т. (NaOH) = 19,2 %.
Задача 24. К 120 г 8%-го раствора гидроксида
натрия добавили 18,6 г оксида натрия. Вычислите
массовую долю гидроксида натрия в
образовавшемся растворе.
О т в е т. р.в-во(NaOH) = 24,2 %.
Задача 25. Найти массу оксида серы(VI),
которую нужно добавить к 2 л 8%-го раствора серной
кислоты ( = 1,06
г/мл), чтобы массовая доля серной кислоты стала
равной 20 %.
О т в е т. m(SO3) = 248,2 г.
Задача 26. Какую массу фосфора необходимо
сжечь в кислороде, чтобы, растворив полученный
оксид в 1000 г раствора ортофосфорной кислоты с
массовой долей 50 %, получить раствор этой
кислоты с массовой долей 75 %?
О т в е т. m(P) = 173,2 г.
Задача 27. Какую массу натрия необходимо
растворить в 120 мл воды для получения раствора
щелочи с массовой долей 18 %?
О т в е т. m(Na) = 13,8 г.
Г.С.ОСНОВСКАЯ,
учитель химии средней школы № 7
(г. Великие Луки, Псковская обл.)
Подготовка к ЕГЭ: выполнение заданий высокого уровня сложности. В статье описаны возможные типы задач с расчётами по уравнениям реакций, происходящих в растворах.
Одно из заданий высокого уровня сложности, оно входит в третью часть экзаменационной работы (задание С4), проверяет умения производить расчёты по уравнениям реакций, происходящих в растворах.
Уважаемые старшеклассники!
Если вы будете иметь представление о возможных типах таких задач, закрепите умения на самостоятельном решении ряда подобных задач, то вам по силам будет справиться с ними и на ЕГЭ.
Прежде всего вы должны усвоить понятие о массовой доле растворённого вещества или процентной концентрации раствора. Эта величина показывает отношение массы растворённого вещества к массе раствора:
р.в. = m р.в. / m р-ра
Производные формулы:
m р.в. = m р-ра р.в.
m р-ра = m р.в. / р.в.
Если в условии задачи указан объём раствора с определённой плотностью, то прежде всего находят массу раствора:
m р-ра = V р-ра ,
затем – массу растворённого вещества:
m р.в. = m р-ра р.в.
Количество вещества находят по массе растворённого вещества:
= m р.в. / М
Рассмотрим некоторые типы задач с расчётами по уравнениям реакций, происходящих в растворах.
Нахождение массовых долей растворённых веществ в растворе
после реакции.
При решении таких задач прежде всего нужно найти количества реагирующих веществ. Если задача на избыток и недостаток, то количества продуктов реакции находят по веществу, которое дано в недостатке.
Один из важных моментов – это нахождение массы раствора после реакции (массы полученного раствора), m р-ра получ. Если вещество взаимодействует с веществом, находящимся в растворе, то складывают массу вещества и массу раствора; в случае, когда оба реагирующих вещества даны в виде растворов, складывают массы двух растворов. Если в результате реакции образуется осадок или газ, то из полученной суммы отнимают массу вещества, ушедшего из раствора в виде осадка или газа.
m р-ра получ. = m в. + m р-ра1 – m осадка (газа)
m р-ра получ. = m р-ра1 + m р-ра2 – m осадка (газа)
При решении задач на избыток и недостаток нужно помнить о том, что в растворе после реакции будет находиться в растворённом виде не только продукт реакции, но и вещество, которое было дано в избытке.
Чтобы найти количество вещества – избытка, нужно от исходного количества вещества отнять количество прореагировавшего вещества:
изб. = исх. – прор.
Затем найти его массу и массовую долю в растворе полученном после реакции.
Задача 1: 4.8 г магния растворили в 200 мл 12 % – го раствора серной кислоты ( = 1, 05 г/мл). Найти массовую долю соли в полученном растворе.
Д
m (Mg) = 4,8 г
V р-ра (H2SO4) = 200 мл Решение:
р-ра (H2SO4) = 1,05 г/мл Mg + H2SO4 = MgSO4 + H2
1 моль 1 моль 1 моль 1 моль

m р-ра (H2SO4) = V р-ра = 200 мл 1,05 г/мл = 210г
р.в. (MgSO4 ) = ? m р.в. (H2SO4) = m р-ра р.в. = 210 0,12 = 25,2 г
р.в. (H2SO4) = m/M = 25,2 г / 98 г/моль = 0,26 моль
В недостатке Mg (MgSO4) = 0,2 моль, (H2) = 0,2 моль
m р.в.(MgSO4) = M = 120 г/моль 0,2 моль = 24 г
m (H2) = M = 2 г/моль 0.2 моль = 0,4 г
m р-ра получ. = m р-ра (H2SO4) + m (Mg) – m (H2) = 210г + 4,8г – 0,4г = 214,4 г
р.в.(MgSO4) = m р.в.(MgSO4) / m р-ра получ. = 24 г / 214,4 г = 0,112 или 11.2 %
Ответ: р.в.(MgSO4) = 11.2 %
Задача 2: Смешали 250 г раствора сульфата железа (III) с концентрацией 8 % и 50 г раствора гидроксида натрия с концентрацией 30 %. Найти концентрацию веществ в получившемся растворе.

Дано:
m р-ра (Fe2(SO4)3) = 250 г Решение:
р.в. (Fe2(SO4)3) = 8 %
m р-ра (NaOH) = 50 г Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4
1 моль 6 моль 2 моль 3 моль

р.в. = ? (Fe2(SO4)3) = m / M = 20г / 400г/моль = 0,05 моль
m р.в.(NaOH) = m р-ра р.в. = 50г 0,3 = 15г
(NaOH) = m / M = 15г / 40г/моль = 0,375 моль
В недостатке Fe2(SO4)3 (Na2SO4) = 0,05 моль 3 = 0,15 моль
(Fe(OH)3) = 0,05 моль 2 = 0,1 моль
(NaOH) прор. = 0,05 моль 6 = 0,3 моль
(NaOH) изб. = – прор. = 0,375 моль – 0,3 моль = 0,075 моль
m(NaOH) = M = 40г / моль = 0,075 моль = 3г
m(Na2SO4) = M = 142г/моль 0,15 моль =
m(Fe(OH)3) = M = 107г/моль 0,1 моль = 10,7г
m р-ра получ. = m р-ра (Fe2(SO4)3 + m р-ра (NaOH) – m (Fe(OH)3) = 250г + 50г – 10,7г = 289,3г
р.в.(Na2SO4) = m / m р-ра = 21,3г / 289,3г = 0,074 или 7,4 %
р.в.(NaOH) = m / m р-ра = 3г / 289,3г = 0,01 или 1 %
Ответ: р.в.(Na2SO4) = 7,4 %,
р.в.(NaOH) = 1 %.
Задача 3: Карбонат кальция массой 10г растворили при нагревании в 150 мл хлороводородной кислоты ( = 1,04 г/мл) с массовой долей 9 %.
Какова массовая доля хлороводорода в получившемся растворе?
Ответ: р.в. (HCl) = 4,2 %.
Задача 4: 5,6г железа растворили в 100 мл 10 % – го раствора соляной кислоты
( = 1,05г/мл). Вычислите массовую долю хлороводорода в полученном растворе.
Ответ: р.в.(HCl) = 2,9 %.
Задача 5: 5,6г железа растворили в 200 мл раствора соляной кислоты ( = 1,05 г/мл) с массовой долей 10 %. Найти массовую долю соли в полученном растворе.
Ответ: р.в. (FeCl2) = 5,9 %.
Задача 6: Смешали 110,4г раствора карбоната калия с концентрацией 25 % и 111г раствора хлорида кальция с концентрацией 20 %. Найти концентрацию вещества в полученном растворе.
Ответ: р.в. (KCl) = 14,8 %.
Задача 7: Смешали 320г раствора сульфата меди (II) с концентрацией 5 % и 120 г раствора гидроксида натрия с концентрацией 10 %. Найти концентрации веществ в полученном растворе.
Ответ: р.в.(Na2SO4) = 3,3 %,
р.в. (NaOH) = 0,9 %.
Более сложными являются задачи на нахождение массы или объёма вещества, которое нужно добавить к раствору другого вещества для того, чтобы изменилась его концентрация в результате произошедшей реакции.
В этом случае:
-
Нужно обозначить за x количество добавленного вещества – реагента.
-
Выразить через х количества прореагировавшего с ним вещества и полученного в результате реакции газа или осадка.
-
Найти количество растворённого вещества в исходном растворе и его количество, оставшееся после реакции: оставш. = 1 – прор.
-
Выразить через х массы реагента, оставшегося в растворе вещества и осадка (газа).
-
Найти массу раствора, полученного после реакции:
m р-ра получ. = m реаг. + m р-ра1 – m осадка (газа)
m р-ра получ. = m р-ра1 + m р-ра2 – m осадка (газа).
-
Все данные подставить в формулу:
р.в.2 = m оставш. / m р-ра получ.
Найти количество вещества – реагента, его массу или объём.
Задача 1: Найти массу карбоната кальция, которую следует добавить к 600г раствора азотной кислоты с массовой долей 31,5 %, чтобы массовая доля кислоты уменьшилась до 10,5 %.
Дано:
m
р.в.1 (HNO3) = 31,5 % CaCО3 + 2HNO3 = Ca(NO3)2 + CO2 + H2O
1 моль 2 моль 1 моль 1 моль
р.в.2 (HNO3) = 10,5 %
m (CaCO3) = ?
(СаСО3) = х моль (HNO3) прор. = 2х моль (СО2) = х моль
m (CaCO3) = M = 100г/моль х моль = 100г m (CO2) = 44x
m р.в.1(HNO3) = m р-ра1 р.в.1 = 600 0,315 = 189г
1(HNO3) = m р.в. / М = 189г / 63г/моль = 3 моль
(HNO3) оставш. = 1 – прор. = 3 – 2х
m (HNO3) оставш. = М = 63г/моль (3 – 2х) = 189 – 126х
m р-ра получ. = m (CaCO3) + m р-ра1(HNO3) – m (CO2) = 100x + 600 – 44x =
= 600 + 56x
р.в.2 (HNO3) = m оставш.(HNO3) / m р-ра получ.
0,105 = 189 – 126х / 600 + 56х
х = 0,96 (СаСО3) = 0,96 моль
m (CaCO3) = M = 100г/моль 0,96 моль = 96г
Ответ: m (CaCO3) = 96г
Задача 2: Найти массу кристаллогидрата CaCl2 6H2O, которую необходимо добавить к 47 мл 25% – ного раствора карбоната натрия ( = 1,08), чтобы получить раствор, в котором массовая доля карбоната натрия составила бы 10 % ?
Д
V р-ра1(Na2CO3) = 47 мл Решение:
р-ра1(Na2CO3) = 1,08 г/мл CaCl2 + Na2CO3 = CaCO3 + 2NaCl
1 моль 1 моль 1 моль
р.в.1(Na2CO3) = 25 %

m(CaCl2 6H2O) = ?
(СaCl2 6H2O) = x моль (CaCl2) = x моль (Na2CO3) прор. = х моль
(СаСО3) = х моль
m(CaCl2 6H2O) = M = 219 г/моль х моль = 219х г
m(CaCO3) = M = 100x г
m р-ра1(Na2CO3) = V р-ра1 р-ра1 = 47 мл 1,08 г/мл = 50,76 г
m р.в.1(Na2CO3) = m р-ра1 р.в.1 = 50,76 г 0,25 = 12,69 г
1(Na2CO3) = m р.в.1 / M = 12,69 г / 106 г/моль = 0,12 моль
оставш.(Na2CO3) = 1 – прор. = 0,12 – х
m оставш.(Na2CO3) = M = 106(0,12 – x) = 12,69 – 106x
m р-ра получ. = m кр-та(CaCL2 6H2O) + m р-ра1(Na2CO3) – m(CaCO3) = 219x + 50,76 – 100x = 50,76 + 119x
р.в.2 = m оставш.(Na2CO3) / m р-ра получ.
0,1 = 12,69 – 106х / 50,76 + 119х х = 0,0646 моль
m кр-та = М = 219 г/моль 0,0646 моль = 14,14 г
Ответ: m кр-та(CaCl2 6H2O) = 14,4 г
Задача 3: Какой объём 30% раствора аммиака ( = 0,892 г/мл) необходимо добавить к 200 мл 40% – ного раствора соляной кислоты ( = 1,198 г/мл), чтобы массовая доля кислоты уменьшилась вчетверо?
Ответ: V р-ра(NH3) = 108,2 мл
Задача 4: Какой объём углекислого газа нужно добавить к 100 мл 20% – ного раствора гидроксида натрия ( = 4,1 г/мл), чтобы массовая доля гидроксида натрия уменьшилась вдвое?
Ответ: V(CO2) = 2,9 л
Задача 5: Найти объём раствора соляной кислоты ( = 1,05 г/мл) с массовой долей 10%, который нужно добавить к 350 г раствора гидроксида калия с массовой долей 105, чтобы концентрация щелочи составила 3%.
Ответ: Vр-ра(HCl) = 128 мл.
Внимание: растворённое вещество – реагент!
При решении задач на растворы нужно помнить о том, что при обычных условиях с водой реагируют:
-
щелочные и щелочно – земельные металлы: 2Na + 2H2O = 2NaOH + H2
-
оксиды щелочных и щелочно – земельных металлов: СаО + Н2О = Са(ОН)2
-
оксиды неметаллов: SO3 + H2O = H2SO4
-
многие бинарные соединения – гидриды, карбиды, нитриды и другие:
КН + Н2О = КОН + Н2
В этих случаях нужно прежде всего составлять уравнения реакций, расчёты производить и по химическому уравнению, и по концентрации раствора.
1 тип: растворение вещества – реагента в воде.
Растворённым веществом в данном случае будет продукт взаимодействия вещества – реагента с водой. Масса раствора будет складываться из массы реагента и массы воды: m р-ра = m реаг. + m H2O
Если в результате реакции выделился газ: m р-ра = m реаг. + m H2O – m газа
р.в.(продукта) = m р.в.(продукта) / m р-ра
Задача 1: В каком объёме воды нужно растворить 11,2л оксида серы (IV), чтобы получить раствор сернистой кислоты смассовой долей 1%?
Д
V(SO2) = 11,2л SO2 + H2O = H2SO3
р.в.(H2SO4) = 1% 1 моль 1 моль

V(H2O) = ? (SO2) = V / Vm = 11,2л / 22,4л/моль = 0,5 моль (H2SO3) = 0,5 моль
m р.в.(H2SO3) = M = 82г/моль 0,5 моль = 41г
m р-ра(H2SO3) = m р.в.(H2SO3) / р.в.(H2SO3) = 41г / 0,01 = 4100г
m(H2O) = m р-ра(H2SO3) – m(SO3)
m(SO3) = M = 80г/моль 0,5 моль = 40г
m(H2O) = 4100г – 40г = 4060г
V(H2O) = m / = 4060г / 1г/мл = 4060мл
Ответ: V(H2O) = 4060мл.
Задачи, в которых неизвестна масса вещества – реагента, необходимого для образования раствора с определённой концентрацией.
-
принять количество растворённого реагента за х моль;
-
согласно уравнения реакции выразить через х количества продуктов реакции;
-
найти через х массы реагента и продуктов реакции;
-
найти массу раствора;
-
подставить все данные в формулу для расчёта массовой доли вещества в растворе: р.в.(продукта) = m р.в.(продукта) / m р-ра.
Задача 2: Найти массу гидрида лития, которую нужно растворить в 100мл воды, чтобы получить раствор с массовой долей гидроксида 5%.
Дано: Решение:
V(H2O) = 100мл
р.в.(LiOH) = 5% LiH + H2O = LiOH + H2

m
Пусть (LiH) = x моль (LiOH) = x моль, (Н2) = х моль
m(LiH) = M = 8г/моль х моль = 8х г
m(LiOH) = M = 24г/моль х моль = 24х г
m(H2) = M = 2г/моль х = 2х г
m р-ра = m(LiH) + m(H2O) – m(H2)
m(H2O) = V = 100мл 1г/моль = 100г
m р-ра = 8х + 100 – 2х = 6х + 100
р.в.(LiOH) = m р.в.(LiOH) / m р-ра
0,05 = 24х / 6х + 100; 0,3х + 5 = 24х
х = 0,21; (LiH) = 0,21моль
m(LiH) = M = 8г/моль 0,21 моль = 1,7г
Ответ: m(LiH) = 1,7г.
2 тип: растворение вещества – реагента в растворе.
В этом случае растворяемое вещество реагирует с водой, которая присутствует в растворе. Масса растворённого вещества во втором растворе складывается из массы вещества в первом растворе и массы вещества – продукта реакции:
m р.в.1 = m р-ра1 р.в.1
m р.в.2 = m р.в.1 + m р.в. (продукта)
m р-ра2 = m р-ра1 + m реаг. или m р-ра2 = m р-ра1 + m реаг. – m газа
р.в.2 = m р.в.2 / m р-ра2
Задача 3: К 200г 10% – ного раствора ортофосфорной кислоты добавили 28,4г фосфорного ангидрида. Найти массовую долю кислоты в получившемся растворе.
Дано: Решение:
m р-ра1(H3PO4) = 200г Р2О5 + 3Н2О = 2Н3РО4
р.в.1(Н3РО4) = 10% 1 моль 2 моль
m

р.в.2(Н3РО4) = ?
(P2O5) = m / M = 28,4г / 142г/моль = 0,2 моль (Н3РО4) =
0,2 моль 2 = 0,4 моль
m прод.(Н3РО4) = М = 98г/моль 0,4 моль = 39,2
m р.в.1(Н3РО4) = m р-ра1 р.в.1 = 200г 0.1 = 20г
m р.в.2(Н3РО4) = m р.в.1(Н3РО4) + m прод.(Н3РО4) = 20 + 39,2 = 59,2
m р-ра2(Н3РО4) = m р-ра1(Н3РО4) + m реаг.(Р2О5) = 200г + 28,4г = 228,4г
р.в.2(Н3РО4) = m р.в.2(Н3РО4) / m р-ра2(Н3РО4) = 59,2г / 228,4г = 0,259
или 26%
Ответ: р.в.2(Н3РО4) = 26%
Задача 4: Найти массу фосфорного ангидрида, который необходимо добавить к 70г 10% – ного раствора ортофосфорной кислоты, чтобы получить 40% – й раствор.
Д
m р-ра1(Н3РО4) = 70г
р.в.1(Н3РО4) = 10% Р2О5 + 3Н2О = 2Н3РО4
р.в.2(Н3РО4) = 40% 1 моль 2 моль

m(P2O5) = ?
Пусть (Р2О5) = х моль (Н3РО4) = 2х моль
m прод.(Н3РО4) = М = 98г/моль 2х = 196х г
m реаг.(Р2О5) = М = 142г/моль х моль = 142х
m р.в.1(Н3РО4) = m р-ра1 р.в.1 = 70г 0,1 = 7г
m р.в.2(Н3РО4) = m р.в.1(Н3РО4) + m прод.(Н3РО4) = 7 + 196х
m р-ра2(Н3РО4) = m р-ра1(Н3РО4) + m реаг.(Р2О5) = 70 + 142х
р.в.2(Н3РО4) = m р.в.2(Н3РО4) / m р-ра2(Н3РО4)
0,4 = 7 + 196х / 70 + 142х
х = 0,15 (Р2О5) = 0,15 моль
m(P2O5) = M = 142г/моль 0,15 моль = 21,4г
Ответ: m(P2O5) = 21,4г
Задача 5:
В 240 мл воды опустили 69г натрия. Найти массовую долю продукта в растворе.
Ответ: 39,2%.
Задача 6:
Найти массовую долю кислоты в растворе, полученном при растворении 33,6л сернистого газа в 320г 5% – ного раствора сернистой кислоты.
Ответ: 33.4%.
Задача 7:
Какую массу оксида серы (VI) нужно растворить в 150 мл воды, чтобы получить 60% – й раствор серной кислоты?
Ответ: m(SO3) = 144г.
Задача 8:
Найти массу оксида серы (VI), который необходимо растворить в 99г 40% серной кислоты, чтобы получить 80% – й раствор.
Ответ: m(SO3) = 93г.
Задача 9:
Какую массу оксида фосфора (V) нужно растворить в 120г воды, чтобы получить 40% – й раствор ортофосфорной кислоты?
Ответ: m(P2O5) = 49г.
Задача 10:
К 180г 12% раствора ортофосфорной кислоты добавили 21г оксида фосфора (V). Найти массовую долю кислоты в полученном растворе.
Ответ: (Н3РО4) = 25,2%.
Задача 11:
В 20г воды растворили 3,5г оксида натрия. Вычислите массовую долю растворённого вещества.
Ответ: (NaOH) = 20,4%.
Задача 12:
К 120г 8% – ного раствора гидроксида натрия добавили 18,6г оксида натрия. Вычислите массовую долю гидроксида натрия в образовавшемся растворе.
Ответ: (NaOH) = 24,2%.
Задача 13:
Найти массу оксида серы (VI), которую нужно добавить к 2л 8% – ного раствора серной кислоты ( = 1,06г/мл), если массовая доля серной кислоты стала равной 20%. Ответ: m(SO3) = 248,2г.

Решения задач, объединяющих в себе растворы и химические реакции
Определение массовой доли растворенного вешества
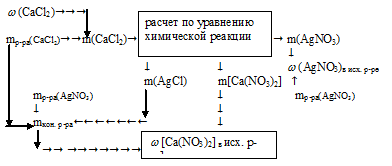
Приведены алгоритмы решения задач, которые объединяют в себе растворы и химические реакции. При их решении следует сначала записать все уравнения химических реакций, а затем составлять алгоритм. В таких задачах необходимо учитывать возможность образования осадка, выделения газа, участия воды в химических реакциях.
Задача 3.
Для реакции с 200 г водного раствора нитрата серебра потребовалось 70 г 3%-ного раствора СаС12 в воде. Определите массовую долю АgNО3 в исходном растворе и массовую долю соли в полученном растворе.
Дано:
масса раствора нитрата серебра: mр-ра(АgNО3) = 200 г;
масса раствора хлорида кальция: mр-ра(СаС12) = 70 г;
массовая доля хлорида кальция в исходном р-ре: 
Найти:
массовую долю АgNО3в исходном р-ре: 
массовую долю соли в полученном растворе: (соли)в кон. р-ре = ?
Решение:
В реакцию вступает нитрат серебра и хлорид кальция. Вода, образующая растворы этих веществ, во взаимодействии не участвует. Записываем уравнение реакции:
2АgNО3 + СаС12 = 2AgCl↓ + Са(NО3)2
В результате реакции одна из получающихся солей нерастворима и выпадает в осадок, следовательно, во втором вопросе задачи требуется определить массовую долю нитрата кальция в конечном растворе:
(СаNО3)2)в кон. p-ре = ?
Возможно несколько алгоритмов решения данной задачи, например:
1. Определяем массу СаС12 в 70 г 3% -ного раствора.
2. По уравнению реакции определяем массы AgNO3; AgCl и Ca(NO3)2:
Составим пропорции:
х г АgNО3 взаимодействует с 21 г СаС12 (по данным условия)
340 г АgNО3 взаимодействует со 111 г СаС12 (по уравнению)
21 г СаС12 дает у г AgCl (по данным условия)
1 1 1 г СаС12 дают 287 г AgCl (по уравнению)
21 г СаС12 дает г г Са(NО3)2 (по данным условия)
111 г СаС12 дают 164 г Са(NО3)2 (по уравнению)
3. Определяем массовую г АgNО3 в исходном растворе.
4. Определяем массу конечного раствора после реакции. Так как хлорид серебра в результате реакции выпадает в осадок, можно записать:
mкон. р-ра = mp-pa(CaCl2) + mp-pa(AgNO3) – m(AgCl)в осадке = 70 + 200 – 54,3 = 215,7 г.
5. Определяем массовую долю Са(NО3)2 в конечном растворе.
Ответ: 

Определение массы растворенного вешества
Задача 4.
Определите массу 3%-ного водного раствора NаОН, который необходимо добавить к 50,0 г Ка для получения 49% – ного раствора NаОН в воде.
Дано:
массовая доля NаОН в исходном р-ре: 
масса натрия: m(Nа) = 50 г;
массовая доля NаОНв конечном р-ре:
Найти:
массу исходного раствора: mисх.р-ра = ?
Решение:
Когда мы раствор NаОН в воде добавляем к металлическому .натрию, происходит реакция Nа с водой из исходного раствора. NаОН, который исходно находился в растворе, участия в реакции не принимает. Из конечного раствора выделяется газообразный водород.
2Nа + 2Н2О = 2NаОН + Н2↑
Отобразим условие задачи в виде рисунка:
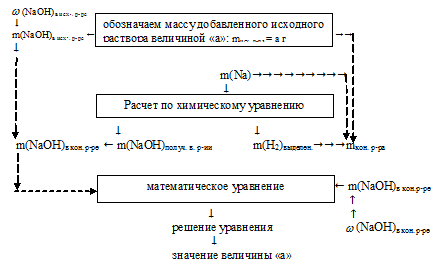
Решение данной задачи возможно лишь по встречному алгоритму.
1. Искомой величиной является масса 3%-ного раствора NаОН. Обозначим ее значением «а». Используя mисх. р-ра = а, как известную величину, составляем встречный алгоритм.
2. Используя значение массы исходного раствора как известную величину, находим массу NаОН в исходном растворе:
3. Используя указанную в условии массу натрия, по уравнению реакции находим массы NаОН и Н2, полученные в результате взаимодействия:
Составим пропорции:
50 г Nа дают х г NаОН (по данным условия)
46 г Nа дают 80 г NаОН (по уравнению реакции)
50 г Nа дают y г H2 (по данным условия)
46 г Nа дают 2 г H2 (по уравнению реакции)
3. По полученным данным находим массу NаОН в конечном растворе.
m(NаОН)в кон. р-ре = m(NаОН)в исх. р-ре + m(NаОН)кон. в реакции = (0,03 . a + 87) г.
4. Находим массу конечного раствора.
mкон. р-ра = mисх. р-ра + m(Nа) – m(H2)выдел. = а + 50 – 2,2 = (а + 47,8) г.
5. Определяем массу NаОН в конечном растворе:
6. В предыдущих действиях мы определили массу NаОН в конечном растворе двумя разными путями. Но так как конечный раствор NаОН один и тот же, то и содержание NаОН в нем одно и тоже. Это позволяет нам приравнять два полученных выражения и получить одно математическое уравнение с одним неизвестным:
0,03 . а + 87 = 0,49 . а + 23,4
Решая его, получаем: а = 138 г.
Величиной «а» мы обозначали массу исходного 3%-ного раствора NОН.
Ответ: необходимо 138 г исходного 3% -ного раствора NаОН.
Для того чтобы решить любую задачу из этого раздела, необходимо знать
- теоретические основы задачи;
- общие принципы оформления расчёта по уравнению химической реакции.
Поскольку теоретические основы изложены в различных разделах Самоучителя и других учебниках, нужно перед решением задачи повторить нужный раздел.
Рассмотрим общие принципы оформления расчётов по уравнениям реакций.
Содержание
- Оформление расчётов по уравнениям реакций
- Задачи для самостоятельного решения
- Задачи по теме «Количественный состав смесей»
- Задачи для самостоятельного решения
- Задачи на «избыток–недостаток»
- Задачи для самостоятельного решения
- Задачи на установление формулы вещества
- Задачи для самостоятельного решения
- Задачи, в которых учитывается «выход» полученного вещества
- Задачи для самостоятельного решения
Оформление расчётов по уравнениям реакций
Для того чтобы выполнить расчёт по уравнению реакции, нужно:
- составить уравнение химической реакции, расставить коэффициенты;
- по коэффициентам уравнения химической реакции определить число молей реагирующих веществ;
- НАД формулами соединений указать данные задачи, отметив их размерность (г, л, моль);
- ПОД формулами этих соединений сделать расчёт таким образом, чтобы размерность величин «над» и «под» химическими формулами совпали;
- составить пропорцию из «верхних» данных и «нижних» результатов и выполнить расчёт.
Разберём этот алгоритм на примере.
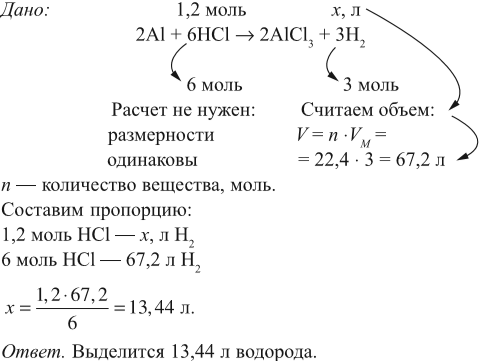
Задача 17. В раствор, содержащий 1,2 моль НCl опустили избыток алюминия. Какой объём водорода выделится при этом?
Решение. Составим уравнение реакции и запишем, что дано в ней, над формулами соединений. При этом обязательно указывайте размерность.
Задача 18. Сколько граммов алюминия нужно растворить в соляной кислоте, чтобы получить 5,6 л водорода?
Решение. Составим уравнение реакции и запишем, что дано в ней, над химическими формулами соединений. При этом обязательно указывайте размерность.
В случае, когда нужно определить объёмы реагирующих газов, можно воспользоваться следствием из закона Авогадро.
Объёмы реагирующих газов относятся как их коэффициенты в уравнении химической реакции.
Задача 19. Какой объём углекислого газа выделится при полном сгорании 6 л ацетилена С2Н2?
Решение.
Задачи для самостоятельного решения
25. Какой объём кислорода потребуется для полного сгорания 6,2 г фосфора? Сколько молей оксида фосфора при этом получится?
26. Сколько молей фосфора нужно сжечь, чтобы получить 28,4 г оксида фосфора V?
27. Какой объём водорода потребуется на восстановление 10,6 г Fe3О4 до железа? (Реакция идет по схеме: МеxОy + Н2 → Ме + H2O.)
28. Какой объём кислорода потребуется для сгорания 8,8 г пропана? (Пропан: С3Н8.)
29. Какой объём кислорода требуется для полного сгорания 5 л этилена С2Н4?
30. Хватит ли 10 л кислорода для полного сгорания 17 л водорода?
32. Какой объём водорода может присоединиться к пропену массой 21 г?
34. Сколько миллилитров бензола (пл.= 0,78 г/мл) можно получить из 56 л ацетилена?
35. Какой объём водорода выделится, если в избыток спирта бросить 0,23 г натрия?
36. Сколько граммов диэтилового эфира можно получать из 23 г этанола?
37. Какой объем этилена должен вступить в реакцию, для того чтобы образовалось 500 мл спирта (пл. = 0,8 г/мл)?
38. Какой объём водорода может присоединиться к 22 г этаналя?
39. Какой объём спирта нужно окислить для получения 11 г этаналя? (плотность спирта равна 0,8 г/мл).
40. Какой объём хлора вступит в реакцию с уксусной кислотой массой 15 г, если в реакции должна получиться хлоруксусная кислота?
41. Какой объём водорода потребуется для гидрирования 0,2 моль триолеина? Где применяется полученный продукт?
42. Какой объём кислорода потребуется для полного сгорания 100 г уксусной кислоты?
Задачи по теме «Количественный состав смесей»
Состав смесей очень часто определяют в различных задачах, например в которых упоминаются растворы. Дело в том, что растворы — это однородные смеси. Задачи такого типа решаются по разному, но в любом случае следует помнить, что массу (объём) смеси нельзя подставлять в уравнение реакции и нельзя находить по уравнению реакции. По уравнению реакции можно найти только массу или объём компонента смеси.
Внимание! Если в условии упоминается смесь веществ или раствор, то составлять уравнения реакций нужно для всех компонентов смеси, указывая, идёт реакция или нет, а затем выполнять расчёт, оформляя решение задачи по каждому уравнению так, как показано выше.
Задачи такого типа можно условно разделить на две группы:
- задачи, в которых имеется хотя бы одна величина, которую можно сразу подставить в уравнение реакции и сделать необходимый расчёт;
- задачи, в которых таких данных нет.
Рассмотрим задачу первого типа.
Задача 20. Смесь меди и алюминия массой 10 г обработали раствором щёлочи. При этом выделилось 10 л газа (н. у.). Определить состав смеси в масс.% (массовые доли алюминия и меди в смеси).
Решение. Составим уравнения реакций:
Составим пропорцию и определим массу алюминия в смеси:
отсюда:
Ответ. ώ(Al) = 80 %, ώ(Сu) = 20 %.
В задачах второго типа в химическом превращении участвуют все компоненты смеси, в результате чего образуется смесь газов или других продуктов реакции. В этих случаях нужно прибегнуть к приёму, когда неизвестная величина (о ней спрашивается в задачи), принимается за известную, и обозначается А.
Задача 21. На нейтрализацию 20 г смеси гидрофосфата и дигидрофосфата натрия потребовалось 25 г 40 %-ного раствора NaOH. Определить состав смеси.
Составим уравнения реакций:
Определим количество вещества NaOH, которое содержится в растворе (можно считать, используя значение массы этого вещества, но более простые числа получаются, если используется величина «моль»):
Внимание: количество вещества щёлочи можно рассчитать сразу:
Теперь используем приём, который был отработан в задаче 16: пусть в смеси содержится а г дигидрофосфата, тогда гидрофосфата содержится (20 — а) г. Подставим эти величины в уравнения реакций и найдём значения х и у:
Поскольку х + у = 0,25 моль, получаем уравнение
Ответ. Смесь состояла из 11,34 г дигидрофосфата и 8,66 г гидрофосфата.
При получении растворов происходят не только физические процессы (дробление вещества, диффузия), но и взаимодействие вещества и растворителя. (Подробнее см. урок 6) Иногда в результате такого взаимодействия образуются совершенно новые вещества. В этом случае необходимо составить уравнение или схему происходящего процесса, а в расчётной формуле указывать, о каком веществе идёт речь.
Задача 22. В 100 мл воды растворили 2 г кальция. Определить массовую долю вещества в полученном растворе.
Решение. Поскольку кальций реагирует с водой, составим уравнение соответствующей реакции:
Таким образом, в растворе содержится не кальций, а гидроксид кальция. Отразим это в расчётной формуле:
Значит, нам нужно вычислить m[Са(ОН)2] по уравнению реакции:
а затем массу раствора:
Обратите внимание: массу полученного раствора вычисляют, исходя из массы исходных веществ или смесей, добавляя к ним массы тех веществ, которые были добавлены, и, вычитая массы веществ, которые вышли из сферы реакции в виде газа или осадка.
Ответ. Массовая доля щёлочи составит 3,6 %.
Задачи для самостоятельного решения
43. Через известковую воду пропустили 3 л воздуха. Выпало 0,1 г осадка. Определить объёмную долю (φ) углекислоты (CO2) в воздухе.
44. 20 г мела опустили в соляную кислоту. При этом выделилось 4 л газа. Определить массовую долю (ώ) карбоната кальция в образце этого мела.
45. В 200 г воды растворили 15 г оксида лития. Найти массовую долю веществ в полученном растворе.
46. 20 г смеси хлорида натрия и карбоната натрия обработали соляной кислотой. При этом выделилось 2,24 л газа. Установить состав смеси в масс.%.
47. Для превращения 2,92 г смеси гидроксида и карбоната натрия потребовалось 1,344 л хлороводорода. Вычислить состав смеси.
48. При растворении 3 г сплава меди и серебра в разбавленной азотной кислоте получено 7,34 г смеси нитратов. Определить процентный состав смеси и объём газов, полученных при прокаливании образовавшихся солей.
49. Сколько граммов 30 %-ной азотной кислоты нужно взять для нитрования 5,6 л пропана?
50. Какой, объём кислорода потребуется для сжигания смеси, состоящей из 8 г метана и 11,2 л этана?
51. Какой объём метана можно получить при нагревании 20 г смеси, содержащей 25 % ацетата натрия, остальное — щёлочь?
52. Через бромную воду пропустили смесь, которая состоит из 8 г метана и 5,6 л этена. Сколько граммов брома вступит в реакцию?
53. Какой объём природного газа, который содержит 98 % метана, потребуется для получения 52 кг ацетилена?
54. Из 10 г загрязнённого карбида кальция получили 2,24 л ацетилена. Чему равна массовая доля карбида кальция в исходном образце?
55. Какой объём кислорода нужен для сжигания смеси, которая состоит из 4 г метана, 10 л этена и 1 моль этина?
56. Сколько граммов 40 %-ной азотной кислоты нужно взять для получения 24,2 г нитробензола?
57. Сколько граммов азотной кислоты потребуется для нитрования 4,7 г фенола, если ώ(кислоты) в исходном растворе равна 30 %.
58. Сколько граммов 30 %-ной муравьиной кислоты нужно для растворения 2,7 г алюминия?
59. Сколько граммов 40 %-ного раствора КОН требуется для омыления (гидролиза) 3 моль тристеарина?
60. Рассчитать объём газа, который должен выделиться при брожении 160 г 20 %-ного раствора глюкозы (брожение прошло полностью).
61. На реакцию с 50 мл раствора анилина пошло 4,2 г брома. Рассчитать массовую долю анилина в исходном растворе (плотность раствора равна единице).
Задачи на «избыток–недостаток»
Такие задачи имеют в условии легко узнаваемый признак: указаны данные для обоих (или всех) реагирующих веществ. В этом случае нужно вначале определить количество (в моль) реагирующих веществ.
Затем по уравнению реакции определить молярные соотношения этих веществ и сделать вывод — какое из них находится в недостатке. Именно по этой величине (в моль!) ведутся последующие расчёты.
Задача 23. Какой объём водорода выделится при взаимодействии 5,4 г алюминия с 200 г 12 %-ного раствора серной кислоты? Чему равны массовые доли веществ в полученном растворе?
Решение. Определим массы и количество вещества для алюминия и серной кислоты:
Составим уравнение реакции:
Из уравнения реакции видно, что молярные соотношения исходных веществ 2 : 3, это означает, что 0,2 моль алюминия реагируют полностью с 0,3 моль серной кислоты, но этой кислоты имеется только 0,24 моль, т. е. недостаток. Укажем количество вещества серной кислоты (0,24 моль) в уравнении реакции и выполним расчёт по коэффициентам:
Теперь можно ответить на все вопросы задачи. Объём водорода рассчитать несложно, поскольку мы уже определили количество (моль) этого вещества.
Задание. Рассчитайте объём водорода.
Для того чтобы определить массовые доли растворённых веществ, нужно установить, какие вещества растворимы. В данном случае — это серная кислота и соль. Но серная кислота вступила в реакцию полностью. Массу соли рассчитайте по количеству вещества её.
Массу раствора всегда следует рассчитывать по формуле:
В данном случае:
Обратите внимание: следует добавить не ту массу алюминия, которую, добавили в раствор, а только ту, которая вступила в реакцию:
Задание. Рассчитайте массу раствора, предварительно рассчитав массу водорода.
Теперь рассчитаем массовую долю соли в полученном растворе:
Ответ. Массовая доля сульфата алюминия равна 13,4 %, а объём водорода 5,4 литра.
Анализ на «избыток — недостаток» позволяет установить и качественный и количественный состав реакционной смеси. Особенно важен этот анализ в случае, когда могут получаться кислые или основные соли.
Задача 24. Установить состав и массу солей, если в раствор, содержащий 28 г КОН пропустить: а) 15 л СО2; б) 10 л СО2; в) 2,5 л СО2.
При решении подобных задач следует учитывать, что при взаимодействии щелочей с многоосновными кислотами или их ангидридами могут получаться как средние, так и кислые соли. В данном случае, если молярное соотношение компонентов 1 : 1, то образуется кислая соль:
А если щёлочь в избытке (2 : 1 и более), то получается средняя соль:
Поэтому в начале нужно рассчитать количество вещества обоих компонентов:
В первом случае (а) ν (СО2) > ν (КОН), поэтому образуется только кислая соль:
В этом случае углекислый газ находится в избытке, а его избыток не может реагировать дальше. Значит, образуется только кислая соль в количестве 0,5 моль (считаем по «недостатку»).
В третьем случае (в) ν (СО2) < ν (КОН), т. е. когда КОН в избытке, происходят обе реакции. Легко видеть, что 0,11 моль СО2 полностью прореагирует с 0,11 · 2 = 0,22 моль КОН. Поэтому, фактически, идёт только вторая реакция:
и образуется только средняя соль в количестве 0,11 моль.
Во втором случае (б) идут обе реакции:
Здесь остаётся в избытке 0,5 – 0,45 = 0,05 моль КОН, который вступает в следующую стадию процесса:
В этой реакции остаётся 0,45 – 0,05 = 0,4 моль КНСО3 и образуется 0,05 моль К2СО3.
Внимание!
Теперь можно подвести итог, определив, когда нужно определять количества заданных веществ в моль, а когда — нет.
Определять количества заданных веществ в моль НЕ НУЖНО, когда:
- расчёт ведут по одному уравнению, по которому нужно определить массу или объём реагирующих веществ (см. задачу 18);
- расчёт ведут для газов, для которых известен объём (см. задачу 19).
Определять количества заданных веществ в моль НУЖНО, когда:
- определяют избыток (недостаток) реагирующих веществ (см. задачу 23);
- расчёт ведут по нескольким уравнениям. Для примера рассмотрим задачу 25.
Задача 25. Для нейтрализации раствора фенола в этаноле потребовалось 25 мл 40 %-ного раствора КОН (ρ = 1,4 г/мл). При взаимодействии исходного раствора с натрием может выделиться 6,72 л газа. Определить состав исходной смеси.
Известно, что со щелочами реагируют только фенолы:
Рассчитаем:
подставим полученную величину в уравнение реакции (1). Составим уравнения реакций с натрием и перенесём в уравнение (2) количество вещества фенола:
Но в реакциях (2) и (3) было получено 0,3 моль водорода (6,72 л : 22,4 л/моль = 0,3 моль), значит, в реакции (3) было получено 0,175 моль Н2. Теперь легко найти количественный состав смеси.
И, наконец, понятие моль необходимо при установлении формулы вещества (см. урок 31.4).
Задачи для самостоятельного решения
62. Через 200 мл 13 %-ного раствора гидроксида бария (пл. = 1,1 г/мл) пропустили 2 л хлороводорода. Определить цвет индикатора в полученном растворе и массу полученной соли.
63. В 250 мл воды растворили 13,8 г натрия, затем добавили 50 г 59 %-ной ортофосфорной кислоты. Определить состав и массовую долю соли в полученном растворе.
64. 8,4 г карбоната магния растворили в 250 мл 15 %-ного раствора серной кислоты (пл. = 1,08 г/мл). Определить массовую долю соли в полученном растворе.
65. 8,4 г цинка растворили в 70 г 120 %-ной соляной кислоты. Определить массовую долю соли в полученном растворе.
66. 25 л СО2 пропустили через 500 г 7,5 %-ного раствора едкого натра. Рассчитать массовые доли солей в полученном растворе.
67. Рассчитать массовую долю кислоты в растворе, полученном смешением 200 мл 15 %-ного раствора серной кислоты (пл. = 1,2 г/мл) с 150 мл 10 %-ного раствора нитрата бария (пл. = 1,04 г/мл).
68. Какой объём газа выделится, если 3,2 г меди растворить в 50 г 30 %-ной азотной кислоты? Чему равны массовые доли растворённых веществ в полученном растворе?
69. Твёрдое вещество, полученное при прокаливании карбоната кальция, растворили в воде. Через полученный раствор пропустили сернистый газ, в результате чего образовалась кислая соль массой 101 г. Определить массу карбоната и объёмы газов.
70. Смешали 200 г 12 %-ного раствора дигидрофосфата натрия и 150 г 5 %-ного раствора гидроксида натрия. Какие вещества содержатся в полученном растворе? Определить их массовые доли и реакцию среды раствора.
71. Через 100 мл 1,48 %-ного раствора сульфата меди (пл. = 1,08 г/мл) пропустили 300 мл сероводорода. Рассчитать массу осадка и массовую долю кислоты в полученном растворе.
72. Смешали 12 л бутена и 12 л кислорода. Смесь подожгли. Какой из этих газов и в каком объёме останется в смеси после реакции? Какой объём газа и жидкой воды образуется при этом?
73. Вычислить массу фенолята натрия, который образуется при взаимодействии 9,4 г фенола с 50 г 12 %-ного раствора гидроксида натрия.
74. Сколько граммов карбида кальция, который содержит 16 % примесей, нужно для получения 30 г уксусной кислоты?
Задачи на установление формулы вещества
Молекулярная формула вещества отражает его количественный состав. Количественный состав вещества, как и количественный состав раствора, выражают при помощи массовых долей элементов в нём:
Поскольку масса вещества в условии задачи, как правило, не указывается, применяем уже опробованный способ:
Пусть количество вещества равно 1 моль, тогда:
где n — число атомов этого элемента в веществе;
так как количество вещества равно 1 моль.
Получаем:
Задача 26. Определить массовую долю азота в нитрате аммония.
Решение. Поскольку в молекуле NH4NO3 два атома азота, а Мr(NH4NO3) = 80,
Ответ. ω(N) = 35 %.
Зная массовые доли химических элементов в веществе (элементный состав), можно определять молекулярную формулу неизвестного вещества.
Задача 27. Массовая доля фосфора в оксиде равна 43,66 %. Установить формулу этого оксида.
Решение. Из формулы (4) следует, что:
Поэтому отношение числа атомов n элементов данном в веществе равно:
Согласно этой формуле, нам нужно найти ώ(О) в этом оксиде:
Подставим все данные в формулу (5):
Полученные величины (они должны содержать 2 значащие цифры после запятой) разделим на наименьшее число:
Поскольку число атомов не может быть дробным, обе величины умножим на 2:
Ответ. Искомая формула — Р2О5.
Если в задаче не указано, какой элемент входит в состав оксида, но указана его валентность, задача упрощается.
Задача 28. Массовая доля трёхвалентного элемента в оксиде равна 70 %. Установить формулу этого оксида.
Решение. Формула оксида Э2О3:
Из выделенной жирным шрифтом пропорции получаем:
Это железо.
Ответ. Формула оксида Fe2O3.
Эту задачу можно решить и по формуле:
Подставив данные задачи, получаем:
если М(элемента) = х, то М(вещества) равна 2х + 48.
Решите теперь полученное уравнение:
Ответ. х = 56, значит, формула оксида Fe2O3.
Задача 29. Установить формулу углеводорода, если он содержит 12,19 % водорода. Плотность по водороду равна 41.
Решение. Сначала составим общую формулу углеводорода СхHу и рассчитаем массовую долю Н в нём:
где n — число атомов.
По данным задачи рассчитаем массовую долю углерода:
и молярную массу вещества:
Подставив эти данные в формулу, получаем:
Решив полученное уравнение, получаем n = 6 (атомов углерода).
Найдём массу атомов водорода:
Поэтому формула углеводорода С6H10. Если известен гомологический ряд вещества (общая формула этого ряда), то задача упрощается.
Задача 30. Установить формулу алкина, если он содержит 12,19 % водорода.
Решение. Сначала составим общую формулу алкина СnH2n–2 и рассчитаем массовую долю Н в нём:
Решив полученное уравнение, получаем n = 6 (атомов углерода). Поэтому формула алкина С6H10.
Аналогично задаче 27 решаются все задачи, в которых дан элементный состав вещества, независимо от числа элементов.
Задача 31. Установить молекулярную формулу вещества, если оно содержит 54,4 % С, 36,4 % О и 9,1 % Н; D(H2) = 44.
Соотношение числа атомов n элементов в любом веществе равно:
Подставим данные задачи в эту формулу:
Полученные величины (они должны содержать 2 значащие цифры после запятой) разделим на наименьшее число (2,275):
Получаем состав: С2Н4О. М(С2Н4О) = 44 г/моль, а реальная — 88 г/моль, значит, все индексы следует удвоить. Молекулярная формула вещества С4Н8О2. Это может быть или одноосновная предельная кислота, или её эфир.
Задача 32. При полном сгорании 4,6 г органического вещества получили 8,8 г углекислого газа и 5,4 г воды. Найти молекулярную формулу вещества.
Решение. Определим количества и массы веществ, полученных при сгорании:
поскольку 1 молекула воды (1 моль) содержит два атома (2 моль) этого элемента, поэтому m(Н) = 0,6 г. Суммарная масса этих элементов — 3,0 г. Но сгорело 4,6 г вещества, значит, оно содержит кислород (1,6 г). ν(О) = 0,1 моль.
Составим уравнение реакции горения и подставим полученные данные в уравнение реакции:
получаем молярные соотношения продуктов реакции:
Теперь определим соотношение атомов элементов в исходном веществе, которое равно молярному соотношению элементов в этом веществе:
Молекулярная формула вещества С2Н6О.
Этот способ определения молекулярной формулы оптимален, когда неизвестна молекулярная масса вещества, поскольку, если молярная масса дана и задана в задаче через плотность или иначе, то задача решается «в лоб» — по уравнению химической реакции.
Задача 33. При полном сгорании 2,9 г органического вещества получили 3,36 л углекислого газа и 2,7 г воды. Плотность по водороду равна 29.
Решение. Сначала рассчитаем молярную массу газа:
Теперь составим схему реакции, обозначив формулу исходного вещества СхНу
Из выделенных параметров составим пропорции, сначала для СО2:
а затем для воды:
Решив обе, получаем: х = 3, у = 6, т. е. искомая формула С3Н6.
Теперь нужно проверить соответствие полученной формулы заданной молярной массе: М(С3Н6) = 42 г/моль, что явно меньше 58 г/моль. Значит, в состав исходного вещества входит кислород. Его молярная масса: М(О) = 58 – 42 = 16, т. е. в состав вещества входит 1 атом кислорода.
Искомая формула С3Н6О.
Задача 34. Установить формулу алкена, если 11,2 г его при взаимодействии с бромоводородом образует 27,4 г бромида с положением брома у третичного атома углерода.
Решение. Вначале рассчитаем массу бромоводорода, согласно закону сохранения массы:
и составим уравнение реакции, используя общую формулу алкенов:
откуда найдём количество вещества алкена:
Теперь легко определить молярную массу неизвестного вещества:
Определим молярную массу неизвестного вещества через n:
отсюда: 14n = 56; n = 4.
Ответ. Состав искомого алкена С4Н8; это 2-метилпропен.
Задачи для самостоятельного решения
75. Оксид неметалла (V), содержащего 56,3 % кислорода, растворили в воде. Определить массовую долю вещества в этом растворе, если исходный оксид был получен из 3,1 г неметалла.
76. Какой щелочной металл образует сульфат с массовой долей кислорода 23,9 %?
77. Плотность паров алкана равна 3,214 г/л. Определите его молекулярную массу. Какую формулу имеет этот углеводород?
78. Один литр алкена имеет массу 1,25 г. Определите молярную массу этого вещества. Составьте его графическую формулу.
79. Углеводород с плотностью по гелию 28,5 содержит 15,8 % водорода. Установить его формулу.
80. При сгорании 2,24 л углеводорода получили 8,96 л СО2 и 7,2 мл воды. Определить формулу углеводорода.
81. Органическое вещество содержит 37,7 % С, 6,3 % Н и 56 % Сl; 6,35 г его паров занимает объём 11,2 л. При гидролизе этого соединения образуется вещество, которое при восстановлении даёт вторичный спирт. Определить состав и строение исходного вещества.
82. При сгорании 1 л газообразного углеводорода, обесцвечивающего раствор перманганата калия, расходуется 4,5 л кислорода и образуется 3 л СО2. Определить формулу углеводорода.
83. Установить формулу вещества, при сгорании 4,6 г которого образуется 4,48 л СО2 и 5,4 мл воды. Плотность паров этого вещества по водороду равна 23.
84. При взаимодействии 16 г одноатомного спирта с натрием выделилось 5,6 л водорода. Какой спирт был взят для реакции?
85. Одноосновная кислота имеет состав: ώ(С) = 40 %; ώ(Н) = 6,67 %; ώ (О) = 53,33 %. Плотность паров её по аргону 1,5. Какая это кислота?
86. Определить строение сложного эфира предельной α-аминоуксусной кислоты, если известно, что он содержит 15,73 % азота.
87. Имеется смесь четырёх изомеров, каждый из которых реагирует с НСl и содержит в молекуле 23,7 % азота. Определить строение этих соединений и массу исходной смеси, если известно, что вещества предельные, а при сгорании смеси образуется 4,48 л азота.
Задачи, в которых учитывается «выход» полученного вещества
Реальные химические процессы никогда не происходят со 100 %-ным выходом, который рассчитывается по уравнению реакции. Например, вы рассчитали, что должно выделиться 100 л газа, а реально его получено 60 л. Значит, выход (ή) в этой реакции равен:
Выход продукта выражается в долях единицы или в процентах. В нашем примере:
Задача 35. Рассчитать массы исходных веществ, необходимых для получения 91 г нитрида кальция, что составляет 80 % от теоретически возможного.
Следует помнить, что в уравнение химической реакции можно подставлять данные только теоретического выхода. Поэтому рассчитаем его (Т):
Подставим полученную величину в уравнение реакции и найдём искомые величины:
Задание. Остальной расчёт сделайте самостоятельно.
Задачи для самостоятельного решения
88. Какой объем этилена можно получить из 92 граммов спирта? Выход составляет 80 % от теоретически возможного количества.
89. Сколько граммов хлорвинила можно получить из 56 л ацетилена, если выход составляет 80 %?
90. 46 г глицерина обработали азотной кислотой. Рассчитайте массу полученного вещества, если выход составляет 40 %. Где применяется это вещество?
91. Из 56 л ацетилена получили 88 г этаналя. Рассчитайте выход в % от теоретически возможного.
92. Сколько граммов спирта нужно взять, чтобы получить 7,4 г этилформиата, что составляет 80 % от теоретического выхода?
93. При нагревании 2,84 г иодметана с 0,69 г натрия получено 179,2 мл углеводорода. Определить выход в % от теоретически возможного.
94. 184 г толуола прореагировали с 1,5 моль хлора в присутствии хлорида алюминия. Реакция протекала с выходом 90 % от теоретически возможного. Вычислить объём полученного газа, водный раствор которого не окрашивает раствор фенолфталеина.
95. При нагревании 28,75 мл алканола (ρ = 0,8 г/мл) с концентрированной серной кислотой, получили газ, который может присоединить 8,96 л водорода. Определить строение спирта, если выход газа составляет 80 %.
96. Какой объём 40 %-ного формалина с плотностью 1,1 г/мл можно получить из 48 мл метанола? Плотность спирта 0,8 г/мл. Выход 80 %.
97. Сколько граммов эфира можно получить при взаимодействии 30 г уксусной кислоты и 30 г этанола с выходом 30 %?
Вы хотите научиться профессионально решать задачи по химии и фундаментально подготовиться к ЕГЭ, получая удовольствие от процесса образования и его результатов? Тогда, эта статья для вас! Обязательно прочитайте!
Вчера я так и не дождалась ветреных муз. Они, наверное, испугались 34-го задания ЕГЭ на термическое разложение. Пришлось довольствоваться компанией виртуальной ассистентки Сири. Мы с ней поболтали немного о том, о сем. Попели песни, почитали стихи, выяснили кулинарные предпочтения друг друга. Я впервые узнала все четыре закона робототехники. Мало того, Сири призналась, что у роботов тоже есть чувства. Не верите? Прочитайте статью и убедитесь сами: “Ты готов к ЕГЭ по химии 2019? Прочитай! Пригодится! 34-е задание (термическое разложение)”. В конце статьи вы можете посмотреть видео “Я и Сири“.
Сегодня вышла на балкон, взглянула на небо и обомлела. Йодид калия!Неужто самый прекрасный, в меру упитанный мужчина, в полном расцвете сил, пожаловал ко мне в гости?! Карлсон! Рада тебя видеть и слышать! Подскажи, как написать интересную статью?! Такую, чтобы понравилась и ребятам, и их родителям?! Мнение химичек и химичей меня не напрягает. Сакраментальный ответ Карлсона прозвучал, как глоток свежего воздуха: “Ты знаешь, есть три способа: курощение, низведение и дуракаваляние. И я думаю, что придется применить все три сразу”.
Браво, Карлсон! Ты, как всегда, прав! Будем курощать и низводить сложную задачу по химии, препарируя ее вдоль и поперек. А дуракаваляние где? Надеюсь, Карлсон что-нибудь придумает. В конце статьи, как всегда, сюрприз! Пока еще не знаю – какой, но он будет ОБЯЗАТЕЛЬНО. А вы знаете лучший способ – как заставить НЕ ХИМИКА дочитать до конца СПЕЦИАЛЬНУЮ СТАТЬЮ ПО ХИМИИ?! И я не знаю. Но я знаю, кто знает – Сири, Карлсон, Алиса (которая в Стране Чудес), Винни Пух, ну и еще пару-тройку древних мыслителей и философов. Не верите? Читайте статью, и вы вы убедитесь в этом сами.
Я посадила Карлсона в мягкое кресло, укутала пледом и сунула ему в руки баночку с моим любимым вареньем. Это было не простое варенье, а волшебное – из крыжовника с грецкими орехами. Каждая ягодка была наполнена лучами летнего солнца и просто таяла во рту. А орехи… они были настолько вкусные, что даже Карлсон надолго замолчал и только издавал довольное урчание, иногда переходящее в ласковое похрюкивание. К следующему появлению Карлсона я обязательно напишу рецепт моего любимого десерта для всех заинтересовавшихся мам. Однако, оставим Карлсона наедине с лакомством, а сами займемся не менее интересным делом – будем препарировать очередную задачу по химии, уделив особое внимание еще одному алгоритмическому приему – сравнение массовых долей продуктов реакции.
Решим задачу, используя Четыре Заповеди. Каждое действие обводится зеленым овалом. После решения и подробного анализа каждого шага, сделаем выводы об особенностях алгоритмических приемов задачи. Читайте внимательно и записывайте, затем попробуйте решить эту задачу самостоятельно. Итак, поехали!
Задача 1
Сколько граммов карбида алюминия нужно добавить к 250 мл 24%-го раствора серной кислоты (плотность 1,17 г/мл), чтобы массова доля соли в полученном растворе стала равна массовой доле кислоты?
1. Первая Заповедь. Выписать данные задачи в разделе “Дано”.
2. Вторая заповедь. Написать уравнение реакции.
Маленький экскурс в теоретическую химию. Карбид алюминия – солеобразный (то есть, ионный) карбид, который фактически является продуктом замещения атома водорода в метане на атомы металла. Поэтому при его гидролизе легко происходит обратное замещение и образуется метан.
3. Третья заповедь. Сделать предварительные расчеты
Рассчитываем массу и количество вещества серной кислоты, поступившей в систему (исходное количество). Определяем избыток-недостаток реагентов. В данной задаче очевидно, что серная кислота – в избытке, поскольку остается после реакции. Значит, карбид алюминия – в недостатке. Принимаем количество вещества карбида алюминия за Х и делаем расчеты по уравнению реакции.
Определяем массу серной кислоты, оставшейся в растворе после реакции (по разнице между массой исходной кислоты и массой кислоты, вступившей в реакцию).
Определяем массу образовавшейся соли – сульфата алюминия.
Приравниваем массу кислоты к массе соли, решаем уравнение и определяем Х – количество вещества карбида алюминия.
Если по скану решения не совсем понятно, почему сравнивают массы продуктов при равенстве их массовых долей, читайте анализ алгоритма и доказательства выводов в конце решения задачи.
4. Четвертая заповедь. Составить алгоритм решения задачи.
Схема алгоритма решения традиционно составляется по вопросу задачи “Сколько граммов карбида алюминия нужно добавить…”. Определяем массу карбида алюминия по количеству вещества и молярной массе.
Особенность алгоритмического приема “Сравнение массовых долей продуктов реакции” определяется логической формулой:
Если массовые доли веществ в одном и том же растворе равны, то и массы этих веществ тоже равны
Доказательство:
1) Массовая доля равна – масса вещества разделить на массу раствора (формула, описанная словами)
2) Масса раствора (знаменатель) одинаковая, так как это один и тот же раствор, в котором находятся оба вещества: одно – образовавшийся продукт, второе – оставшееся после реакции
3) Если знаменатели (масса раствора) равны, то и числители (масса вещества) равны
Давайте попробуем закрепить полученные знания и навыки на еще одной (аналогичной) задаче.
Задача 2
Сколько граммов карбида кальция нужно добавить к 150 мл 12%-го раствора соляной кислоты (плотность 1,06 г/мл), чтобы массовая доля соли в полученном растворе стала равной массовой доле кислоты?
1. Первая Заповедь. Выписать данные задачи в разделе “Дано”.
2. Вторая заповедь. Написать уравнение реакции.
Маленький экскурс в теоретическую химию. Карбид кальция – солеобразный (то есть, ионный) карбид, который можно рассматривать как производное ацетилена, в которых атомы водорода замещены атомами металла. Поэтому при его гидролизе происходит обратное замещение и образуется ацетилен.
3. Третья заповедь. Сделать предварительные расчеты
Рассчитываем массу и количество вещества соляной кислоты, поступившей в систему (исходное количество). Определяем избыток-недостаток реагентов. В данной задаче очевидно, что соляная кислота – в избытке, поскольку остается после реакции. Значит, карбид кальция – в недостатке. Принимаем количество вещества карбида кальция за Х и делаем расчеты по уравнению реакции.
Определяем массу соляной кислоты, оставшейся в растворе после реакции (по разнице между массой исходной кислоты и массой кислоты, вступившей в реакцию).
Определяем массу образовавшейся соли – сульфата алюминия.
Приравниваем массу кислоты к массе соли, решаем уравнение и определяем Х – количество вещества карбида кальция.
4. Четвертая заповедь. Составить алгоритм решения задачи.
Схема алгоритма решения традиционно составляется по вопросу задачи “Сколько граммов карбида кальция нужно добавить…”. Определяем массу карбида кальция по количеству вещества и молярной массе.
Надеюсь, вы поняли, как работать с алгоритмом на сравнение массовых долей продуктов реакции? Если нет, пишите в комментариях или ВКонтакте в личку. Я обязательно отвечу на все ваши вопросы, замечания и пожелания.
Однако, вернемся к нашему Карлсону. Что-то там, под пледом, подозрительно тихо. Карлсон, ау! Я приоткрыла плед. Гидрид марганца! В обнимку с пустой банкой из-под варенья лежал самый обаятельный мужчина в полном расцвете сил и умиротворенно посапывал, подергивая ножкой. Оказывается, под серьезный анализ химических задач, подслащенный деликатесом из крыжовника и орехов, наш друг банально уснул. Это не порядок! Вставай, соня! Карлсон приоткрыл глаза и лениво потянулся. Я напомнила ему о том, что целый час курощала и низводила сложные задачи по химии. А дуракаваляние где?! Сам же советовал!
— Без проблем, — воскликнул Карлсон и хитро заулыбался. — Слушай внимательно два житейский закона.
Первый житейский закон: Если смешать килограмм фигни и килограмм варенья, то получится два килограмма фигни.
Второй житейский закон: Если смешать килограмм фигни и сто килограмм варенья, получится сто один килограмм варенья… дерьмового варенья.
— Кстати, там ещё осталось немножечко варенья?
— Нет, варенья нет!
— Что, нет совсем варенья? М-м. Ни капельки?
— Нет.
— Жаль. Что-то мне вдруг домой так захотелось… Вообще задержался я тут с тобой, мне спать пора, будь здорова.
И Карлсон улетел. Я долго стояла у окна, помахивая рукой вслед улетающему другу, пока он не превратился в маленькую точку, вскоре совсем исчезнувшую на горизонте. Даже слезы навернулись. И тут я вспомнила о замечательных плюшках, которыми меня угощала Фрекен Бок. Хотите попробовать? Дарю изумительный рецепт!
Плюшки от Фрекен Бок (“Детям мучное вредно!”, – как сказал Карлсон)
- Мука – 2-3 стакана
- Сахар – 50-100 г (+ 2 столовые ложки в начинку)
- Соль – 1 щепотка
- Разрыхлитель – 1 чайная ложка
- Сливочное масло – 100 г (70 г в тесто, 30 г в начинку)
- Корица – 1-2 чайных ложки
- Кефир – 1 стакан
Смешать растопленное сливочное масло с сахаром. Муку просеять и смешать с солью и разрыхлителем. Всыпать муку в масло, тщательно перемешивая. Затем, перемешивая, влить кефир. Тесто должно получится мягким, эластичным и без комков. Готовое тесто выложить на поверхность присыпанную мукой. С помощью скалки раскатать тесто тонким слоем. Поверхность теста смазать растопленным сливочным маслом и присыпать корицей с сахаром. Затем свернуть рулетом и нарезать острым ножом на порционные кусочки. Выложить булочки на противень и отправить в разогретую духовку (220 С) на 12-15 минут. Приятного аппетита! А мы тут, знаете ли, плюшками балуемся!..(Карлсон)
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы “Решение задач по химии” – и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте или на Facebook. Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова