В ЕГЭ по химии несколько расчетных задач. Три из них относительно просты. Это задача на растворы (№27) и задачи, связанные с расчетами по химическому уравнению (№№ 28 и 29).
Более сложная задача на нахождение массовой доли вещества в смеси
(№ 34) отличается своеобразием как в химизме, так и в расчетах. В основе этой задачи как минимум 2 последовательных или параллельных реакции различных типов, включая электролиз и гидролиз. Набор реагентов, промежуточных веществ и продуктов – самый разнообразный, от олеума до кислых и комплексных солей.
Особенности расчетов связаны с использованием растворимости веществ, избытка одного из реагентов, неполнотой протекания реакции или использования реакционной смеси, применением в реакции металлической пластинки и т.д.
Можно сказать, что 34 задача – один из самых «грозных» вопросов ЕГЭ по химии. По силу справиться с ней только тому, кто не допустит ошибок в химизме и правильно выберется из лабиринта расчетов.
В интернете представлено множество видеоматериалов и статей, направленных на помощь школьникам в решении этой задачи. Общим для большинства материалов является подход, учитывающий особенности оценки 34 задачи: сперва – рекомендуется написать все уравнения, затем – выявить логику решения и в соответствии с ней провести расчеты. Этот подход сформировался в то время, когда задание на нахождение массовой доли было проще и «прозрачнее» (см.таблицу).
Для устранения (уменьшения) этих проблем мною при обучении школьников решению 34 задачи применяется прием «step by step» (шаг за шагом). Его сущность заключается в анализе каждого предложения текста задачи, извлечении из него максимума информации, и только после этого мы переходим к следующему предложению. В этом случае на каждый этап решения задачи ученик приходит уже полностью вооруженным информацией о составе реакционной смеси. Это дает ему возможность более успешно определиться с химизмом и логикой последующего решения.
Продемонстрирую данный прием на решении задач, приведенных в таблице.
1. Задача 2018 года
Для проведения электролиза (на инертных электродах) взяли 282 г 40%-ного раствора нитрата меди(II). После того как масса раствора уменьшилась на 32 г, процесс остановили. К образовавшемуся раствору добавили 140 г 40%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
Необходимо отметить, что я давно перестала заносить числовую информацию в раздел «Дано». Причины – в ЕГЭ не оценивается наличие этого раздела, на его запись тратится драгоценное время, а самое главное – прием «step by step» позволяет обходиться без дополнительного акцентирования внимания на числах.
При оформлении решения буду выделять цель каждого действия.
Решение.
1. Цель – анализ и использование информации из 1 предложения
«Для проведения электролиза (на инертных электродах) взяли 282 г 40%-ного раствора нитрата меди(II)».
а) уравнение реакции:
2Cu(NO3)2 +2H2O=2Cu↓+O2↑+4HNO3(1)
б) находим количество вещества Cu(NO3)2:
n Cu(NO3)2=282*0,4/188=0,6моль
2. Цель – извлечение максимума информации из 2 предложения
«После того как масса раствора уменьшилась на 32 г, процесс остановили».
а)Из уравнения реакции (1) видно, что 32 г= m(Cu)+m(O2)
На основании этой информации находим количество вещества Cu и O2.
Пусть n O2 = х моль, тогда n Cu = 2 х моль
32х+64*2х=32, откуда х=0,2 моль.
n O2= 0,2 моль, n Cu = 0,4 моль
б) на основании полученных результатов по уравнению реакции (1) находим количества
образовавшейся HNO3: n HNO3 = 0,8 моль
прореагировавшей Cu(NO3)2 : n Cu(NO3)2 прореаг = 0,4 моль
оставшейся в растворе Cu(NO3)2 : n Cu(NO3)2 оставш = 0,6-0,4 =0,2 моль
в) найдем массу образовавшегося раствора:
m пол.рра= m исх.рра –Δm=282-32=250 г
г) подведем итоги: в образовавшемся растворе содержатся
n HNO3 = 0,8 моль, n Cu(NO3)2 оставш = 0,2 моль, m пол.рра= 250 г
3. Цель – анализ и использование информации из 3 предложения
«К образовавшемуся раствору добавили 140 г 40%-ного раствора гидроксида натрия».
а) напишем уравнения потенциально возможных реакций между образовавшимся раствором и щелочью:
HNO3 +NaOH=NaNO3 +H2O (2)
Cu(NO3)2 + 2NaOH=NaNO3 +Cu(OH)2↓ (3)
б) найдем n NaOH исх =140*0,4/40=1,4 моль
найдем n NaOH прореаг = 0,8+0,2*2=1,2 моль (по 2 и 3 реакциям)
n NaOH оставш.=1,4-1,2=0,2 моль
в) найдем массу конечного раствора:
m кон.рра= 250 + m рра NaOH – m Cu(OH)2 =250+ 140-0,2*98=370,4 г
4.W(NaOH)=100*0,2*40/370,4=2,16%
Задача 2019 года
Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 200 мл воды. Раствор разлили на две колбы. К раствору в первой колбе добавили избыток соляной кислоты, при этом выделился газ объёмом 4,48 л (н.у.). К раствору во второй колбе добавили 222 г 25%-го раствора хлорида кальция. Определите массовую долю хлорида кальция в конечном растворе во второй колбе.
Решение.
1. Цель – извлечение максимума информации о приготовленном растворе
«Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 200 мл воды.».
а)найдем массу и количество вва Na2CO3, растворившегося в 200 мл воды:
В 100 г воды ——–31,8 г Na2CO3
В 200 г воды ———х г Na2CO3, откуда х=63,6 г
n Na2CO3=63,6/106=0,6 моль
б)найдем массу раствора: m рра=200+63,6=263,6г
2. Цель – анализ и использование информации из 2 предложения
«К раствору в первой колбе добавили избыток соляной кислоты, при этом выделился газ объёмом 4,48 л (н.у.).».
а)уравнение реакции
Na2CO3 +2HCl=2NaCl+CO2↑+H2O (1)
n(CO2)=4,48/22,4=0,2моль
б)найдем количество вва Na2CO3 в первой колбе
n1 Na2CO3=0,2 моль
в)найдем количество вва Na2CO3 и массу раствора во второй колбе
n2 Na2CO3=0,6-0,2 =0,4 моль, m2 раствора= 263,6*0,4/0,6=175,7 г
3. Цель – извлечение максимума информации из 3 предложения
«К раствору во второй колбе добавили 222 г 25%-го раствора хлорида кальция. Определите массовую долю хлорида кальция в конечном растворе во второй колбе».
а) уравнение :
Na2CO3 +СаCl2=2NaCl+СаСО3↓ (2)
Б)найдем n исх СаCl2=222*0,25/111=0,5 моль
Из условия задачи следует, что СаCl2- в избытке
Тогда n прореаг СаCl2= n2 Na2CO3=0,4 моль
n СаCl2 оставш=0,5-0,4=0,1 моль
в) найдем массу конечного раствора во второй колбе:
m кон.рра= 222+175,7- mСаСО3 =222+175,7-0,4*100=357,7 г
4.W(СаCl2)=100*0,1*111/357,7=3,1%
Таким образом, на двух примерах был продемонстрирован прием «step by step», упрощающий решение сложных многостадийных задач.
В следующей публикации будет разобрано решение этим приемом задач с участием кислых и комплексных солей.
Ни для кого не секрет, что задача 34 в ЕГЭ по химии — самое сложное. По статистике ФИПИ только 8,3% выпускников справляются с ним, поэтому большинство сдающих ЕГЭ даже не читает условие этой задачи — и зря. В статье объясняю, как подойти к заданию 34, и даю советы по решению.
В этой статье:
Задача 34 по химии: суть и критерии оцениванияПошаговый разбор реального задания 34

Задача 34 по химии: суть и критерии оценивания
Задание 34 в ЕГЭ по химии — это расчетная задача высокого уровня сложности. Чтобы успешно решить ее, вам необходимо знать химические свойства веществ, уметь устанавливать логические связи между реакциями, применять расчетные формулы для нахождения количества вещества, массы и объема, массовой доли вещества в смеси.
Для получения максимально возможных 4 баллов за задачу 34 вам предстоит:
- записать все уравнения реакций, описанных в тексте (1 балл);
- рассчитать количества вещества всех известных и искомых веществ (1 балл);
- провести анализ и рассчитать искомые величины (1 балл);
- дать правильный ответ и безошибочно оформить решение (1 балл; снимается за отсутствие размерных величин — больше трех, также за математические ошибки)
Но слова в сторону, нам нужна успешная пошаговая стратегия: что делать, чтобы не получить за этот номер 0?
ЕГЭ по химии — в принципе достаточно сложный экзамен. Чтобы получить за него высокий балл, нужно хорошо постараться. Так, необходимо хорошо знать теорию и формулы, уметь выводить уравнения без ошибок, понимать, как правильно читать задания (в них могут быть ловушки!) и оформлять ответы по критериям. И все это — за ограниченный период времени.
Чтобы не стрессовать на экзамене и показать лучший результат, записывайтесь ко мне на курсы подготовки к ЕГЭ по химии. Мы изучим только то, что гарантированно пригодится вам на экзамене: ничего лишнего, только актуальные знания. А пробные экзамены, которые мы обязательно проводим, помогут понять, что ЕГЭ — совсем не такое страшное. Приходите к нам — за знаниями и спокойствием!
Пошаговый разбор реального задания 34

Уровень «Новичок»
Вы выбрали химию для поступления и готовились к ЕГЭ минимум год. Вам абсолютно под силу записать уравнения реакций, описанных в тексте. Чаще всего здесь встречаются реакции обмена, замещения и разложения, ОВР, электролиз и совместный гидролиз. Правильно записанные реакции с расставленными коэффициентами дают 1 первичный балл за 34 задачу в ЕГЭ по химии.
ШАГ 1. Запишите все уравнения реакций, о которых идет речь в тексте
Если возможны вариации одной и той же реакции, рассмотрите их на черновике (например, получение средних/кислых солей, образование амфотерного гидроксида/ комплексной соли и т.п.). Какую реакцию оставить, вы поймете после получения первых результатов расчета.
Совет: повторите перед экзаменом тривиальные названия. Например, если вы не знаете, что такое «железная окалина», то ни записать реакцию, ни решить данную задачу не удастся 🙃
Смесь железной окалины и оксида железа III растворяют в азотной концентрированной кислоте. Запишем их по очереди. Железная окалина содержит железо в степени окисления +2, отсюда и протекание окислительно-восстановительной реакции: железо повышает степень окисления до +3, а азот изменяет свою степень окисления с +5 до +4. Вторая реакция представляет собой классическую реакцию обмена:
Fe3O4 + 10HNO3 = 3Fe(NO3)3 + NO2 + 5H2O
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
Образовавший газ (это NO2, полученный в первой реакции) взаимодействует с гидроксидом натрия:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
ИТОГО: +1 балл
С одним пунктом вы справились. Далее запишите «дано». Баллов за эту запись вам не добавят, но при этом вы сможете увидеть все известные величины и помнить, что необходимо найти.
Дано:
N(Fe) : N(O) = 7 : 10
mp-p(HNO3) = 500 г
mp-p(NaOH) = 20 г
w(NaOH) = 20%
Найти:
w(Fe(NO3)3) — ?
Уровень «Мастер»
Вы готовы сделать больше, чем записать уравнения реакции. Вы помните основные расчетные формулы и можете найти количество вещества по заданной массе и объему.
ШАГ 2. Используйте известные числовые значения, чтобы рассчитать количества вещества всех необходимых участников реакций
Переходим к действию. Нужно найти вещество, о котором мы все знаем. В приведенном примере это гидроксид натрия. Необходимо рассчитать количество вещества. Используем для этого основные расчетные формулы:
NaOH
mp-pa = 20 г
w = 0,2
m = mp-pw = 20 × 0,2 = 4 г
М = 40 г/моль
n = m : M = 4 : 40 = 0,1 моль
Задаем себе вопрос: что нам дает это значение? Каждый ответ должен вести к следующему действию. Так, мы можем рассчитать количество оксида азота IV – NO2, а благодаря ему получим количество вещества Fe3O4.
Совет: в задаче 34 по химии рассчитывайте сразу и количество вещества, и массу любого соединения, с которым работаете. Эти массы пригодятся при нахождении итогового раствора. А если не пригодятся, не переписывайте их в чистовик.
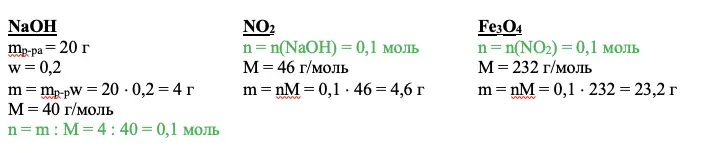
ИТОГО: +1 балл
Уровень «Гуру»
Вас не пугает уравнение с иксом в химии. Более того, вы можете его и составить, и решить.
ШАГ 3. Продумайте, как от найденных количеств вещества дойти по цепочке до искомого соединения
Что нужно найти дополнительно, чтобы получить ответ в задаче 34 по химии? Здесь может пригодиться работа с переменными, пропорции, соотношения и даже составление системы уравнений с двумя неизвестными.
Работаем!
Мы получили количества вещества нескольких соединений. Но так и не добрались до второй реакции и Fe2O3. Кроме того, мы не использовали соотношение атомов. Если вам ничего не дано для вещества по условию, а также вам не удалось подойти к нему через промежуточные расчеты, дело за уравнением. За х всегда принимайте количество неизвестного вещества.
Для нашего примера получим:
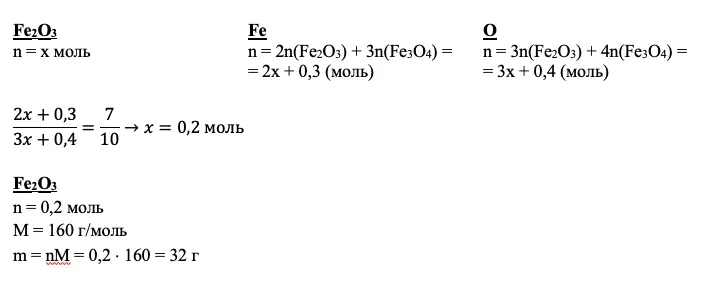
Совет: не пытайтесь принять за х все, что не получается рассчитать. Чаще всего задача 34 по химии решается без каких-либо переменных.
ИТОГО: +1 балл
Уровень «Профессионал»
Самое сложное уже позади. Теперь вам остается грамотно довести до конца. Обычно в завершении задачи требуется рассчитать массу полученного раствора и массовую долю вещества в нем. Чтобы не допустить ошибку на последнем этапе, помним, что в раствор входят все вещества, описанные в условии задачи, за исключением веществ, участвующих в реакциях сплавления, разложения и горения. Также обязательно нужно вычесть из этой массы потери. Потерями считаем осадки, газы, выпаренную воду, непрореагировавшие металлы и их оксиды.
ШАГ 4. Внимательно прочитайте вопрос задачи и рассчитайте искомую величину
Чаще всего необходимо вычислять массовую долю вещества в растворе. Предварительно вычислите массу полученного раствора с учетом всех потерь — осадков, газов и т.п.
В приведенном примере в раствор входит смесь железной окалины и оксида железа (III) и раствор азотной кислоты. Потеря — газообразное вещество NO2 (он же бурый газ).
mp-pa = m(Fe3O4) + m(Fe2O3) + mp-p(HNO3) – m(NO2) = 23,2 + 32 + 500 – 4,6 = 550,7 г
Зная количества вещества оксидов, вычислим количество вещества и массу искомой соли, а также ее массовую долю:

ИТОГО: +1 балл
Вот вы и решили 34 задачу в ЕГЭ по химии. Сложная ли она? Безусловно. Но можно ли с ней побороться? Да! Помните, что это задание, как и любое другое из второй части, оценивают согласно критериям. Не оставляйте его совсем без решения. Вы сможете остановиться на любом этапе и при этом принести в свою копилку больше, чем 0 баллов. А в пересчете на 100-балльную шкалу это будет уже весомо!
А если хотите научиться пошагово решать и другие задания из ЕГЭ по химии, записывайтесь ко мне на курсы подготовки к экзамену. Мы разберемся во всей теории, будем тренироваться в практических заданиях и научимся оформлять ответы в полном соответствии с критериями. Не теряйте возможность получить 80+ за ЕГЭ по химии — записывайтесь.
Решение расчётных задач по химии подчиняется логике и проводится по определенным алгоритмам. Прежде всего, нужно внимательно прочитать и проанализировать условие задачи, написать необходимые уравнения химических реакций. Важно осознать ключевой (главный) вопрос в задаче и понять, количество какого вещества следует найти и по количеству какого вещества будет производиться расчёт. На основе анализа условия определить причинно-следственные связи и составить план последовательности решения задачи. Почему мы главным вопросом задачи считаем нахождение количества вещества? По количеству вещества всегда можно найти его массу, объём и массу раствора (массу и объём газа) и ответить на возможные дополнительные вопросы, содержащиеся в задаче.
В рассматриваемых примерах мы не будем пояснять выполнение формальных расчётов, предполагая, что вы проводите их без затруднений.
Пример 1. Электролиз 470 г 5%-ного раствора нитрата меди(II) прекратили после того, как масса раствора уменьшилась на 8 г. Из полученного раствора отобрали порцию массой 92,4 г. Вычислите массу 11,2 %-ного раствора едкого кали, необходимого для полного осаждения меди из отобранной порции раствора.
А) Проводим анализ условия
(составляем уравнения химических реакций, о которых упоминается в условии задачи).
1-й фрагмент.
«Электролиз 470 г 5%-ного раствора нитрата меди(II) прекратили… ».

При проведении этого этапа стараемся не обращать внимания на численные значения, а выделяем только химическую часть условия – она выделена в тексте фрагмента полужирным шрифтом.
2-й фрагмент.
«…Из полученного раствора отобрали порцию массой 92,4 г. Вычислите массу 11,2 %-ного раствора едкого кали, необходимого для полного осаждения меди из отобранной порции раствора».

Необходимо понять: в смеси после реакции находятся продукты реакции (Cu, O2, HNO3) и исходные вещества, которые не прореагировали, были «в избытке» (Cu(NO3)2, H2O), и следует рассматривать возможность взаимодействия каждого из этих веществ с добавляемым реагентом.
Б) Устанавливаем логические связи (формулируем главный вопрос задачи, т.е. находим вещество, количество которого необходимо рассчитать, и логическую цепочку, связывающую количество этого вещества с веществами, количество которых мы знаем или можем вычислить).
Главный вопрос – найти количество KOH (прореагировавшего с HNO3 и Cu(NO3)2, находящимися в отобранной части раствора).

Выводы (логическая цепочка):
При проведении расчётов будем использовать уменьшение массы раствора на 8 г (единственная количественная величина, относящаяся к протеканию реакции), которое происходит за счёт осаждения меди и выделения кислорода.
1) Количество KOH связано с количеством Cu(NO3)2 и HNO3 в порции раствора (уравнения (2) и (3)).
2) Количество HNO3 связано с количеством Cu и O2, которые образовались в процессе электролиза (уравнение (1)).
3) Количество Cu(NO3)2 в растворе после электролиза (избыток Cu(NO3)2) связано с количеством выделившихся Cu и O2.
В) План решения задачи.
1) Найти количество Cu(NO3)2 до электролиза.
2) Найти количество образовавшейся HNO3 по количеству выделившихся Cu и O2 (уравнение 1).
3) По уменьшению массы (т.е. по количеству выделившихся Cu и O2) найти количество прореагировавшего Cu(NO3)2 по уравнению (1).
4) Найти количество непрореагировавшего Cu(NO3)2.
5) Найти количество Cu(NO3)2 и HNO3в отобранной порции раствора.
6) По количеству Cu(NO3)2 и HNO3 в порции найти количество прореагировавшего KOH.
7) Вычислить массу раствора KOH.
Г) Решение.
1) Находим количество вещества Cu(NO3)2 до электролиза.

2) По уравнению (1) находим количество прореагировавшего Cu(NO3)2:

Пусть прореагировало x моль Cu(NO3)2, тогда

г) 
3) По уравнению (1) находим количество прореагировавшего HNO3:
г) 
4) Находим количество вещества Cu(NO3)2 и HNO3 в отобранной порции раствора.
а) 
б) находим количество вещества Cu(NO3)2 с помощью пропорции – концентрация вещества одинакова как во всём растворе, так и в любой его части
а) 
в) находим количество вещества HNO3 в отобранной порции:
а) 
5) Находим количество KOH и массу добавленного раствора KOH.
а) По уравнению (2).

б) По уравнению (3).

в) 
Пример 2. Насыщенный раствор нитрата алюминия получили, растворив кристаллогидрат Al(NO3)3·12H2O (растворимость 241 г в 100 г воды при 25 ºС) в 250 г воды. Полученный раствор разделили на две части. В первую добавили раствор Na2CO3 (избыток), во вторую 400 г раствора аммиака (избыток). Во второй колбе осадок в 4 раза тяжелее, чем в первой. Найдите концентрацию соли во второй колбе.
В ответе приведите уравнения реакций, которые указаны в условии задачи, и все необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Проводим анализ условия
Разбиваем условие на смысловые фрагменты, выделяем ключевые слова и понятия и составляем уравнения реакций (химическая часть задачи).
1-й фрагмент:
«Насыщенный раствор нитрата алюминия получили, растворив кристаллогидрат Al(NO3)3·12H2O (растворимость 241 г в 100 г воды при 25 ºС) в 250 г воды. Полученный раствор разделили на две части».

2-й фрагмент:
« В первую добавили раствор Na2CO3 (избыток), …»

3-й фрагмент:
«во вторую 200 г раствора аммиака (избыток)»

4-й фрагмент:
«Во второй колбе осадок в 4 раза тяжелее, чем в первой. Найдите концентрацию соли во второй колбе».
Химических превращений нет.
Б) Устанавливаем логические связи (формулируем главный вопрос задачи, т.е. находим вещество, количество которого необходимо рассчитать, и логическую цепочку, связывающую количество этого вещества с веществами, количество которых мы знаем или можем вычислить).
Главный вопрос – найти количество NH4NO3.

Выводы (логическая цепочка):
Единственная цифра, которую можно использовать при проведении расчётов, это «4» – отношение масс Al(OH)3, образовавшихся во 2-й и 1-й колбах.

В) План решения задачи.
1) Найти количество Al(NO3)3(общее).
2) Найти количество Al(NO3)3 в 1-й части (уравнение (1) по Al(OH)3.
3) Найти количество Al(NO3)3 во 2-й части (уравнение 2) по Al(OH)3.
4) Найти количество NH4NO3 (по уравнению (3)) по количеству AlCl3 (2-я часть)).
5) Найти ω(NH4NO3) по уравнению (3).
Г) Решение
1) Находим количество Al(NO3)3 в исходном растворе.
а) находим количество Al(NO3)3·12H2O, которое растворилось в 250 г воды:
Используя данные по растворимости (растворимость 241 г в 100 г воды при 25 ºС), составляем пропорцию,

б) 
2) Находим количество Al(NO3)3, прореагировавшего по уравнениям (2) и (3):
Пусть по уравнению (1) прореагировало x моль Al(NO3)3, по уравнению (2) – y моль Al(NO3)3, тогда
а) x + y = 1,4
б) по уравнению (2):

в) по уравнению (3):

г)

3) По уравнению (3) находим количество NH4NO3:
а) 
4) По уравнению (3) находим количество образовавшегося Al(OH)3:

5) Находим массу 2-й части раствора Al(NO3)3.
Концентрация вещества в растворе и в любой его части одинакова, следовательно

6) Находим массовую долю NH4NO3 в растворе:
а) 
б) 
Похожие статьи
- Как эффективно подготовиться к ЕГЭ по химии?
- Обзорная лекция по функциональной грамотности
- Бесплатные тренировочные варианты ЕГЭ по химии
- Обмен методическими знаниями
РЕКОМЕНДУЕМЫЕ ТОВАРЫ
Разбор задания 34 ЕГЭ по химии 2023
В ЕГЭ по химии 2023 года поменяли порядок заданий 33 и 34. Теперь сделать расчёт по химическим формулам и уравнениям реакций нужно в 34 задании. В статье по шагам разбираем решение на примере задачи из демоверсии ЕГЭ по химии.
0
524

В задании 34 (бывшее 33) будет дана задача на одну из следующих тем кодификатора:
- 4.3.1. Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе».
- 4.3.5. Расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси).
- 4.3.6. Расчёты массы (объёма, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определённой массовой долей растворённого вещества.
- 4.3.9. Расчёты массовой доли (массы) химического соединения в смеси.
Это одно из 6 заданий в ЕГЭ высокого уровня сложности. За правильное решение можно получить 4 балла.
Решение задачи будут проверять и оценивать два эксперта. А если их оценки разойдутся — привлекут третьего.
Пошаговый разбор задачи 34 по химии на ЕГЭ
Разберём решение задания 34 примере задачи из демоверсии ЕГЭ по химии 2023 года. Вот условия:
«Смесь кальция и карбоната кальция, в которой массовая доля атомов кальция составляет 50%, растворили в 300 г соляной кислоты, взятой в избытке. При этом образовался раствор массой 330 г. Один из выделившихся газов был поглощён 400 г 4%-ного раствора гидроксида натрия. Вычислите массовую долю соли в образовавшемся после поглощения газа растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин)».
Теперь пошагово решим задание.
Шаг 1. Записываем уравнения реакций
Реакция кальция с соляной кислотой:
Ca + 2HCl → CaCl2 + H2
Реакция карбоната кальция с соляной кислотой:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
Реакция углекислого газа с гидроксидом натрия:
CO2 + NaOH → NaHCO3
Шаг 2. Рассчитываем изменение массы раствора
Из условия задачи мы знаем, что масса раствора после реакции составляет 330 граммов, а масса исходной соляной кислоты составляет 300 граммов.
Следовательно, изменение массы раствора составляет:
330 – 300 = 30 г.
Шаг 3. Определяем количество вещества и массу продуктов реакций
Пусть в исходной смеси содержится x моль кальция (Ca) и y моль карбоната кальция (CaCO3).
Тогда изменение массы раствора можно выразить через количество вещества реагентов:
40x + 100y – 2x – 44y = 30,
где 40, 100, 2 и 44 – это молярные массы соответствующих веществ.
Из условия задачи мы также знаем, что массовая доля атомов кальция в исходной смеси составляет 50%:
(40 * (x + y)) / (40x + 100y) = 0.5.
Решая систему этих двух уравнений относительно x и y, находим:
x = 0.2 и y = 0.4.
Следовательно, в исходной смеси содержится 0.2 моль кальция и 0.4 моль карбоната кальция.
Шаг 4. Определяем количество вещества и массу углекислого газа
Из уравнения реакции карбоната кальция с соляной кислотой следует, что количество вещества углекислого газа (CO2), образующегося в результате реакции, равно количеству вещества карбоната кальция (CaCO3):
n(CO2) = n(CaCO3) = y = 0.4 моль.
Масса углекислого газа равна количеству вещества, умноженному на его молярную массу:
m(CO2) = n(CO2) * M(CO2) = 0.4 * 44 = 17.6 г.
Шаг 5. Определяем количество вещества и массу продуктов реакции углекислого газа с гидроксидом натрия
Из условия задачи мы знаем, что было использовано 400 г 4%-ного раствора гидроксида натрия (NaOH).
Это означает, что в растворе содержится 400 * 0.04 = 16 г гидроксида натрия.
Количество вещества гидроксида натрия равно массе, деленной на его молярную массу:
n(NaOH) = m(NaOH) / M(NaOH) = 16 / 40 = 0.4 моль.
Из уравнения реакции углекислого газа с гидроксидом натрия следует, что количество вещества гидрокарбоната натрия (NaHCO3), образующегося в результате реакции, равно количеству вещества гидроксида натрия (NaOH):
n(NaHCO3) = n(NaOH) = 0.4 моль.
Масса гидрокарбоната натрия равна количеству вещества, умноженному на его молярную массу:
m(NaHCO3) = n(NaHCO3) * M(NaHCO3) = 0.4 * 84 = 33.6 г.
Шаг 6. Вычисляем массовую долю соли в растворе
Общая масса раствора после поглощения газа равна сумме массы исходного раствора гидроксида натрия, массы образовавшегося гидрокарбоната натрия и разности между массой использованного гидроксида натрия:
m(раствор) = 400 + 33.6 – 16 = 417.6 г.
Следовательно, массовая доля соли (гидрокарбоната натрия) в образовавшемся после поглощения газа растворе составляет:
(33.6 / 417.6) * 100% ≈ 8.05%.
О чём нужно помнить на экзамене
Недостаточно верно определить физическую величину, которую просят в задании. Ещё нужно правильно записать уравнения реакций, произвести вычисления с физическими величинами и не забыть о логике решения задачи. Иначе за задание снимут баллы даже при правильном ответе.
В онлайн-школе «СОТКА» ученики тренируются решать задания из ЕГЭ по химии на вебинарах с преподавателями и в домашних заданиях с обратной связью. Если что-то не получается, помогут наставники. Наставникам можно задать вопрос через чат в личном кабинете и получить ответ в течение 15 минут.
Готовиться в «СОТКЕ» можно сразу к 4 предметам по цене 1.
Задания 34 (2019). Расчет массовой доли химического соединения в смеси.
Источник текстов условий задач — паблик Вконтакте И.С. Ермолаева «ЕГЭ по химии на максимум».
Авторы решений: Широкопояс С.И, Борисов И.С.
Задание №1
Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 400 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора сульфата железа (III). К раствору во второй колбе добавили 300 г раствора азотной кислоты, также взятой в избытке. При этом объем газа, выделившегося из второй колбы, оказался в 2 раза больше объема газа, выделившегося из первой колбы. (Объемы газов измерены при одинаковых условиях). Определите массовую долю нитрата натрия в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 22,07%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и во второй (II) колбах:
Fe2(SO4)3 + 3Na2CO3 + 3H2O = 2Fe(OH)3 + 3Na2SO4 + 3CO2 (I)
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O (II)
Вычислим массу карбоната натрия (y г) в исходном растворе, составив пропорцию:
31,8 г соли – 100 г воды;
y г соли – 400 г воды (плотность воды равна 1 г/мл);
y = 127,2 г.
Вычислим общее количество карбоната натрия:
ν(Na2CO3) = m/M = 127,2/106 = 1,2 моль.
Далее обратим внимание на то, что в обеих реакциях соотношение по молям карбоната натрия и углекислого газа одно и то же, равное 1:1. По условию задачи соотношение объемов газов, которые выделились в реакциях (I) и (II), равно 1:2. Тогда пусть в первой реакции выделилось х моль газа, тогда во второй реакции выделилось 2х моль. Составим уравнение:
х + 2x = 1,2 г;
х = 0,4 моль газа выделилось в первой колбе,
2x = 0,8 моль газа выделилось во второй колбе.
Количество нитрата натрия, образовавшегося по второй реакции, находим по стехиометрическому соотношению из второго уравнения:
ν(NaNO3) = 2νII(CO2) = 0,8 · 2 = 1,6 моль.
Вычислим массу нитрата натрия, образовавшегося по реакции (II):
m(NaNO3) = ν · M = 1,6 · 85 = 136 г.
Масса раствора во второй колбе складывается из масс растворов азотной кислоты и карбоната натрия за вычетом углекислого газа. Обратим внимание на то, что масса раствора карбоната натрия во второй колбе пропорциональна количеству чистого вещества. Вычислим массы части раствора карбоната магния, которую ввели в реакцию с азотной кислотой, и углекислого газа, выделившегося по второй реакции:
mII(р-ра Na2CO3) = (m(H2O) + m(Na2CO3))/1,2 · 0,8 = (400 + 127,2)/1,2 · 0,8 = 351,47 г,
mII(CO2) = ν · M = 0,8 · 44 = 35,2 г.
Масса конечного раствора во второй колбе рассчитывается из масс растворов карбоната натрия и азотной кислоты с учетом вычета массы выделившегося CO2:
mII(конечного р-ра) = m(р-ра HNO3) + mII(р-ра Na2CO3) − mII(CO2) = 300 + 351,47 − 35,2 = 616,27 г.
Ответим на вопрос задачи и найдем массовую долю нитрата натрия:
ω(NaNO3) = 100% · m(NaNO3)/mII(конечного р-ра) · 100% = 136/616,27 · 100% = 22,07%.
Задание №2
Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили 289 г насыщенного раствора сульфида натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида алюминия. К раствору во второй колбе добавили 100 г раствора соляной кислоты, также взятой в избытке. При этом объем газа, выделившийся из второй колбы, оказался в 1,5 раза больше объема газа, выделившегося из первой колбы. (Объемы газов измерены при одинаковых условиях). Определите массовую долю хлорида натрия в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 13,34%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3 + 6NaCl + 3H2S (I)
Na2S + 2HCl = 2NaCl + H2S (II)
Из условия мы видим, что смешав 100 г воды и 15,6 г сульфида натрия мы получаем насыщенный раствор, масса которого, очевидно, будет равна 115,6 г (100 г + 15,6 г)
Вычислим массу сульфида натрия (mисх.(Na2S)) в исходном растворе:
15,6 г Na2S – 115,6 г раствора (из данных о растворимости);
mисх.(Na2S) – 289 г раствора.
Тогда, mисх.(Na2S) = 289 · 15,6/115,6 = 39 г.
Вычислим общее количество сульфида натрия:
ν(Na2S) = m/M = 39/78 = 0,5 моль.
Пусть количество сульфида натрия, содержавшегося в первой колбе равно x моль, тогда, в соответствии с первым уравнением реакции, количество сероводорода, выделившегося из первой колбы, также будет равно х моль. В условии сказано, что объем газа, выделившегося из второй колбы в 1,5 раза больше объема газа, выделившегося из первой. Это означает, что и количество моль выделившегося газа тоже будет в полтора раза больше, то есть 1,5 х моль. В соответствии с уравнением реакции (II), количество сульфида натрия во второй колбе равно количеству вещества сероводорода, то есть тоже 1,5х моль.
Мы знаем, что общее количество сульфида натрия равно 0,5 моль. Тогда, мы можем записать уравнение:
х + 1,5х = 0,5;
2,5x = 0,5;
х = 0,2.
То есть, в первой колбе содержалось количество вещества сульфида натрия равное:
νI(Na2S) = x моль = 0,2 моль,
в свою очередь, во второй колбе содержалось количество вещества сульфида натрия равное:
νII(Na2S) = 1,5x моль = 1,5 · 0,2 моль = 0,3 моль.
В соответствии с уравнением реакции (II) количество вещества хлорида натрия во второй колбе будет равно:
νII(NaCl) = 2νII(Na2S) = 0,3 · 2 = 0,6 моль.
Тогда: mII(NaCl) = ν · M = 0,6 · 58,5 = 35,1 г.
Для расчета массы конечного раствора во второй колбе нужно сложить массы растворов добавленной соляной кислоты и массы раствора сульфида натрия во второй колбе, а также вычесть массу выделившегося из второй колбы сероводорода.
Вычислим массу раствора сульфида натрия во второй колбе, зная, что весь исходный раствор сульфида натрия до разделения имел массу 289 г и содержал 0,5 моль сульфида натрия, а во второй колбе до прибавления соляной кислоты содержалось 0,3 моль сульфида натрия. Запишем пропорцию:
0,5 моль Na2S − 289 г раствора;
0,3 моль Na2S − mII(р-ра Na2S);
mII(р-ра Na2S) = 289/0,5 · 0,3 = 173,4 г.
В соответствии с уравнением реакции (II) количество выделившегося сероводорода из второй колбы равно количеству вещества Na2S во второй колбе.
νII(H2S) = νII(Na2S) = 0,3 моль,
тогда масса выделившегося из второй колбы сероводорода будет равна:
mII(H2S) = ν · M = 0,3 · 34 = 10,2 г.
Масса конечного раствора во второй колбе рассчитывается из масс растворов сульфида натрия и соляной кислоты с учетом вычета массы выделившегося H2S:
mII(конечного р-ра) = m(р-ра HCl) + mII(р-ра Na2S) − mII(H2S) = 100 + 173,4 − 10,2 = 263,2 г.
Ответим на вопрос задачи и найдем массовую долю хлорида натрия:
ω(NaCl) = 100% · mII(NaCl)/mII(конечного р-ра) = 100% · 35,1/263,2 = 13,34%.
Задание №3
Растворимость безводного хлорида алюминия при некоторой температуре составляет 53,4 г на 100 г воды. При этой температуре приготовили 306,8 г насыщенного раствора хлорида алюминия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора карбоната калия. К раствору во второй колбе добавили 300 г раствора аммиака, также взятого в избытке. При этом масса осадка, выпавшего во второй колбе, оказалась в 3 раза больше массы осадка, выпавшего в первой колбе. Определите массовую долю хлорида аммония в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 19,93%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
2AlCl3 + 3K2CO3 + 3H2O = 2Al(OH)3 + 6KCl + 3CO2 (I)
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl (II)
Вычислим массу хлорида алюминия (y г) в исходном растворе:
53,4 г соли – 153,4 г раствора (по условию растворимости)
y г соли – 306,8 г раствора
y = 106,8 г.
Вычислим общее количество хлорида алюминия:
ν(AlCl3) = m/M = 106,8/133,5 = 0,8 моль.
Далее обратим внимание на то, что в обеих реакциях соотношение по молям хлорида алюминия и гидроксида алюминия одно и то же, равное 1:1. По условию задачи соотношение масс осадков, которые выделились в реакциях (I и II), равно 1:3. Тогда пусть в первой реакции образовалось х моль осадка, во второй колбе образовалось 3х моль. Составим уравнение:
х + 3x = 0,8
х = 0,2 моль Al(OH)3 образовалось в первой колбе,
3x = 0,6 моль Al(OH)3 образовалось во второй колбе.
Количество хлорида аммония находим по стехиометрическому соотношению из второго уравнения:
ν(NH4Cl) = 3νII(Al(OH)3) = 0,6 · 3 = 1,8 моль.
Масса хлорида аммония, образовавшегося во второй колбе:
m(NH4Cl) = ν · M = 1,8 · 53,5 = 96,3 г.
Масса раствора во второй колбе складывается из масс растворов аммиака и хлорида алюминия за вычетом осадка гидроксида алюминия. Обратим внимание на то, что масса раствора хлорида алюминия во второй колбе пропорциональна количеству чистого вещества. Вычислим массы части раствора хлорида алюминия, которую ввели в реакцию с раствором аммиака (реакция (II)) и образовавшегося гидроксида алюминия:
mII(р-ра AlCl3) = 306,8/0,8 · 0,6 = 230,1 г,
mII(Al(OH)3) = ν · M = 0,6 · 78 = 46,8 г.
Масса раствора во второй колбе рассчитывается из масс растворов хлорида алюминия и аммиака с учетом вычета образовавшегося осадка Al(OH)3:
mII(конечного р-ра) = m(р-ра NH3) + mII(р-ра AlCl3) − mII(Al(OH)3) = 300 + 230,1 − 46,8 = 483,3 г.
Ответим на вопрос задачи и найдем массовую долю хлорида аммония во второй колбе:
ω(NH4Cl) = m(NH4Cl)/mII(конечного р-ра) · 100% = 96,3/483,3 · 100% = 19,93%.
Видеоразбор решения данной задачи на моем ютуб-канале:
Задание №4
Растворимость безводного карбоната аммония при некоторой температуре составляет 96 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната аммония к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток твердого гидроксида натрия и нагрели до прекращения выделения газа. К раствору во второй колбе добавили 250 г раствора соляной кислоты, также взятой в избытке. При этом объем газа, выделившегося из первой колбы, оказался в 3 раза больше объема газа, выделившегося из второй колбы. (Объемы газов измерены при одинаковых условиях). Определите массовую долю хлорида аммония в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 26,62%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
(NH4)2CO3 + 2NaOH = Na2CO3 + 2NH3 + 2H2O (I)
(NH4)2CO3 + 2HCl = 2NH4Cl + CO2 + H2O (II)
Вычислим массу карбоната аммония (y г) в исходном растворе:
96 г соли – 100 г воды (по условию растворимости);
y г соли – 250 г воды (плотность воды равна 1 г/мл);
y = 240 г.
Вычислим общее количество карбоната аммония:
ν((NH4)2CO3) = m/M = 240/96 = 2,5 моль.
Далее обратим внимание на то, что в первой реакции соотношение по молям исходной соли и газа (NH3) равно 1:2, а во второй реакции соотношение соли и газа (CO2) равно 1:1. По условию задачи соотношение объемов газов, которые выделились в реакциях (I) и (II), равно 3:1. Тогда, если в первой реакции выделилось 3х моль газа, то во второй − х моль. Соответственно, карбоната аммония в первой реакции затрачено 1,5х моль, а во второй реакции − х моль. Составим уравнение:
х + 1,5x = 2,5
х = 1 моль (NH4)2CO3 затратилось по второй реакции,
1,5x = 1,5 моль (NH4)2CO3 затратилось по первой реакции.
Количество хлорида аммония находим по стехиометрическому соотношению из второго уравнения:
ν(NH4Cl) = 2νII((NH4)2CO3) = 1 · 2 = 2 моль.
Вычислим массу хлорида аммония, образовавшегося по второй реакции:
m(NH4Cl) = ν · M = 2 · 53,5 = 107 г.
Масса раствора во второй колбе складывается из масс растворов соляной кислоты и карбоната аммония за вычетом углекислого газа. Обратим внимание на то, что масса раствора карбоната аммония во второй колбе пропорциональна количеству чистого вещества. Вычислим массы углекислого газа и части раствора карбоната аммония, которую ввели в реакцию с соляной кислотой:
mII(р-ра (NH4)2CO3) = (mII((NH4)2CO3 + m(H2O))/2,5 · 1 = (240 + 250)/2,5 · 1 = 196 г,
m(CO2) = ν · M = 1 · 44 = 44 г.
Масса конечного раствора во второй колбе рассчитывается из масс растворов карбоната натрия и соляной кислоты с учетом вычета массы углекислого газа:
mII(конечного р-ра) = m(HCl) + mII(р-ра (NH4)2CO3) − m(CO2) = 250 + 196 − 44 = 402 г.
Ответим на вопрос задачи и найдем массовую долю хлорида аммония:
ω(NH4Cl) = m(NH4Cl)/mII(конечного р-ра) · 100% = 107/402 · 100% = 26,62%.
Задание №5
Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 200 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора соляной кислоты. При этом выделилось 4,48 л газа (н.у.). К раствору во второй колбе добавили 222 г 25% раствора хлорида кальция. (Объемы газов измерены при одинаковых условиях). Определите массовую долю хлорида кальция в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 3,1%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O (I)
Na2CO3 + CaCl2 = 2NaCl + CaCO3 (II)
Вычислим массу карбоната натрия (y г) в исходном растворе:
31,8 г соли – 100 г воды;
y г соли – 200 г воды (плотность воды равна 1 г/мл);
y = 63,6 г.
Вычислим количества исходного карбоната натрия и углекислого газа, выделившегося в первой реакции:
ν(Na2CO3) = m/M = 63,6/106 = 0,6 моль,
ν(CO2) = V/Vm = 4,48/22,4 = 0,2 моль.
Далее вычислим количество карбоната натрия, которое ввели во вторую реакцию:
νII(Na2CO3) = 0,6 − 0,2 = 0,4 моль.
Вычислим исходное количество хлорида кальция:
m(CaCl2) = ν · M = 222 · 0,25 = 55,5 г,
ν(CaCl2) = m/M = 55,5/111 = 0,5 моль.
Вычислим массу избытка хлорида кальция, который остался во второй колбе после прохождения реакции:
ν(CaCl2) = 0,5 − 0,4 = 0,1 моль,
m(CaCl2) = ν · M = 0,1 · 111 = 11,1 г.
Масса раствора во второй колбе складывается из масс растворов хлорида кальция и карбоната натрия за вычетом осадка карбоната кальция. Обратим внимание на то, что масса раствора карбоната натрия во второй колбе пропорциональна количеству чистого вещества. Вычислим массы карбоната кальция и части раствора карбоната натрия, которую ввели в реакцию с хлоридом кальция:
mII(р-ра Na2CO3) = (m(H2O) + m(Na2CO3))/ 0,6 · 0,4 = (200 + 63,6)/0,6 · 0,4 = 175,73 г,
m(CaCO3) = ν · M = 0,4 · 100 = 40 г,
mII(конечного р-ра) = m(CaCl2) + mII(р-ра Na2CO3) – m(CaCO3) = 222 + 175,73 − 40 = 357,73 г.
Ответим на вопрос задачи и найдем массовую долю хлорида кальция:
ω(CaCl2) = m(CaCl2)/m(конечного р-ра) · 100% = 11,1/357,73 · 100% = 3,1%.
[adsp-pro-3]
Задание №6
Растворимость безводного сульфата железа (II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили 326 г насыщенного раствора сульфата железа (II). Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида бария. При этом образовалось 46,6 г осадка. К раствору во второй колбе добавили 50 г 34%-ного раствора аммиака. Определите массовую долю аммиака в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 3,11%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
FeSO4 + BaCl2 = FeCl2 + BaSO4 (I)
FeSO4 + 2NH3 + 2H2O = Fe(OH)2 + 2NH4Cl (II)
Вычислим массу сульфата железа (II) (y г) в исходном растворе:
30,4 г соли – 130,4 г раствора;
y г соли – 326 г раствора;
y = 76 г.
Вычислим общее количество сульфата железа (II):
ν(FeSO4) = m/M = 76/152 = 0,5 моль.
Поскольку ν(BaSO4) = νI(FeSO4), тогда количество осадка сульфата бария в первой колбе:
ν(BaSO4) = νI(FeSO4) = m/M = 46,6/233 = 0,2 моль.
Вычислим количества сульфата железа (II) и аммиака, которые ввели во вторую реакцию:
νII(FeSO4) = ν(FeSO4) − νI(FeSO4) = 0,5 − 0,2 = 0,3 моль,
m(NH3) = w(NH3) · m(р-ра)/100 = 50 · 34/100 = 17 г,
ν(NH3) = m/M = 17/17 = 1 моль.
Поскольку ν(NH3) = 2νII(FeSO4), тогда вычислим количество и массу аммиака, оставшегося после реакции с сульфатом железа (II):
νост.(NH3) = ν(NH3) − 2νII(NH3) = 1 − 0,3 · 2 = 0,4 моль,
mост.(NH3) = ν · M = 0,4 · 17 = 6,8 г.
Масса раствора во второй колбе складывается из масс растворов сульфата железа (II) и аммиака за вычетом осадка гидроксида железа (II). Обратим внимание на то, что масса раствора сульфата железа (II) во второй колбе пропорциональна количеству чистого вещества. Вычислим массы гидроксида железа (II) и части раствора сульфата железа (II), которую ввели в реакцию с раствором аммиака:
mII(р-ра FeSO4) = 326/0,5 · 0,3 = 195,6 г,
mII(Fe(OH)2) = ν · M = 0,3 · 90 = 27 г,
mII(конечного р-ра) = mII(р-ра FeSO4) + m(NH3) − mII(Fe(OH)2) = 195,6 + 50 − 27 = 218,6 г.
Ответим на вопрос задачи и найдем массовую долю аммиака:
ω(NH3) = mост.(NH3)/ m(конечного р-ра) · 100% = 6,8/218,6 · 100% = 3,11%.
Задание №7
Растворимость безводного сульфата алюминия при некоторой температуре составляет 34,2 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата алюминия к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора аммиака. При этом образовалось 15,6 г осадка. К раствору во второй колбе добавили 320 г 25%-ного раствора гидроксида натрия. Определите массовую долю сульфата натрия в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 14,48%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
Al2(SO4)3 + 6NH3 + 6H2O = 2Al(OH)3 + 3(NH4)2SO4 (I)
Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4 (II)
Вычислим массу сульфата алюминия (y г) в исходном растворе:
34,2 г соли – 100 г воды (по условию растворимости);
y г соли – 300 г воды (плотность воды равна 1 г/мл);
y = 102,6 г.
Вычислим общее количество сульфата алюминия:
ν(Al2(SO4)3) = m/M = 102,6/342 = 0,3 моль.
Вычислим количество осадка гидроксида алюминия в первой колбе:
νI(Al(OH)3) = m/M = 15,6/78 = 0,2 моль.
Поскольку νI(Al(OH)3) = 2νI(Al2(SO4)3),
то νI(Al2(SO4)3) = 0,1 моль.
Вычислим количества сульфата алюминия и гидроксида натрия, которые ввели во вторую реакцию:
νII(Al2(SO4)3) = ν(Al2(SO4)3) − νI(Al2(SO4)3) = 0,3 − 0,1 = 0,2 моль,
mII(NaOH) = m(р-ра NaOH) · w(NaOH)/100% = 320 · 0,25 = 80 г,
νII(NaOH) = m/M = 80/40 = 2 моль.
Обратим внимание на то, что гидроксид натрия находится в большом избытке относительно сульфата алюминия, поэтому следует учитывать растворение гидроксида алюминия в растворе щелочи с образованием комплексного соединения:
Al(OH)3 + NaOH = Na[Al(OH)4] (III)
Рассчитаем количество щелочи, которое необходимо для превращения сульфата алюминия в комплекс (исходя из коэффициентов реакции (II)):
νIII(NaOH) = 0,2 · 6 + 0,4 = 1,6 моль.
Количество щелочи, необходимое для реакции меньше, чем у нас имеется по задаче, гипотеза про образование комплексного соединения верна. Далее вычислим массу сульфата натрия:
m(Na2SO4) = ν · M = 0,6 · 142 = 85,2 г.
Масса раствора во второй колбе складывается из масс растворов сульфата алюминия и гидроксида натрия. Осадков и газов в итоге не получилось, из массы раствора ничего не вычитаем. Обратим внимание на то, что масса раствора сульфата алюминия во второй колбе пропорциональна количеству чистого вещества. Вычислим массу части раствора сульфата алюминия, которую ввели в реакцию с раствором щелочи:
mII(р-ра Al2(SO4)3) = (m(H2O) + m(Na2CO3)/0,3 · 0,2 = (300 + 102,6)/0,3 · 0,2 = 268,4 г,
mII(конечного р-ра) = m(р-ра NaOH) + mII(р-ра Al2(SO4)3) = 320 + 268,4 = 588,4 г.
Ответим на вопрос задачи и найдем массовую долю сульфата натрия:
ω(Na2SO4) = m(Na2SO4)/mII(конечного р-ра) · 100% = 85,2/588,4 · 100% = 14,48%.
Задание №8
Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили 395,4 г насыщенного раствора карбоната натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора нитрата кальция. При этом образовалось 50 г осадка. К раствору во второй колбе добавили 252 г 30%-ного раствора азотной кислоты. (Объемы газов измерены при одинаковых условиях). Определите массовую долю азотной кислоты в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 6,14%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
Na2CO3 + Ca(NO3)2 = CaCO3 + 2NaNO3 (I)
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O (II)
Вычислим массу карбоната натрия (y г) в исходном растворе:
31,8 г соли – 131,8 г раствора (по условию растворимости);
y г соли – 395,4 г раствора;
y = 95,4 г.
Вычислим общее количество карбоната натрия:
ν(Na2CO3) = m/M = 95,4/106 = 0,9 моль.
Вычислим общее количество карбоната кальция:
ν(CaCO3) = m/M = 50/100 = 0,5 моль.
Вычислим массу и количество вещество исходного количества азотной кислоты:
m(HNO3) = m(р-ра HNO3) · w(HNO3)/100% = 252 · 0,3 = 75,6 г,
ν(HNO3) = m/M = 75,6/63 = 1,2 моль.
По уравнению реакции (I) νI(Na2CO3) = ν(CaCO3), следовательно,
νII(Na2CO3) = ν(Na2CO3) − νI(Na2CO3) = 0,9 – 0,5 = 0,4 моль.
По уравнению реакции (II) 2νII(Na2CO3) = νII(HNO3), следовательно,
νII(HNO3) = 2 · 0,4 = 0,8 моль.
Вычислим массу оставшейся азотной кислоты:
mост.(HNO3) = (1,2 − 0,8) · 63 = 25,2 г.
Масса раствора во второй колбе складывается из масс растворов карбоната натрия и азотной кислоты за вычетом углекислого газа. Обратим внимание на то, что масса раствора карбоната натрия во второй колбе пропорциональна количеству чистого вещества. Вычислим массу части раствора карбоната натрия, которую ввели в реакцию с раствором азотной кислоты:
mII(р-ра Na2CO3) = 395,4/0,9 · 0,4 = 175,73 г,
m(CO2) = ν · M = 0,4 · 44 = 17,6 г,
mII(конечного р-ра) = m(р-ра HNO3) + mII(р-ра Na2CO3) − m(CO2) = 252 + 175,73 − 17,6 = 410,13 г.
Ответим на вопрос задачи и найдем массовую долю азотной кислоты:
ω(HNO3) = mост.(HNO3)/mII(конечного р-ра) · 100% = 25,2/410,13 · 100% = 6,14%.
Задание №9
Растворимость безводного сульфата железа (II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата железа (II) к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора гидроксида натрия. При этом образовалось 18 г осадка. К раствору во второй колбе добавили 870 г 15%-ного раствора нитрата бария. Определите массовую долю нитрата бария в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 5,24%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4 (I)
FeSO4 + Ba(NO3)2 = Fe(NO3)2 + BaSO4 (II)
Вычислим массу сульфата железа (II) (y г) в исходном растворе:
30,4 г соли – 100 г воды;
y г соли – 250 г воды (плотность воды равна 1 г/мл);
y = 76 г.
Вычислим общее количество сульфата железа (II):
ν(FeSO4) = m/M = 76/152 = 0,5 моль.
Вычислим количество гидроксида железа (II):
ν(Fe(OH)2) = m/M = 18/90 = 0,2 моль.
Вычислим исходные массу и количество вещества нитрата бария:
m(Ba(NO3)2) = m(р-ра Ba(NO3)2) · w(р-ра Ba(NO3)2)/100% = 870 · 0,15 = 130,5 г,
ν(Ba(NO3)2) = m/M = 130,5/261 = 0,5 моль.
Поскольку по уравнению реакции II ν(Fe(OH)2) = νI(FeSO4) = 0,2 моль,
νII(FeSO4) = ν(FeSO4) − νI(FeSO4) = 0,5 – 0,2 = 0,3 моль,
νII(FeSO4) = νII(Ba(NO3)2) = 0,3 моль, тогда масса оставшегося нитрата бария:
νост.(Ba(NO3)2) = ν(Ba(NO3)2) − νII(Ba(NO3)2) = 0,5 – 0,3 = 0,2 моль,
mост.(Ba(NO3)2) = ν · M = 0,2 · 261 = 52,2 г.
Масса раствора во второй колбе складывается из масс растворов сульфата железа (II) и нитрата бария за вычетом осадка сульфата бария. Обратим внимание на то, что масса раствора сульфата железа (II) во второй колбе пропорциональна количеству чистого вещества. Вычислим массу части раствора сульфата железа (II), которую ввели в реакцию с раствором нитрата бария:
mII(р-ра FeSO4) = (m(H2O) + m(FeSO4))/0,5 · 0,3 = (250 + 76)/0,5 · 0,3 = 195,6 г,
νII(Ba(NO3)2) = ν(BaSO4) = 0,3 моль, тогда масса образовавшегося сульфата бария:
m(BaSO4) = ν · M = 0,3 · 233 = 69,9 г,
mII(конечного р-ра) = m(р-ра Ba(NO3)2) + mII(р-ра FeSO4) − m(BaSO4) = 870 + 195,6 − 69,9 = 995,7 г.
Ответим на вопрос задачи и найдем массовую долю нитрата бария:
ω(Ba(NO3)2) = mост.(Ba(NO3)2)/mII(конечного р-ра) · 100% = 52,2/995,7 · 100% = 5,24%.
Задание №10
Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфида натрия к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора соляной кислоты. При этом выделилось 4,48 л (н.у.) газа. К раствору во второй колбе добавили 450 г 15%-ного раствора хлорида меди (II). (Объемы газов измерены при одинаковых условиях). Определите массовую долю хлорида меди (II) в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 4,54%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
Na2S + 2HCl = 2NaCl + H2S (I)
Na2S + CuCl2 = 2NaCl + CuS (II)
Вычислим массу сульфида натрия (y г) в исходном растворе:
15,6 г соли – 100 г воды;
y г соли – 250 г воды (плотность воды равна 1 г/мл);
y = 39 г.
Вычислим исходное количество сульфида натрия:
ν(Na2S) = m/M = 39/78 = 0,5 моль.
Вычислим количество сероводорода, выделившееся по реакции (I):
ν(H2S) = V/Vm = 4,48/22,4 = 0,2 моль.
Вычислим массу и исходное количество хлорида меди (II):
m(CuCl2) = m(р-ра CuCl2) · w(CuCl2)/100% = 450 · 15/100 = 67,5 г,
ν(CuCl2) = m/M = 67,5/135 = 0,5 моль.
По реакции (I) νI(Na2S) = ν(H2S) = 0,2 моль, следовательно, в реакции (II)
νII(Na2S) = ν(Na2S) − νI(Na2S) = 0,5 – 0,2 = 0,3 моль.
По реакции (II) с сульфидом натрия хлорид меди (II) взаимодействуют в соотношении 1:1, т.е. νII(Na2S) = νII(CuCl2) = 0,3 моль.
Вычислим массу оставшегося хлорида меди (II):
mост.(CuCl2) = (0,5 − 0,3) · 135 = 27 г.
Масса раствора во второй колбе складывается из масс растворов сульфида натрия и хлорида меди (II) за вычетом осадка сульфида меди (II). Обратим внимание на то, что масса раствора сульфида натрия во второй колбе пропорциональна количеству чистого вещества. Вычислим массу части раствора сульфида натрия, которую ввели в реакцию с раствором хлорида меди (II):
mII(р-ра Na2S) = (m(H2O) + m(Na2S))/0,5 · 0,3 = (250 + 39)/0,5 · 0,3 = 173,4 г,
m(CuS) = ν · M = 0,3 · 96 = 28,8 г,
mII(конечного р-ра) = m(р-ра CuCl2) + mII(р-ра Na2S) − m(CuS) = 450 + 173,4 − 28,8 = 594,6 г.
Ответим на вопрос задачи и найдем массовую долю хлорида меди (II):
ω(CuCl2) = mост.(CuCl2)/mII(конечного р-ра) · 100% = 27/594,6 · 100% = 4,54%.
[adsp-pro-3]
Задание №11
Растворимость безводного хлорида кальция при некоторой температуре составляет 55,5 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество хлорида кальция к 160 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора карбоната натрия. При этом образовалось 30 г осадка. К раствору во второй колбе добавили 595 г 40%-ного раствора нитрата серебра. Определите массовую долю нитрата серебра в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 11,2%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
CaCl2 + Na2CO3 = CaCO3 + 2NaCl (I)
CaCl2 + 2AgNO3 = Ca(NO3)2 + 2AgCl (II)
Вычислим массу хлорида кальция (y г) в исходном растворе:
55,5 г соли – 100 г воды;
y г соли – 160 г воды (плотность воды равна 1 г/мл);
y = 88,8 г.
Вычислим исходное количество хлорида кальция:
ν(CaCl2) = m/M = 88,8/111 = 0,8 моль.
Вычислим количество карбоната кальция:
ν(CaCO3) = m/M = 30/100 = 0,3 моль.
Вычислим массу и исходное количество нитрата серебра:
m(AgNO3) = m(р-ра (AgNO3)) · w(AgNO3)/100% = 595 · 0,4 = 238 г,
ν(AgNO3) = m/M = 238/170 = 1,4 моль.
По уравнению реакции (I) ν(CaCO3) = νI(CaCl2) = 0,3 моль, следовательно,
νII(CaCl2) = ν(CaCl2) − νI(CaCl2) = 0,8 – 0,3 = 0,5 моль.
По уравнению реакции (II) 2νII(CaCl2) = ν(AgNO3) = 2 · 0,5 = 1 моль.
Вычислим массу оставшегося нитрата серебра:
mост.(AgNO3) = (1,4 − 1) · 170 = 68 г.
Масса раствора во второй колбе складывается из масс растворов хлорида кальция и нитрата серебра за вычетом осадка хлорида серебра. Обратим внимание на то, что масса раствора хлорида кальция во второй колбе пропорциональна количеству чистого вещества. Вычислим массу части раствора хлорида кальция, которую ввели в реакцию с раствором нитрата серебра:
mII(р-ра CaCl2) = (m(H2O) + m(CaCl2))/0,8 · 0,5 = (160 + 88,8)/0,8 · 0,5 = 155,5 г.
По уравнению реакции (II) ν(AgNO3) = ν(AgCl) = 1 моль, тогда
m(AgCl) = ν · M = 1 · 143,5 = 143,5 г;
mII(конечного р-ра) = m(р-ра AgNO3) + mII(р-ра CaCl2) − m(AgCl) = 595 + 155,5 − 143,5 = 607 г.
Ответим на вопрос задачи и найдем массовую долю нитрата серебра в конечном растворе:
ω(AgNO3) = mост.(AgNO3)/mII(конечного р-ра) · 100% = 68/607 · 100% = 11,2%.
Задание №12
Растворимость безводного гидрокарбоната натрия при некоторой температуре составляет 12,6 г на 100 г воды. При этой температуре приготовили 450,4 г насыщенного раствора гидрокарбоната натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора гидроксида бария. При этом образовалось 39,4 г осадка. К раствору во второй колбе добавили 245 г 20%-ного раствора серной кислоты. При этом образовалась средняя соль. Определите массовую долю серной кислоты в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 5,57%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
NaHCO3 + Ba(OH)2 = BaCO3 + NaOH + H2O (I)
2NaHCO3 + H2SO4 = Na2SO4 + 2CO2 + 2H2O (II)
Вычислим массу гидрокарбоната натрия (y г) в исходном растворе:
12,6 г соли – 112,6 г раствора;
y г соли – 450,4 г раствора;
y = 50,4 г.
Вычислим общее количество гидрокарбоната натрия:
ν(NaHCO3) = m/M = 50,4/84 = 0,6 моль.
Вычислим количество карбоната бария:
ν(BaCO3) = m/M = 39,4/197 = 0,2 моль.
Вычислим массу и исходное количество серной кислоты:
m(H2SO4) = m(р-ра H2SO4) · w(H2SO4)/100% = 245 · 20%/100% = 49 г,
ν(H2SO4) = m/M = 49/98 = 0,5 моль.
По уравнению реакции (II) ν(BaCO3) = νI(NaHCO3) = 0,2 моль, следовательно,
νII(NaHCO3) = ν(NaHCO3) − νI(NaHCO3) = 0,6 – 0,2 = 0,4 моль.
По уравнению реакции (II) νII(NaHCO3) = 2νII(H2SO4), следовательно,
во второй колбе реагирует νII(H2SO4) = νII(NaHCO3)/2 = 0,4/2 = 0,2 моль.
Вычислим количество массу оставшейся серной кислоты:
νост.(H2SO4) = 0,5 – 0,2 = 0,3 моль,
mост.(H2SO4) = ν · M = 0,3 · 98 = 29,4 г.
Масса раствора во второй колбе складывается из масс растворов гидрокарбоната натрия и серной кислоты за вычетом углекислого газа. Обратим внимание на то, что масса раствора гидрокарбоната натрия во второй колбе пропорциональна количеству чистого вещества. Вычислим массу части раствора гидрокарбоната натрия, которую ввели в реакцию с раствором серной кислоты:
mII(р-ра NaHCO3) = 450,4/0,6 · 0,4 = 300,27 г,
m(CO2) = ν · M = 0,4 · 44 = 17,6 г.
mII(конечного р-ра) = m(р-ра HCl) + mII(р-ра NaHCO3) − m(CO2) = 245 + 300,27 − 17,6 = 527,67 г.
Ответим на вопрос задачи и найдем массовую долю серной кислоты:
ω(H2SO4) = mост.(H2SO4)/mII(конечного р-ра) · 100% = 29,4/527,67 · 100% = 5,57%.
Задание №13
Растворимость безводного хлорида алюминия при некоторой температуре составляет 53,4 г на 100 г воды. При этой температуре приготовили 767 г насыщенного раствора хлорида алюминия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора нитрата серебра. При этом образовалось 344,4 г осадка. К раствору во второй колбе добавили 960 г 40%-ного раствора гидроксида натрия. Определите массовую долю хлорида натрия в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 14,83%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
AlCl3 + 3AgNO3 = Al(NO3)3 + 3AgCl (I)
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl (II)
Вычислим массу сульфата алюминия (y г) в исходном растворе:
53,4 г соли – 153,4 г раствора;
y г соли – 767 г раствора;
y = 267 г.
Вычислим исходное количество хлорида алюминия:
ν(AlCl3) = m/M = 267/133,5 = 2 моль.
Вычислим количество хлорида серебра, образовавшегося в первой колбе:
ν(AgCl) = m/M = 344,4/143,5 = 2,4 моль.
Вычислим массу и количество гидроксида натрия:
m(NaOH) = m(р-ра NaOH) · w(NaOH)/100% = 960 · 40%/100% = 384 г,
ν(NaOH) = m/M = 384/40 = 9,6 моль.
Обратим внимание на то, что гидроксид натрия находится в большом избытке относительно хлорида алюминия. Поэтому следует учитывать растворение гидроксида алюминия в растворе щелочи с образованием комплексного соединения:
Al(OH)3 + NaOH = Na[Al(OH)4] (III)
Рассчитаем количество щелочи, которое необходимо для превращения хлорида алюминия в комплекс.
По уравнению реакции (I) ν(AgCl) = 3νI(AlCl3), следовательно,
νI(AlCl3) = m/M = 2,4/3 = 0,8 моль.
Количество хлорида алюминия, прореагировавшего по второй реакции, составляет:
νII(AlCl3) = ν(AlCl3) − νI(AlCl3) = 2 – 0,8 = 1,2 моль.
Для образования комплекса необходимо количество NaOH, равное 4νII(AlCl3). Отсюда
νIII(NaOH) = 1,2 · 3 + 1,2 = 4,8 моль.
Количество щелочи, необходимое для реакции меньше, чем у нас имеется по задаче, гипотеза про образование комплексного соединения верна. Далее вычислим массу хлорида натрия, если
ν(NaCl) = 3νII(AlCl3) = 1,2 · 3 = 3,6 моль,
m(NaCl) = ν · M = 3,6 · 58,5 = 210,6 г.
Масса раствора во второй колбе складывается из масс растворов хлорида алюминия и гидроксида натрия. Осадков и газов в итоге не образовалось, из массы раствора ничего не вычитаем. Обратим внимание на то, что масса раствора хлорида алюминия во второй колбе пропорциональна количеству чистого вещества. Вычислим массу части раствора хлорида алюминия, которую ввели в реакцию с раствором гидроксида натрия:
mII(р-ра AlCl3) = m(р-ра AlCl3) /2 · 1,2 = 767/2 · 1,2 = 460,2 г,
m(конечного р-ра) = m(р-ра NaOH) + mII(р-ра AlCl3) = 960 + 460,2 = 1420,2 г.
Ответим на вопрос задачи и найдем массовую долю хлорида натрия:
ω(NaCl) = m(NaCl)/m(конечного р-ра) · 100% = 210,6/1420,2 · 100% = 14,83%.
Задание №14
Растворимость безводного сульфата железа (II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата железа (II) к 400 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора аммиака. При этом образовалось 27 г осадка. К раствору во второй колбе добавили 780 г 20%-ного раствора хлорида бария. Определите массовую долю хлорида бария в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 5,26%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
FeSO4 + 2NH3 + 2H2O = Fe(OH)2 + 2NH4Cl (I)
FeSO4 + BaCl2 = FeCl2 + BaSO4 (II)
Вычислим массу сульфата железа (II) (y г) в исходном растворе:
30,4 г соли – 100 г воды;
y г соли – 400 г воды (плотность воды равна 1 г/мл);
y = 121,6 г.
Вычислим количество сульфата железа (II):
ν(FeSO4) = m/M = 121,6/152 = 0,8 моль.
Вычислим количество гидроксида железа (II):
ν(Fe(OH)2) = m/M = 27/90 = 0,3 моль.
Вычислим массу и исходное количество хлорида бария:
m(BaCl2) = m(р-ра) · w(BaCl2)/100% = 780 · 20%/100% = 156 г,
ν(BaCl2) = m/M = 156/208 = 0,75 моль.
По уравнению реакции (I) ν(Fe(OH)2) = νI(FeSO4) = 0,3 моль, следовательно, во второй реакции
νII(FeSO4) = ν(FeSO4) − νI(FeSO4) = 0,8 – 0,3 = 0,5 моль.
По уравнению реакции (II) νII(FeSO4) = νII(BaCl2) = 0,5 моль.
Вычислим количество вещества и массу оставшегося хлорида бария:
νост.(BaCl2) = 0,75 – 0,5 = 0,25 моль,
mост.(BaCl2) = ν · M = 0,25 · 208 = 52 г.
Масса раствора во второй колбе складывается из масс растворов сульфата железа (II) и хлорида бария за вычетом осадка сульфата бария. Обратим внимание на то, что масса раствора сульфата железа (II) во второй колбе пропорциональна количеству чистого вещества. Вычислим массу части раствора сульфата железа (II), которую ввели в реакцию с раствором хлорида бария:
mII(р-ра FeSO4) = (m(FeSO4)) + m(FeSO4))/0,8 · 0,5 = (400 + 121,6)/0,8 · 0,5 = 326 г,
m(BaSO4) = ν · M = 0,5 · 233 = 116,5 г.
mII(конечного р-ра) = m(р-ра BaCl2) + mII(р-ра FeSO4) − m(BaSO4) = 780 + 326 – 116,5 = 989,5 г.
Ответим на вопрос задачи и найдем массовую долю хлорида бария:
ω(BaCl2) = mост.(BaCl2)/mII(конечного р-ра) · 100% = 52/989,5 · 100% = 5,26%.
Задание №15
Растворимость безводного хлорида кальция при некоторой температуре составляет 55,5 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество хлорида кальция к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора нитрата серебра. При этом образовалось 143,5 г осадка. К раствору во второй колбе добавили 1272 г 10%-ного раствора карбоната натрия. Определите массовую долю карбоната натрия в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 1,43%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
CaCl2 + 2AgNO3 = Ca(NO3)2 + 2AgCl (I)
CaCl2 + Na2CO3 = CaCO3 + 2NaCl (II)
Вычислим массу хлорида кальция (y г) в исходном растворе:
55,5 г соли – 100 г воды;
y г соли – 300 г воды (плотность воды равна 1 г/мл);
y = 166,5 г.
Вычислим исходное количество хлорида кальция:
ν(CaCl2) = 166,5/111 = 1,5 моль.
Вычислим количество хлорида серебра:
ν(AgCl) = 143,5/143,5 = 1 моль.
Вычислим массу и исходное количество карбоната натрия:
m(Na2CO3) = m(р-ра Na2CO3) · m(Na2CO3)/100% = 1272 · 10%/100% = 127,2 г,
ν(Na2CO3) = m/M = 127,2/106 = 1,2 моль.
По уравнению реакции (I) ν(AgCl) = 2νI(CaCl2) = 1 моль, следовательно,
νI(CaCl2) = 1/2 = 0,5 моль,
νII(CaCl2) = ν(CaCl2) − νI(CaCl2) = 1,5 – 0,5 = 1 моль.
По уравнению реакции (II)
νII(CaCl2) = νII(Na2CO3) = 1 моль.
Зная νII(Na2CO3), вычислим массу оставшегося карбоната натрия:
mост.(Na2CO3) = ν · M = (1,2 − 1) · 106 = 21,2 г.
Масса раствора во второй колбе складывается из масс растворов хлорида кальция и карбоната натрия за вычетом осадка карбоната кальция. Обратим внимание на то, что масса раствора хлорида кальция во второй колбе пропорциональна количеству чистого вещества. Вычислим массу части раствора хлорида кальция, которую ввели в реакцию с раствором карбоната натрия:
mII(р-ра CaCl2) = ((m(H2O) + m(CaCl2))/1,5 · 1 = (300 + 166,5)/1,5 · 1 = 311 г.
По уравнению реакции (II) νII(CaCl2) = ν(CaCO3) = 1 моль,
m(CaCO3) = ν · M = 1 · 100 = 100 г.
mII(конечного р-ра) = m(р-ра Na2CO3) + mII(р-ра CaCl2) − m(CaCO3) = 1272 + 311 − 100 = 1483 г.
Ответим на вопрос задачи и найдем массовую долю карбоната натрия:
ω(Na2CO3) = mост.(Na2CO3)/mII(конечного р-ра) · 100% = 21,2/1483 · 100% = 1,43%.
[adsp-pro-3]
Задание №16
Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 400 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора сульфата железа (III). К раствору во второй колбе добавили 300 г раствора азотной кислоты, также взятой в избытке. При этом объем газа, выделившегося из второй колбы, оказался в 2 раза больше объема газа, выделившегося из первой колбы. (Объемы газов измерены при одинаковых условиях). Определите массовую долю нитрата натрия в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 22,07%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
Fe2(SO4)3 + 3Na2CO3 + 3H2O = 2Fe(OH)3 + 3Na2SO4 + 3CO2 (I)
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O (II)
Вычислим массу карбоната натрия (y г) в исходном растворе:
31,8 г соли – 100 г воды;
y г соли – 400 г воды (плотность воды равна 1 г/мл);
y = 127,2 г.
Вычислим количество карбоната натрия:
ν(Na2CO3) = 127,2/106 = 1,2 моль.
Далее обратим внимание на то, что в обеих реакциях соотношение по молям карбоната натрия и углекислого газа одно и то же, равное 1:1. По условию задачи соотношение объемов газов, которые выделились в реакциях (I) и (II), равно 2:1. Тогда пусть в первой реакции выделилось х моль газа, во второй 2х моль. Составим уравнение:
х + 2x = 1,2;
х = 0,4 моль;
следовательно, в первой колбе выделилось 0,4 моль CO2, во второй колбе – 0,8 моль CO2.
Количество нитрата натрия находим по стехиометрическому соотношению из второго уравнения:
ν(NaNO3) = 2νII(CO2) = 0,8 · 2 = 1,6 моль.
Вычислим массу нитрата натрия:
m(NaNO3) = ν · M = 1,6 · 85 = 136 г.
Масса раствора во второй колбе складывается из масс растворов азотной кислоты и карбоната натрия за вычетом углекислого газа. Обратим внимание на то, что масса раствора карбоната натрия во второй колбе пропорциональна количеству чистого вещества. Вычислим массы углекислого газа и части раствора карбоната натрия, которую ввели в реакцию с азотной кислотой:
mII(р-ра Na2CO3) = (m(H2O) + m(р-ра Na2CO3)/1,2 · 0,8 = (400+127,2)/1,2 · 0,8 = 351,47 г.
mII(CO2) = ν · M = 0,8 · 44 = 35,2 г.
mII(конечного р-ра) = m(р-ра NaNO3) + mII(р-ра Na2CO3) − mII(CO2) = 300 + 351,47 − 35,2 = 616,27 г.
Ответим на вопрос задачи и найдем массовую долю нитрата натрия:
ω(NaNO3) = m(NaNO3)/mII(конечного р-ра) · 100% = 136/616,27 · 100% = 22,07%.
Задание №17
Растворимость безводного сульфита аммония при некоторой температуре составляет 58 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфита аммония к 120 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток концентрированной азотной кислоты. При этом выделился бурый газ. К раствору во второй колбе добавили 120 г раствора соляной кислоты, также взятой в избытке. При этом объем газа, выделившегося из второй колбы, оказался в 4 раза меньше объема газа, выделившегося из первой колбы. (Объемы газов измерены при одинаковых условиях). Определите массовую долю хлорида аммония в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 12,56%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и во второй (II) колбах:
(NH4)2SO3 + 2HNO3 = (NH4)2SO4 + 2NO2 + H2O (I)
(NH4)2SO3 + 2HCl = 2NH4Cl + SO2 + H2O (II)
Вычислим массу сульфита аммония (y г) в исходном растворе:
58 г соли – 100 г воды;
y г соли – 120 г воды (плотность воды равна 1 г/мл);
y = 69,6 г.
Вычислим количество сульфита аммония:
ν((NH4)2SO3) = m/M = 69,6/116 = 0,6 моль.
Далее обратим внимание на то, что в первой реакции соотношение по молям сульфита аммония и газа равно 1:2, а во второй реакции – 1:1. По условию задачи соотношение объемов газов, которые выделились в реакциях (I) и (II), равно 4:1. Тогда пусть в первой реакции выделилось 4х моль газа, во второй колбе − х моль. Тогда по реакции (I) прореагировало 2x моль сульфита аммония, по реакции (II) – x моль сульфита аммония. Составим уравнение:
х + 2x = 0,6;
х = 0,2 моль сульфита аммония прореагировало во второй колбе,
2x = 0,4 моль сульфита аммония прореагировало в первой колбе.
Количество хлорида аммония находим по стехиометрическому соотношению из второго уравнения.
По уравнению реакции (II) ν(NH4Cl) = 2νII((NH4)2SO3), следовательно,
ν(NH4Cl) = 0,2 · 2 = 0,4 моль.
Вычислим массу хлорида аммония:
m(NH4Cl) = ν · M = 0,4 · 53,5 = 21,4 г.
Масса раствора во второй колбе складывается из масс растворов сульфита аммония и соляной кислоты за вычетом сернистого газа. Обратим внимание на то, что масса раствора сульфита аммония во второй колбе пропорциональна количеству чистого вещества. Вычислим массы сернистого газа и части раствора сульфита аммония, которую ввели в реакцию с соляной кислотой:
mII(р-ра (NH4)2SO3) = (m(H2O) + m((NH4)2SO3)/0,6 · 0,2 = (120 + 69,6)/0,6 · 0,2 = 63,2 г,
m(SO2) = ν · M = 0,2 · 64 = 12,8 г.
mII(конечного р-ра) = m(р-ра HCl) + mII(р-ра (NH4)2SO3) − m(SO2) = 120 + 63,2 − 12,8 = 170,4 г.
Ответим на вопрос задачи и найдем массовую долю хлорида аммония:
ω(NH4Cl) = m(NH4Cl)/mII(конечного р-ра) · 100% = 21,4/170,4 · 100% = 12,56%.


