Лучший ответ
Buzablue
Ученик
(183)
11 лет назад
Надо массу в-ва делить на W(там занчок такой) и умножить на 100%
Остальные ответы
Евгений Секретик
Знаток
(378)
11 лет назад
налей в краску и посчитай
Кристина Миронова
Профи
(683)
11 лет назад
нужно массу растворенного вещества умножить на массовую долю растворителя
Ксения Казаку
Знаток
(251)
2 года назад
Чтобы найти массу растворителя, то есть ВОДЫ, нужно: масса (раствора) -масса (растворенного вещества)
Растворимость соединений, состоящих в одном гомологическом ряду значительно уменьшается в случае увеличения молекулярной массы, это связано с тем, что межмолекулярные силы взаимодействия повышаются.
К примеру, бензол способен полностью смешаться с этанолом, тогда как этанол и антрацен смешиваются только частично. Влияние молекулярной массы на общую растворимость особенно заметно в макромолекулах. Например, ацетон, спирт и концентрированная уксусная кислота способны легко растворить стирол, однако не могут растворить полистирол; винилацетат без проблем растворяется в эфирах и насыщенных углеводородах, но с поливинилацетатом такое не наблюдается. В спиртах не растворяется целлюлоза, в эфирах – полиэтиленгликоль, в винилхлориде – поливинилхлорид, в ацетонитриле – полиакрилонитрил, хотя наличие химического родства между этими полимерами и мономерами очевидно.
Из-за большой молекулярной массы структурированные полимеры не способны раствориться в растворителях даже при высокой температуре. Одна они способны набухать в присутствии растворителей в зависимости от плотности и природы поперечных связей.
В растворах общее соотношение количеств растворителя и растворенного вещества бывает разным. Если же количество растворенного вещества в отношении к растворителю довольно большое, то этот раствор называется концентрированным. В противном случает этот раствор считается слабым.
Масса раствора представляет собой сумму масс растворителя и растворенного вещества. К примеру, если 10 г сахара растворить в 100 г воды, то масса всего раствора составит 110 г. При описании любого раствора очень важной характеристикой считается его концентрация, т.е. сколько процентов занимает растворенное вещество в растворе. Например, если масса растворителя 647 равна 10 г, а масса раствора 110 г, то для нахождения концентрации 647 растворителя нужно 10 г разделить на 110 г, а результат умножить на 100%. Следовательно, 10г/110г*100%=9,09%.
Концентрация растворов точно описывает массовую долю всего растворенного вещества (w) – отношение всей массы растворенного вещества к массе раствора. Следует отметить, что именно отношение к массе самого раствора, а не к общей массе растворителя. Массовая доля выражается в процентах и в долях (безмерная величина).
Если же масса раствора будет составлять 200 г, а масса растворенного вещества в данном растворе равняется 50 г, то рассчитать массовую долю очень просто – 50/200 = 25% или 0,25. Также легко можно найти массовую долю самого растворителя. Она будет равна 200-50 = 150 г, таким образом, 150/200 = 75% или 0,75.
Пример 5. Определите массу нитрата
натрия и воды, необходимые для приготовления
800 г раствора с ω(NaNO3) = 12%.
Решение:
Масса растворенной соли:
m(NaNO3) = ω(NaNO3)·m(р-ра) = 0,12·800 =
96 г.
m(р-ра) = m(NaNO3) + m(H2O)
Отсюда
m(H2O) = m(р-ра) – m(NaNO3) = 800 – 96
= 704 г.
Ответ: m(NaNO3) = 96 г, m(H2O) =
704 г.
Пример 6. Определите массу
кристаллогидрата CuSO4·5H2O и
воды, необходимые для приготовления
0,4 кг раствора с ω(CuSO4) = 8%.
Решение (см. пример 2):
ω(CuSO4) =
=
m(H2O) = m(р-ра) – m(CuSO4·5H2O)
m(CuSO4·5H2O) = n(CuSO4·5H2O)·M(CuSO4·5H2O)
n(CuSO4·5H2O)·= n(CuSO4) =
Находим
m(CuSO4) = ω(CuSO4)·m(р-ра) = 0,08·400
= 32 г.
n(CuSO4) =
=
0,2 моль.
Отсюда m(CuSO4·5H2O) = 0,2·250 = 50 г
Масса воды m(H2O) = 400 – 50 = 350 г
Ответ: m(CuSO4·5H2O) = 50 г,
m(H2O) = 350 г.
1. 2. Вычисление массы раствора определенной концентрации по заданной массе растворенного вещества или растворителя
Пример 7. Определить массу раствора
с массовой долей K2SO4 10%,
который можно приготовить из 200 г воды
и сульфата калия.
Решение:
m(р-ра) =
Из условия задачи m(K2SO4)
неизвестна, но известна масса воды, а
поскольку вода – один из компонентов
раствора, то:
ω(Н2О) = 100% – ω(K2SO4) =
100 – 10 = 90%
m(р-ра) =
=
= 222,2 г.
Ответ: можно приготовить 222,2 г
раствора.
Пример 8. При растворении в 400 г воды
некоторого количества CuSO4·5H2O
получен раствор с массовой долей CuSO4
5%. Рассчитать массу использованного
кристаллогидрата и массу полученного
раствора.
Решение (см. примеры 2, 6):
m(р-ра) =
=
В этом уравнении неизвестны m(р-ра) и
m(CuSO4), но
m(р-ра) = m(CuSO4·5H2O) + m(H2O)
= m(CuSO4·5H2O) + 400
Таким образом, неизвестны две величины:
m(р-ра) и m(CuSO4·5H2O).
m(CuSO4) = n(CuSO4)·m(CuSO4)
m(CuSO4·5H2O) = n(CuSO4·5H2O)·m(CuSO4·5H2O)
m(CuSO4)
= 160 г/моль, m(CuSO4·5H2O)
= 250 г/моль.
Подставим эти величины в исходную
формулу:
400 + n(CuSO4)·250 =
Решаем уравнение относительно n(CuSO4):
20 + 0,05·250· n(CuSO4) = n(CuSO4)·160,
n(CuSO4) =
= 0,136 моль.
Отсюда
m(CuSO4·5H2O) = 0,136·250 = 34 г,
m(р-ра) = 400 + 34 = 434 г.
Возможны и другие варианты решения этой
задачи:
ω(CuSO4) =
=
В этом уравнении тоже два неизвестных
– m(CuSO4) и m(CuSO4·5H2O), но
величину m(CuSO4) можно представить
в виде m(CuSO4·5H2O)·х.
Здесь х – массовая доля CuSO4 в
кристаллогидрате, она равна:
х =
=
= 0,64
С учетом исходных данных, теперь можно
записать:
0,05 =
Решаем уравнение относительно
m(CuSO4·5H2O):
20 + 0,05 m(CuSO4·5H2O) = 0,66·m(CuSO4·5H2O)
m(CuSO4·5H2O) = 34 г.
Находим m(р-ра) = 400 + 34 = 434 г.
Ответ: для приготовления раствора
используют 34 г CuSO4·5H2O, масса
полученного раствора 434 г.
1. 3. Разбавление и концентрирование растворов
При решении задач, связанных с разбавлением
и концентрированием растворов, следует
помнить, что масса растворенного
вещества остается неизменной, т.е.
m(Х) = const. Изменяется только масса
растворителя и, соответственно, масса
раствора.
Пример 9. К 50 мл раствора H2SO4
(ω1 = 48%, ρ = 1,38 г/мл) добавили 950 мл
воды. Определить массовую долю H2SO4
в полученном растворе.
Решение:
ω2(H2SO4) =
m2(р-ра) = m1(р-ра) + m(H2O)
m(H2O) = V(H2O)·ρ(H2O) = 950·1 =
950 г
m1(р-ра) = V1(р-ра)·ρ(р-ра) =
50·1,38 = 69 г
m1(H2SO4) = m1(р-ра)
ω1(H2SO4) = 69·0,48 = 33,12 г
ω2(H2SO4) =
= 0,032 или 3,2%
Ответ: ω(H2SO4) в новом
растворе 0,032 или 3,2%.
Пример 10. Какой объем воды необходимо
добавить к 100 мл раствора азотной кислоты
(ρ = 1,1 г/мл, ω1 = 20%), чтобы получить
раствор HNO3 с ω2 = 5%?
Решение:
V(H2O) =
m(H2O) = m2(р-ра) – m1(р-ра)
m1(р-ра) = V1(р-ра)·ρ(р-ра) =
100·1,1 = 110 г
Масса искомого раствора определяется
по формуле:
m2(р-ра) =
m(HNO3) = m1(р-ра)·ω1(р-ра)
= 110·0,2 = 22 г.
Отсюда масса нового раствора:
m2(р-ра) =
= 440 г
Масса и объем добавленной воды будут
равны
m(H2O) = 440 – 110 = 330 г V(H2O) =
=
330 мл
Ответ: следует добавить 330 мл воды.
Пример 11. Из 200 мл раствора сульфата
меди (ρ = 1,1 г/мл, ω1 = 8%)
выпарили
100 мл воды. Определить ω(CuSO4)
в полученном растворе.
Решение:
ω2(CuSO4) =
При концентрировании растворов масса
растворенного вещества, как и при
разбавлении, остается неизменной, т.е.
m(CuSO4) = const.
m(CuSO4) = m1(р-ра)·ω1(р-ра)
= 220·0,08 = 17,6 г
Масса раствора после упаривания
уменьшилась на 100 г:
m(H2O) = V(H2O)·ρ(H2O) = 100·1
= 100 г
Масса исходного раствора
m1(р-ра) = V1(р-ра)·ρ(р-ра) =
200·1,1 = 220 г
Следовательно, m2(р-ра) = 220 – 100 =
120 г
Отсюда ω2(CuSO4) =
= 0,147 или 14,7%
Ответ: ω(CuSO4) в полученном
растворе равна 0,147 или 14,7%.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
ЗАДАЧИ на Вычисление массы
растворенного вещества
Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе. Элемент ЕГЭ: 4.3.1. Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе».
Расчёты с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
Раствор — это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности. Растворы состоят из растворителя (например, воды) и растворенного вещества.
Массовой долей растворенного вещества (ω) называют отношение его массы m(В) к массе раствора m(p).
ω(В) = m(В) : m(p)
Это безразмерная величина, поэтому выражается в долях единицы (изменяется от 0 до 1), но иногда выражается в процентах (тогда изменяется от 0 до 100 %).
Обозначение ω(В) аналогично обозначению ω(р. в-ва) или ω(в-ва);
обозначение m(В) аналогично обозначению m(р. в-ва) или m(в-ва);
обозначение m(р) аналогично обозначению m(р-ра),
где р-ра – сокращение слова «раствора», а р. в-ва и в-ва – сокращения слов «растворенного вещества».
Обратите внимание также на следующие обозначения:
m(в) — масса безводного вещества;
m(р-ля) — масса растворителя.
Соотношения между величинами, характеризующими раствор
Следует учитывать, что любой способ выражения содержания растворенного вещества в растворе дается в расчете на безводное вещество, даже если для приготовления раствора использован кристаллогидрат. Если для приготовления растворов используют не безводное вещество, а его кристаллогидрат, B • nH20, то масса растворителя (воды) рассчитывается по формуле: m(H20) = m(р) – m(кр.), где m(кр.) — масса кристаллогидрата, в граммах. Следует учитывать, что количество (моль) кристаллогидрата равно количеству (моль) безводного вещества, т.е. m(кр.) : М(кр.) = m(в) : М(в).
Молярная концентрация характеризует количество растворенного вещества, выраженное, в молях, содержащееся в 1 л раствора. Молярная концентрация вычисляется по формуле С = v / V, где С — молярная концентрация (измеряется в моль/л), v — количество вещества, V — объем раствора, измеренный в литрах. Часто размерность молярной концентрации обозначают символом М. Например, раствор с концентрацией 1 М (одномолярный раствор) содержит 1 моль растворенного вещества в 1л раствора, 0,1 М (децимолярный раствор) — 0,1 моль растворенного вещества в 1 л раствора и т. д.
Титр (Т) определяет массу растворенного вещества (в г), содержащуюся в 1 мл раствора: T = m / V.
Растворимость характеризует способность вещества растворяться в том или ином растворителе. Растворимость обозначается символом S, она равна концентрации насыщенного при данной температуре раствора. Чаще всего растворимость измеряют числом граммов вещества, способных раствориться в 100 г растворителя при данной температуре. Важно не путать растворимость с массовой долей вещества в растворе, так как растворимость показывает, сколько граммов растворенного вещества содержится в 100 г растворителя, а массовая доля — сколько граммов растворенного вещества содержится в 100 г раствора. Растворимость веществ зависит от температуры. Растворимость твердых веществ при повышении температуры, как правило, увеличивается, растворимость газов — уменьшается.
Приготовление растворов. Способы приготовления растворов: 1) Разбавление раствора водой; 2) Выпаривание воды из раствора; 3) Сливание двух растворов; 4) Выпадение кристаллов.
Способы приготовления растворов в задачах на Вычисление массы растворенного вещества
РЕШЕНИЯ ЗАДАЧ с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
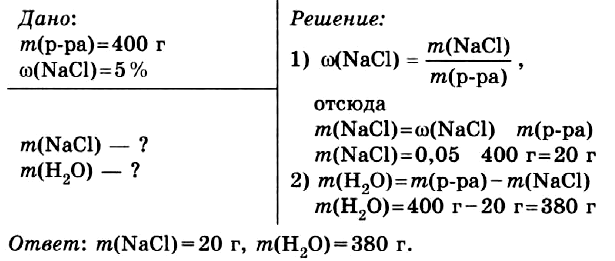
Задача № 1.
Приготовить 400 г водного раствора с массовой долей хлорида натрия в нём 5 %.
Правильный ОТВЕТ: m(NaCl) = 20 г, m(H2O) = 380 г.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 2.
Найти массовую долю растворённого вещества (в %) в растворе, полученном при смешивании 450 г воды и 50 г сахара.
Правильный ОТВЕТ: ω(сах.) = 10%.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 3.
Вычислите молярную концентрацию 4%-ного раствора поваренной соли, плотность которого равна 1,027 г/мл.
Правильный ОТВЕТ: C(NaCl) ≈ 0,7 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 4.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 5.
При 25 °С растворимость хлорида калия в воде составляет 25 г соли на 100 г воды. Вычислите массовую долю соли в насыщенном растворе и его молярную концентрацию, если плотность насыщенного раствора равна 1,132 г/мл.
Правильный ОТВЕТ: ω(KCl) = 20%, С(KCl) = 3,04 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради
Задача № 6.
Массовая доля соли в растворе, насыщенном при температуре 40 °С, равна 35%. При охлаждении 300 г этого раствора до температуры 10 °С в осадок выпадает 45 г соли. Определите растворимость соли при 10 °С.
Правильный ОТВЕТ: S10°С = 30,77 г.
Смотреть РЕШЕНИЯ заданий в тетради
Задачи с ответами
на Вычисление массы растворенного вещества
Задача № 7.
Масса нитрата калия, которую следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%, равна ______. (Записывайте ответ с точностью до десятых.)
Правильный ОТВЕТ: 3,4 г.
Задача № 8.
Плотность 10% -ного раствора хлорида калия составляет 1,063 г/мл. Определите массу (г) хлорида калия, который содержится в 750 мл такого раствора.
Правильный ОТВЕТ: 75,0 г.
Задача № 9.
Рассчитайте массовую долю (%) нитрата натрия в растворе, полученном при смешивании 250 г 10%-ного и 750 г 15%-ного растворов этой соли.
Правильный ОТВЕТ: 13,75 %.
Задача № 10.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Задача № 11.
В 125 г воды растворили 25 г азотной кислоты. Вычислите титр образовавшегося раствора, если его плотность равна 1,095 г/мл.
Правильный ОТВЕТ: T(HNO3) = 0,182 г/мл.
Задача № 12.
Титр раствора сульфата аммония равен 0,223 г/мл, а его плотность — 1,115 г/мл. Рассчитайте массовую долю сульфата аммония в данном растворе и молярную концентрацию раствора.
Правильный ОТВЕТ: ω((NH4)2SO4) = 20%, C((NH4)2SO4) = 1,689 моль/л.
(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «ЗАДАЧИ на Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Расчеты концентрации
растворенных веществ
в растворах
Решение задач на разбавление растворов особой
сложности не представляет, однако требует
внимательности и некоторого напряжения. Тем не
менее можно упростить решение этих задач,
используя закон разбавления, которым пользуются
в аналитической химии при титровании растворов.
Во всех задачниках по химии показаны решения
задач, представленных как образец решения, и во
всех решениях используется закон разбавления,
принцип которого состоит в том, что количество
растворенного вещества и масса m
в исходном и разбавленном
растворах остаются неизменными. Когда мы решаем
задачу, то это условие держим в уме, а расчет
записываем по частям и постепенно, шаг за шагом,
приближаемся к конечному результату.
Рассмотрим проблему решения задач на
разбавление, исходя из следующих соображений.
Количество растворенного вещества :
= c
V
,
где c
– молярная концентрация
растворенного вещества в моль/л, V
– объем
раствора в л.
Масса растворенного вещества m
(р.в.):
m(р. в.) = m
(р-ра) ,
где m
(р-ра) – масса раствора в г, – массовая доля
растворенного вещества.
Обозначим в исходном (или неразбавленном)
растворе величины c
, V
, m
(р-ра), через с
1 , V
1 ,
m
1 (р-ра), 1 ,
а в разбавленном растворе – через с
2 , V
2 ,
m
2 (р-ра), 2 .
Составим уравнения разбавления растворов. Левые
части уравнений отведем для исходных
(неразбавленных) растворов, а правые части – для
разбавленных растворов.
Неизменность количества растворенного вещества
при разбавлении будет иметь вид:
Сохранение массы m
(р. в.):
Количество растворенного вещества связано с его массой m
(р. в.) cоотношением:
= m
(р.
в.)/M
(р. в.),
где M
(р. в.) – молярная масса растворенного
вещества в г/моль.
Уравнения разбавления (1) и (2) связаны между собой
следующим образом:
с 1 V
1 = m
2 (р-ра) 2 /M
(р. в.),
m 1 (р-ра) 1 = с
2 V
2 M
(р.
в.).
Если в задаче известен объем растворенного
газа V
(газа), то его количество вещества связано с объемом
газа (н.у.) отношением:
= V
(газа)/22,4.
Уравнения разбавления примут соответственно
вид:
V(газа)/22,4 = с
2 V
2 ,
V(газа)/22,4 = m
2 (р-ра) 2 /M
(газа).
Если в задаче известны масса вещества или
количество вещества, взятого для приготовления
раствора, то в левой части уравнения разбавления
ставится m
(р. в.) или , в зависимости от условия задачи.
Если по условию задачи требуется объединить
растворы разной концентрации одного и того же
вещества, то в левой части уравнения массы
растворенных веществ суммируются.
Довольно часто в задачах используется плотность
раствора (г/мл). Но
поскольку молярная концентрация с
измеряется в моль/л, то и плотность следует
выражать в г/л, а объем V
– в л.
Приведем примеры решения «образцовых» задач.
Задача 1.
Какой
объем 1М раствора серной кислоты надо взять,
чтобы получить 0,5 л 0,1М
H 2 SO 4 ?
Дано:
с 1 = 1 моль/л,
V
2 = 0,5 л,
с
2 = 0,1 моль/л.
Найти:
Решение
V 1 с
1 = V
2 с
2 ,
V 1 1 = 0,5 0,1; V
1 = 0,05 л,
или 50 мл.
Ответ.
V
1 = 50 мл.
Задача 2
(,
№ 4.23). Определите массу раствора с массовой
долей
(СuSО 4)
10% и массу воды, которые потребуются для
приготовления раствора массой 500 г с массовой
долей
(СuSО 4) 2%.
Дано:
1 = 0,1,
m
2 (р-ра) = 500 г,
2 = 0,02.
Найти:
m
1 (р-ра) = ?
m
(H 2 O) = ?
Решение
m 1 (р-ра) 1 = m
2 (р-ра) 2 ,
m 1 (р-ра) 0,1 = 500 0,02.
Отсюда m
1 (р-ра) = 100 г.
Найдем массу добавляемой воды:
m(H 2 O) = m
2 (р-ра) – m
1 (р-ра),
m(H 2 O) = 500 – 100 = 400 г.
Ответ.
m
1 (р-ра) = 100 г, m
(H 2 O)
= 400 г.
Задача 3
(,
№ 4.37). Какой объем раствора с массовой долей
серной кислоты 9,3%
( = 1,05 г/мл)
потребуется для приготовления 0,35М
раствора
H 2 SO 4
объемом 40 мл?
Дано:
1 = 0,093,
1 = 1050 г/л,
с
2 = 0,35 моль/л,
V
2 = 0,04 л,
М
(H 2 SO 4) = 98 г/моль.
Найти:
Решение
m 1 (р-ра) 1 = V
2 с
2 М
(H 2 SO 4),
V 1 1 1
= V
2 с
2 М
(H 2 SO 4).
Подставляем значения известных величин:
V 1 1050 0,093 = 0,04 0,35 98.
Отсюда V
1 = 0,01405 л, или 14,05 мл.
Ответ.
V
1 = 14,05 мл.
Задача 4
. Какой
объем хлороводорода (н.у.) и воды потребуется,
чтобы приготовить 1 л раствора ( = 1,05 г/см 3), в котором
содержание хлороводорода в массовых долях равно
0,1
(или 10%)?
Дано:
V(р-ра) = 1 л,
(р-ра) = 1050 г/л,
= 0,1,
М
(HCl) = 36,5 г/моль.
Найти:
V
(HCl) = ?
m
(H 2 O) = ?
Решение
V(HCl)/22,4 = m
(р-ра) /М
(HCl),
V(HCl)/22,4 = V
(р-ра) (р-ра) /М
(HCl),
V(HCl)/22,4 = 1 1050 0,1/36,5.
Отсюда V
(HCl) = 64,44 л.
Найдем массу добавляемой воды:
m(H 2 O) = m
(р-ра) – m
(HСl),
m(H 2 O) = V
(р-ра) (р-ра) – V
(HCl)/22,4 М
(HCl),
m(H 2 O) = 1 1050 – 64,44/22,4 36,5 = 945 г.
Ответ.
64,44 л HCl и 945 г воды.
Задача 5
(,
№ 4.34). Определите молярную концентрацию
раствора с массовой долей гидроксида натрия 0,2 и
плотностью 1,22 г/мл.
Дано:
0,2,
= 1220 г/л,
М
(NaOH) = 40 г/моль.
Найти:
Решение
m(р-ра) = с
V
М
(NaOH),
m(р-ра) = с
m
(р-ра) М
(NaOH)/.
Разделим обе части уравнения на m
(р-ра) и
подставим численные значения величин.
0,2 = c
40/1220.
Отсюда c
= 6,1 моль/л.
Ответ.
c
= 6,1 моль/л.
Задача 6
(,
№ 4.30). Определите молярную концентрацию
раствора, полученного при растворении сульфата
натрия массой 42,6 г в воде массой 300 г, если
плотность полученного раствора равна 1,12 г/мл.
Дано:
m(Na 2 SO 4) = 42,6 г,
m
(H 2 O) = 300 г,
= 1120 г/л,
M
(Na 2 SO 4) = 142 г/моль.
Найти:
Решение
m(Na 2 SO 4) = с
V
М
(Na 2 SO 4).
500 (1 – 4,5/(4,5 + 100)) = m
1 (р-ра) (1 –
4,1/(4,1 + 100)).
Отсюда m
1 (р-ра) = 104,1/104,5 500 = 498,09 г,
m(NaF) = 500 – 498,09 = 1,91 г.
Ответ.
m
(NaF) = 1,91 г.
ЛИТЕРАТУРА
1. Хомченко Г.П., Хомченко И.Г.
Задачи по химии
для поступающих в вузы. М.: Новая волна, 2002.
2. Фельдман Ф.Г., Рудзитис Г.Е.
Химия-9. М.:
Просвещение, 1990, с. 166.
Раствором
называют гомогенную смесь двух или более компонентов.
Вещества, смешением которых получен раствор, называют его компонентами
.
Среди компонентов раствора различают растворенное вещество
, которое может быть не одно, и растворитель
. Например, в случае раствора сахара в воде сахар является растворенным веществом, а вода является растворителем.
Иногда понятие растворитель может быть применимо в равной степени к любому из компонентов. Например, это касается тех растворов, которые получены смешением двух или более жидкостей, идеально растворимых друг в друге. Так, в частности, в растворе, состоящем из спирта и воды, растворителем может быть назван как спирт, так и вода. Однако чаще всего в отношении водосодержащих растворов традиционно растворителем принято называть воду, а растворенным веществом — второй компонент.
В качестве количественной характеристики состава раствора чаще всего используют такое понятие, как массовая доля
вещества в растворе. Массовой долей вещества называют отношение массы этого вещества к массе раствора, в котором оно содержится:
где ω
(в-ва) – массовая доля вещества, содержащегося в растворе (г), m
(в-ва) – масса вещества, содержащегося в растворе (г), m(р-ра) – масса раствора (г).
Из формулы (1) следует, что массовая доля может принимать значения от 0 до 1, то есть составляет доли единицы. В связи с этим массовую долю можно также выражать в процентах (%), причем именно в таком формате она фигурирует практически во всех задачах. Массовая доля, выраженная в процентах, рассчитывается по формуле, схожей с формулой (1) с той лишь разницей, что отношение массы растворенного вещества к массе всего раствора умножают на 100%:
Для раствора, состоящего только из двух компонентов, могут быть соответственно рассчитаны массовые доли растворенного вещества ω(р.в.) и массовая доля растворителя ω(растворителя).
Массовую долю растворенного вещества называют также концентрацией раствора
.
Для двухкомпонентного раствора его масса складывается из масс растворенного вещества и растворителя:
Также в случае двухкомпонентного раствора сумма массовых долей растворенного вещества и растворителя всегда составляет 100%:
Очевидно, что, помимо записанных выше формул, следует знать и все те формулы, которые напрямую из них математически выводятся. Например:
Также необходимо помнить формулу, связывающую массу, объем и плотность вещества:
m = ρ∙V
а также обязательно нужно знать, что плотность воды равна 1 г/мл. По этой причине объем воды в миллилитрах численно равен массе воды в граммах. Например, 10 мл воды имеют массу 10 г, 200 мл — 200 г и т.д.
Для того чтобы успешно решать задачи, помимо знания указанных выше формул, крайне важно довести до автоматизма навыки их применения. Достичь этого можно только прорешиванием большого количества разнообразных задач. Задачи из реальных экзаменов ЕГЭ на тему «Расчеты с использованием понятия «массовая доля вещества в растворе»» можно порешать .
Примеры задач на растворы
Пример 1
Рассчитайте массовую долю нитрата калия в растворе, полученном смешением 5 г соли и 20 г воды.
Решение:
Растворенным веществом в нашем случае является нитрат калия, а растворителем — вода. Поэтому формулы (2) и (3) могут быть записаны соответственно как:
Из условия m(KNO 3) = 5 г, а m(Н 2 O) = 20 г, следовательно:
Пример 2
Какую массу воды необходимо добавить к 20 г глюкозы для получения 10%-ного раствора глюкозы.
Решение:
Из условий задачи следует, что растворенным веществом является глюкоза, а растворителем — вода. Тогда формула (4) может быть записана в нашем случае так:
Из условия мы знаем массовую долю (концентрацию) глюкозы и саму массу глюкозы. Обозначив массу воды как x г, мы можем записать на основе формулы выше следующее равносильное ей уравнение:
Решая это уравнение находим x:
т.е. m(H 2 O) = x г = 180 г
Ответ: m(H 2 O) = 180 г
Пример 3
150 г 15%-ного раствора хлорида натрия смешали со 100 г 20%-ного раствора этой же соли. Какова массовая доля соли в полученном растворе? Ответ укажите с точностью до целых.
Решение:
Для решения задач на приготовление растворов удобно использовать следующую таблицу:
где m р.в. , m р-ра и ω р.в. — значения массы растворенного вещества, массы раствора и массовой доли растворенного вещества соответственно, индивидуальные для каждого из растворов.
Из условия мы знаем, что:
m (1) р-ра = 150 г,
ω (1) р.в. = 15%,
m (2) р-ра = 100 г,
ω (1) р.в. = 20%,
Вставим все эти значения в таблицу, получим:
Нам следует вспомнить следующие формулы, необходимые для расчетов:
ω р.в. = 100% ∙ m р.в. /m р-ра, m р.в. = m р-ра ∙ ω р.в. /100% , m р-ра = 100% ∙ m р.в. /ω р.в.
Начинаем заполнять таблицу.
Если в строчке или столбце отсутствует только одно значение, то его можно посчитать. Исключение — строчка с ω р.в.
, зная значения в двух ее ячейках, значение в третьей рассчитать нельзя.
В первом столбце отсутствует значение только в одной ячейке. Значит мы можем рассчитать его:
m (1) р.в. = m (1) р-ра ∙ ω (1) р.в. /100% = 150 г ∙ 15%/100% = 22,5 г
Аналогично у нас известны значения в двух ячейках второго столбца, значит:
m (2) р.в. = m (2) р-ра ∙ ω (2) р.в. /100% = 100 г ∙ 20%/100% = 20 г
Внесем рассчитанные значения в таблицу:
Теперь у нас стали известны два значения в первой строке и два значения во второй строке. Значит мы можем рассчитать недостающие значения (m (3)р.в. и m (3)р-ра):
m (3)р.в. = m (1)р.в. + m (2)р.в. = 22,5 г + 20 г = 42,5 г
m (3)р-ра = m (1)р-ра + m (2)р-ра = 150 г + 100 г = 250 г.
Внесем рассчитанные значения в таблицу, получим:
Вот теперь мы вплотную подобрались к расчету искомой величины ω (3)р.в. . В столбце, где она расположена, известно содержимое двух других ячеек, значит мы можем ее рассчитать:
ω (3)р.в. = 100% ∙ m (3)р.в. /m (3)р-ра = 100% ∙ 42,5 г/250 г = 17%
Пример 4
К 200 г 15%-ного раствора хлорида натрия добавили 50 мл воды. Какова массовая доля соли в полученном растворе. Ответ укажите с точностью до сотых _______%
Решение:
Прежде всего следует обратить внимание на то, что вместо массы добавленной воды, нам дан ее объем. Рассчитаем ее массу, зная, что плотность воды равна 1 г/мл:
m доб. (H 2 O) = V доб. (H 2 O) ∙ ρ
(H 2 O) =
50 мл ∙ 1 г/мл = 50 г
Если рассматривать воду как 0%-ный раствор хлорида натрия, содержащий соответственно 0 г хлорида натрия, задачу можно решить с помощью такой же таблицы, как в примере выше. Начертим такую таблицу и вставим известные нам значения в нее:
В первом столбце известны два значения, значит можем посчитать третье:
m (1)р.в. = m (1)р-ра ∙ ω (1)р.в. /100% = 200 г ∙ 15%/100% = 30 г,
Во второй строчке тоже известны два значения, значит можем рассчитать третье:
m (3)р-ра = m (1)р-ра + m (2)р-ра = 200 г + 50 г = 250 г,
Внесем рассчитанные значения в соответствующие ячейки:
Теперь стали известны два значения в первой строке, значит можем посчитать значение m (3)р.в. в третьей ячейке:
m (3)р.в. = m (1)р.в. + m (2)р.в. = 30 г + 0 г = 30 г
ω (3)р.в. = 30/250 ∙ 100% = 12%.
Методика решения задач по химии
При решении задач необходимо руководствоваться несколькими простыми правилами:
- Внимательно прочитать условие задачи;
- Записать, что дано;
- Перевести, если это необходимо, единицы физических величин в единицы системы СИ (некоторые внесистемные единицы допускаются, например литры);
- Записать, если это необходимо, уравнение реакции и расставить коэффициенты;
- Решать задачу, используя понятие о количестве вещества, а не метод составления пропорций;
- Записать ответ.
В целях успешной подготовки по химии следует внимательно рассмотреть решения задач, приводимых в тексте, а также самостоятельно решить достаточное число их. Именно в процессе решения задач будут закреплены основные теоретические положения курса химии. Решать задачи необходимо на протяжении всего времени изучения химии и подготовки к экзамену.
Вы можете использовать задачи на этой странице, а можете скачать хороший сборник задач и упражнений с решением типовых и усложненных задач (М. И. Лебедева, И. А. Анкудимова): скачать .
Моль, молярная масса
Молярная масса – это отношение массы вещества к количеству вещества, т.е.
М(х) = m(x)/ν(x), (1)
где М(х) – молярная масса вещества Х, m(x) – масса вещества Х, ν(x) – количество вещества Х. Единица СИ молярной массы – кг/моль, однако обычно используется единица г/моль. Единица массы – г, кг. Единица СИ количества вещества – моль.
Любая задача по химии решается
через количество вещества. Необходимо помнить основную формулу:
ν(x) = m(x)/ М(х) = V(x)/V m = N/N A , (2)
где V(x) – объем вещества Х(л), V m – молярный объем газа (л/моль), N – число частиц, N A – постоянная Авогадро.
1. Определите массу
иодида натрия NaI количеством вещества 0,6 моль.
Дано
: ν(NaI)= 0,6 моль.
Найти
: m(NaI) =?
Решение
. Молярная масса иодида натрия составляет:
M(NaI) = M(Na) + M(I) = 23 + 127 = 150 г/моль
Определяем массу NaI:
m(NaI) = ν(NaI) M(NaI) = 0,6 150 = 90 г.
2. Определите количество вещества
атомного бора, содержащегося в тетраборате натрия Na 2 B 4 O 7 массой 40,4 г.
Дано
: m(Na 2 B 4 O 7)=40,4 г.
Найти
: ν(B)=?
Решение
. Молярная масса тетрабората натрия составляет 202 г/моль. Определяем количество вещества Na 2 B 4 O 7:
ν(Na 2 B 4 O 7)= m(Na 2 B 4 O 7)/ М(Na 2 B 4 O 7) = 40,4/202=0,2 моль.
Вспомним, что 1 моль молекулы тетрабората натрия содержит 2 моль атомов натрия, 4 моль атомов бора и 7 моль атомов кислорода (см. формулу тетрабората натрия). Тогда количество вещества атомного бора равно: ν(B)= 4 ν (Na 2 B 4 O 7)=4 0,2 = 0,8 моль.
Расчеты по химическим формулам. Массовая доля.
Массовая доля вещества – отношение массы данного вещества в системе к массе всей системы, т.е. ω(Х) =m(Х)/m, где ω(X)– массовая доля вещества Х, m(X) – масса вещества Х, m – масса всей системы. Массовая доля – безразмерная величина. Её выражают в долях от единицы или в процентах. Например, массовая доля атомного кислорода составляет 0,42, или 42%, т.е. ω(О)=0,42. Массовая доля атомного хлора в хлориде натрия составляет 0,607, или 60,7%, т.е. ω(Cl)=0,607.
3. Определите массовую долю
кристаллизационной воды в дигидрате хлорида бария BaCl 2 2H 2 O.
Решение
: Молярная масса BaCl 2 2H 2 O составляет:
М(BaCl 2 2H 2 O) = 137+ 2 35,5 + 2 18 =244 г/моль
Из формулы BaCl 2 2H 2 O следует, что 1 моль дигидрата хлорида бария содержит 2 моль Н 2 О. Отсюда можно определить массу воды, содержащейся в BaCl 2 2H 2 O:
m(H 2 O) = 2 18 = 36 г.
Находим массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl 2 2H 2 O.
ω(H 2 O) = m(H 2 O)/ m(BaCl 2 2H 2 O) = 36/244 = 0,1475 = 14,75%.
4. Из образца горной породы массой 25 г, содержащей минерал аргентит Ag 2 S, выделено серебро массой 5,4 г. Определите массовую долю
аргентита в образце.
Дано
: m(Ag)=5,4 г; m = 25 г.
Найти
: ω(Ag 2 S) =?
Решение
: определяем количество вещества серебра, находящегося в аргентите: ν(Ag) =m(Ag)/M(Ag) = 5,4/108 = 0,05 моль.
Из формулы Ag 2 S следует, что количество вещества аргентита в два раза меньше количества вещества серебра. Определяем количество вещества аргентита:
ν(Ag 2 S)= 0,5 ν (Ag) = 0,5 0,05 = 0,025 моль
Рассчитываем массу аргентита:
m(Ag 2 S) = ν(Ag 2 S) М(Ag 2 S) = 0,025 248 = 6,2 г.
Теперь определяем массовую долю аргентита в образце горной породы, массой 25 г.
ω(Ag 2 S) = m(Ag 2 S)/ m = 6,2/25 = 0,248 = 24,8%.
Вывод формул соединений
5. Определите простейшую формулу соединения
калия с марганцем и кислородом, если массовые доли элементов в этом веществе составляют соответственно 24,7, 34,8 и 40,5%.
Дано
: ω(K) =24,7%; ω(Mn) =34,8%; ω(O) =40,5%.
Найти
: формулу соединения.
Решение
: для расчетов выбираем массу соединения, равную 100 г, т.е. m=100 г. Массы калия, марганца и кислорода составят:
m (К) = m ω(К); m (К) = 100 0,247= 24,7 г;
m (Mn) = m ω(Mn); m (Mn) =100 0,348=34,8 г;
m (O) = m ω(O); m (O) = 100 0,405 = 40,5 г.
Определяем количества веществ атомных калия, марганца и кислорода:
ν(К)= m(К)/ М(К) = 24,7/39= 0,63 моль
ν(Mn)= m(Mn)/ М(Mn) = 34,8/ 55 = 0,63 моль
ν(O)= m(O)/ М(O) = 40,5/16 = 2,5 моль
Находим отношение количеств веществ:
ν(К) : ν(Mn) : ν(O) = 0,63: 0,63: 2,5.
Разделив правую часть равенства на меньшее число (0,63) получим:
ν(К) : ν(Mn) : ν(O) = 1: 1: 4.
Следовательно, простейшая формула соединения KMnO 4 .
6. При сгорании 1,3 г вещества образовалось 4,4 г оксида углерода (IV) и 0,9 г воды. Найти молекулярную формулу
вещества, если его плотность по водороду равна 39.
Дано
: m(в-ва) =1,3 г; m(СО 2)=4,4 г; m(Н 2 О)=0,9 г; Д Н2 =39.
Найти
: формулу вещества.
Решение
: Предположим, что искомое вещество содержит углерод, водород и кислород, т.к. при его сгорании образовались СО 2 и Н 2 О. Тогда необходимо найти количества веществ СО 2 и Н 2 О, чтобы определить количества веществ атомарных углерода, водорода и кислорода.
ν(СО 2) = m(СО 2)/ М(СО 2) = 4,4/44 = 0,1 моль;
ν(Н 2 О) = m(Н 2 О)/ М(Н 2 О) = 0,9/18 = 0,05 моль.
Определяем количества веществ атомарных углерода и водорода:
ν(С)= ν(СО 2); ν(С)=0,1 моль;
ν(Н)= 2 ν(Н 2 О); ν(Н)= 2 0,05 = 0,1 моль.
Следовательно, массы углерода и водорода будут равны:
m(С) = ν(С) М(С) = 0,1 12 = 1,2 г;
m(Н) = ν(Н) М(Н) = 0,1 1 =0,1 г.
Определяем качественный состав вещества:
m(в-ва) = m(С) + m(Н) = 1,2 + 0,1 = 1,3 г.
Следовательно, вещество состоит только из углерода и водорода (см. условие задачи). Определим теперь его молекулярную массу, исходя из данной в условии задачи
плотности вещества по водороду.
М(в-ва) = 2 Д Н2 = 2 39 = 78 г/моль.
ν(С) : ν(Н) = 0,1: 0,1
Разделив правую часть равенства на число 0,1, получим:
ν(С) : ν(Н) = 1: 1
Примем число атомов углерода (или водорода) за «х», тогда, умножив «х» на атомные массы углерода и водорода и приравняв эту сумму молекулярной массе вещества, решим уравнение:
12х + х = 78. Отсюда х= 6. Следовательно, формула вещества С 6 Н 6 – бензол.
Молярный объем газов. Законы идеальных газов. Объемная доля
.
Молярный объем газа равен отношению объема газа к количеству вещества этого газа, т.е.
V m = V(X)/ ν(x),
где V m – молярный объем газа – постоянная величина для любого газа при данных условиях; V(X) – объем газа Х; ν(x) – количество вещества газа Х. Молярный объем газов при нормальных условиях (нормальном давлении р н = 101 325 Па ≈ 101,3 кПа и температуре Тн= 273,15 К ≈ 273 К) составляет V m = 22,4 л/моль.
В расчетах, связанных с газами, часто приходится переходить от данных условий к нормальным или наоборот. При этом удобно пользоваться формулой, следующей из объединенного газового закона Бойля-Мариотта и Гей-Люссака:
──── = ─── (3)
Где p – давление; V – объем; Т- температура в шкале Кельвина; индекс «н» указывает на нормальные условия.
Состав газовых смесей часто выражают при помощи объемной доли – отношения объема данного компонента к общему объему системы, т.е.
где φ(Х) – объемная доля компонента Х; V(X) – объем компонента Х; V – объем системы. Объемная доля – безразмерная величина, её выражают в долях от единицы или в процентах.
7. Какой объем
займет при температуре 20 о С и давлении 250 кПа аммиак массой 51 г?
Дано
: m(NH 3)=51 г; p=250 кПа; t=20 o C.
Найти
: V(NH 3) =?
Решение
: определяем количество вещества аммиака:
ν(NH 3) = m(NH 3)/ М(NH 3) = 51/17 = 3 моль.
Объем аммиака при нормальных условиях составляет:
V(NH 3) = V m ν(NH 3) = 22,4 3 = 67,2 л.
Используя формулу (3), приводим объем аммиака к данным условиям [температура Т= (273 +20)К = 293 К]:
p н TV н (NH 3) 101,3 293 67,2
V(NH 3) =──────── = ───────── = 29,2 л.
8. Определите объем
, который займет при нормальных условиях газовая смесь, содержащая водород, массой 1,4 г и азот, массой 5,6 г.
Дано
: m(N 2)=5,6 г; m(H 2)=1,4 ; н.у.
Найти
: V(смеси)=?
Решение
: находим количества вещества водорода и азота:
ν(N 2) = m(N 2)/ М(N 2) = 5,6/28 = 0,2 моль
ν(H 2) = m(H 2)/ М(H 2) = 1,4/ 2 = 0,7 моль
Так как при нормальных условиях эти газы не взаимодействуют между собой, то объем газовой смеси будет равен сумме объемов газов, т.е.
V(смеси)=V(N 2) + V(H 2)=V m ν(N 2) + V m ν(H 2) = 22,4 0,2 + 22,4 0,7 = 20,16 л.
Расчеты по химическим уравнениям
Расчеты по химическим уравнениям (стехиометрические расчеты) основаны на законе сохранения массы веществ. Однако в реальных химических процессах из-за неполного протекания реакции и различных потерь веществ масса образующихся продуктов часто бывает меньше той, которая должна образоваться в соответствии с законом сохранения массы веществ. Выход продукта реакции (или массовая доля выхода) – это выраженное в процентах отношение массы реально полученного продукта к его массе, которая должна образоваться в соответствии с теоретическим расчетом, т.е.
η = /m(X) (4)
Где η– выход продукта, %; m p (X) – масса продукта Х, полученного в реальном процессе; m(X) – рассчитанная масса вещества Х.
В тех задачах, где выход продукта не указан, предполагается, что он – количественный (теоретический), т.е. η=100%.
9. Какую массу фосфора надо сжечь для получения
оксида фосфора (V) массой 7,1 г?
Дано
: m(P 2 O 5)=7,1 г.
Найти
: m(Р) =?
Решение
: записываем уравнение реакции горения фосфора и расставляем стехиометрические коэффициенты.
4P+ 5O 2 = 2P 2 O 5
Определяем количество вещества P 2 O 5 , получившегося в реакции.
ν(P 2 O 5) = m(P 2 O 5)/ М(P 2 O 5) = 7,1/142 = 0,05 моль.
Из уравнения реакции следует, что ν(P 2 O 5)= 2 ν(P), следовательно, количество вещества фосфора, необходимого в реакции равно:
ν(P 2 O 5)= 2 ν(P) = 2 0,05= 0,1 моль.
Отсюда находим массу фосфора:
m(Р) = ν(Р) М(Р) = 0,1 31 = 3,1 г.
10. В избытке соляной кислоты растворили магний массой 6 г и цинк массой 6,5 г. Какой объем
водорода, измеренный при нормальных условиях, выделится
при этом?
Дано
: m(Mg)=6 г; m(Zn)=6,5 г; н.у.
Найти
: V(H 2) =?
Решение
: записываем уравнения реакции взаимодействия магния и цинка с соляной кислотой и расставляем стехиометрические коэффициенты.
Zn + 2 HCl = ZnCl 2 + H 2
Mg + 2 HCl = MgCl 2 + H 2
Определяем количества веществ магния и цинка, вступивших в реакцию с соляной кислотой.
ν(Mg) = m(Mg)/ М(Mg) = 6/24 = 0,25 моль
ν(Zn) = m(Zn)/ М(Zn) = 6,5/65 = 0,1 моль.
Из уравнений реакции следует, что количество вещества металла и водорода равны, т.е. ν(Mg) = ν(Н 2); ν(Zn) = ν(Н 2), определяем количество водорода, получившегося в результате двух реакций:
ν(Н 2) = ν(Mg) + ν(Zn) = 0,25 + 0,1= 0,35 моль.
Рассчитываем объем водорода, выделившегося в результате реакции:
V(H 2) = V m ν(H 2) = 22,4 0,35 = 7,84 л.
11. При пропускании сероводорода объемом 2,8 л (нормальные условия) через избыток раствора сульфата меди (II) образовался осадок массой 11,4 г. Определите выход
продукта реакции.
Дано
: V(H 2 S)=2,8 л; m(осадка)= 11,4 г; н.у.
Найти
: η =?
Решение
: записываем уравнение реакции взаимодействия сероводорода и сульфата меди (II).
H 2 S + CuSO 4 = CuS ↓+ H 2 SO 4
Определяем количество вещества сероводорода, участвующего в реакции.
ν(H 2 S) = V(H 2 S) / V m = 2,8/22,4 = 0,125 моль.
Из уравнения реакции следует, что ν(H 2 S) = ν(СuS) = 0,125 моль. Значит можно найти теоретическую массу СuS.
m(СuS) = ν(СuS) М(СuS) = 0,125 96 = 12 г.
Теперь определяем выход продукта, пользуясь формулой (4):
η = /m(X)= 11,4 100/ 12 = 95%.
12. Какая масса
хлорида аммония образуется при взаимодействии хлороводорода массой 7,3 г с аммиаком массой 5,1 г? Какой газ останется в избытке? Определите массу избытка.
Дано
: m(HCl)=7,3 г; m(NH 3)=5,1 г.
Найти
: m(NH 4 Cl) =? m(избытка) =?
Решение
: записываем уравнение реакции.
HCl + NH 3 = NH 4 Cl
Эта задача на «избыток» и «недостаток». Рассчитываем количества вещества хлороводорода и аммиака и определяем, какой газ находится в избытке.
ν(HCl) = m(HCl)/ М(HCl) = 7,3/36,5 = 0,2 моль;
ν(NH 3) = m(NH 3)/ М(NH 3) = 5,1/ 17 = 0,3 моль.
Аммиак находится в избытке, поэтому расчет ведем по недостатку, т.е. по хлороводороду. Из уравнения реакции следует, что ν(HCl) = ν(NH 4 Cl) = 0,2 моль. Определяем массу хлорида аммония.
m(NH 4 Cl) = ν(NH 4 Cl) М(NH 4 Cl) = 0,2 53,5 = 10,7 г.
Мы определили, что аммиак находится в избытке (по количеству вещества избыток составляет 0,1 моль). Рассчитаем массу избытка аммиака.
m(NH 3) = ν(NH 3) М(NH 3) = 0,1 17 = 1,7 г.
13. Технический карбид кальция массой 20 г обработали избытком воды, получив ацетилен, при пропускании которого через избыток бромной воды образовался 1,1,2,2 –тетрабромэтан массой 86,5 г. Определите массовую долю
СаС 2 в техническом карбиде.
Дано
: m = 20 г; m(C 2 H 2 Br 4)=86,5 г.
Найти
: ω(СаC 2) =?
Решение
: записываем уравнения взаимодействия карбида кальция с водой и ацетилена с бромной водой и расставляем стехиометрические коэффициенты.
CaC 2 +2 H 2 O = Ca(OH) 2 + C 2 H 2
C 2 H 2 +2 Br 2 = C 2 H 2 Br 4
Находим количество вещества тетрабромэтана.
ν(C 2 H 2 Br 4) = m(C 2 H 2 Br 4)/ М(C 2 H 2 Br 4) = 86,5/ 346 = 0,25 моль.
Из уравнений реакций следует, что ν(C 2 H 2 Br 4) =ν(C 2 H 2) = ν(СаC 2) =0,25 моль. Отсюда мы можем найти массу чистого карбида кальция (без примесей).
m(СаC 2) = ν(СаC 2) М(СаC 2) = 0,25 64 = 16 г.
Определяем массовую долю СаC 2 в техническом карбиде.
ω(СаC 2) =m(СаC 2)/m = 16/20 = 0,8 = 80%.
Растворы. Массовая доля компонента раствора
14. В бензоле объемом 170 мл растворили серу массой 1,8 г. Плотность бензола равна 0,88 г/мл. Определите массовую долю
серы в растворе.
Дано
: V(C 6 H 6) =170 мл; m(S) = 1,8 г; ρ(С 6 C 6)=0,88 г/мл.
Найти
: ω(S) =?
Решение
: для нахождения массовой доли серы в растворе необходимо рассчитать массу раствора. Определяем массу бензола.
m(С 6 C 6) = ρ(С 6 C 6) V(C 6 H 6) = 0,88 170 = 149,6 г.
Находим общую массу раствора.
m(р-ра) = m(С 6 C 6) + m(S) =149,6 + 1,8 = 151,4 г.
Рассчитаем массовую долю серы.
ω(S) =m(S)/m=1,8 /151,4 = 0,0119 = 1,19 %.
15. В воде массой 40 г растворили железный купорос FeSO 4 7H 2 O массой 3,5 г. Определите массовую долю сульфата железа (II)
в полученном растворе.
Дано
: m(H 2 O)=40 г; m(FeSO 4 7H 2 O)=3,5 г.
Найти
: ω(FeSO 4) =?
Решение
: найдем массу FeSO 4 содержащегося в FeSO 4 7H 2 O. Для этого рассчитаем количество вещества FeSO 4 7H 2 O.
ν(FeSO 4 7H 2 O)=m(FeSO 4 7H 2 O)/М(FeSO 4 7H 2 O)=3,5/278=0,0125моль
Из формулы железного купороса следует, что ν(FeSO 4)= ν(FeSO 4 7H 2 O)=0,0125 моль. Рассчитаем массу FeSO 4:
m(FeSO 4) = ν(FeSO 4) М(FeSO 4) = 0,0125 152 = 1,91 г.
Учитывая, что масса раствора складывается из массы железного купороса (3,5 г) и массы воды (40 г), рассчитаем массовую долю сульфата железа в растворе.
ω(FeSO 4) =m(FeSO 4)/m=1,91 /43,5 = 0,044 =4,4 %.
Задачи для самостоятельного решения
- На 50 г йодистого метила в гексане подействовали металлическим натрием, при этом выделилось 1,12 л газа, измеренного при нормальных условиях. Определите массовую долю йодистого метила в растворе. Ответ
: 28,4%. - Некоторый спирт подвергли окислению, при этом образовалась одноосновная карбоновая кислота. При сжигании 13,2 г этой кислоты получили углекислый газ, для полной нейтрализации которого потребовалось 192 мл раствора КОН с массовой долей 28%. Плотность раствора КОН равна 1,25 г/мл. Определите формулу спирта. Ответ
: бутанол. - Газ, полученный при взаимодействии 9,52 г меди с 50 мл 81 % раствора азотной кислоты, плотностью 1,45 г/мл, пропустили через 150 мл 20 % раствора NaOH плотностью 1,22 г/мл. Определите массовые доли растворенных веществ. Ответ
: 12,5% NaOH; 6,48% NaNO 3 ; 5,26% NaNO 2 . - Определите объем выделившихся газов при взрыве 10 г нитроглицерина. Ответ
: 7,15 л. - Образец органического вещества массой 4,3 г сожгли в кислороде. Продуктами реакции являются оксид углерода (IV) объемом 6,72 л (нормальные условия) и вода массой 6,3 г. Плотность паров исходного вещества по водороду равна 43. Определите формулу вещества. Ответ
: С 6 Н 14 .
Окружающее нас пространство наполнено разными физическими телами, которые состоят из разных веществ с различной массой. Школьные курсы химии и физики, ознакомляющие с понятием и методом нахождения массы вещества, прослушали и благополучно забыли все, кто учился в школе. Но между тем теоретические знания, приобретенные когда-то, могут понадобиться в самый неожиданный момент.
Вычисление массы вещества с помощью удельной плотности вещества. Пример – имеется бочка на 200 литров. Нужно заполнить бочку любой жидкостью, скажем, светлым пивом. Как найти массу наполненной бочки? Используя формулу плотности вещества p=m/V, где p – удельная плотность вещества, m – масса, V – занимаемый объем, найти массу полной бочки очень просто:
- Меры объемов – кубические сантиметры, метры. То есть бочка на 200 литров имеет объем 2 м³.
- Мера удельной плотности находится с помощью таблиц и является постоянной величиной для каждого вещества. Измеряется плотность в кг/м³, г/см³, т/м³. Плотность пива светлого и других алкогольных напитков можно посмотреть на сайте . Она составляет 1025,0 кг/м³.
- Из формулы плотности p=m/V => m=p*V: m = 1025,0 кг/м³* 2 м³=2050 кг.
Бочка объемом 200 литров, полностью наполненная светлым пивом, будет иметь массу 2050 кг.
Нахождение массы вещества с помощью молярной массы. M (x)=m (x)/v (x) – это отношение массы вещества к его количеству, где M (x) – это молярная масса X, m (x) – масса X, v (x) – количество вещества X. Если в условии задачи прописывается только 1 известный параметр – молярная масса заданного вещества, то нахождение массы этого вещества не составит труда. Например, необходимо найти массу йодида натрия NaI количеством вещества 0,6 моль.
- Молярная масса исчисляется в единой системе измерений СИ и измеряется в кг/моль, г/моль. Молярная масса йодида натрия – это сумма молярных масс каждого элемента: M (NaI)=M (Na)+M (I). Значение молярной массы каждого элемента можно вычислить по таблице, а можно с помощью онлайн-калькулятора на сайте : M (NaI)=M (Na)+M (I)=23+127=150 (г/моль).
- Из общей формулы M (NaI)=m (NaI)/v (NaI) => m (NaI)=v (NaI)*M (NaI)= 0,6 моль*150 г/моль=90 грамм.
Масса йодида натрия (NaI) с массовой долей вещества 0,6 моль составляет 90 грамм.
Нахождение массы вещества по его массовой доле в растворе. Формула массовой доли вещества ω=*100%, где ω – массовая доля вещества, а m (вещества) и m (раствора) – массы, измеряемые в граммах, килограммах. Общая доля раствора всегда принимается за 100%, иначе будут погрешности в вычислении. Несложно из формулы массовой доли вещества вывести формулу массы вещества: m (вещества)=[ω*m (раствора)] /100%. Однако есть некоторые особенности изменения состава раствора, которые нужно учитывать при решении задач на эту тему:
- Разбавление раствора водой. Масса вещества растворенного X не изменяется m (X)=m’(X). Масса раствора увеличивается на массу добавленной воды m’ (р)=m (р)+m (H 2 O).
- Выпаривание воды из раствора. Масса растворенного вещества X не изменяется m (X)=m’ (X). Масса раствора уменьшается на массу выпаренной воды m’ (р)=m (р)-m (H 2 O).
- Сливание двух растворов. Массы растворов, а также массы растворенного вещества X при смешивании складываются: m’’ (X)=m (X)+m’ (X). m’’ (р)=m (р)+m’ (р).
- Выпадение кристаллов. Массы растворенного вещества X и раствора уменьшаются на массу выпавших кристаллов: m’ (X)=m (X)-m (осадка), m’ (р)=m (р)-m (осадка).
Алгоритм нахождения массы продукта реакции (вещества), если известен выход продукта реакции. Выход продукта находится по формуле η=*100%, где m (x практическая) – масса продукта х, которая получена в результате практического процесса реакции, m (x теоретическая) – рассчитанная масса вещества х. Отсюда m (x практическая)=[η*m (x теоретическая)]/100% и m (x теоретическая)=/η. Теоретическая масса получаемого продукта всегда больше практической, в связи с погрешностью реакции, и составляет 100%. Если в задаче не дается масса продукта, полученного в практической реакции, значит, она принимается за абсолютную и равна 100%.
Варианты нахождение массы вещества – небесполезный курс школьного обучения, а вполне применяемые на практике способы. Каждый сможет без труда найти массу необходимого вещества, применяя вышеперечисленные формулы и пользуясь предлагаемыми таблицами. Для облегчения задания прописывайте все реакции, их коэффициенты.
Концентрации растворов
Великий Новгород
Пример 1.
Решение
:
ω(NaCl) = = 0,125 или 12,5%
Ответ
: ω(NaCl) = 0,125 или 12,5%.
Пример 2.
Решение
:
= ·m(FeSO 4) = = 22,8 г,
ω(FeSO 4) = = 0,076 или 7,6%
Ответ
: ω(FeSO 4) = 0,076 или 7,6%.
Пример 3.
Определить массовую долю хлороводородной кислоты, если в 1 л воды растворили 350 л HCl (н.у.).
Решение
:
Массу HCl определяем по формуле:
m(HCl) = n(HCl)·m(HCl) = ·m(HCl) = ·36,5 = 570,3 г.
Масса раствора m(р-ра) = m(HCl) + m(H 2 O) = m(HCl) + V(H 2 O)·ρ(H 2 O)
ω(HCl) = = 0,363 или 36,3%
Ответ
: ω(HCl) = 0,363 или 36,3%.
Пример 4.
Определите объем хлороводорода, измеренного при н.у., и объем воды, необходимые для приготовления 500 г раствора с массовой долей HCl 20%.
Решение
:
Находим массу HCl:
Рассчитываем объем HCl:
Вычисляем m(H 2 O):
V(H 2 O) = = = 400 мл
Ответ
Или растворителя по массе раствора
Пример 5.
Определите массу нитрата натрия и воды, необходимые для приготовления 800 г раствора с ω(NaNO 3) = 12%.
Решение
:
Масса растворенной соли:
m(NaNO 3) = ω(NaNO 3)·m(р-ра) = 0,12·800 = 96 г.
m(р-ра) = m(NaNO 3) + m(H 2 O)
m(H 2 O) = m(р-ра) – m(NaNO 3) = 800 – 96 = 704 г.
Ответ
: m(NaNO 3) = 96 г, m(H 2 O) = 704 г.
Пример 6.
Определите массу кристаллогидрата CuSO 4 ·5H 2 O и воды, необходимые для приготовления 0,4 кг раствора с ω(CuSO 4) = 8%.
Решение
(см. пример 2):
ω(CuSO 4) = =
m(H 2 O) = m(р-ра) – m(CuSO 4 ·5H 2 O)
m(CuSO 4 ·5H 2 O) = n(CuSO 4 ·5H 2 O)·M(CuSO 4 ·5H 2 O)
n(CuSO 4 ·5H 2 O)·= n(CuSO 4) =
m(CuSO 4) = ω(CuSO 4)·m(р-ра) = 0,08·400 = 32 г.
n(CuSO 4) = = 0,2 моль.
Отсюда m(CuSO 4 ·5H 2 O) = 0,2·250 = 50 г
Масса воды m(H 2 O) = 400 – 50 = 350 г
Ответ
: m(CuSO 4 ·5H 2 O) = 50 г, m(H 2 O) = 350 г.
Вычисление массы раствора определенной концентрации
Молярная концентрация
Молярная концентрация (молярность)
– это количество моль вещества, содержащееся в 1 литре раствора.
С(Х) = , моль/л
где Х – количество вещества, моль;
V – объем раствора, л.
Объем раствора связан с массой раствора следующим образом:
где ρ – плотность раствора, г/мл.
Молярная концентрация эквивалента
– это количество моль вещества эквивалента, содержащееся в 1 литре раствора.
С( Х) = , моль/л
где n( Х) – количество вещества эквивалента, моль;
V – объем раствора, л.
где m(X) – молярная масса растворенного вещества;
m(X) – масса растворенного вещества;
m – масса раствора;
ω(Х) – массовая доля раствора.
Молярная концентрация эквивалента всегда больше или равна молярной концентрации. Это положение используется при проверке полученных данных.
Молярную концентрацию эквивалента часто называют нормальной и обозначают
1,0 н.; 0,5 н. и т.д.
Приведенные выше расчетные формулы позволяют определять объем раствора, количество вещества и количество вещества эквивалента:
V = или V =
n(X) = C(X)·V или n( X) = C( X)·V
Литература
1. Коровин Н. В.
Общая химия. – М.: Высшая школа, 2002. – 558 с.
2. Никольский А. Б.
, Суворов А. В.
Химия: Учебное пособие для вузов. – СПб.: Химиздат, 2001. – 512 с.
3. Глинка Н. Л.
Задачи и упражнения по общей химии. – М.: Интеграл-Пресс, 2004. – 240 с.
4. Задачи и упражнения по общей химии: Учебное пособие / Б. И. Адамсон, О. Н. Гончарук, В. Н. Камышова и др.
/ Под ред. Н. В. Коровина. – М.: Высшая школа, 2003. – 255 с.
5. Суворов А. В., Никольский А. Б.
Вопросы и задачи по общей химии. – СПб.: Химиздат, 2002. – 304 с.
Концентрации растворов
Методические указания к самостоятельной работе студентов
Великий Новгород
Концентрации роастворов: Методические указания к самостоятельной работе студентов / Сост. В.П. Кузьмичева, Г.Н.Олисова, Н.И.Ульянова. – Великий Новгород: НовГУ, 2006.
1. Расчёт массовой доли растворённого вещества……………………………………………….4
1. 1. Вычисление массы растворённого вещества или растворителя по массе раствора……5
1. 2. Вычисление массы раствора определённой концентрации по заданной массе растворённого вещества или растворителя……………………………………………………6
1. 3. Разбавление и концентрирование растворов…………………………………………….7
1. 4. Расчёты, связанные со смешиванием растворов…………………………………………9
1. 5. Задания для самостоятельной работы……………………………………………………11
2. Молярная концентрация………………………………………………………………………..14
2. 1. Определение молярной концентрации вещества С(Х) по массе вещества и массы вещества по заданной молярной концентрации………………………………………………15
2. 2. Расчёты, связанные с разбавлением и концентрированием растворов………………..17
2. 3. Расчёты, связанные со смешиванием растворов различной концентрации……………17
2. 4. Расчёты материального баланса химических процессов: избыток (недостаток)
реагентов…………………………………………………………………………………………19
2. 5. Задания для самостоятельной работы……………………………………………………21
Литература…………………………………………………………………………………………25
1. Расчет массовой доли растворенного вещества
Пример 1.
Вычислить массовую долю хлорида натрия в растворе, если 40 г его растворено в 280 мл воды.
Решение
:
Масса раствора m(р-ра) = m(NaCl) + m(H 2 O)
m(H 2 O) = V(H 2 O)·ρ(H 2 O) = 280 мл ·1 г/мл = 280 г,
ω(NaCl) = = 0,125 или 12,5%
Ответ
: ω(NaCl) = 0,125 или 12,5%.
Пример 2.
В 258,3 г воды растворили 41,7 г кристаллогидрата FeSO 4 ·7H 2 O. Определить массовую долю FeSO 4 в полученном растворе.
Решение
:
Сначала рассчитываем массу раствора:
m(р-ра) = m(FeSO 4 ·7H 2 O) + m(H 2 O) = 41,7 + 258,3 = 300 г
m(FeSO 4) = n(FeSO 4)·m(FeSO 4) = n(FeSO 4 ·7H 2 O)·m(FeSO 4) =
m(HCl) = ω(HCl)·m(р-ра) = 0,2·500 = 100 г.
Рассчитываем объем HCl:
V(HCl) = n(HCl)·V M = ·22,4 л/моль = 61,37 л.
Вычисляем m(H 2 O):
m(H 2 O) = m(р-ра) – m(HCl) = 500 – 100 = 400 г.
V(H 2 O) = = = 400 мл
Ответ
: V(HCl) = 61,37 л, V(H 2 O) = 400 мл.
Вычисление массы растворенного вещества