Попробуйте провести следующий опыт. Приготовление раствора
сахара и расчёт его массовой доли в растворе.
Отмерьте мерным цилиндром 50 мл дистиллированной воды и влейте её в коническую колбочку ёмкостью 100 мл.
Чайную ложку сахарного песка (или два кусочка) взвесьте на лабораторных весах, затем поместите его в колбочку с водой и перемешивайте стеклянной палочкой до полного растворения.
Теперь приступайте к расчётной части. Вначале рассчитайте массовую долю сахара в растворе. Необходимые данные у вас есть: масса сахара, объём воды, плотность воды примите равной 1 г/мл.
![]()
m(p-p) = m(cax.) + m(вода),
m(вода) = V(вода) • р(вода).
Вы также сможете рассчитать, сколько молекул сахара содержится в полученном растворе, используя известные вам соотношения:
N(мол. сах.) = NA ∙ n(сах.),
![]()
Поскольку сахар состоит на 99,9% из сахарозы, имеющей формулу С12Н22О11, вы легко рассчитаете молярную массу сахара и затем найдёте число молекул сахара в полученном вами растворе.
Приготовление раствора сахара и расчёт его массовой доли в растворе.
Отмерьте мерным цилиндром 50 мл дистиллированной воды и влейте её в коническую колбочку ёмкостью 100 мл. Чайную ложку сахарного песка (или два кусочка) взвесьте на лабораторных весах, затем поместите его в колбочку с водой и перемешивайте стеклянной палочкой до полного растворения. Теперь приступайте к расчётной части. Вначале рассчитайте массовую долю сахара в растворе. Необходимые данные у вас есть: масса сахара, объём воды, плотность воды примите равной 1 г/мл.
ω
(
с
а
х
.
)
=
m
(
с
а
х
.
)
m
(
р
−
р
)
,
m (р−р) = m (сах.) + m (вода),
m (вода) = V (вода) * ρ (вода),
Вы также сможете рассчитать, сколько молекул сахара содержится в полученном растворе, используя известные вам соотношения:
N
(
м
о
л
.
с
а
х
.
)
=
N
А
∗
n
(
с
а
х
.
)
,
n
(
с
а
х
.
)
=
m
(
с
а
х
.
)
M
(
с
а
х
.
)
.
Поскольку сахар состоит на 99,9% из сахарозы, имеющей формулу
C
12
H
22
O
11
, вы легко рассчитаете молярную массу сахара и затем найдёте число молекул сахара в полученном вами растворе.

reshalka.com
ГДЗ учебник по химии 8 класс Габриелян. Практическая работа №5. Номер №1
Решение
В коническую колбочку ёмкостью 100 мл нальём 50 мл дистиллированной воды и поместим в колбочку чайную ложку сахарного песка, предварительно взвешенного. Раствор перемешаем стеклянной палочкой.
Рассчитаем массовую долю сахара в растворе. Пусть масса сахарного песка, взвешенного на весах, равна х, тогда:
ω
(
с
а
х
.
)
=
m
(
с
а
х
.
)
m
(
р
−
р
)
,
ω
(
с
а
х
.
)
=
х
m
(
р
−
р
)
.
Так как ρ воды = 1 г/мл, то
m (вода) = V (вода) * ρ (вода) = 1 * 50 = 50 г.
m (р−р) = m (сах.) + m (вода) = 50 + x
ω
(
с
а
х
.
)
=
х
50
+
x
.
n
(
с
а
х
.
)
=
m
(
с
а
х
.
)
M
(
с
а
х
.
)
;
M (
C
12
H
22
O
11
) = 12 *Ar (C) + 22 * Ar (H) + 11 * Ar (O) = 12 * 12 + 22 * 1 + 11 * 16 = 342 г/моль;
n
(
с
а
х
.
)
=
x
342
;
N
(
м
о
л
.
с
а
х
.
)
=
N
А
∗
n
(
с
а
х
.
)
,
N
A
=
6
,
02
∗
10
23
;
N
(
м
о
л
.
с
а
х
.
)
=
6
,
02
x
∗
10
23
342
=
1
,
76
x
∗
10
21
.
Методы правильного расчета массы вещества в его растворе
Задача 3.
5 г поваренной соли (NаС1) растворили в некотором количестве воды. В результате получили 4%-ный раствор NаС1 в воде. Определить массу использованной воды.
Дано:
масса поваренной соли: mNaСl) = 5 г;
массовая доля NаС1 в полученном растворе:  NаС1) = 4%.
NаС1) = 4%.
Найти:
массу использованной воды.
Решение:
Эту задачу можно решить двумя способами: с использованием формулы и пропорции.
I способ:
Схематично алгоритм решения можно представить следующим образом:
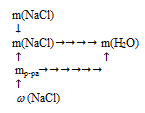
Применим предложенный алгоритм.
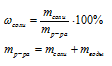
Подставляем данные из условия в первую формулу и находим массу раствора.
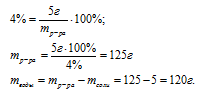
II способ:
Схематично алгоритм решения можно представить следующим образом:
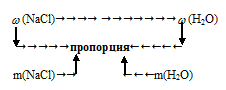
Массовая доля воды в растворе равна: 100% – 4% = 96%.
Так как в растворе содержится 5 г соли, которые составляют 4%, можно составить пропорцию:
5 г составляют 4%
х г составляют 96%
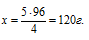
Ответ: mводы = 120 г.
Задача 4.
Некоторое количество чистой серной кислоты растворили в 70 г воды. В результате получили 10%-ный раствор Н2SO4. Определить массу использованной серной кислоты.
Дано:
масса воды: m(Н2О) = 70 г;
массовая доля Н2SО4 в полученном растворе:  Н2SО4) = 10%.
Н2SО4) = 10%.
Найти:
массу использованной серной кислоты.
Решение:
Здесь также возможно использование и соотношения, и пропорции.
I способ:

Подставим последнее выражение в соотношение для массовой доли:
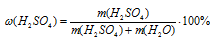
Подставляем данные из условия в полученную формулу:

Получили одно уравнение с одним неизвестным [x = m(Н2SО4) ] Решая его, находим массу использованной серной кислоты:
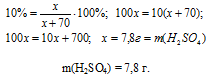
II способ:
Схематично алгоритм решения можно представить следующим образом:
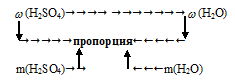
Применим предложенный алгоритм.
m(Н2О) = 100% – (Н2SО4) = 100% – 10% = 90%
Составляем пропорцию:
70 г составляют 90%
х г составляют 10%
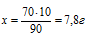
Ответ: m(H2SO4) = 7,8 г.
Задача 5.
Некоторое количество сахара растворили в воде. В результате получили 2 л 30%-ного раствора (р = 1,127 г/мл). Определить массу растворенного сахара и объем использованной воды.
Дано:
объем раствора: Vр-ра = 2 л ;
массовая доля сахара в растворе:  (сахара) = 30%;
(сахара) = 30%;
плотность раствора: рр-ра =1,127 г/мл
Найти:
массу растворенного сахара; объем использованной воды.
Решение:
Схематично алгоритм решения можно представить следующим образом:
Применим предложенный алгоритм.
В первую очередь, переходим от объема раствора к его массе, используя соотношение:
m = V . р.
Объем раствора в условии выражен в литрах, а в единицах плотности использованы мл, поэтому переведем объем раствора в мл и только потом подставим данные в формулу.
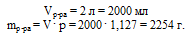
Находим массу сахара в растворе:
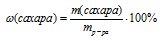
Подставляем все известные данные:
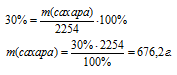
Теперь вспомним, что плотность воды1 равна 1 г/мл.
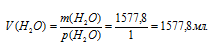
Ответ: mcахара = 676,2 г; Vводы = 1577,8 мл.
Комментарии:
1р(Н2О) = 1 г/мл при температуре О °С. С повышением температуры плотность воды уменьшается (поэтому более теплая вода находится на поверхности водоемов и не опускается на дно). Но при решении задач этой погрешностью можно пренебречь и принимать плотность чистой воды за 1 г/мл (если в условии специально не оговорены дополнительные требования и не указана плотность воды).
Приготовление раствора сахара и расчет его массовой доли в растворе
Оборудование и реактивы. Цилиндр мерный на 100 мл, колба коническая, весы с разновесами, палочка стеклянная с резиновым наконечником, калькулятор; сахар (кусочки) , вода дистиллированная.
Порядок работы Задания Наблюдения. Выводы
Отмерьте мерным цилиндром 50 мл дистиллированной воды и влейте ее в коническую колбу емкостью 100 мл. Два кусочка сахара взвесьте на лабораторных весах, затем поместите их в колбу с водой и перемешивайте стеклянной палочкой до полного растворения
Рассчитайте массовую долю сахара в растворе. Необходимые данные у вас есть: масса сахара, объем воды. Плотность воды примите равной 1 г/мл. Формулы для расчета:
(сах. ) = m(сах.) /m(р-ра) ,
m(р-ра) = m(сах. ) + m(H2O),
m(H2O) = V(H2O)•(H2O)
Молярная масса М вещества равна сумме атомных масс элементов в формуле, а размерность [М] – г/моль Рассчитайте молярную массу сахара, если известно, что сахароза имеет формулу С12Н22О11
Число Авогадро
NA = 6,02•1023 молекул/моль Рассчитайте, сколько молекул сахара содержится в полученном растворе.
(сах. ) = m(сах.) /M(сах.) ,
N(мол. сах. ) = NA•(сах. )
Светило науки – 1259 ответов – 0 раз оказано помощи
Ответ:25г, 475г.
Объяснение:
Дано:
m(р-ра сахара)=500г
ω(сахара )=5%=0,05
Найти:
m(р.в. сахара) -?
m (H2O)-?
Решение:
Есть формула по которой мы рассчитываем массовую долю растворенного вещества- ω
Mассовая доля растворенного вещества = Mассе растворенного вещества / Масса раствора *100%
ω = m р.в-ва/ m р-ра*100% (1)
У нас в задаче известна масса раствора сахара и его дано 500г. и его массовая доля =5%
Поэтому мы можем найти массу растворимого вещества. Из формулы(1) находим массу растворимого вещества:
m р.в-ва=m р-ра*ω/100% (2)
m р.в-ва(сахара)= 500г*0,05=25г
Подставляем m р.в-ва(сахара)= 500г*5%/100% =25г или можно сразу 500г*0,05=25г ( это как тебе удобно)
Теперь находим массу воды.
m р-ра= m р.в-ва+ m (H2O) (3)
m (H2O)= m р-ра-m р.в-ва=500г-25г=475г
Ответ: 25г, 475г.
