поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,658 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,962 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
- Формула: H2O4S или H2SO4
- Относительная молекулярная масса H2O4S: 98.07848
- Молярная масса H2O4S: 98.07848 г/моль (0.09808 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| H (водород) | 2 | 1.00794 | 2.01588 |
| O (кислород) | 4 | 15.9994 | 63.9976 |
| S (сера) | 1 | 32.065 | 32.065 |
| 98.07848 |
Расчёт молярной и относительной молекулярной массы H2O4S
- Mr[H2O4S] = Ar[H] * 2 + Ar[O] * 4 + Ar[S] = 1.00794 * 2 + 15.9994 * 4 + 32.065 = 98.07848
- Молярная масса (в кг/моль) = Mr[H2O4S] : 1000 = 98.07848 : 1000 = 0.09808 кг/моль
Расчёт массовых долей элементов в H2O4S
- Массовая доля водорода (H) = 2.01588 : 98.07848 * 100 = 2.055 %
- Массовая доля кислорода (O) = 63.9976 : 98.07848 * 100 = 65.251 %
- Массовая доля серы (S) = 32.065 : 98.07848 * 100 = 32.693 %
Калькулятор массы
Масса серной кислоты: понимание и расчет
Серная кислота (H2SO4) является одним из основных и наиболее часто используемых реагентов в химической промышленности. Она используется в производстве удобрений, кислот, солей, водорода и многих других химических веществ. Важным аспектом работы с серной кислотой является знание ее массы, молярной массы и способов расчета массы растворов.
Молярная масса серной кислоты
Молярная масса – это масса одного моля вещества, выраженная в граммах. Для серной кислоты молярная масса рассчитывается следующим образом:
M(H2SO4) = 2 * M(H) + M(S) + 4 * M(O)
где M(H) – масса водорода, M(S) – масса серы и M(O) – масса кислорода.
С учетом атомных масс водорода (1 г/моль), серы (32 г/моль) и кислорода (16 г/моль), молярная масса серной кислоты составляет:
M(H2SO4) = 2 * 1 + 32 + 4 * 16 = 2 + 32 + 64 = 98 г/моль
Расчет массы раствора серной кислоты
Часто при работе с серной кислотой используются растворы разной концентрации. Для определения массы серной кислоты в растворе необходимо учесть массовую долю серной кислоты (w) и массу раствора (mр).
Масса серной кислоты (mк) в растворе определяется следующим образом:
mк = w * mр
где mк – масса серной кислоты в растворе, w – массовая доля серной кислоты, выраженная в десятичной дроби (например, 0,5 для 50% раствора), и mр – масса раствора.
Пример расчета массы серной кислоты в растворе
Предположим, что у нас есть 200 г 40%-ного раствора серной кислоты. Найдем массу серной кислоты в этом растворе:
1. Определяем массовую долю: w = 0,4 (40% = 0,4)
2. Используем формулу: mк = w * mр
3. Подставляем значения: mк = 0,4 * 200 г = 80 г
Таким образом, в 200 г 40%-ного раствора серной кислоты содержится 80 г серной кислоты.
Заключение
Знание массы и молярной массы серной кислоты, а также умение проводить расчеты для определения массы серной кислоты в растворах, является важным навыком для химиков, работающих с этим веществом. Соблюдение правил безопасности при работе с серной кислотой также крайне важно, так как она является сильно коррозирующей и опасной для здоровья химической веществом.
| Серная кислота | ||
|---|---|---|
|
||
 |
||
| Общие | ||
| Систематическое наименование |
Серная кислота | |
| Традиционные названия | Серная кислота | |
| Хим. формула | H2SO4 | |
| Рац. формула | H2SO4 | |
| Физические свойства | ||
| Состояние | Жидкость | |
| Молярная масса | 98,078 ± 0,006 г/моль | |
| Плотность | 1,8356 г/см³ | |
| Динамическая вязкость | 21 мПа·с[2] | |
| Термические свойства | ||
| Температура | ||
| • плавления | +10,38 °C | |
| • кипения | +337 °C | |
| • разложения | +450 °C | |
| Удельная теплота плавления | 10,73 Дж/кг | |
| Давление пара | 0,001 ± 0,001 мм рт.ст.[3] | |
| Химические свойства | ||
Константа диссоциации кислоты  |
-3 | |
| Растворимость | ||
| • в воде | Растворима | |
| Оптические свойства | ||
| Показатель преломления | 1.397 | |
| Структура | ||
| Дипольный момент | 2.72 Д | |
| Классификация | ||
| Рег. номер CAS | 7664-93-9 | |
| PubChem | 1118 | |
| Рег. номер EINECS | 231-639-5 | |
| SMILES |
OS(O)(=O)=O |
|
| InChI |
InChI=1S/H2O4S/c1-5(2,3)4/h(H2,1,2,3,4) QAOWNCQODCNURD-UHFFFAOYSA-N |
|
| Кодекс Алиментариус | E513 | |
| RTECS | WS5600000 | |
| ChEBI | 26836 | |
| Номер ООН | 1830 | |
| ChemSpider | 1086 | |
| Безопасность | ||
| Предельная концентрация | 1 мг/м3 | |
| ЛД50 | 100 мг/кг | |
| Токсичность | 2-й класс опасности[1], общетоксическое действие. | |
| Краткие характер. опасности (H) |
H290, H314 |
|
| Меры предостор. (P) |
P280, P301+P330+P331, P303+P361+P353, P305+P351+P338, P308+P311 |
|
| Сигнальное слово | опасно | |
| Пиктограммы СГС |
|
|
| NFPA 704 |
0 3 2
|
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
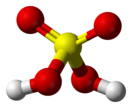
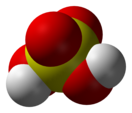
Се́рная кислота́ (химическая формула — H2SO4) — сильная неорганическая кислота, отвечающая высшей степени окисления серы (+6).
При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха, с сильнокислым «медным» вкусом. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3 : H2O < 1, то это водный раствор серной кислоты, если > 1 — раствор SO3 в серной кислоте (олеум). Токсична в больших дозах[4], обладает исключительно сильной коррозионной активностью.
Название[править | править код]
В XVIII—XIX веках серу для пороха производили из серного колчедана (пирит) на купоросных заводах. Серную кислоту в то время называли «купоросным маслом»[5][6], очевидно отсюда происхождение названия её солей (а точнее именно кристаллогидратов) — купоросы.
Исторические сведения[править | править код]
Серная кислота известна с древности, она встречается в природе в свободном виде, например, в виде озёр вблизи вулканов. Возможно, первое упоминание о кислых газах, получаемых при прокаливании квасцов или железного купороса «зеленого камня», встречается в сочинениях, приписываемых арабскому алхимику Джабир ибн Хайяну.
В IX веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (FeSO4•7H2O и CuSO4•5H2O), также получил раствор серной кислоты. Этот способ усовершенствовал европейский алхимик Альберт Магнус, живший в XIII веке.
Схема получения серной кислоты из железного купороса — термическое разложение сульфата железа (II) с последующим охлаждением смеси[7]

В трудах алхимика Василия Валентина (XVI век) описывается способ получения серной кислоты путём поглощения водой газа (серный ангидрид), выделяющегося при сжигании смеси порошков серы и селитры. Впоследствии этот способ лег в основу т. н. «камерного» способа, осуществляемого в небольших камерах, облицованных свинцом, который не растворяется в серной кислоте. В СССР такой способ просуществовал вплоть до 1955 г.
Алхимикам XV века в известен был также способ получения серной кислоты из пирита — серного колчедана, более дешёвого и распространенного сырья, чем сера. Таким способом получали серную кислоту на протяжении 300 лет, небольшими количествами в стеклянных ретортах. Впоследствии, в связи с развитием катализа этот метод вытеснил камерный способ синтеза серной кислоты. В настоящее время серную кислоту получают каталитическим окислением (на V2O5) оксида серы (IV) в оксид серы (VI), и последующим растворением оксида серы (VI) в 70 % серной кислоте с образованием олеума.
В России производство серной кислоты впервые было организовано в 1805 году под Москвой в Звенигородском уезде. В 1913 году Россия по производству серной кислоты занимала 13 место в мире.[8]
Физические и физико-химические свойства[править | править код]
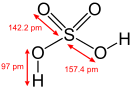
Серная кислота — это очень сильная двухосновная кислота, при 18оС pKa (1) = −2,8, pKa (2) = 1,92 (К₂ 1,2 10−2); длины связей в молекуле S=O 0,143 нм, S—OH 0,154 нм, угол HOSOH 104°, OSO 119°; кипит, образуя азеотропную смесь (98,3 % H2SO4 и 1,7 % H2О с температурой кипения 338,8оС). Смешивается с водой и SO3, во всех соотношениях. В водных растворах серная кислота практически полностью диссоциирует на H3О+, HSO3+, и 2НSO₄−. Образует гидраты H2SO4·nH2O, где n = 1, 2, 3, 4 и 6,5.
| H2SO4 | HSO4− | H3SO4+ | H3O+ | HS2O7⁻ | H2S2O7 | |
| состав, % | 99,5 | 0,18 | 0,14 | 0,09 | 0,05 | 0,04 |
Олеум[править | править код]
Основная статья: Олеум
Растворы серного ангидрида SO3 в серной кислоте называются олеумом, они образуют два соединения H2SO4·SO3 и H2SO4·2SO3.
Олеум содержит также пиросерные кислоты, образующиеся по реакциям:
-
Сульфит
Температура кипения водных растворов серной кислоты повышается с ростом её концентрации и достигает максимума при содержании 98,3 % H2SO4.
| Содержание % по массе | Плотность при 20 °C, г/см3 | Температура плавления, °C | Температура кипения, °C | |
|---|---|---|---|---|
| H2SO4 | SO3 (свободный) | |||
| 10 | – | 1,0661 | −5,5 | 102,0 |
| 20 | – | 1,1394 | −19,0 | 104,4 |
| 40 | – | 1,3028 | −65,2 | 113,9 |
| 60 | – | 1,4983 | −25,8 | 141,8 |
| 80 | – | 1,7272 | −3,0 | 210,2 |
| 98 | – | 1,8365 | 0,1 | 332,4 |
| 100 | – | 1,8305 | 10,4 | 296,2 |
| 104,5 | 20 | 1,8968 | −11,0 | 166,6 |
| 109 | 40 | 1,9611 | 33,3 | 100,6 |
| 113,5 | 60 | 2,0012 | 7,1 | 69,8 |
| 118,0 | 80 | 1,9947 | 16,9 | 55,0 |
| 122,5 | 100 | 1,9203 | 16,8 | 44,7 |
Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов серной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H2SO4 достигает минимума. С увеличением концентрации SO3 в олеуме общее давление пара над ним повышается. Давление пара над водными растворами серной кислоты и олеума можно вычислить по уравнению:
величины коэффициентов А и В зависят от концентрации серной кислоты. Пар над водными растворами серной кислоты состоит из смеси паров воды, H2SO4 и SO3, при этом состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси.
С повышением температуры усиливается диссоциация:
Уравнение температурной зависимости константы равновесия:
При нормальном давлении степень диссоциации: 10−5 (373 К), 2,5 (473 К), 27,1 (573 К), 69,1 (673 К).
Плотность 100%-ной серной кислоты можно определить по уравнению:
С повышением концентрации растворов серной кислоты их теплоемкость уменьшается и достигает минимума для 100%-ной серной кислоты, теплоемкость олеума с повышением содержания SO3 увеличивается.
При повышении концентрации и понижении температуры теплопроводность λ уменьшается:
где С — концентрация серной кислоты, в %.
Максимальную вязкость имеет олеум H2SO4·SO3, с повышением температуры η снижается. Для олеума минимальное ρ при концентрации 10 % SO3. С повышением температуры ρ серной кислоты увеличивается. Диэлектрическая проницаемость 100%-ной серной кислоты 101 (298,15 К), 122 (281,15 К); криоскопическая постоянная 6,12, эбулиоскопическая постоянная 5,33; коэффициент диффузии пара серной кислоты в воздухе изменяется в зависимости от температуры; D = 1,67·10−5T3/2 см2/с.
| ω, % | 5 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 85 | 86 | 87 | 88 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ρ H2SO4, г/мл | 1,03 | 1,064 | 1,1365 | 1,215 | 1,2991 | 1,3911 | 1,494 | 1,6059 | 1,7221 | 1,7732 | 1,7818 | 1,7897 | 1,7968 | 1,8033 | 1,8091 | 1,8142 | 1,8188 | 1,8227 | 1,826 | 1,8286 | 1,8305 | 1,8314 | 1,831 | 1,8292 | 1,8255 |
Химические свойства[править | править код]
Серная кислота в концентрированном виде при нагревании — довольно сильный окислитель.
1. Окисляет HI и частично HBr до свободных галогенов:
-
ΔH° = −561.9 кДж/моль (экзотермическая)[10] ΔG° = −305.4 кДж/моль (экзэргоническая)[10]
-
ΔH° = 18.14 кДж/моль (эндотермическая)[11] ΔS° = −14.95 Дж/моль (экзоэнтропическая)[11] ΔG° = 22.5 кДж/моль (эндэргоническая)[11]
Углерод до CO2, серу — до SO2.
- Окисляет угарный газ до углекислого.

2. Окисляет многие металлы (исключения: Au, Pt, Ir, Rh, Ta). При этом концентрированная серная кислота восстанавливается до диоксида серы, например[12]:
3. На холоде в концентрированной серной кислоте Fe, Al, Cr, Co, Ni, Ba пассивируются, и реакции не протекают.
Наиболее сильными восстановителями концентрированная серная кислота восстанавливается до серы и сероводорода. Концентрированная серная кислота поглощает водяные пары, поэтому она применяется для сушки газов, жидкостей и твёрдых тел, например, в эксикаторах. Однако концентрированная H2SO4 частично восстанавливается водородом, из-за чего не может применяться для его сушки. Отщепляя воду от органических соединений и оставляя при этом чёрный углерод (уголь), концентрированная серная кислота приводит к обугливанию древесины, сахара и других веществ[12].
4. Разбавленная H2SO4 взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода с его выделением, например[12]:
5. Окислительные свойства для разбавленной H2SO4 нехарактерны. Серная кислота образует два ряда солей: средние — сульфаты и кислые — гидросульфаты, а также эфиры. Известны пероксомоносерная (или кислота Каро) H2SO5 и пероксодисерная H2S2O8 кислоты.
6. Серная кислота реагирует с основными оксидами, образуя сульфат металла и воду:
7. На металлообрабатывающих заводах раствор серной кислоты применяют для удаления слоя оксида металла с поверхности металлических изделий, подвергающихся в процессе изготовления сильному нагреванию. Так, оксид железа удаляется с поверхности листового железа действием нагретого раствора серной кислоты:
8. Концентрированная H2SO4 превращает некоторые органические вещества в другие соединения углерода:
9. Качественная реакция на серную кислоту и её растворимые соли — это их взаимодействие с растворимыми солями бария, при котором образуется белый осадок сульфата бария, нерастворимый в воде и кислотах, например[13]:
Получение серной кислоты[править | править код]
Промышленный (контактный) способ[править | править код]
В промышленности серную кислоту получают окислением диоксида серы (сернистый газ, образующийся в процессе сжигания элементарной серы, серного колчедана или сероводород-содержащих газов, поступающих с установок гидроочистки и систем отпарки кислых стоков) до триоксида (серного ангидрида) на твёрдом ванадиевом катализаторе в четыре ступени (данная реакция экзотермична, поэтому применяется промежуточное охлаждение после первого слоя с помощью трубных пучков, через которые подаётся воздух, и после следующих двух ступеней — с помощью кольцевой трубы, имеющей большой диаметр, через которую подаётся воздух, над которой расположен дефлектор. Воздух нагнетается воздуходувками, часть горячего воздуха подаётся на горелочные устройства котлов, в которых производится сжигание сероводородсодержащих газов) последующим охлаждением и взаимодействием SO3 с водой. Получаемую данным способом серную кислоту также называют «контактной» (концентрация 92-94 %).
Нитрозный (башенный) способ[править | править код]
Раньше серную кислоту получали исключительно нитрозным методом в специальных башнях, а кислоту называли «башенной» (концентрация 75 %). Сущность этого метода заключается в окислении диоксида серы диоксидом азота в присутствии воды. Именно таким способом произошла реакция в воздухе Лондона во время Великого смога.
Лабораторные методы[править | править код]
В лаборатории можно получить серную кислоту взаимодействием сероводорода, элементарной серы и диоксида серы с хлорной или бромной водой или пероксидом водорода:









Также её можно получить взаимодействием диоксида серы с кислородом и водой при +70 °C под давлением в присутствии сульфата меди (II):

Применение[править | править код]


Серную кислоту применяют:
- в обработке руд, особенно при добыче редких элементов, в том числе урана, иридия, циркония, осмия и т. п.;
- в производстве минеральных удобрений;
- в качестве электролита в свинцовых аккумуляторах;
- для получения различных минеральных кислот и солей;
- в производстве химических волокон, красителей, дымообразующих и взрывчатых веществ;
- в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
- в пищевой промышленности — зарегистрирована в качестве пищевой добавки E513 (эмульгатор);
- в промышленном органическом синтезе в реакциях:
- дегидратации (получение диэтилового эфира, сложных эфиров);
- гидратации (этанола из этилена);
- сульфирования (синтетические моющие средства и промежуточные продукты в производстве красителей);
- алкилирования (получение изооктана, полиэтиленгликоля, капролактама) и др.;
- восстановления смол в фильтрах на производстве дистиллированной воды.
Мировое производство серной кислоты около 200 млн тонн в год[14]. Самый крупный потребитель серной кислоты — производство минеральных удобрений. На P2O5 фосфорных удобрений расходуется в 2,2—3,4 раза больше по массе серной кислоты, а на (NH4)2SO4 серной кислоты 75 % от массы расходуемого (NH4)2SO4. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Токсическое действие[править | править код]





Серная кислота и олеум — очень едкие вещества, поражающие все ткани организма. При вдыхании паров этих веществ они вызывают затруднение дыхания, кашель, нередко — ларингит, трахеит, бронхит и т. д. Попадание кислоты на глаза в высокой концентрации может привести как к конъюнктивиту, так и к полной потере зрения[15].
Предельно допустимая концентрация (ПДК) паров серной кислоты в воздухе рабочей зоны 1 мг/м3, в атмосферном воздухе 0,3 мг/м3 (максимальная разовая) и 0,1 мг/м3 (среднесуточная). Поражающая концентрация паров серной кислоты 0,008 мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин).
Серная кислота — токсичное вещество. В соответствии с ГОСТ 12.1.007-76 серная кислота является токсичным высокоопасным веществом[16] по воздействию на организм, 2-го класса опасности.
Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов химических и металлургических производств, содержащих оксиды серы и выпадать в виде кислотных дождей.
В России оборот серной кислоты концентрации 45 % и более — законодательно ограничен[17].
Дополнительные сведения[править | править код]
Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (Полуостров Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже[18]. Взрыв вулкана Пинатубо в 1991 году, отправивший в атмосферу 3⋅107 тонн серы, привёл к тому, что 1992 и 1993 года были значительно холоднее, чем 1991 и 1994[19].
Стандарты[править | править код]
- Кислота серная техническая ГОСТ 2184—77
- Кислота серная аккумуляторная. Технические условия ГОСТ 667—73
- Кислота серная особой чистоты. Технические условия ГОСТ 14262—78
- Реактивы. Кислота серная. Технические условия ГОСТ 4204—77
Примечания[править | править код]
- ↑ Кислота серная техническая ГОСТ 2184—77
- ↑ Encyclopedia of chemical technology (англ.) / R. E. Kirk, D. Othmer
- ↑ http://www.cdc.gov/niosh/npg/npgd0577.html
- ↑ name=https://docs.cntd.ru_Серная кислота
- ↑ Ушакова Н. Н., Фигурновский Н. А. Василий Михайлович Севергин: (1765—1826) / Ред. И. И. Шафрановский. М.: Наука, 1981. C. 59.
- ↑ См. также Каменное масло
- ↑ Эпштейн, 1979, с. 40.
- ↑ Эпштейн, 1979, с. 41.
- ↑ Density-Concentration Calculator (англ.). Дата обращения: 21 декабря 2021. Архивировано 21 декабря 2021 года.
- ↑ 1 2 sulfuric acid hydrogen iodide -> iodine H2S water – Wolfram|Alpha (англ.). www.wolframalpha.com. Дата обращения: 19 мая 2022.
- ↑ 1 2 3 sulfuric acid hydrogen bromide -> bromine sulfur dioxide water – Wolfram|Alpha (англ.). www.wolframalpha.com. Дата обращения: 19 мая 2022.
- ↑ 1 2 3 Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 91. Химические свойства серной кислоты // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 209—211. — 240 с. — 1 630 000 экз.
- ↑ Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 92. Качественная реакция на серную кислоту и её соли // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 212. — 240 с. — 1 630 000 экз.
- ↑ Sulfuric acid (англ.) // «The Essential Chemical Industry — online»
- ↑ SULFURIC ACID | CAMEO Chemicals | NOAA. cameochemicals.noaa.gov. Дата обращения: 22 мая 2020.
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 12.1.007-76. ССБТ. Вредные вещества. Классификация и общие требования
- ↑ Постановление Правительства Российской Федерации от 3 июня 2010 года № 398. Дата обращения: 30 мая 2016. Архивировано из оригинала 30 июня 2016 года.
- ↑ см. статью «Вулканы и климат» Архивная копия от 28 сентября 2007 на Wayback Machine (рус.)
- ↑ Русский архипелаг — Виновато ли человечество в глобальном изменении климата? Архивная копия от 1 декабря 2007 на Wayback Machine (рус.)
Литература[править | править код]
- Справочник сернокислотчика [Текст] / А. С. Ленский, П. А. Семенов, Г. А. Максудов; ред. К. М. Малин. — 2 изд., перераб. и доп. — М.: Химия, 1971. — 744 с. — Библиогр. в конце разд.- Предм. указ.: с. 723—744.
- Эпштейн Д. А. Общая химическая технология. — М.: Химия, 1979. — 312 с.
Ссылки[править | править код]
- Статья «Серная кислота» (Химическая энциклопедия)
- Плотность и значение pH серной кислоты при t=20 °C

ЯМаНюНиК
+17
Решено
9 лет назад
Химия
5 – 9 классы
Рассчитайте молярную массу серной кислоты – H2 SO4
Смотреть ответ
2
Ответ проверен экспертом
4
(28 оценок)
39

borz26
9 лет назад
Светило науки – 2050 ответов – 42099 раз оказано помощи
М(Н2SO4)=2*1+32+4*16=98 г/моль
(28 оценок)
Ответ
3
(13 оценок)
35

balenova
9 лет назад
Светило науки – 140 ответов – 0 раз оказано помощи
M (H2SO4) = 2*M(H)+M(S)+4*M(O)=2+32+4*16=98 г/моль
молярная масса серной кислоты равна 98 г/моль…=)
(13 оценок)
https://vashotvet.com/task/10394773