← Молярная и молекулярная масса
- Относительная молекулярная масса S: 32.065
- Молярная масса S: 32.065 г/моль (0.03207 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| S (сера) | 1 | 32.065 | 32.065 |
| 32.065 |
Расчёт молярной и относительной молекулярной массы S
- Mr[S] = Ar[S] = 32.065 = 32.065
- Молярная масса (в кг/моль) = Mr[S] : 1000 = 32.065 : 1000 = 0.03207 кг/моль
Электронная конфигурация атома серы
Калькулятор массы
Химическая формула соединения
Рассчитать
Поделитесь информацией с друзьями
Скачать перечень калькуляторов
Относительные молекулярные массы других соединений
CH2ClF [68.4779832]
AgCl [143.3212]
Калькулятор молекулярной массы

У этого термина существуют и другие значения, см. Сера (значения).
| Сера | |||
|---|---|---|---|
| ← Фосфор | Хлор → | |||
|
|||
| Внешний вид простого вещества | |||

Образец серы |
|||
| Свойства атома | |||
| Название, символ, номер | Сера / Sulfur (S), 16 | ||
| Группа, период, блок |
16 (устар. 6), 3, p-элемент |
||
| Атомная масса (молярная масса) |
[32,059; 32,076][комм. 1][1] а. е. м. (г/моль) | ||
| Электронная конфигурация |
[Ne] 3s23p4 1s22s22p63s23p4 |
||
| Радиус атома | 127 пм | ||
| Химические свойства | |||
| Ковалентный радиус | 102 пм | ||
| Радиус иона | 30 (+6e) 184 (−2e) пм | ||
| Электроотрицательность | 2,58 (шкала Полинга) | ||
| Электродный потенциал | 0 | ||
| Степени окисления | -2, -1, 0, +1, +2, +4, +6 | ||
| Энергия ионизации (первый электрон) |
999,0 (10,35) кДж/моль (эВ) | ||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) | 2,070 г/см³ | ||
| Температура плавления | 386 К (112,85 °С) | ||
| Температура кипения | 717,824 К (444,67 °С) | ||
| Уд. теплота плавления | 1,23 кДж/моль | ||
| Уд. теплота испарения | 10,5 кДж/моль | ||
| Молярная теплоёмкость | 22,61[2] Дж/(K·моль) | ||
| Молярный объём | 15,5 см³/моль | ||
| Кристаллическая решётка простого вещества | |||
| Структура решётки | Орторомбическая | ||
| Параметры решётки | a = 10,437, b = 12,845, c = 24,369 Å | ||
| Прочие характеристики | |||
| Теплопроводность | (300 K) 0,27 Вт/(м·К) | ||
| Номер CAS | 7704-34-9 | ||
| Эмиссионный спектр | |||
|
|
Се́ра (химический символ — S, от лат. sulpur, sulphur, sulfur[3]) — химический элемент 16-й группы (по устаревшей классификации — главной подгруппы шестой группы, VIA), третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 16.
Простое вещество сера — это светло-жёлтый порошкообразный неметалл. В водородных и кислородных соединениях находится в составе различных ионов, образуя многие кислоты и соли. Практически нерастворима в воде. Многие серосодержащие соли малорастворимы в воде.
Изотопы[править | править код]
Природная сера состоит из четырёх стабильных изотопов:
32S (95,02 %), 33S (0,75 %), 34S (4,21 %), 36S (0,02 %).
Получены также искусственные радиоактивные изотопы
31S (T½ = 2,4 с), 35S (T½ = 87,1 сут), 37S (Т½= 5,04 мин) и другие.
История и этимология[править | править код]
Происхождение названия[править | править код]
Слово «сера», известное в древнерусском языке с XV века, заимствовано из старославянского «сѣра» — «сера, смола», вообще «горючее вещество, жир». Этимология слова не выяснена до настоящих времён, поскольку первоначальное общеславянское название вещества утрачено и слово дошло до современного русского языка в искажённом виде[4].
По предположению Фасмера[5], «сера» восходит к лат. сera — «воск» или лат. serum — «сыворотка».
Латинское sulpureus, sulphurous впервые использовал древнеримский поэт Квинт Энний[6]. Возможно происходит из эллинизированного написания этимологического sulpur (Серу греки называли «Theion»), предположительно, восходит к индоевропейскому корню *swelp — «гореть»[7].
История открытия[править | править код]
Точное время открытия серы не установлено, но этот элемент использовался до нашей эры.
Сера использовалась жрецами в составе священных курений при религиозных обрядах. Она считалась произведением сверхчеловеческих существ из мира духов или подземных богов.
Очень давно сера стала применяться в составе различных горючих смесей для военных целей. Уже у Гомера описаны «сернистые испарения», смертельное действие выделений горящей серы. Сера, вероятно, входила в состав «греческого огня», наводившего ужас на противников.
Около VIII века китайцы стали использовать её в пиротехнических смесях, в частности, в смеси типа пороха. Горючесть серы, лёгкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что её считали «принципом горючести» и обязательной составной частью металлических руд.
Пресвитер Теофил (XII век) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, ещё в древнем Египте.
В период арабской алхимии возникла ртутно-серная теория состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов.
В дальнейшем она стала одним из трёх принципов алхимиков, а позднее «принцип горючести» явился основой теории флогистона. Элементарную природу серы установил Лавуазье в своих опытах по сжиганию.
С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения её из пиритов; последний был распространён в древней Руси. Впервые в литературе он описан у Агриколы.
Сера в природе[править | править код]
Большие скопления самородной серы (с содержанием > 25 %) редки, они встречаются в местах вулканической активности, им сопутствуют сернистые фумаролы и сернистые воды[8].
Серная руда разрабатывается в месторождениях самородной серы, добывается из сульфидных руд и промышленных газов[9].
Серные бактерии могут окислять сероводород от гниющих органических остатков до серы и накапливать её[10].
Природные минералы серы[править | править код]
Сера является шестнадцатым по химической распространённости элементом в земной коре. Встречается в свободном (самородном) состоянии и в связанном виде.
Важнейшие природные минералы серы: FeS2 — железный колчедан, или пирит, ZnS — цинковая обманка, или сфалерит (вюрцит), PbS — свинцовый блеск, или галенит, HgS — киноварь, Sb2S3 — антимонит, Cu2S — халькозин, CuS — ковеллин, CuFeS2 — халькопирит. Кроме того, сера присутствует в нефти, природном угле, природных газах и сланцах. Сера — шестой элемент по содержанию в природных водах, встречается в основном в виде сульфат-иона и обусловливает «постоянную» жёсткость пресной воды. Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
Свойства[править | править код]
Физические свойства[править | править код]
Природный сросток кристаллов самородной серы
Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую). Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами. В воде сера нерастворима, но хорошо растворяется в органических растворителях, например, в сероуглероде, скипидаре.
Плавление серы сопровождается заметным увеличением объёма (примерно 15 %). Расплавленная сера представляет собой жёлтую легкоподвижную жидкость, которая выше 160 °C превращается в очень вязкую тёмно-коричневую массу. Наибольшую вязкость расплав серы приобретает при температуре 190 °C; дальнейшее повышение температуры сопровождается уменьшением вязкости и выше 300 °C расплавленная сера снова становится подвижной. Это связано с тем, что при нагревании серы она постепенно полимеризуется, увеличивая длину цепочки с повышением температуры. При нагревании серы свыше 190 °C полимерные звенья начинают рушиться.
Сера может служить простейшим примером электрета. При трении сера приобретает сильный отрицательный заряд[11].
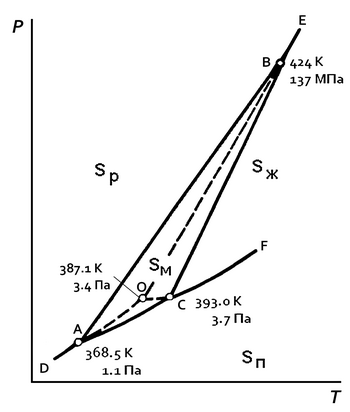
Фазовая диаграмма серы[править | править код]
Фазовая диаграмма элементарной серы.
Sp — ромбическая сера; Sм — моноклинная сера; Sж — жидкая сера; Sп — пары серы.
Элементарная кристаллическая сера может существовать в виде двух аллотропных модификаций (энантиотропия серы) — ромбической и моноклинной, — то есть сера диморфна, поэтому для элементарной серы возможно существование четырёх фаз: твёрдой ромбической, твёрдой моноклинной, жидкой и газообразной, а на фазовой диаграмме серы (см. рисунок; для давления использован логарифмический масштаб) имеются два поля твёрдых фаз: область ромбической серы и область существования моноклинной серы (треугольник АВС)[12].
На фазовой диаграмме серы[12]:
- DA — линия возгонки ромбической серы Sp, описывающая зависимость давления насыщенного пара серы Sп от температуры над твёрдой ромбической серой;
- AС — линия возгонки моноклинной серы Sм, описывающая зависимость давления насыщенного пара серы от температуры над твёрдой моноклинной серой;
- СF — линия испарения жидкой серы Sж, описывающая зависимость давления насыщенного пара серы от температуры над расплавом серы;
- AB — линия полиморфного превращения сера ромбическая <—> сера моноклинная, описывающая зависимость температуры фазового перехода между ромбической и моноклинной серой от давления;
- ВЕ — линия плавления ромбической серы, описывающая зависимость температуры плавления ромбической серы от давления;
- CВ — линия плавления моноклинной серы, описывающая зависимость температуры плавления моноклинной серы от давления.
Пунктирные линии отражают возможность существования метастабильных фаз, которые наблюдаются при резком изменении температуры:
- AО — линия сублимации перегретой ромбической серы;
- ВО — линия плавления перегретой ромбической серы;
- СО — линия испарения переохлаждённой жидкой серы;
На фазовой диаграмме серы имеются три стабильные тройные точки и одна метастабильная, каждая из которых отвечает условиям термодинамического равновесия трёх фаз[12]:
- точка А (дополнительная): равновесие твёрдой ромбической, твёрдой моноклинной и газообразной серы;
- точка В (дополнительная): равновесие твёрдой ромбической, твёрдой моноклинной и жидкой серы;
- точка С (основная): равновесие твёрдой моноклинной, расплавленной и газообразной серы;
- точка О (метастабильная): метастабильное равновесие между перегретой твёрдой ромбической, переохлаждённой жидкой и газообразной серой.
Как показывает фазовая диаграмма, ромбическая сера не может одновременно находиться в равновесии с расплавом и парами серы[13], поэтому в основной тройной точке (когда равновесные фазы находятся в разных агрегатных состояниях) твёрдая фаза представлена моноклинной серой. Метастабильная тройная точка появляется вследствие низкой скорости превращения одной кристаллической модификации серы в другую[14].
Химические свойства[править | править код]
Сера — хороший окислитель, как и O2, Но более сильные окислители, такие как кислород и галогены, окисляют её.
| Реагент | Уравнение | Описание |
|---|---|---|
| O2 |  
|
На воздухе сера горит, образуя сернистый газ — бесцветный газ с резким запахом.
С помощью спектрального анализа установлено, что на самом деле процесс окисления серы в двуокись представляет собой цепную реакцию и происходит с образованием ряда промежуточных продуктов: моноокиси серы S2O2, молекулярной серы S2, свободных атомов серы S и свободных радикалов моноокиси серы SO[15]. Окисляется оксид серы (IV) кислородом воздуха при температуре 400—500 °C, в присутствии катализатора (V2O5, Pt, NaVO3, Fe2O3). Реакция |
| Hal2 | 
|
Восстановительные свойства серы проявляются в реакциях серы и с другими неметаллами, однако при комнатной температуре сера реагирует только со фтором.
Гексафторид серы представляет собой плотный газ, используемый в качестве изоляционного газа в высоковольтных трансформаторах; это также нереактивный и нетоксичный пропеллент для контейнеров под давлением. |
  
|
Расплав серы реагирует с хлором, при этом возможно образование двух низших хлоридов (дихлорид серы и дитиодихлорид)[16], являющиеся важными промышленными химическими веществами.
При избытке серы также образуются разнообразные дихлориды полисеры типа SnCl2[17]. |
|
| P | 
|
При нагревании сера также реагирует с фосфором, образуя смесь сульфидов фосфора[18], среди которых — высший сульфид P2S5 |
| H2
С Si |
  
|
Кроме того, при нагревании сера реагирует с водородом, углеродом, кремнием, образуя сероводород, сероуглерод, сульфид кремния |
| Реагент | Уравнение | Описание |
|---|---|---|
| M |    
|
При нагревании сера взаимодействует со многими металлами, часто — весьма бурно. Иногда смесь металла с серой загорается при поджигании. При этом взаимодействии образуются сульфиды |
| M2S | 
|
Растворы сульфидов щелочных металлов реагируют с серой с образованием полисульфидов |
| Реагент | Уравнение | Описание |
|---|---|---|
| KOH | 
|
Из сложных веществ следует отметить прежде всего реакцию серы с расплавленной щёлочью, в которой сера диспропорционирует аналогично хлору.
Полученный сплав называется серной печенью. |
| HNO3
H2SO4 |
 
|
С концентрированными кислотами-окислителями (HNO3, H2SO4) сера реагирует только при длительном нагревании |
| Реагент | Уравнение | Описание |
|---|---|---|
| to | 
|
При увеличении температуры в парах серы происходят изменения в количественном молекулярном составе[19]. Число атомов в молекуле уменьшается |

|
При 800—1400 °C пары состоят в основном из двухатомной серы | |

|
А при 1700 °C сера становится атомарной |
Получение[править | править код]
В древности и в средние века серу добывали, вкапывая в землю большой глиняный горшок, на который ставили другой, с отверстием в дне. Последний заполняли породой, содержащей серу, и затем нагревали. Сера плавилась и стекала в нижний горшок.
В настоящее время серу получают главным образом путём выплавки самородной серы непосредственно в местах её залегания под землёй. Серные руды добывают разными способами — в зависимости от условий залегания. Залежам серы почти всегда сопутствуют скопления ядовитых газов — соединений серы. К тому же нельзя забывать о возможности её самовозгорания.
При добыче руды открытым способом экскаваторами снимают пласты пород, под которыми залегает руда. Взрывами рудный пласт дробят, после чего глыбы руды отправляют на сероплавильный завод, где из концентрата извлекают серу.
В 1890 г. Герман Фраш предложил плавить серу под землёй и через скважины, подобные нефтяным, выкачивать её на поверхность. Сравнительно невысокая (113 °C) температура плавления серы подтверждала реальность идеи Фраша. В 1890 г. начались испытания, приведшие к успеху.
Известно несколько методов получения серы из серных руд: пароводяные, фильтрационные, термические, центрифугальные и экстракционные.
Также сера в больших количествах содержится в природном газе в газообразном состоянии (в виде сероводорода, сернистого ангидрида). При добыче она откладывается на стенках труб и оборудования, выводя их из строя. Поэтому её улавливают из газа как можно быстрее после добычи. Полученная химически чистая мелкодисперсная сера является идеальным сырьём для химической и резиновой промышленности.
Серу из природного сернистого газа получают методом Клауса. Для этого используются так называемые серные ямы, где происходит дегазация серы, на выходе получают модифицированную серу — продукт, широко использующийся в производстве асфальта. Технологические установки для получения серы обычно включают в себя ямы недегазированной серы, ямы дегазации, ямы хранения дегазированной серы, а также налив жидкой серы и склад комовой серы. Стены ямы обычно делают из кирпича, дно заливают бетоном, а сверху закрывают яму алюминиевой крышей. Так как сера — это весьма агрессивная среда, ямы периодически приходится полностью реконструировать.
Крупнейшее месторождение самородной серы вулканического происхождения находится на острове Итуруп с запасами категории A+B+C1 — 4227 тыс. тонн и категории C2 — 895 тыс. тонн, что достаточно для строительства предприятия мощностью 200 тыс. тонн гранулированной серы в год.
Склад серы у химического цеха ММСК (1960-е гг.)
Производители[править | править код]
Традиционный и опасный вид добычи серы на вулкане Иджен Восточной Явы, Индонезия. То, что выглядит как водяной пар, является в действительности высококонцентрированными испарениями сероводорода и диоксида серы. 2015 год[20]
Ввиду высокой потребности Красной Армии в боеприпасах постановлением Президиума ВСНХ от 19 декабря 1930 года решено «включить строительство серных предприятий в число ударных первоочередных строек». В 1930—1931 годах были разведаны и запущены в производство два месторождения в Средней Азии — Каракумский завод самородной серы (3 тысячи тонн в год) и серный рудник Шорсу. Богатый (25 % каменной серы в руде) рудник Шорсу начал разрабатываться шахтным способом, а затем открытым. После ввода в строй этих рудников, в 1932 году был построен Калатинский завод газовой серы (4 тысячи тонн в год), а также несколько заводов в РСФСР. Основанный в 1939 году в Оренбургской области Медногорский медно-серный комбинат (ММСК)[21] до 1986 года был крупнейшим производителем серы в СССР: в середине 1950-х годов он выпускал до 250—280 тысяч тонн в год, что составляло 80 % серы, производившейся в стране.
…Утром мы были на медносерном заводе. Около 80 процентов серы, выпускаемой в нашей стране, добывается на этом предприятии.
— До пятидесятого года стране приходилось импортировать много серы из-за границы. Теперь нужда в импорте серы отпала, — говорил директор завода Александр Адольфович Бурба. — Но завод продолжает расширяться. Начали строить цех производства серной кислоты.
С высокой эстакады застывшим потоком повис ярко-жёлтый массив серы. То, что мы видим в небольших количествах в стеклянных баночках в лабораториях, здесь, на заводском дворе, лежало огромными глыбами.
— А. Софронов. В Оренбургских степях (журнал «Огонёк», 1956)[22]
В начале XXI века основными производителями серы в России являются предприятия ОАО Газпром: ООО Газпром добыча Астрахань и ООО Газпром добыча Оренбург, получающие её как побочный продукт при очистке газа[23].
Товарные формы[править | править код]
В промышленности реализовано получение серы в различных товарных формах[24][с. 193—196]. Выбор той или иной формы определяется требованиями заказчика.
Комовая сера до начала 1970-х годов была основным видом серы, выпускаемым промышленностью СССР. Её получение технологически просто и осуществляется подачей жидкой серы по обогреваемому трубопроводу на склад, где производится заливка серных блоков. Застывшие блоки высотой 1—3 метра разрушают на более мелкие куски и транспортируют заказчику. Метод, однако, имеет недостатки: невысокое качество серы, потери на пыль и крошку при рыхлении и погрузке, сложность автоматизации.
Жидкую серу хранят в обогреваемых резервуарах и транспортируют в цистернах. Транспорт жидкой серы более выгоден, чем её плавление на месте. Достоинства получения жидкой серы — отсутствие потерь и высокая чистота. Недостатки — опасность возгорания, траты на обогрев цистерн.
Формованная сера бывает чешуйчатая и пластинчатая. Чешуйчатую серу начали производить на НПЗ в 1950-х годах. Для получения используют вращающийся барабан, внутри он охлаждается водой, а снаружи кристаллизуется сера в виде чешуек толщиной 0,5—0,7 мм. В начале 1980-х годов вместо чешуйчатой стали выпускать пластинчатую серу. На движущуюся ленту подаётся расплав серы, который охлаждается по мере движения ленты. На выходе образуется застывший лист серы, который ломают с образованием пластинок. Сегодня эта технология считается устаревшей, хотя около 40 % канадской серы экспортируется именно в таком виде ввиду больших капиталовложений в установки для её получения.
Гранулированную серу получают различными методами.
- Водная грануляция (пеллетирование) разработана в 1964 году английской фирмой «Эллиот». Процесс основан на быстром охлаждении капель серы, падающих в воду. Первое внедрение технологии — процесс «Салпел» в 1965 году. Крупнейший завод позже был построен в Саудовской Аравии в 1986 году. На нём каждая из трёх установок может производить до 3500 т гранулированной серы в сутки. Недостаток технологии — ограниченное качество гранул серы, обладающих неправильной формой и повышенной хрупкостью.
- Грануляция в кипящем слое разработана французской компанией «Перломатик». Капли жидкой серы подаются вверх. Они охлаждаются водой и воздухом и смачиваются жидкой серой, которая застывает на образующихся гранулах тонким слоем. Конечный размер гранул 4—7 мм. Более прогрессивным является процесс «Прокор», который широко внедрён в Канаде. В нём применяются барабанные грануляторы. Однако этот процесс очень сложен в управлении.
- Воздушно-башенная грануляция разработана и внедрена в Финляндии в 1962 году. Расплав серы диспергируется с помощью сжатого воздуха в верхней части грануляционной башни. Капли падают и затвердевают, попадая на транспортную ленту.
Молотая сера является продуктом размола комовой или гранулированной серы. Степень измельчения может быть различной. Его проводят сначала в дробилке, потом в мельнице. Таким способом возможно получение очень высокодисперсной серы с размером частиц менее 2 мкм. Грануляцию порошковой серы проводят в прессах. Необходимо использование связующих добавок, в качестве которых используют битумы, стеариновую кислоту, жирные кислоты в виде водной эмульсии с триэтаноламином и другие[11].
Крупнейшими производителями молотой серы в России являются предприятия ООО «Каспийгаз» и АО «Сера».
Коллоидная сера — разновидность молотой серы с размером частиц менее 20 мкм. Её применяют в сельском хозяйстве для борьбы с вредителями и в медицине как противовоспалительные и дезинфицирующие средства. Коллоидную серу получают различными способами.
- Способ получения путём размола широко распространён, поскольку не предъявляет высоких требований к сырью. Одним из лидеров по этой технологии является фирма «Bayer».
- Способ получения из расплавленной серы или её паров был внедрён в США в 1925 году. Технология подразумевает смешение с бентонитом, полученная смесь образует устойчивые суспензии с водой. Однако содержание серы в растворе невелико (не более 25 %).
- Экстракционные способы получения основаны на растворении серы в органических растворителях и дальнейшем испарении последних. Однако они не получили широкого распространения.
Высокочистую серу получают используя химические, дистилляционные и кристаллизационные методы. Её применяют в электронной технике, при изготовлении оптических приборов, люминофоров (серная лампа), в производстве фармацевтических и косметических препаратов — лосьонов, мазей, средств против кожных болезней.
Применение[править | править код]
Примерно половина производимой серы используется в производстве серной кислоты.
Серу применяют для вулканизации каучука, как фунгицид в сельском хозяйстве и серу коллоидную как лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона. Сера находит применение для производства пиротехнических составов, ранее использовалась в производстве пороха, применяется для производства спичек. Серная лампа — источник белого света, очень близкого к солнечному, с высоким КПД.
Биологическая роль[править | править код]
Сера — один из биогенных элементов. Сера входит в состав некоторых аминокислот (цистеин, метионин), витаминов (биотин, тиамин), ферментов.
Сера участвует в образовании третичной структуры белка (формирование дисульфидных мостиков).
Также сера участвует в бактериальном фотосинтезе (сера входит в состав бактериохлорофилла, а сероводород является источником водорода). Окислительно-восстановительные реакции серы — источник энергии в хемосинтезе[25].
В человеке содержится примерно 2 г серы на 1 кг массы тела.
Самородная сера на почтовой марке, 2009
Биологическое действие[править | править код]
Чистая сера не ядовита, но многие летучие серосодержащие соединения ядовиты (сернистый газ, серный ангидрид, сероводород и др.).
Пожароопасные свойства серы[править | править код]
Тонкоизмельчённая сера склонна к химическому самовозгоранию в присутствии влаги, при контакте с окислителями, а также в смеси с углём, жирами, маслами. Сера образует взрывчатые смеси с нитратами, хлоратами и перхлоратами.
Самовозгорается при контакте с хлорной известью.
Средства тушения: распылённая вода, воздушно-механическая пена[26].
По данным В. Маршалла пыль серы относится к разряду взрывоопасных, но для взрыва необходима достаточно высокая концентрация пыли — порядка 20 г/м³ (20 000 мг/м³), такая концентрация во много раз превышает предельно допустимую концентрацию для человека в воздухе рабочей зоны — 6 мг/м³[27].
Пары образуют с воздухом взрывчатую смесь[28].
- Горение серы
Горение серы протекает только в расплавленном состоянии аналогично горению жидкостей. Верхний слой горящей серы кипит, создавая пары, которые образуют слабо светящееся голубое пламя высотой до 5 см[29]. Температура пламени при горении серы составляет 1820 °C[30].
Так как воздух по объёму состоит приблизительно из 22 % кислорода и 78 % азота и при горении серы из одного объёма кислорода получается один объём SO2, то максимальное теоретически возможное содержание SO2 в газовой смеси составляет 21 %. На практике горение происходит с некоторым избытком воздуха, и объёмное содержание SO2 в газовой смеси меньше теоретически возможного, составляя обычно 14—15 %[15].
- Обнаружение горения
Обнаружение горения серы пожарной автоматикой является трудной проблемой. Пламя сложно обнаружить человеческим глазом или видеокамерой, спектр голубого пламени лежит в основном в ультрафиолетовом диапазоне. Тепловыделение при пожаре приводит к температуре ниже, чем при пожарах других распространённых пожароопасных веществ. Для обнаружения горения тепловым извещателем необходимо размещать его непосредственно близко к сере. Пламя серы не излучает в инфракрасном диапазоне. Таким образом оно не будет обнаружено распространёнными инфракрасными извещателями. Ими будут обнаруживаться лишь вторичные возгорания. Пламя серы не выделяет паров воды. Таким образом детекторы ультрафиолетовых извещателей пламени, использующие соединения никеля, не будут работать.
Для эффективного обнаружения пламени используется ультрафиолетовые извещатели с детекторами на основе молибдена. Они имеют спектральный диапазон чувствительности 1850…2650 ангстрем, который подходит для обнаружения горения серы[31].
Пожары на складах серы[править | править код]
|
|
Этот раздел имеет чрезмерный объём или содержит маловажные подробности неэнциклопедичного характера. Если вы не согласны с этим, пожалуйста, покажите в тексте существенность излагаемого материала. В противном случае раздел может быть удалён. Подробности могут быть на странице обсуждения. |
В декабре 1995 года на открытом складе серы предприятия, расположенного в городе Сомерсет-Уэст Западно-Капской провинции Южно-Африканской Республики, произошёл крупный пожар, погибли два человека[32][33].
16 января 2006 года около 17 часов на череповецком предприятии «Аммофос» загорелся склад с серой. Общая площадь пожара — около 250 квадратных метров. Полностью ликвидировать его удалось лишь в начале второго ночи. Жертв и пострадавших нет[34].
15 марта 2007 года рано утром на ООО «Балаковский завод волоконных материалов» произошёл пожар на закрытом складе серы. Площадь пожара составила 20 м2. На пожаре работало 4 пожарных расчёта с личным составом в 13 человек. Примерно через полчаса пожар был ликвидирован. Никто не пострадал[35].
4 и 9 марта 2008 года произошло возгорание серы в Атырауской области в хранилище серы ТШО на Тенгизском месторождении. В первом случае очаг возгорания удалось потушить быстро, во втором случае сера горела 4 часа. Масса горевших отходов нефтепереработки, к каковым по казахстанским законам отнесена сера, составила более 9 тонн[36].
В апреле 2008 недалеко от посёлка Кряж Самарской области загорелся склад, на котором хранилось 70 тонн серы. Пожару была присвоена вторая категория сложности. К месту происшествия выехали 11 пожарных расчётов и спасатели. В тот момент, когда пожарные оказались около склада, горела ещё не вся сера, а только её небольшая часть — около 300 килограммов. Площадь возгорания вместе с участками сухой травы, прилегающими к складу, составила 80 квадратных метров. Пожарным удалось быстро сбить пламя и локализовать пожар: очаги возгорания были засыпаны землёй и залиты водой[37].
В июле 2009 года в Днепродзержинске горела сера. Пожар произошёл на одном из коксохимических предприятий в Баглейском районе города. Огонь охватил более восьми тонн серы. Никто из сотрудников комбината не пострадал[38].
В конце июля 2012 года под Уфой в посёлке Тимашево загорелся склад с серой площадью 3200 квадратных метров. На место выехало 13 единиц техники, в тушении пожара задействован 31 пожарный. Произошло загрязнение атмосферного воздуха продуктами горения. Погибших и пострадавших нет[39].
Юникод[править | править код]
В Юникоде есть алхимический символ серы.
| Графема | Unicode | HTML | |||
|---|---|---|---|---|---|
| Код | Название | Шестнадцатеричное | Десятичное | Мнемоника | |
| 🜍 | U+1F70D | ALCHEMICAL SYMBOL FOR SULFUR | 🜍
|
🜍
|
— |
См. также[править | править код]
- Соединения серы
- Жупел
- Акарициды
- Ушная сера
- Desulfobulbus propionicus — бактерия, осуществляющая диспропорционирование серы
Примечания[править | править код]
- Комментарии
- ↑ Указан диапазон значений атомной массы в связи с неоднородностью распространения изотопов в природе.
- Источники
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02. Архивировано 5 февраля 2014 года.
- ↑ Химическая энциклопедия: в 5 т / Редкол.: Зефиров Н. С. (гл. ред.). — Москва: Советская энциклопедия, 1995. — Т. 4. — С. 319. — 639 с. — 20 000 экз. — ISBN 5—85270—039—8.
- ↑ Webster Dictionary
- ↑ Этимологический словарь русского языка Семёнова Архивная копия от 27 января 2013 на Wayback Machine.
- ↑ Фасмер М. Этимологический словарь русского языка, том 3. — М.: Прогресс. — 1964 – 1973. — С. 603.
- ↑ Michie C. A., Langslow D. R. «Sulphur Or Sulfur? A Tale Of Two Spellings.» // British Medical Journal. 1988. Vol. 297. N 6664. P. 1697-99.
- ↑ Mallory J. P., Adams D. Q. The Oxford Introduction To Proto-Indo-European And Indo-European World. — Oxford:University Press. — 2006. — С. 124.
- ↑ Сернистые фумаролы; Сернистые воды // Геологический словарь. Т. 2. М.: Госгеолтехиздат, 1960. С. 248.
- ↑ Серная руда // Геологический словарь. Т. 2. М.: Госгеолтехиздат, 1960. С. 247.
- ↑ Серные бактерии // Геологический словарь. Т. 2. М.: Госгеолтехиздат, 1960. С. 248.
- ↑ 1 2 Б. В. Некрасов. Основы общей химии. — 3-е изд., исправленное и доп. — М.: Химия, 1973. — Т. 1. — 656 с.
- ↑ 1 2 3 Булидорова Г. В. и др., Физическая химия, 2012, с. 228.
- ↑ Ансельм А. И., Основы статистической физики и термодинамики, 1973, с. 227.
- ↑ Мейер К., Физико-химическая кристаллография, 1972, с. 134.
- ↑ 1 2 Непенин Н. Н. Технология целлюлозы. Производство сульфитной целлюлозы. — М.: «Лесная промышленность», 1976. — С. 151.
- ↑ Ключников Н. Г. Неорганчиеский синтез. М., Просвещение, 1971, С. 267—269
- ↑ Н. С. Ахметов. Общая и неорганическая химия / Рецезент: проф. Я.А.Угай. — Москва: Высшая школа, 1981. — Т. 1. — 672 с.
- ↑ Реми Г. Курс неорганической химии. — М.: «Издательство иностранной литературы», 1961. — С. 695.
- ↑ Глинка Н. Л. Общая химия. — М.: «Химия», 1977, переработанное. — С. 382. — 720 с.
- ↑ Ijen Volcano: sulphur mine workers of Indonesia. www.news.com.au. Дата обращения: 5 марта 2019. Архивировано 3 ноября 2018 года.
- ↑ Иванов В. Рядом с Ушаковым Архивная копия от 15 октября 2014 на Wayback Machine. К 70-летию Медногорска // газета «Медногорский рабочий», № 25, 9 апреля 2009, с. 2.
- ↑ Софронов А. В Оренбургских степях Архивная копия от 18 июля 2018 на Wayback Machine. // Журнал «Огонёк». — 1956. — № 30. — С. 15—17.
- ↑ Под редакцией Е. А. Козловского. «Оренбурггазпром» // Горная энциклопедия. — Советская энциклопедия. — М., 1984—1991.: Горная энциклопедия.
- ↑ А. Л. Лапидус, И. А. Голубева, Ф. Г. Жагфаров. Газохимия. Учебное пособие. — Москва: ЦентрЛитНефтеГаз, 2008. — 450 с. — ISBN 978-5-902665-31-1.
- ↑ Т. Л. Богданова, Е. А. Солодова. Биология: Справочник для старшеклассников и поступающих в ВУЗы. — М.: АСТ-ПРЕСС КНИГА. — 2011. — С. 85.
- ↑ А. Я. Корольченко, Д. А. Корольченко. Пожаровзрывоопасность веществ и материалов и средства их тушения. Справочник: в 2 ч. — 2-е изд., переработанное и дополненное. — М.: Асе. «Пожнаука», 2004. — Т. 2. — 396 с.
- ↑ Е. П. Белобров, А. В. Сидоров. «Эколого-гигиенические последствия взрывов пыли и пожаров комовой серы, сопровождающие её перегрузку в порту Мариуполь» Архивная копия от 1 ноября 2011 на Wayback Machine.
- ↑ РД 50-290-81 Методические указания. Анализаторы содержания серы в нефти. Методы и средства поверки Архивная копия от 9 октября 2011 на Wayback Machine.
- ↑ В. Аксютин, П. Щеглов, В. Жолобов, С. Алексанянц. «Ликвидация пожаров при аварийных ситуациях с опасными грузами» (недоступная ссылка).
- ↑ Теребнев В. В. Справочник руководителя тушения пожара. Тактические возможности пожарных подразделений. — М.: Пожкнига, 2004. — С. 99.
- ↑ Архивированная копия. Дата обращения: 16 мая 2009. Архивировано из оригинала 18 сентября 2010 года.
- ↑ South African sulphur fire (англ.) (недоступная ссылка — история). Refdoc. Дата обращения: 5 августа 2013. Архивировано 13 августа 2013 года.
- ↑ AECI fire puts sulphur stockpiles in spotlight (англ.) (недоступная ссылка — история). Reed Business Information Limited (1 января 1996). Дата обращения: 5 августа 2013. Архивировано 13 августа 2013 года.
- ↑ Пожар на череповецком «Аммофосe». Накануне около пяти вечера на этом предприятии загорелся склад с серой. Радио «Трансмит» (17 января 2006). Дата обращения: 5 августа 2013. Архивировано 25 октября 2011 года.
- ↑ В Балакове сгорел склад с серой. Информационное агентство Взгляд-инфо (16 марта 2007). Дата обращения: 5 августа 2013. Архивировано 3 июня 2013 года.
- ↑ ТОО «Тенгизшевройл» оштрафуют за два пожара в хранилище серы. Информационный портал Zakon.kz (19 марта 2008). Дата обращения: 5 августа 2013. Архивировано 17 июня 2013 года.
- ↑ Алина Калинина. МЧСники ищут владельца сарая с серой, который горел под Самарой. Комсомольская правда (17 апреля 2008). Дата обращения: 5 августа 2013. Архивировано 4 марта 2016 года.
- ↑ Коксохим горел в Днепродзержинске. Mobus.com (3 июля 2009). Дата обращения: 5 августа 2013. Архивировано 13 августа 2013 года.
- ↑ В Уфе загорелся склад с серой. Rambler.ru (31 июля 2012). Дата обращения: 5 августа 2013. Архивировано 13 августа 2013 года.
Литература[править | править код]
- Сера, химический элемент // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Ансельм А. И. Основы статистической физики и термодинамики. — М.: Наука, 1973. — 424 с.
- Булидорова Г. В., Галяметдинов Ю. Г., Ярошевская Х. М., Барабанов В.П. Физическая химия. — Казань: Изд-во Казан. нац. исслед. технол. ун-та, 2012. — 396 с. — ISBN 978-5-7882-1367-5.
- Мейер К. Физико-химическая кристаллография. — Пер. с нем. О. П. Никитиной. — Под ред. Е. Д. Щукина и Б. Д. Сумма. — М.: Металлургия, 1972. — 480 с.
Ссылки[править | править код]
- Sulfur (англ.). WebElements. Дата обращения: 5 августа 2013.
- Сера. Популярная библиотека химических элементов (18 марта 2002). Дата обращения: 5 августа 2013.
- Самородная сера. Каталог минералов. Дата обращения: 5 августа 2013.
- Сера – роль в организме человека. Дата обращения: 5 августа 2013. Архивировано 13 августа 2013 года.
- Малышев А. И. Сера в магматическом рудообразовании. — ИГГ УрО РАН, 2004. — 189 с.
- Сера. Справочник химика.
Molar mass of S = 32.065 g/mol
Convert grams Sulfur to moles
or
moles Sulfur to grams
Percent composition by element
Element: Sulfur
Symbol: S
Atomic Mass: 32.065
# of Atoms: 1
Mass Percent: 100.000%
Calculate the
molecular weight of a chemical compound
More information
on molar mass and molecular weight
In chemistry, the formula weight is a quantity computed by multiplying the atomic weight (in atomic mass units) of each element in a chemical formula by the number of atoms of that element present in the formula, then adding all of these products together.
The atomic weights used on this site come from NIST, the National Institute of Standards and Technology. We use the most common isotopes. This is how to calculate molar mass (average molecular weight), which is based on isotropically weighted averages. This is not the same as molecular mass, which is the mass of a single molecule of well-defined isotopes. For bulk stoichiometric calculations, we are usually determining molar mass, which may also be called standard atomic weight or average atomic mass.
Finding molar mass starts with units of grams per mole (g/mol). When calculating molecular weight of a chemical compound, it tells us how many grams are in one mole of that substance. The formula weight is simply the weight in atomic mass units of all the atoms in a given formula.
A common request on this site is to convert grams to moles. To complete this calculation, you have to know what substance you are trying to convert. The reason is that the molar mass of the substance affects the conversion. This site explains how to find molar mass.
Using the chemical formula of the compound and the periodic table of elements, we can add up the atomic weights and calculate molecular weight of the substance.
Formula weights are especially useful in determining the relative weights of reagents and products in a chemical reaction. These relative weights computed from the chemical equation are sometimes called equation weights.
If the formula used in calculating molar mass is the molecular formula, the formula weight computed is the molecular weight. The percentage by weight of any atom or group of atoms in a compound can be computed by dividing the total weight of the atom (or group of atoms) in the formula by the formula weight and multiplying by 100.
Химия
Ralf
3 год назад
Как найти атомную массу серы
плиз очень срочно
ОТВЕТЫ
Baptiste
Jul 2, 2020
Посмотри в табличку Менделеева. Если что атомная маса серы : 32
СПАСИБО
185
Вычисление молярной массы
To calculate molar mass of a chemical compound enter its formula and click ‘Compute’. В химической формуле, вы можете использовать:
- Любой химический элемент. Capitalize the first letter in chemical symbol and use lower case for the remaining letters: Ca, Fe, Mg, Mn, S, O, H, C, N, Na, K, Cl, Al.
- Функциональные группы:D, Ph, Me, Et, Bu, AcAc, For, Ts, Tos, Bz, TMS, tBu, Bzl, Bn, Dmg
- круглые () и квадратные [] скобки.
- Общие составные имена.
Примеры расчета молярной массы:
NaCl,
Ca(OH)2,
K4[Fe(CN)6],
CuSO4*5H2O,
water,
nitric acid,
potassium permanganate,
ethanol,
fructose.
Molar mass calculator also displays common compound name, Hill formula, elemental composition, mass percent composition, atomic percent compositions and allows to convert from weight to number of moles and vice versa.
Вычисление молекулярной массы (молекулярная масса)
Для того, чтобы рассчитать молекулярную массу химического соединения, введите её формулу, указав его количество массы изотопа после каждого элемента в квадратных скобках.
Примеры молекулярные вычисления веса:
C[14]O[16]2,
S[34]O[16]2.
Определение молекулярной массы, молекулярный вес, молекулярная масса и молярная масса
- Молекулярная масса ( молекулярной массой ) это масса одной молекулы вещества, выражающаяся в атомных единицах массы (и). (1 и равна 1/12 массы одного атома углерода-12)
- Молярная масса ( молекулярной массой ) является масса одного моля вещества и выражается в г / моль.
Массы атомов и изотопов с NIST статью .
См. также: молекулярные массы аминокислот