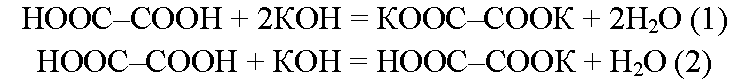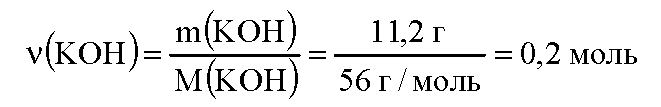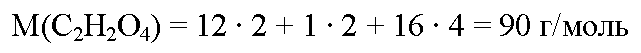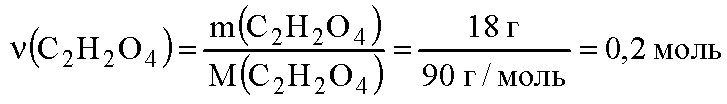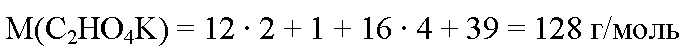снова аналитическая химия.. . (определение массы навески щавелевой кислоты)
Мыслитель
(6244),
закрыт
9 лет назад
Дополнен 9 лет назад
21.Определите массу навески щавелевой кислоты (H2C2O42H2O), необходимую для приготовления 300 мл 0,6М раствора. Чему равно значение рН раствора и степень диссоциации кислоты? Как изменяется рН, степень диссоциации и константа диссоциации при: а) разбавлении раствора водой до 3 л; б) при добавлении равного объема и эквивалентного количества хлороводородной кислоты?
Екатерина Ганженко
Высший разум
(132726)
9 лет назад
М (Н2С2О4*2Н2О) = 90 + 36 = 126 г/моль
m (H2C2O4*2H2O) = 90*0.6*0.3 *126/90 = 22.68 г
Кд = 5,6*10^-2 – константа диссоциации щавелевой кислоты по первой ступени, рН и степень диссоциации считай, используя закон разбавления Оствальда
а) при разбавлении водой константа диссоциации не изменится, степень диссоциации увеличится в 10 раз .
Светило науки – 540 ответов – 0 раз оказано помощи
Дано:
V(C₂H₂O₄) = 200 мл = 0,2 л
Cн(C₂H₂O₄) = 0,2 Н = 0,2 моль/л
————————————————-
Найти:
m(C₂H₂O₄) – ?
Решение:
1) Для начала мы запишем формулу нормальной концентрированной щавелевой кислоты, именно по такой формуле мы найдем массу щавелевой кислоты:
Cн(C₂H₂O₄) = m(C₂H₂O₄)/(M(C₂H₂O₄)×V(C₂H₂O₄)) ⇒ m(C₂H₂O₄) = Cн(C₂H₂O₄)×(M(C₂H₂O₄)×V(C₂H₂O₄))
2) Для начала мы найдем молекулярную массу щавелевой кислоты:
M(C₂H₂O₄) = 12×2+1×2+16×4 = 24+2+64 = 90 гр/моль
3) Потом мы находим массу щавелевой кислоты используя формулу из 1) :
m(C₂H₂O₄) = 0,2 моль/л × (90 гр/моль × 0,2 л) = 0,2 моль/л × 90 гр/моль × 0,2 л = 18 гр/л × 0,2 л = 3,6 гр
Ответ: m(C₂H₂O₄) = 3,6 гр
Привет) Уже решали))
возможно образование средней (уравнение 1) и кислой (уравнение 2) солей:
вычислим массу гидроксида калия, содержащегося в растворе:
вычислим молярную массу гидроксида калия:
вычислим количество вещества гидроксида калия:
молекулярная формула щавелевой кислоты с2н2о4. вычислим молярную массу щавелевой кислоты:
вычислим количество вещества щавелевой кислоты:
таким образом, на 0,2 моль гидроксида калия приходится 0,2 моль щавелевой кислоты. это соотношение соответствует уравнению (2), согласно которому для нейтрализации 1 моль гидроксида калия необходимо 1 моль щавелевой кислоты. следовательно, образуется кислая соль – гидрооксалат калия. по уравнению 2 из 1 моль щавелевой кислоты образуется 1 моль гидрооксалата калия, следовательно из 0,2 моль щавелевой кислоты получится 0,2 моль гидрооксалата калия.
молекулярная формула гидрооксалата калия с2но4к. вычислим его молярную массу:
вычислим массу гидрооксалата калия:
ответ: получится 25,6 г гидрооксалата калия ноос-соок.
Расчёт: 1. Рассчитаем
массу навески по формуле: m = Сн.•Э•V
2. Найдем эквивалентную массу щавелевой
кислоты по формуле:
Э = Mн2с2о4·2н2о /nH+ =
126/2=63 г/моль;
3. Вычислим массу кислоты: m = 0,1•63•0,25=1,5750 г
2) Приготовление
рабочего раствора по
неточной навеске (KOH, NaOH, Na2S2O3). При этом нет необходимости отбирать точную навеску вещества, так
как при всей тщательности взвешивания из таких веществ нельзя получить раствор
с точной концентрацией. Поэтому для приготовления рабочих растворов навеску
взвешивают на технических весах и
применяют неточную мерную
посуду. Для стандартизации рабочего раствора его титруют другим стандартным раствором.
Растворы, титр которых находят не по точной навеске, а
устанавливают по тому или иному стандартному веществу, называют стандартизированными
или растворами с установленным
титром.
Так, нормальность раствора гидроксида натрия и перманганата
натрия устанавливают по стандартному раствору щавелевой кислоты, а нормальность
соляной кислоты – по исходному раствору тетрабората натрия.
Задача: Определите нормальность раствора KMnO4, если на титрование 10,0 мл его раствора было израсходовано 12,5
мл 0,1 н. раствора щавелевой кислоты.
Решение:
Для определения нормальности раствора KMnO4 по итогам титрования используем уравнение титрования:
H1V1=H2V2
Н KMnO4= 12,5 · 0,1/ 10,0 = 0,1250 моль/л
3) Приготовление рабочего раствора разбавлением более концентрированного раствора (HCl, H2SO4, HNO3).
Задача: Необходимо приготовить 500 мл раствора гидроксида натрия
с молярной концентрацией эквивалента 0,1 н. из раствора щелочи с массовой долей
13,28%, плотностью p=1,145 г/см3.
Решение:
1. Рассчитаем массу (г) NaOH в 500 мл раствора при нормальной
концентрации 0,1 н. по формуле:
m = Сн. •Э • V m = 0,1• 40 • 0,5 = 2,0 г
2. Вычислим массу раствора NaOH с массовой долей 13,28%, в котором содержится 2,0 г NaOH из пропорции:
|
13.28 г |
NaOH |
содержится в |
100 г |
раствора |
|
2,0 г |
NaOH |
» » » |
Х г |
раствора |
Предыдущая Следующая