Методика решения задачи на определение начальной массы смеси двух веществ при полной нейтрализации полученной смеси
Задача 1.
В воде растворили смесь оксида натрия и оксида калия, где массовая доля натрия 46%. Определите массу начальной смеси, если для полной нейтрализации полученной смеси израсходовано 175 мл 2 молярного раствора серной кислоты.
Решение:
М(Na2O ) = (2 • 23) + 16 = 62 г/моль;
М(К2O ) = (2 •39) + 16=94 г/моль.
Из формулы оксида натрия Na2O следует, что на 46 весовых частей Na приходится 16 весовых частей О, т.е. на 46% Na в смеси оксидов будет приходится 16% О. Тогда смесь оксидов натрия и калия будет содержать 62% (46 + 16 = 62) Na2O. Соответственно, содержание К2О в смеси будет 38% (100 – 61 = 100).
Уравнение реакции имеет вид:
Me2O + H2SO4 = Me2SO4 + H2O
Из уравнения реакции следует, что на нейтрализацию 1 моля оксидов натрия или калия расходуется 1 моль серной кислоты.
Рассчитаем количество серной кислоты по условию задачи, получим:
(175мл • 2моль/1000мл) = 0,35 мол. Значит, n(смеси) = 0,35 мол.
Смесь содержит 0,35 моль оксидов натрия и калия .
Обозначим массу смеси оксидов через х г.
Тогда
n(Na2O) = (62% • х г)/(100% • 62 г/моль) = 0,01х моль;
n(К2O) = (38% • х г)/(100% • 94 г/моль) = 0,0004х моль.
Теперь рассчитаем массу смеси оксидов натрия и калия, используя алгебраическое уравнение, получим:
0,01х + 0,004х = 0,35;
0,014х = 0,35;
х = 0,35/0,014 = 25 г; m((смеси) = 25 г.
Отсюда
m(Na2O) = [m((смеси) • w%( Na2O)]/100% = [(25г • 62%)]/100% = 15,5 г;
m(К2O) = [m((смеси) • w%( К2O)]/100% = [(25 г • 38%)]/100% = 9,5 г.
Ответ: m(смеси) = 2 5г.
Содержание:
Количество вещества:
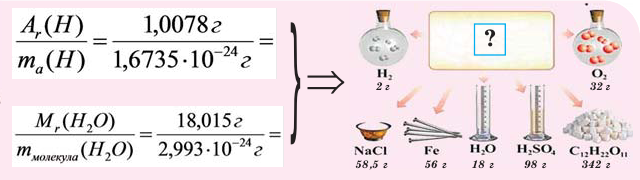
В чём разница между понятиями «масса» и «количество»
Если мы будем производить подобные расчеты, соответствующие этому заданию, для простых веществ, образованных различными элементами, то всякий раз получим одно и то же число — 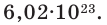
Например, в 1 моле водородного газа содержится  молекул, в 1 моле поваренной соли (NaCI)
молекул, в 1 моле поваренной соли (NaCI)  ионов натрия
ионов натрия  и
и  ионов хлора
ионов хлора 
Количество частиц, содержащихся в 1 моле химических веществ (  ), называется постоянной Авогадро (Na). Постоянная Авогадро отличается от числа Авогадро тем, что измеряется определенной единицей
), называется постоянной Авогадро (Na). Постоянная Авогадро отличается от числа Авогадро тем, что измеряется определенной единицей 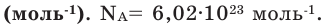
Количество вещества можно вычислить по следующей формуле:
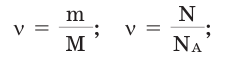
Здесь 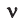 — количество вещества,
— количество вещества, 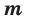 — масса, М — молярная масса, N – заданное количество молекул,
— масса, М — молярная масса, N – заданное количество молекул, 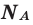 — постоянная Авогадро. Все представленные в формуле величины нам уже известны. Кроме понятия молярной массы. Давайте выясним сущность этого понятия.
— постоянная Авогадро. Все представленные в формуле величины нам уже известны. Кроме понятия молярной массы. Давайте выясним сущность этого понятия.
Молярная масса
Молярной массой называют массу 1 моля вещества, выраженного в граммах. Молярная масса обозначается
буквой М, единицей измерения является г/моль.
При выражении молярной массы вещества в граммах, она численно бывает равна его относительной молекулярной массе (если состоит из молекул). Для сравнения запишем (таблица 1):

Как видно из сравнений, молярная масса веществ по своей единице отличается от относительной молекулярной массы. То есть молярная масса – измеряемая величина.
Как видно из вышесказанного, понятие молярная масса применяется как к химическим элементам, так и к простым и сложным веществам с молекулярным и немолекулярным строением.
На основе количества вещества (моль) можно производить следующие вычисления. Если известно мольное количество вещества:
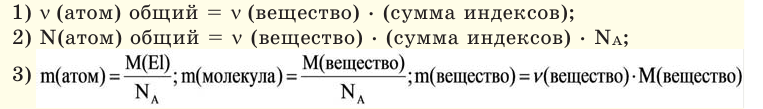
Закон Авогадро и молярный объём газов
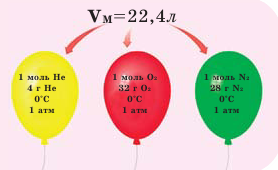
Обратите внимание на рисунки. Почему, несмотря на разные массы газов, они занимают одинаковый объём?
В начале XIX века итальянский ученый Авогадро, проведя наблюдения над свойствами газов в различных условиях и проанализировав открытые прежде законы о газах (Бойля-Мариотта, Гей-Люссака и др.) в 1811 году сформулировал новый закон о газах. Закон Авогадро звучит следующим образом: в равных объемах различных газов при одинаковых условиях (одинаковых температуре и давлении) содержится одинаковое число молекул.

Итальянский ученый. В 1811 году им был открыт закон о газах, который впоследствии был назван его именем.
Мы уже знаем, что 1 моль любого вещества содержит  молекул. Согласно закону Авогадро, можно утверждать, что одинаковое число молекул в 2 г водорода, 32 г кислорода, 28 г азота, 44 г углекислого газа занимает одинаковый объём.
молекул. Согласно закону Авогадро, можно утверждать, что одинаковое число молекул в 2 г водорода, 32 г кислорода, 28 г азота, 44 г углекислого газа занимает одинаковый объём.
Было вычислено, что при нормальных условиях объем 1 моля любого газа или смеси газов составляет примерно 22,4 л. Объем 1 моля газа при нормальных условиях (н.у.) называют молярным объемом данного газа, выраженным знаком 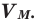 . При измерении объема газа в литрах молярный объём составит
. При измерении объема газа в литрах молярный объём составит 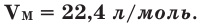 Зависимость между количеством вещества и молярным объёмом газа можно выразить следующей формулой:
Зависимость между количеством вещества и молярным объёмом газа можно выразить следующей формулой:
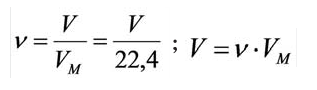
Здесь 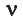 – количество вещества,
– количество вещества, 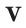 – объём газа,
– объём газа, 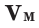 – молярный объем.
– молярный объем.
На основе закона Авогадро и молярного объёма газов можно вычислить плотность газов при нормальных условиях и относительную плотность одного газа по отношению к другому газу. Плотность обозначается буквой 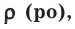 её единица
её единица
измерения – 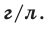
Нормальные условия означают: температура 0°С, 1 атм давления 1атм — 101,3 кПа
Для вычисления плотности какого-либо газа X в нормальных условиях (н.у.), следует его молярную массу разделить на молярный объем:
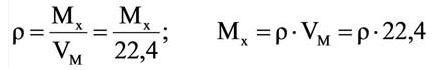
Например, вычислим плотности кислорода и углекислого газа при нормальных условиях:
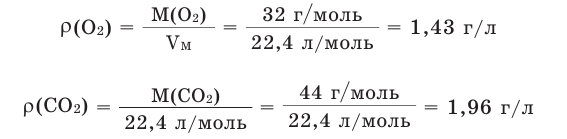
Плотность твёрдых и жидких веществ при н.у. вычисляется по формуле 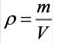 .
.
Для того, чтобы определить, масса какого из газов с одинаковыми объемами и при одинаковых условиях бывает тяжелее, пользуются понятием относительной плотности. Отношение плотностей различных газов при одинаковых условиях равно отношению их молярных масс. Относительная плотность обозначается буквой D и не имеет единицы измерения. Формула относительной плотности следующая:
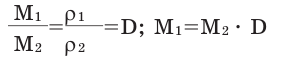
Относительную плотность газов в большинстве случаев вычисляют по самому легкому газу – водороду и воздуху:
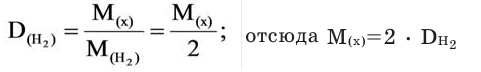
В таком случае, относительная плотность углекислого газа по водороду вычисляется следующим образом:
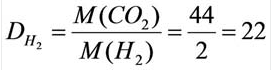
Так как средняя молярная масса воздуха, состоящего из смеси газов, примерно равна 29 г/моль, то формула его относительной плотности следующая:
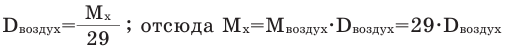
Способы вычисления средней молярной массы газовой смеси

Здесь: 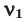 и
и 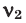 количество молей газов,
количество молей газов, 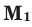 и
и 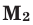 – молярные массы газов,
– молярные массы газов,  и
и 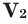 – объем газов в н.у., (
– объем газов в н.у., (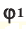 и
и 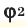 – доля газов в объеме газовой смеси.
– доля газов в объеме газовой смеси.
Среднюю молярную массу 1 моля смеси из двух различных газов можно вычислить по следующей формуле: 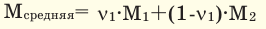 .
.
При смешивании газов с одинаковыми молярными массами, которые при одинаковом давлении не вступают друг с другом в реакцию, плотность газовой смеси (при н.у.), а также их средняя молярная масса остаются неизменными. Например, при смешивании 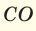 и
и 
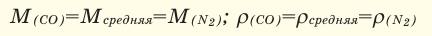
При смешивании газов с различными молярными массами, при одинаковом давлении, средняя молярная масса (при н.у.) и плотность полученной газовой смеси приобретают значение между молярными массами и плотностями смешиваемых газов. Например, при смешивании 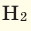 и
и 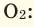
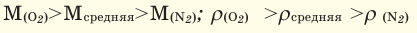
При добавлении газа с большей молярной массой в тот или иной газ при постоянном давлении плотность газовой смеси увеличивается, а при добавлении газа с меньшей молярной массой — уменьшается.
Закон объемных отношений
В химических реакциях соотношение объемов, вступающих в реакцию, и полученных газов равно соотношению их коэффициентов. Например:
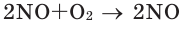 (объёмное соотношение 2:1:2)
(объёмное соотношение 2:1:2)
Численное соотношение объемов, молей и молекул газов равно друг другу.
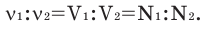
Можно производить следующие вычисления по смесям:
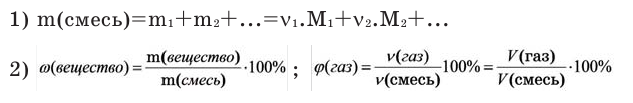
3) Массовое соотношение двух газов: 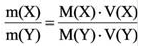
- Физические и химические явления
- Растворы в химии
- Периодический закон Д. И. Менделеева
- Химические связи
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
- Химическая формула
- Относительная атомная и относительная молекулярная масса
Команда “Газы!” была объявлена еще две недели назад. И что?! Легкие задачи порешали и расслабились?! Или вы думаете, что задачи на газы касаются только 28-х заданий ЕГЭ?! Как бы не так! Если газов пока еще не было в 34-х заданиях, это ничего не значит! Задач на электролиз тоже не было в ЕГЭ до 2018 года. А потом как врезали, мама не горюй! Обязательно прочитайте мою статью “Тайны задач по химии? Тяжело в учении – легко в бою!”. В этой статье очень подробно рассказывается о новых фишках на электролиз. Статья вызвала шквал самых разных эмоций у преподавателей химии. До сих пор мне и пишут, и звонят, и благодарят, и бьются в конвульсиях. Просто цирк с конями, в котором я – зритель в первом ряду.
Однако, вернемся к нашим баранам, вернее, Газам. Я прошла через огонь и воду вступительных экзаменов и знаю точно – хочешь завалить абитуриента, дай ему задачу на Газы. Почитайте на досуге сборник задач И.Ю. Белавина. Я процитирую одну такую “мозгобойню”, чтобы вам жизнь медом не казалась. Попробуйте решить.
И.Ю. Белавин, 2005, задача 229
“Два из трех газов (сероводород, водород и кислород) смешали и получили газовую смесь, плотность которой оказалась равной плотности оставшегося газа. Полученную газовую смесь вместе с равным ей объемом третьего газа под давлением поместили в замкнутый сосуд емкостью 4 л, содержавший азот при н.у. и нагревали при 600 С до окончания химических реакций, затем постепенно охладили. Определите массы веществ, содержавшихся в сосуде после охлаждения, если плотность газовой смеси в сосуде перед нагреванием равнялась 9,25г/л. (Ответ: m(S) = 7,5 г, m(SO2) = 15 г, m(Н2О) = 9 г)”
Ну как, решили? Нет?! А ваши репетиторы?! Извините, это был риторический вопрос. Кстати, мои ученики, абитуриенты 2003-2008 гг. такие задачи щелкали, как семечки, на экзаменах во 2-й медицинский (теперь РНИМУ им. Н.И. Пирогова). Надеюсь, вам понятно, что 34-м задачам ЕГЭ еще есть куда усложняться, perfectio interminatus est (нет предела совершенству), с газами нужно работать, работать и работать. Поэтому команду “Газы!” отменять рано. Итак, поехали!
Сегодня мы поговорим о газовых смесях, затронем понятие плотности газа (абсолютной и относительной), средней молярной массы, решим задачи: определение средней молярной массы и плотности газа по компонентам смеси и наоборот.
• Газовая смесь – смесь отдельных газов НЕ вступающих между собой в химические реакции. К смесям газов относятся: воздух (состоит из азота, кислорода, углекислого газа, водяного пара и др.), природный газ (смесь предельных и непредельных углеводородов, оксида углерода, водорода, сероводорода, азота, кислорода, углекислого газа и др.), дымовые газы (содержат азот, углекислый газ, пары воды, сернистый газ и др.) и др.
• Объемная доля – отношение объема данного газа к общему объему смеси, показывает, какую часть общего объема смеси занимает данный газ, измеряется в долях единицы или в процентах.
• Мольная доля – отношение количества вещества данного газа к общему количеству вещества смеси газов, измеряется в долях единицы или в процентах.
• Плотность газа (абсолютная) – определяется как отношение массы газа к его объему, единица измерения (г/л). Физический смысл абсолютной плотности газа – масса 1 л, поэтому молярный объем газа (22,4 л при н.у. t° = 0°C, P = 1 атм) имеет массу, численно равную молярной массе.
• Относительная плотность газа (плотность одного газа по другому) – это отношение молярной массы данного газа к молярной массе того газа, по которому она находится
• Средняя молярная масса газа – рассчитывается на основе молярных масс составляющих эту смесь газов и их объемных долей
Настоятельно рекомендую запомнить среднюю молярную массу воздуха Мср(в) = 29 г/моль, в заданиях ЕГЭ часто встречается.
Обязательно посетите страницу моего сайта “Изучаем Х-ОбХ-04. Закон Авогадро. Следствия из закона Авогадро. Нормальные условия. Молярный объем газа. Абсолютная и относительная плотность газа. Закон объемных отношений” и сделайте конспекты по теории. Затем возьмите бумагу и ручку и решайте задачи вместе со мной.
ВАНГУЮ: чует мое сердце, что ЕГЭ по химии 2019 года устроит нам газовую атаку, а противогазы не выдаст!
Задача 1
Определить плотность по азоту газовой смеси, состоящей из 30% кислорода, 20% азота и 50% углекислого газа.
Задача 2
Вычислите плотность по водороду газовой смеси, содержащей 0,4 моль СО2, 0,2 моль азота и 1,4 моль кислорода.
Задача 3
5 л смеси азота и водорода имеют относительную плотность по водороду 12. Определить объем каждого газа в смеси.
Несколько задач со страницы моего сайта
Задача 4
Плотность по водороду пропан-бутановой смеси равна 23,5. Определите объемные доли пропана и бутана
Задача 5
Газообразный алкан объемом 8 л (н.у.) имеет массу 14,28 г. Чему равна его плотность по воздуху
Задача 6
Плотность паров альдегида по метану равна 2,75. Определите альдегид
Ну как? Пошло дело? Если туго, вернитесь к задачам и решайте их самостоятельно до тех пор, пока не щелкнет! А для стимуляции – десерт в виде еще одной задачи И.Ю. Белавина на газы. Наслаждайтесь ее решением самостоятельно!
И.Ю. Белавин, 2005, задача 202
“Сосуд емкостью 5,6 л при н.у. заполнили метаном, затем нагрели до высокой температуры, в результате чего произошло частичное разложение метана. Определите массу образовавшейся сажи, если известно, что после приведения к нормальным условиям объем полученной газовой смеси оказался в 1,6 раза больше объема исходного метана, эта газовая смесь обесцвечивает бромную воду и имеет плотность по воздуху 0,2931. (Ответ: m(C) = 0,6 г)”
Задачи И.Ю. Белавина – это крутой драйв! Попробуйте порешать, и вы откажетесь от просмотра любых ужастиков, поскольку запасетесь адреналином надолго! Но нам нужно спуститься на землю к ЕГЭ, простому и надежному, как первый советский трактор. Кстати, у меня в коллекции припасено немало сюрпризов с газовыми фишками, собранными за все годы работы и бережно хранимыми. Думаю, пришло время сказать им: “И снова здравствуйте!”, поскольку ЕГЭ с каждым годом становится “все чудесатее и чудесатее”. Но это уже совсем другая история. Читайте мои статьи – и вы подстелите соломку под свою ЕГЭшную попу.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Позвоните мне +7(903)186-74-55, приходите ко мне на курс, на бесплатные Мастер-классы “Решение задач по химии”. Я с удовольствием вам помогу.
Репетитор по химии и биологии кбн В.Богунова
Задачи на атомистику — это задачи на соотношения частиц (атомов, молекул, ионов и т.д.) в гомогенных и гетерогенных системах (растворах, твердых и газообразных смесях). Это могут быть массовые соотношения (например, массовая доля элемента в смеси), мольные соотношения (например, соотношение числа атомов водорода и кислорода или мольная доля), объемные соотношения (объемная доля и др.).
Ниже я выкладываю задачи на атомистику из реального ЕГЭ по химии 16 июля 2020 года.
Для решения задач на атомистику используются довольно простые идеи. Во-первых, понятие массовой доли. Во-вторых, умение выражать число атомов через число молекул или других структурных единиц.
Например, в молекуле триоксида серы SO3 на 1 молекулу приходится один атом серы и три атома кислорода:
1 молекула SO3 — 1 атом серы, 3 атома кислорода
Несложно пропорцией определить, что на две молекулы триоксида серы будет приходиться два атома серы и шесть атомов кислорода:
2 молекулы SO3 — 2 атома S, 6 атомов О
На 20 молекул триоксида:
20 молекул SO3 — 20 атомов S, 60 атомов О
А вот сколько атомов приходится на х молекуле триоксида? Это также легко определить через пропорцию:
х молекул SO3 — х атомов S, 3х атомов О
Иначе говоря, количество атомов кислорода в молекуле SO3 в три раза больше, чем количество молекул. А количество атомов серы равно количеству молекул триоксида серы. Это простая, но не всегда очевидная идея. То есть индексы в формуле вещества показывают не только, как соотносится количество атомов между собой, но и какое число атомов приходится на 1 молекулу или другую структурную единицу вещества.
Если так соотносится число атомов и молекул, то также будет соотноситься и количество вещества атомов и молекул, выраженное в молях. Потому что 1 моль — это не что иное, как порция, состоящая из одинакового числа данных частиц.
То есть на х моль триоксида серы приходится:
х моль SO3 — х моль атомов S, 3х моль атомов О
Представьте себе, что атомы — это элементы изделия, а молекула состоит из некоторого числа таких деталей. Таким образом, число деталей разного типа всегда больше или равно числа изделий. Получается, в молекуле число атомов всегда больше или равно, чем количество молекул.
И наоборот, число молекуле триоксида серы в 3 раза меньше, чем число атомов кислорода в составе SO3. И число молекул равно количеству атомов серы.
Например, на х моль атомов серы приходится х моль молекул SO3.
Еще одно понятие, которое пригодится при решении задач на атомистику — молярное соотношение веществ.
Молярное соотношение — это отношение количества одного вещества к количеству другого вещества.
Например, молярное соотношение хлорида натрия и воды в растворе составляет 1 к 20, или 0,05:
n(NaCl)/ n(H2O) = 1/20 = 0,5
Молярное соотношение можно задавать отдельным числом, а можно соотношением:
n(NaCl) : n(H2O) = 1:20
А вот выражать молярное соотношение через проценты нельзя. Это безразмерная величина.
Научиться решать задачи на атомистику не очень сложно. В ЕГЭ по химии атомистика станет, скорее всего, лишь частью более сложной комплексной задачи 34. Но я бы рекомендовал не пытаться сразу решать задачи на атомистику уровня ЕГЭ по химии. Занимаясь в спортзале, вы же не пытаетесь на первой тренировке поднять сразу тяжелую штангу. Точнее, попытаться вы можете, но последствия будут плачевными.
Для начала сделайте разминку возьмите простые задачи, чтобы освоить основные приемы и понять логику решения таких заданий. А после легких задач можно постепенно перейти к более сложным. Именно в таком порядке и расположены задачи в данной подборке «Атомистика», которые позволяют понять, как именно удобно работать с такими заданиями.
Публикую подборку задач, в которых используются идеи атомистики. Все задачи взяты из сборника С.А. Пузакова, В.А. Попкова «Пособие по химии. Вопросы. Упражнения. Задачи». В скобках я привожу нумерацию этих задач в задачнике.
1. (66) В смеси оксида меди (I) и оксида меди (II) на 4 атома меди приходится 3 атома кислорода. Вычислите массовые доли веществ в такой смеси.
Пусть n (количество вещества) (Cu2O) = х моль, n(CuO) = y моль, тогда:
количество вещества атомов меди в первом оксиде n1(Cu) = 2х моль, во втором оксиде: n2(Cu) = у моль
количество вещества атомов кислорода в первом оксиде n1(О) = х моль, во втором оксиде: n2(О) = у моль
общее количество вещества атомов меди: n(Cu) = (2x + y) моль, атомов кислорода: n(O) = (x + y) моль.
По условию задачи их отношение равно как 4 : 3, т. е. (2x + y) / (x + y) = 4 / 3.
Преобразуем приведённое выше равенство, получаем y = 2x.
Выразим через х массы соединений:
m(Cu2O) = n(Cu2O) * M(Cu2O) = (144x) г;
m(CuO) = n(CuO) * M(CuO) = 80 * у = 80 * 2x = (160x) г
Масса смеси двух оксидов будет равна:
m(смеси) = (144x + 160x) г = (304x) г
Теперь рассчитываем массовую долю оксидов в смеси:
ω(Cu2O) = m(Cu2O) / m(смеси) = 144x / 304x = 0.4737 (47.37%)
ω(CuO) = m(CuO) / m(смеси) = 160x / 304x = 0.5263 (52.63%)
Ответ: ω(CuO) = 52,6%, ω(Cu2O) = 47,4%
2. (67) В смеси двух хлоридов железа на 5 атомов железа приходится 13 атомов хлора. Вычислите массовые доли веществ в такой смеси.
Железо образует два устойчивых хлорида: FeCl2 и FeCl3.
Пусть n(FeCl2) = х моль, n(FeCl3) = y моль, тогда:
количество вещества атомов железа в первом хлориде n1(Fe) = х моль, во втором хлориде: n2(Fe) = у моль,
количество вещества атомов хлора в первом хлориде n1(Cl) = 2х моль, во втором хлориде: n2(Сl) = 3у моль,
общее количество вещества атомов железа: n(Fe) = (x + y) моль, атомов хлора: n(Cl) = (2x + 3y) моль.
По условию задачи их отношение равно как 5 : 13, т. е. (x + y) / (2x + 3y) = 5 / 13.
Преобразуя приведённое выше равенство, получаем y = 1,5x.
Выразим через х массы соединений:
m(FeCl2) = n(FeCl2) * M(FeCl2) = (127x) г;
m(FeCl3) = n(FeCl3) * M(FeCl3) = 162,5 * у = 162,5 * 1,5x = (243,75x) г
Масса смеси двух хлоридов будет равна:
m(смеси) = (127x + 243,75x) г = (370,75x) г
Теперь рассчитываем массовую долю хлоридов в смеси:
ω(FeCl2) = m(FeCl2) / m(смеси) = 127x / 370,75x = 0,343 (34,3%)
ω(FeCl3) = m(FeCl3) / m(смеси) = 243,75x / 370,75x = 0,657 (65,7%)
Ответ: ω(FeCl2) = 34,3%, ω(FeCl3) = 65,7%
3. (70) В каком молярном соотношении были смешаны карбид кальция и карбонат кальция, если массовая доля углерода в полученной смеси равна 25%?
Формулы карбида и карбоната кальция: CaC2 и CaCO3.
Пусть n(CaC2) = х моль, n(CaCO3) = y моль, тогда:
количество вещества атомов углерода в карбиде кальция n1(С) = 2х моль, в карбонате: n2(С) = у моль,
общее количество вещества атомов углерода: n(С) = (2x + y) моль.
масса атомов углерода: m(С) = 12(2x + y) г.
Выразим через х массы соединений:
m(CaC2) = n(CaC2) * M(CaC2) = (64x) г;
m(CaCO3) = n(CaCO3) * M(CaCO3) = 100у г
Масса смеси двух веществ будет равна:
m(смеси) = (64x + 100у) г
Теперь записываем выражение для массовой доли атомов углерода в смеси:
ω(C) = m(C) / m(смеси)
0,25 = 12(2x + y) / (64x + 100у)
Преобразуем выражение, выражаем х через у:
х = 1,625у
Это и есть искомое молярное соотношение карбида кальция и карбоната кальция:
n(CaC2)/ n(CaCO3) = х/у = 1,625
Ответ: n(CaC2)/ n(CaCO3) = 1,625
4. (71) В каком молярном соотношении были смешаны гидросульфит натрия и гидросульфид натрия, если массовая доля серы в полученной смеси равна 45%?
Ответ: n(NaHS)/ n(NaHSO3) = 2,18
5. (72) Какую массу сульфата калия следует добавить к 5,5г сульфида калия, чтобы в полученной смеси массовая доля серы стала равной 20%?
6. (73) В смеси нитрата аммония и нитрата свинца (II) массовая доля азота равна 25%. Вычислите массовую долю свинца в этой смеси.
7. (74) В смеси нитрата аммония и нитрата бария массовая доля азота равна 30%. Вычислите массовую долю нитрат-ионов в смеси.
8. (75) В смеси двух оксидов углерода на 5 атомов углерода приходится 7 атомов кислорода. Вычислите объемную долю более тяжелого оксида в этой смеси
9. (619) Через 13,1 г смеси бромида калия и йодида калия, в которой массовая доля брома равна 24,5%, пропустили смесь хлора и брома, в результате чего получилась смесь двух солей, в которой массовая доля брома равна 57%. Вычислите массу смеси галогенов, вступившую в реакцию.
Масса брома в исходной смеси равна:
m(Br) = mсмеси·ω(Br) = 13,1·0,245 = 3,21 г
Количество вещества атомов брома:
n(Br) = m/M = 3,21 г/80 г/моль = 0,04 моль
Количество вещества бромида калия:
n(KBr) = n(Br) = 0,04 моль
Масса этого образца бромида калия:
m(KBr) = n·M = 0.04 моль·119 г/моль = 4,77 г
Масса йодида калия:
m(KI) = m(смеси) — m(KBr) =13,1 — 4,77 = 8,33 г
Количество вещества йодида калия:
n(KI) = m/M = 8,33 г/166 г/моль = 0,05 моль
По условию задачи, смесь йодида калия и бромида калия вступила в реакцию не полностью, но в конечной смеси осталось только две соли. При этом йодид калия, скорее всего, вступил в реакцию полностью, так как иначе конечная смесь будет содержать более двух солей.
Предположим, что сначала прореагируют наиболее активные окислитель и восстановитель — йодид калия и хлор:
2KI + Cl2 = 2KCl + I2
Если весь йодид калия вступил в эту реакцию, то в конечной смеси присутствуют только исходный бромид калия и образовавшийся хлорид калия. Количество хлорида калия:
n(KCl) = n(KI) = 0,05 моль
m(KCl) = n·M = 0,05 моль·74,5 г/моль = 37,25 г
Массовая доля брома в такой смеси:
ω(Br) = m(Br) / m(смеси) = 3,21 г / (3,725 г + 4,77) = 0,378 или 37,8%, что не соответствует условию задачи.
Следовательно, йодид калия реагирует не только с хлором, но и с бромом:
2KI + Cl2 = 2KCl + I2
2KI + Br2 = 2KBr + I2
Пусть с хлором прореагировало х моль йодида калия, тогда с бромом 0,05-х моль
Тогда образуется х моль хлорида калия и 0,05-х моль бромида калия.
Масса образовавшегося хлорида калия:
m(KCl) = n·M = x моль·74,5 г/моль = 74,5x г
Бромида калия:
m2(KBr) = n·M = (0,05-х) моль·119 г/моль = (5,95 — 119x) г
Масса конечной смеси солей:
mсмеси = mисх(KBr) + m2(KBr) + m(KCl) = 4,77 г + (5,95 — 119x) г + 74.5х = (10,72 — 44,5х) г
Количество атомов брома в конечной смеси:
n(Br) = 0,04 моль + (0,05 — х) моль = (0,09 — х) моль
Масса атомов брома:
m(Br) = n·M = (0,09 — х) моль·80 г/моль = (7,2 — 80х) г
Массовая доля брома в конечной смеси:
ω(Br) = (7,2 — 80х) / (10,72 — 44,5х) = 0,57
Решаем полученное уравнение, находим х:
х = 0,02 моль
Количество вещества и масса хлора, который вступил в первую реакцию:
n(Cl2) = 0,5х = 0,5·0,02 = 0,01 моль
m(Cl2) = n·M = 0,01·71 г/моль = 0,71 г
Количество вещества брома, который вступил во вторую реакцию:
n(Br2) = n·M = 0,5(0,05 — 0,02) моль = 0,015 моль
Масса брома:
m(Br2) = n·M =0,015 моль·160 г/моль = 2,4 г
Масса смеси галогенов, которые прореагировали с йодидом калия:
m(смеси) = m(Cl2) + m(Br2) = 0,71 г + 2,4 г = 3,11 г
Ответ: 3,11 г
10. (620) Через смесь натрия и бромида калия, в которой массовая доля брома равна 60%, пропустили хлор, в результате чего масса брома в смеси солей оказалась в 2 раза меньше, чем в исходной смеси. Вычислите массовую долю брома в полученной смеси солей.
Примем массу исходной смеси за 100 г, тогда масса брома в исходной смеси равна:
m(Br) = mсмеси·ω(Br) = 100·0,6 = 60 г
Количество вещества атомов брома:
n(Br) = m/M = 60 г/80 г/моль = 0,75 моль
Количество вещества бромида калия:
n(KBr) = n(Br) = 0,75 моль
Масса этого образца бромида калия:
m(KBr) = n·M = 0,75 моль·119 г/моль = 89,25 г
Масса натрия:
m(Na) = m(смеси) — m(KBr) =100 — 89,25 = 10,75 г
Количество вещества натрия:
n(Na) = m/M = 10,75 г/23 г/моль = 0,467 моль
Поскольку масса брома в смеси уменьшилась в два раза, в реакцию вступила половина исходного бромида калия, то есть 0,375 моль KBr. При этом натрий прореагировал полностью, так как, по условию, образовалась смесь солей:
2Na + Cl2 = 2NaCl
2KBr + Cl2 = 2KCl + Br2
В первой реакции образовался хлорид натрия:
n(NaCl) = n(Na) = 0,467 моль
m(NaCl) = n·M = 0,467 моль ·58,5 г/моль = 27,32 г
Во второй образовался хлорид калия:
n(KCl) = 0,5·n(KBr) = 0,375 моль
m(KCl) = n·M = 0,375 моль ·74,5 г/моль = 27,94 г
И остался бромид калия:
mост(KBr) = n·M = 0,375 моль ·74,5 г/моль = 44,625 г
В конечной смеси масса брома равна:
mост(Br) = n·M = 0,375 моль ·80 г/моль = 30 г
Масса конечной смеси:
mсм = mост(KBr) + m(KCl) + m(NaCl) = 44,625 г + 27,94 г + 27,32 г = 99,89 г
Массовая доля брома в конечной смеси солей:
ω(Br) = mост(Br)=/mсм = 30 г/99,89 г = 0,30 или 30%
Ответ: ω(Br) = 30%
11. (621) К смеси калия и иодида натрия, в которой массовая доля калия равна 40%, добавили бром, в результате чего масса йода в полученной смеси солей уменьшилась в 5 раз по сравнению с исходной. Вычислите массовую долю йода в полученной смеси солей.
12. (827) Аммиак, образовавшийся при гидролизе смеси нитрида кальция и нитрида лития, в которой массовая доля азота равнялась 30%, пропустили через 80 мл бромоводородной кислоты. В результате реакции молярная концентрация кислоты уменьшилась с 2,8 до 1,2 моль/л (изменением объема раствора за счет поглощения газа пренебречь). Вычислите массу исходного образца смеси нитридов.
13. (828) К 1,59%-му раствору карбоната натрия добавили по каплям 40 г 3,78%-го раствора азотной кислоты; в результате в образовавшемся растворе число атомов азота оказалось в 2 раза больше числа атомов углерода. Вычислите массовые доли веществ в получившемся растворе.
Ответ: 1,28% NaNO3, 0,631 NaHCO3.
14. (855)Через 15 г 9,45%-го раствора азотной кислоты пропустили аммиак; в результате в образовавшемся растворе массовая доля азота оказалась равной 3,5%. Вычислите массовые доли веществ в образовавшемся растворе.
Ответ: 2,82% HNO3, 8,21% NH4NO3.
15. (951) К смеси фосфата натрия, дигидрофосфата натрия и гидрофосфата натрия общей массой 15 г (молярное соотношение солей в порядке перечисления 3:2:1) добавили 100 г 4%-го раствора гидроксида натрия. Установите количественный состав раствора (в массовых долях).
Ответ: w(Na3PO4) = 14,7%, w(NaOH) = 34,3%.
16. (952) К 2 г смеси гидрофосфата калия и дигидрофосфата калия, в которой массовая доля фосфора равна 20%, добавили 20 г 2%-го раствора фосфорной кислоты. Вычислите массовые доли всех веществ в получившемся растворе.
Ответ: w(KH2PO4) = 9,05%, w(K2HPO4) = 1,87%.
17. (992) В смеси карбида алюминия и карбида кальция число атомов алюминия равно числу атомов кальция. При гидролизе этой смеси выделяется 1,12 л (н.у.) смеси газов. Вычислите массу исходной смеси карбидов.
18. (1007) Смесь карбоната стронция и гидрокарбоната аммония общей массой 12 г, в которой масса атомов углерода в 12 раз больше массы атомов водорода, добавили к избытку 10%-го раствора серной кислоты. Вычислите массу выпавшего осадка и объем выделившегося газа (н.у.)
19. (1009) Какой объем газа (н.у.) выделится при добавлении к 20 г 20%-го раствора серной кислоты 20 г смеси карбоната калия и гидрокарбоната натрия с одинаковым числом атомов калия и водорода?
20. (1021) В смеси сульфита кальция и гидрокарбоната кальция число атомов кальция в 6 раз больше числа атомов серы. Вычислите плотность по воздуху газовой смеси, образующейся при обработке этой смеси избытком разбавленного раствора серной кислоты.
21. (1059) Массовая доля калия в растворе, содержащем силикат калия и сульфат калия, равна 0,909%, а масса серы равна массе кремния. К этому раствору добавили в 4 раза меньшую массу соляной кислоты с массовой долей хлороводорода 1,46%. Вычислите, во сколько раз масса серы оказалась больше массы кремния в образовавшемся растворе.
22. (1162) Смесь натрия с другим щелочным металлом поместили в воду. По окончании реакции воду полностью испарили. Массовая доля кислорода в полученной смеси веществ оказалась равной 50%. Вычислите массовые доли веществ в полученной смеси.
Ответ: w(NaOH) =62,5%, w(LiOH) = 37,5%
23. (1215) В смеси оксида ванадия (V) и оксида ванадия (III) массовая доля кислорода равна 40%. Какое количество вещества алюминия понадобится для полного восстановления ванадия из 100 г этой смеси?
Задача на атомистику, которую составители ЕГЭ по химии рекомендовали к прорешиванию:
24. Некоторое количество смеси гидрата дигидрофосфата калия и дигидрата гидрофосфата калия с равными массовыми долями веществ растворили в воде, которую взяли в 10 раз больше по массе, чем смеси. Сколько атомов кислорода приходится на один атом фосфора в полученном растворе? (104)
Гидрат дигидрофосфата калия: KH2PO4·H2O
Дигидрат гидрофосфата калия: K2HPO4·2H2O
Пусть количество вещества гидрата дигидрофосфата калия равно х моль, а дигидрата гидрофосфата — у моль.
Масса кристаллогидратов:
m(KH2PO4·H2O) = n·M = 154x г
m(K2HPO4·2H2O) = n·M = 210у г
Поскольку массовые доли кристаллогидратов в исходной смеси равны, массы кристаллогидратов также равны:
m(KH2PO4·H2O) = m(K2HPO4·2H2O)
154х = 210у
Отсюда: х = 1,364у
Масса исходной смеси:
mсм = m(KH2PO4·H2O) + m(K2HPO4·2H2O) = 154x + 210у = 154·1,364у + 210у = 420,056·y г
Количество чистых солей в составе кристаллогидратов:
n(KH2PO4·H2O) = n(KH2PO4) = x моль = 1,36·у моль
n(K2HPO4·2H2O) = n(K2HPO4) = у моль
Масса добавленной воды отличается в 10 раз от массы смеси солей:
m(H2O) = 10mсм = 10·420,056·у = 4200,56у г
Количество вещества добавленной воды:
n(H2O) = 4200,56·у/18 = 233,36·у моль
Определим количество атомов кислорода и фосфора:
в гидрате дигидрофосфата калия KH2PO4·H2O: n1(O) = 5x = 6,82·у моль n(Р) = 1,364·у моль
в дигидрате гидрофосфата калия K2HPO4·2H2O:
n2(O) = 6·у моль = 6·у моль
n(Р) = у моль = у моль
в добавленной воде: n3(O) = 233,36у моль
Общее количество атомов кислорода: n(O) = 233,36у + 6,82у + 6у = 246,18 моль
Атомов фосфора: n(Р) = у + 1,364у = 2,363у моль
Отношение числа атомов кислорода к числу атомов фосфора равно:
246,18х/2,364х ≈ 104
Ответ: n(O)/n(Р) = 104
24. Некоторое количество смеси гидрата дигидрофосфата калия и дигидрата гидрофосфата калия с равными массовыми долями веществ растворили в воде, которую взяли в 10 раз больше по массе, чем смеси. Сколько атомов кислорода приходится на один атом фосфора в полученном растворе? (104)
Гидрат дигидрофосфата калия: KH2PO4·H2O
Дигидрат гидрофосфата калия: K2HPO4·2H2O
Пусть количество вещества гидрата дигидрофосфата калия равно х моль, а дигидрата гидрофосфата — у моль.
Масса кристаллогидратов:
m(KH2PO4·H2O) = n·M = 154x г
m(K2HPO4·2H2O) = n·M = 210у г
Поскольку массовые доли кристаллогидратов в исходной смеси равны, массы кристаллогидратов также равны:
m(KH2PO4·H2O) = m(K2HPO4·2H2O)
154х = 210у
Отсюда: х = 1,364у
Масса исходной смеси:
mсм = m(KH2PO4·H2O) + m(K2HPO4·2H2O) = 154x + 210у = 154·1,364у + 210у = 420,056·y г
Количество чистых солей в составе кристаллогидратов:
n(KH2PO4·H2O) = n(KH2PO4) = x моль = 1,36·у моль
n(K2HPO4·2H2O) = n(K2HPO4) = у моль
Масса добавленной воды отличается в 10 раз от массы смеси солей:
m(H2O) = 10mсм = 10·420,056·у = 4200,56у г
Количество вещества добавленной воды:
n(H2O) = 4200,56·у/18 = 233,36·у моль
Определим количество атомов кислорода и фосфора:
в гидрате дигидрофосфата калия KH2PO4·H2O: n1(O) = 5x = 6,82·у моль n(Р) = 1,364·у моль
в дигидрате гидрофосфата калия K2HPO4·2H2O:
n2(O) = 6·у моль = 6·у моль
n(Р) = у моль = у моль
в добавленной воде: n3(O) = 233,36у моль
Общее количество атомов кислорода: n(O) = 233,36у + 6,82у + 6у = 246,18 моль
Атомов фосфора: n(Р) = у + 1,364у = 2,363у моль
Отношение числа атомов кислорода к числу атомов фосфора равно:
246,18х/2,364х ≈ 104
Ответ: n(O)/n(Р) = 104
Задачи на атомистику из реального ЕГЭ по химии 16 июля 2020 года
1. В смеси оксида магния и фосфида магния массовая доля атомов магния равна 54,4%. Они полностью прореагировала с соляной кислотой массой 365 г 34-% раствора. К полученному раствору добавили раствор фторида калия массой 232 грамма 30-% раствора. Найти массовую долю хлорида калия в конечном растворе.
2. Взяли смесь оксида кальция и карбоната кальция. Массовая доля кальция в смеси 50%. Смесь растворили в 300 г раствора избытка соляной кислоты. Выделившийся газ полностью прореагировал с раствором гидроксида натрия массой 200г и массовой долей 8%. Вычислите массовую долю образовавшейся соли.
3. Взяли смесь Cu и CuO . Массовая доля меди в смеси 96%. Полученную смесь растворили в концентрированной серной кислоте массой 496 г, взятой в избытке. Полученный газ растворили в необходимом количестве раствора гидроксида натрия массой 200 г и массовой долей 10%. Найдите массовую долю соли в растворе после растворения.
4. Смесь из оксида и сульфида алюминия, где массовая доля алюминия 50%, залили 700 г, раствора соляной кислоты, взятой в избытке. Выделившийся газ полностью поглотили 240 г 20% раствора сульфата меди. Вычислите концентрацию соли после того, как залили соляную кислоту.
5. Смесь оксида кальция и карбоната кальция с массовой долей кальция 62,5% растворили в 300 г раствора соляной кислоты. Масса раствора стала 361,6 г. Выделившийся газ пропустили через 80 г 10%-ного раствора гидроксида натрия. Вычислите массовую долю соли в конечном растворе.
Пусть n(CaO) = х моль, n(CaCO3) = y моль, тогда:
количество вещества атомов кальция в оксида n1(Ca) = х моль, в карбонате: n2(Са) = у моль,
общее количество вещества атомов кальция: n(Са) = (x + y) моль.
Масса атомов кальция: m(Ca) = n(Са)·M(Ca) = 40(x + y) г.
Масса оксида кальция: m(CaО) = n(СаО)·M(CaО) = 56x г.
Масса карбоната кальция: m(CaCO3) = n(CaCO3)·M(CaCO3) = 100у г.
Масса смеси: mсм = m(CaО) + m(CaCO3) = (56х + 100у) г
Получаем выражение:
40(x + y)/(56х + 100у) = 0,625
Преобразуя приведённое выше равенство, получаем х = 4,5у.
Далее протекают реакции:
CaO + 2HCl = CaCl2 + H2O
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
Количество образовавшегося углекислого газа n(CO2) = y моль, масса m(CO2) = 44y г.
Запишем уравнение материального баланса для конечного раствора:
mр-ра = m(CaO) + m(CaCO3) + mр-ра(HCl) — m(CO2)
361,6 = 56х + 100у + 300 — 44у
или
61,6 = 56х + 56у
Получаем систему:
х + у = 1,1
х = 4,5у
5,5у = 1,1
у = 0,2 моль, х = 0,9 моль.
Количество углекислого газа: n(CO2) = 0,2 моль, масса m(CO2) = 44·0,2 = 8,8 г.
При взаимодействии углекислого газа с гидроксидом натрия возможно образование средней или кислой соли:
2NaOH + CO2 = Na2CO3 + H2O (1)
NaOH + CO2 = NaHCO3 (2)
Какие продукты образуются, определяется соотношением количества вещества реагентов.
Масса щелочи: m(NaOH) = mр-ра(NaOH) · ω(NaOH) = 80 · 0,1 = 8 г
Количество вещества: n(NaOH) = m(NaOH) / M(NaOH) = 8/40 = 0,2 моль
Соотношение количества вещества реагентов n(NaOH):n(CO2) = 0,2:0,2 = 1:1
Следовательно, протекает только вторая реакция с образованием кислой соли — гидрокарбоната натрия.
n(NaHCO3) = n(CO2) = 0,2 моль
m(NaHCO3) = n(NaHCO3)·M(NaHCO3) = 0,2·84 = 16,8 г
Масса конечного раствора гидрокарбоната:
mр-ра = m(CO2) + mр-ра(NaOH) = 8,8 + 80 = 88,8 г
Массовая доля гидрокарбоната натрия в конечном растворе:
ω(NaHCO3) = m(NaHCO3)/mр-ра = 16,8/88,8 = 0,1892 или 18,92%
Ответ: ω(NaHCO3) = 18,92%
6. Смесь оксида и пероксида натрия, в которой соотношение атомов натрия к атомам кислорода равно 3:2, нагрели с избытком углекислого газа. Полученное вещество растворили в воде. В результате образовалось 600 г раствора. К полученному раствору добавили 229,6 г раствора хлорида железа(III).Найдите массовую долю оксида натрия в исходной смеси, если масса конечного раствора 795 г и массовая доля карбоната натрия в этом растворе 4%.
7. Смесь карбида алюминия и карбида кальция, в которой массовая доля углерода равна 30%, полностью растворили в 547.5 г соляной кислоте. При этом кислота прореагировала без остатка. К образовавшемуся раствору добавили 1260г 8% раствора гидрокарбоната натрия. Найдите массовую долю кислоты в растворе, в котором растворили исходную смесь.
8. В смесь железной окалины и оксида железа(III) добавили 500 г раствора конц. азотной кислоты, причём соотношение атомов железа к атомам кислорода в смеси равно 7:10. Чтобы полностью поглотить выделившийся газ использовали 20 г раствора NaOH с массовой долей 20%.. Найдите массу соли, образовавшейся при добавлении кислоты в смесь.
9. Дана смесь оксида и пероксида бария, в которой число атомов бария относится к числу атомов кислорода как 5:9. Добавили 490 г 20% холодной серной кислоты при этом смесь прореагировала полностью и раствор стал нейтральным. Определить массовую долю воды в полученном растворе.
10. Смесь из оксида лития и нитрида лития с массовой долей атомов лития 56%, смешали с 265 г раствора соляной кислоты с массовой долей 20%. (все вещества полностью прореагировали). После к образовавшемуся раствору добавили 410г 20%- ного фосфата натрия. Найдите массовую долю образовавшегося хлорида натрия.
11. Дан холодный раствор серной кислоты. К нему добавили пероксид бария, при этом вещества прореагировали полностью. В полученном растворе соотношение атомов водорода к кислороду составило 9 к 5. Затем к этому раствору добавили каталитическое количество оксида марганца (IV), в результате масса раствора уменьшилась на 6,4 г. Вычислите массовую долю серной кислоты в исходном растворе.
Холодный раствор серной кислоты реагирует с пероксидом бария без ОВР:
H2SO4 + BaO2 = BaSO4 + H2O2
При этом в растворе присутствует пероксид водорода, а сульфат бария выпадает в осадок.
Пусть n(H2O2) = х моль, n(H2O) = y моль, тогда:
количество вещества атомов водорода в пероксиде n1(H) = 2х моль, в воде: n2(Н) = 2у моль,
количество вещества атомов кислорода в пероксиде n1(О) = 2х моль, в воде: n2(О) = у моль,
общее количество вещества атомов водорода: n(Н) = (2x + 2y) моль,
общее количество вещества атомов кислорода: n(О) = (2x + y) моль.
Получаем соотношение:
(2x + 2y)/(2x + y) = 9/5
Упрощаем его:
у = 8х
При добавлении каталитического количества оксида марганца (IV) пероксид водорода разлагается:
2H2O2 = 2H2O + O2
Пусть весь пероксид водорода разложился, тогда изменение массы раствора равно массе выделившегося газа, то есть массе кислорода:
m(O2) = 6,4 г
n(O2) = m(O2)/M(O2) = 6,4 / 32 = 0,2 моль
Отсюда
n(H2O2) = 2·n(O2) = 2·0,2 = 0,4 моль
х = 0,4 моль
у = 3,2 моль
Отсюда количество вещества серной кислоты с исходном растворе:
n(H2SO4) = n(H2O2) = 0,4 моль
m(H2SO4) = n(H2SO4)·M(H2SO4) = 0,4·98 = 39,2 г
Количество и масса воды не изменялись:
m(H2O) = n(H2O)·M(H2O) = 3,2·18 = 57,6 г
Массовая доля серной кислоты в исходном растворе:
ω(H2SO4) = m(H2SO4)/(m(H2O)+ m(H2SO4)) = 39,2/(39,2 + 57,6) = 0,405 или 40,5%
Ответ: ω(H2SO4) = 40,5%
Задачи на «атомистику» из реального ЕГЭ по химии-2020
- Дан раствор массой 200 г, содержащий хлорид железа(II) и хлорид железа(III). В этом растворе соотношение числа атомов железа к числу атомов хлора равно 3 : 8. Через него пропустили хлор до прекращения реакции. К образовавшемуся раствору добавили раствор гидроксида натрия также до полного завершения реакции. При этом образовалось 526,5 г 20%-ного раствора хлорида натрия. Вычислите массовую долю гидроксида натрия в использованном растворе.
2FeCl2 + Cl2 = 2FeCl3
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
Ответ: w(NaOH) = 18,8%
- Смесь цинка и карбоната цинка, в которой соотношение числа атомов цинка к числу атомов кислорода равно 5 : 6, растворили в 500 г разбавленного раствора серной кислоты. При этом все исходные вещества прореагировали полностью, и выделилось 22,4 л смеси газов (н.у.). К этому раствору добавили 500 г 40%-ного раствора гидроксида натрия. Вычислите массовую долю сульфата натрия в конечном растворе.
Zn + H2SO4 = ZnSO4 + H2
ZnCO3 + H2SO4 = ZnSO4 + H2O + CO2
ZnSO4 + 4NaOH = Na2[Zn(OH)4] + Na2SO4
Ответ: w(Na2SO4) = 13,3%
- Смесь пероксида и оксида бария, в которой соотношение числа атомов бария к числу атомов кислорода равно 5 : 9 растворили в 490 г холодного 20%-ного раствора серной кислоты. При этом соединения бария прореагировали полностью и образовался нейтральный раствор. Вычислите массовую долю воды в образовавшемся растворе.
BaO2 + H2SO4 = BaSO4 + H2O2
BaO + H2SO4 = BaSO4 + H2O
Ответ: w(H2O) = 93,6%
- Смесь оксида и пероксида натрия, в которой соотношение числа атомов натрия к числу атомов кислорода равно 3 : 2, нагрели в избытке углекислого газа. Продукт реакции растворили в воде и получили 600 г раствора. К этому раствору добавили 229,6 г раствора хлорида железа(III). После завершения реакции масса раствора составила 795 г, а массовая доля карбоната натрия в нём – 4%. Вычислите массу оксида натрия в исходной смеси.
Na2O + CO2 = Na2CO3
2Na2O2 + 2CO2 = 2Na2CO3 + O2
3Na2CO3 + 2FeCl3 + 3H2O = 2Fe(OH)3 + 6NaCl + 3CO2
Ответ: m(Na2O) = 24,8 г
- Смесь железной окалины и оксида железа(III), в которой соотношение числа атомов железа к числу атомов кислорода равно 7 : 10, растворили в 500 г концентрированной азотной кислоты, взятой в избытке. Для полного поглощения выделившегося при этом газа потребовалось 20 г 20%-ного раствора гидроксида натрия. Вычислите массовую долю соли в растворе, образовавшемся после растворения оксидов в кислоте.
Fe3O4 + 10HNO3 = 3Fe(NO3)3 + NO2 + 5H2O
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
Ответ: w(Fe(NO3)3) = 30,8%
- Смесь карбида алюминия и карбида кальция, в которой массовая доля атомов углерода равна 30%, полностью растворили в 547,5 г соляной кислоты. При этом соляная кислота прореагировала без остатка. К образовавшемуся раствору добавили 1260 г 8%-ного раствора гидрокарбоната натрия до полного завершения реакции. Вычислите массовую долю кислоты в растворе, в котором растворили исходную смесь.
Al4C3 + 12HCl = 4AlCl3 + 3CH4
CaC2 + 2HCl = CaCl2 + C2H2
AlCl3 + 3NaHCO3 = Al(OH)3 + 3CO2 + 3NaCl
CaCl2 + 2NaHCO3 = CaCO3 + CO2 + H2O + 2NaCl
Ответ: w(HCl) = 8%
- Смесь меди и оксида меди(II), в которой массовая доля атомов меди равна 96%, растворили в 472 г концентрированной серной кислоты, взятой в избытке. Минимальная масса 10%-ного раствора гидроксида натрия, который может прореагировать с выделившимся при этом газом, составляет 200 г. Вычислите массовую долю соли в растворе, образовавшемся после растворения исходной смеси в кислоте.
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2
CuO + H2SO4 = CuSO4 + H2O
SO2 + NaOH = NaHSO3
Ответ: w(CuSO4) = 20%
- Смесь сульфида и оксида алюминия, в которой массовая доля атомов алюминия равна 50%, растворили в 700 г соляной кислоты, взятой в избытке. Для полного поглощения выделившегося при этом газа потребовалось 240 г 20%-ного раствора сульфата меди(II). Вычислите массовую долю соли в растворе, образовавшемся после растворения сульфида и оксида алюминия в кислоте.
Al2S3 + 6HCl = 2AlCl3 + 3H2S
Al2O3 + 6HCl = 2AlCl3 + 3H2O
H2S + CuSO4 = CuS + H2SO4
Ответ: w(AlCl3) = 27,5%
- Смесь карбоната кальция и оксида кальция, в которой массовая доля атомов кальция равна 62,5%, растворили в 300 г соляной кислоты, взятой в избытке. При этом образовался раствор массой 361,6 г. Выделившийся в результате реакции газ полностью поглотился 80 г 10%-ного раствора гидроксида натрия. Вычислите массовую долю соли в растворе, получившемся в результате реакции.
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
CaO + 2HCl = CaCl2 + H2O
CO2 + NaOH = NaHCO3
Ответ: w(NaHCO3) = 18,9%
- Смесь кальция и карбоната кальция, в которой массовая доля атомов кальция равна 50%, растворили в 300 г соляной кислоты, взятой в избытке. При этом образовался раствор массой 330 г. Один из выделившихся в результате реакции газов полностью поглотился 200 г 8%-ного раствора гидроксида натрия. Вычислите массовую долю соли в растворе, получившемся в результате реакции.
Ca + 2HCl = CaCl2 + H2
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
CO2 + NaOH = NaHCO3
Ответ: w(NaHCO3) = 15,4%
- Смесь оксида магния и фосфида магния, в которой массовая доля атомов магния равна 54,4%, растворили в 365 г 34%-ной соляной кислоты. При этом реагирующие вещества вступили в реакцию полностью. К полученному раствору добавили 232 г 30%-ного раствора фторида калия. Вычислите массовую долю хлорида калия в конечном растворе.
MgO + 2HCl = MgCl2 + H2O
Mg3P2 + 6HCl = 3MgCl2 + 2PH3
MgCl2 + 2KF = MgF2 + 2KCl
Ответ: w(KCl) = 14,9%
- Смесь оксида лития и нитрида лития, в которой массовая доля атомов лития равна 56%, растворили в 365 г 20%-ной соляной кислоты. При этом реагирующие вещества вступили в реакцию полностью. К полученному раствору добавили 410 г 20%-ного раствора фосфата натрия. Вычислите массовую долю хлорида натрия в конечном растворе.
Li2O + 2HCl = 2LiCl + H2O
Li3N + 4HCl = 3LiCl + NH4Cl
3LiCl + Na3PO4 = Li3PO4 + 3NaCl
Ответ: w(NaCl) = 11,9%
- В колбу с холодным раствором серной кислоты внесли пероксид бария, при этом оба вещества между собой прореагировали полностью. В образовавшемся растворе соотношение числа атомов водорода и атомов кислорода составило 9 : 5. Затем в колбу добавили каталитическое количество оксида марганца(IV). При этом произошла реакция, в результате которой масса раствора в колбе уменьшилась на 6,4 г. Вычислите массовую долю серной кислоты, которая содержалась в исходном растворе.
BaO2 + H2SO4 = BaSO4 + H2O2
2H2O2 = 2H2O + O2
Ответ: w(H2SO4) = 40,5%
- Железную пластинку полностью растворили в 500 г раствора кислоты. Объем выделившейся смеси оксида азота(II) и оксида азота(IV) составляет 20,16 л (н.у.). В этой смеси соотношение числа атомов кислорода к числу атомов азота равно 5 : 3. Вычислите массовую долю соли в полученном растворе.
Fe + 6HNO3 = Fe(NO3)3 + 3NO2 + 3H2O
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O
Ответ: w(Fe(NO3)3) = 24,6%
- Смесь сульфата железа(II) и сульфата железа(III), в которой соотношение числа атомов железа к числу атомов серы равно 3 : 4, поместили в 126,4 г раствора перманганата калия, подкисленного серной кислотой, с массовой долей перманганата калия 5%. Все вещества, участвующие в окислительно-восстановительной реакции, прореагировали полностью. Вычислите массу 20%-ного раствора гидроксида натрия, который требуется добавить к полученному раствору для полного завершения всех реакций.
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4
MnSO4 + 2NaOH = Mn(OH)2 + Na2SO4
Ответ: m(раствора NaOH) = 376 г
Воронежская
область
Нижнедевицкий
район
МКОУ
«Вязноватовская СОШ имени Пенькова С.В.»
ВЫЧЕСЛЕНИЕ МАССЫ КОМПОНЕНТОВ В СМЕСИ
подготовил:
учитель химии Носов А.В.
В
части С задач по химии в рамках ЕГЭ встречаются задачи разной направленности и
разной степени трудности. Приведем примеры решения задач на взаимодействие
смеси веществ с одним реагентом.
Предлагаю
решение задач словесно-логическим методом. Использование данного метода
развивает в первую очередь логику и помогает решать задачи как по химии, так и
по другим предметам.
Разберем
вариант, когда в смеси взаимодействует с реагентом только один компонент.
Смесь
веществ А и В, массой х, обработали реагентом, при этом выделился газ.
Определить массовые доли компонентов в исходной смеси.
Записываем
уравнение взаимодействия одного из веществ с реагентом.
А
+ Р(реагент) → СД + Г(газ)
Находим
массу газа и записываем над Г. Проводим вспомогательные расчеты. Решаем пропорцию
по нахождению массы А. Затем рассчитываем массовую долю в исходной смеси.
Записываем ответ.
Например(демоверсии по
химии):
1. Определите массовые
доли ( в %) сульфата железа( II)
и сульфида алюминия в смеси, если при обработке 25 г. этой смеси водой
выделился газ, который полностью прореагировал с 960 г 5% раствора сульфата
меди.
Запишем уравнения
реакций:
1)
FeSO4
+ H2O
→ реакция не идет
2)
Al2S3
+ 6H2O → 2Al(OH)3 + 3H2S↑
Определили, что
выделившийся газ H2S.
Определим массу сульфата меди.
|
Дано |
Решение |
|||
|
w(CuSO4)=5% |
Составим пропорцию |
|||
|
m(р-ра)= |
960 – 100% |
|||
|
Найти |
х – 5% |
|||
|
m(CuSO4)-? |
||||
Определим массу газа.
|
Дано |
Решение |
||||||
|
m(CuSO4)=48г. |
х |
48 |
|||||
|
найти |
H2S |
+ CuSO4 |
→ CuS↓ + H2SO4 |
||||
|
m(H2S)-? |
34 |
160 |
|||||
|
Решаем пропорцию по |
|||||||
Решаем второе уравнение:
|
Дано |
Решение |
|||||
|
m(H2S)= |
х |
10,2 |
||||
|
Найти |
Al2S3 |
+ 6H2O → |
3H2S↑ |
|||
|
m(Al2S3)-? |
150 |
102 |
||||
|
Решаем пропорцию по |
||||||
Получаем m(Al2S3)=15г.
Соответственно m(FeSO4)=25-15=10г.
Произведя несложные
расчеты, получаем ответ: w(Al2S3)=60%,
w(FeSO4)=40%.
2.Смесь алюминия и меди
массой 9 г обработали хлороводородной кислотой. После окончания реакции собрали
5,6 л газа. Определите массовую долю (в %) меди в смеси.
Запишем уравнения
реакций:
Cu
+ HCl →
реакция не идет
2Al
+ 6HCl
→ 2AlCl3
+ 3H2
Переведём 5,6 л газа
(водорода) в граммы. Получим 0,5г.
Определим массу алюминия:
|
Дано |
Решение |
|
m(H2)=0.5г |
|
|
найти |
2Al |
|
m(Al)=? |
|
Находим х=4,5
Вычисляем массу m(Cu)=9-4,5=4,5
Соответственно вычисляем
правильный ответ w(Cu)=50%.
Литература:
1.
Лидин Р.А. Полный сборник
задач для школьников и поступающих в вузы /М. : Дрофа. 2007.
2.
Киреев В.А. Курс физической
химии. Изд.3-е, перераб. и доп. М., «Химия»1975г.
3.
Глинка П.Л. Общая химия.
Госхимиздат 1955 г.
