Команда “Газы!” была объявлена еще две недели назад. И что?! Легкие задачи порешали и расслабились?! Или вы думаете, что задачи на газы касаются только 28-х заданий ЕГЭ?! Как бы не так! Если газов пока еще не было в 34-х заданиях, это ничего не значит! Задач на электролиз тоже не было в ЕГЭ до 2018 года. А потом как врезали, мама не горюй! Обязательно прочитайте мою статью “Тайны задач по химии? Тяжело в учении – легко в бою!”. В этой статье очень подробно рассказывается о новых фишках на электролиз. Статья вызвала шквал самых разных эмоций у преподавателей химии. До сих пор мне и пишут, и звонят, и благодарят, и бьются в конвульсиях. Просто цирк с конями, в котором я – зритель в первом ряду.
Однако, вернемся к нашим баранам, вернее, Газам. Я прошла через огонь и воду вступительных экзаменов и знаю точно – хочешь завалить абитуриента, дай ему задачу на Газы. Почитайте на досуге сборник задач И.Ю. Белавина. Я процитирую одну такую “мозгобойню”, чтобы вам жизнь медом не казалась. Попробуйте решить.
И.Ю. Белавин, 2005, задача 229
“Два из трех газов (сероводород, водород и кислород) смешали и получили газовую смесь, плотность которой оказалась равной плотности оставшегося газа. Полученную газовую смесь вместе с равным ей объемом третьего газа под давлением поместили в замкнутый сосуд емкостью 4 л, содержавший азот при н.у. и нагревали при 600 С до окончания химических реакций, затем постепенно охладили. Определите массы веществ, содержавшихся в сосуде после охлаждения, если плотность газовой смеси в сосуде перед нагреванием равнялась 9,25г/л. (Ответ: m(S) = 7,5 г, m(SO2) = 15 г, m(Н2О) = 9 г)”
Ну как, решили? Нет?! А ваши репетиторы?! Извините, это был риторический вопрос. Кстати, мои ученики, абитуриенты 2003-2008 гг. такие задачи щелкали, как семечки, на экзаменах во 2-й медицинский (теперь РНИМУ им. Н.И. Пирогова). Надеюсь, вам понятно, что 34-м задачам ЕГЭ еще есть куда усложняться, perfectio interminatus est (нет предела совершенству), с газами нужно работать, работать и работать. Поэтому команду “Газы!” отменять рано. Итак, поехали!
Сегодня мы поговорим о газовых смесях, затронем понятие плотности газа (абсолютной и относительной), средней молярной массы, решим задачи: определение средней молярной массы и плотности газа по компонентам смеси и наоборот.
• Газовая смесь – смесь отдельных газов НЕ вступающих между собой в химические реакции. К смесям газов относятся: воздух (состоит из азота, кислорода, углекислого газа, водяного пара и др.), природный газ (смесь предельных и непредельных углеводородов, оксида углерода, водорода, сероводорода, азота, кислорода, углекислого газа и др.), дымовые газы (содержат азот, углекислый газ, пары воды, сернистый газ и др.) и др.
• Объемная доля – отношение объема данного газа к общему объему смеси, показывает, какую часть общего объема смеси занимает данный газ, измеряется в долях единицы или в процентах.
• Мольная доля – отношение количества вещества данного газа к общему количеству вещества смеси газов, измеряется в долях единицы или в процентах.
• Плотность газа (абсолютная) – определяется как отношение массы газа к его объему, единица измерения (г/л). Физический смысл абсолютной плотности газа – масса 1 л, поэтому молярный объем газа (22,4 л при н.у. t° = 0°C, P = 1 атм) имеет массу, численно равную молярной массе.
• Относительная плотность газа (плотность одного газа по другому) – это отношение молярной массы данного газа к молярной массе того газа, по которому она находится
• Средняя молярная масса газа – рассчитывается на основе молярных масс составляющих эту смесь газов и их объемных долей
Настоятельно рекомендую запомнить среднюю молярную массу воздуха Мср(в) = 29 г/моль, в заданиях ЕГЭ часто встречается.
Обязательно посетите страницу моего сайта “Изучаем Х-ОбХ-04. Закон Авогадро. Следствия из закона Авогадро. Нормальные условия. Молярный объем газа. Абсолютная и относительная плотность газа. Закон объемных отношений” и сделайте конспекты по теории. Затем возьмите бумагу и ручку и решайте задачи вместе со мной.
ВАНГУЮ: чует мое сердце, что ЕГЭ по химии 2019 года устроит нам газовую атаку, а противогазы не выдаст!
Задача 1
Определить плотность по азоту газовой смеси, состоящей из 30% кислорода, 20% азота и 50% углекислого газа.
Задача 2
Вычислите плотность по водороду газовой смеси, содержащей 0,4 моль СО2, 0,2 моль азота и 1,4 моль кислорода.
Задача 3
5 л смеси азота и водорода имеют относительную плотность по водороду 12. Определить объем каждого газа в смеси.
Несколько задач со страницы моего сайта
Задача 4
Плотность по водороду пропан-бутановой смеси равна 23,5. Определите объемные доли пропана и бутана
Задача 5
Газообразный алкан объемом 8 л (н.у.) имеет массу 14,28 г. Чему равна его плотность по воздуху
Задача 6
Плотность паров альдегида по метану равна 2,75. Определите альдегид
Ну как? Пошло дело? Если туго, вернитесь к задачам и решайте их самостоятельно до тех пор, пока не щелкнет! А для стимуляции – десерт в виде еще одной задачи И.Ю. Белавина на газы. Наслаждайтесь ее решением самостоятельно!
И.Ю. Белавин, 2005, задача 202
“Сосуд емкостью 5,6 л при н.у. заполнили метаном, затем нагрели до высокой температуры, в результате чего произошло частичное разложение метана. Определите массу образовавшейся сажи, если известно, что после приведения к нормальным условиям объем полученной газовой смеси оказался в 1,6 раза больше объема исходного метана, эта газовая смесь обесцвечивает бромную воду и имеет плотность по воздуху 0,2931. (Ответ: m(C) = 0,6 г)”
Задачи И.Ю. Белавина – это крутой драйв! Попробуйте порешать, и вы откажетесь от просмотра любых ужастиков, поскольку запасетесь адреналином надолго! Но нам нужно спуститься на землю к ЕГЭ, простому и надежному, как первый советский трактор. Кстати, у меня в коллекции припасено немало сюрпризов с газовыми фишками, собранными за все годы работы и бережно хранимыми. Думаю, пришло время сказать им: “И снова здравствуйте!”, поскольку ЕГЭ с каждым годом становится “все чудесатее и чудесатее”. Но это уже совсем другая история. Читайте мои статьи – и вы подстелите соломку под свою ЕГЭшную попу.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Позвоните мне +7(903)186-74-55, приходите ко мне на курс, на бесплатные Мастер-классы “Решение задач по химии”. Я с удовольствием вам помогу.
Репетитор по химии и биологии кбн В.Богунова
Содержание:
Количество вещества:
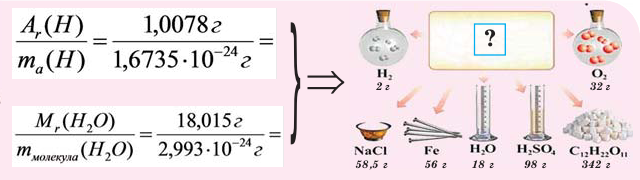
В чём разница между понятиями «масса» и «количество»
Если мы будем производить подобные расчеты, соответствующие этому заданию, для простых веществ, образованных различными элементами, то всякий раз получим одно и то же число — 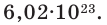
Например, в 1 моле водородного газа содержится  молекул, в 1 моле поваренной соли (NaCI)
молекул, в 1 моле поваренной соли (NaCI)  ионов натрия
ионов натрия 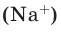 и
и  ионов хлора
ионов хлора 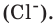
Количество частиц, содержащихся в 1 моле химических веществ (  ), называется постоянной Авогадро (Na). Постоянная Авогадро отличается от числа Авогадро тем, что измеряется определенной единицей
), называется постоянной Авогадро (Na). Постоянная Авогадро отличается от числа Авогадро тем, что измеряется определенной единицей 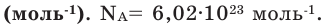
Количество вещества можно вычислить по следующей формуле:
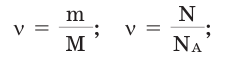
Здесь 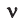 — количество вещества,
— количество вещества, 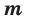 — масса, М — молярная масса, N – заданное количество молекул,
— масса, М — молярная масса, N – заданное количество молекул, 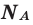 — постоянная Авогадро. Все представленные в формуле величины нам уже известны. Кроме понятия молярной массы. Давайте выясним сущность этого понятия.
— постоянная Авогадро. Все представленные в формуле величины нам уже известны. Кроме понятия молярной массы. Давайте выясним сущность этого понятия.
Молярная масса
Молярной массой называют массу 1 моля вещества, выраженного в граммах. Молярная масса обозначается
буквой М, единицей измерения является г/моль.
При выражении молярной массы вещества в граммах, она численно бывает равна его относительной молекулярной массе (если состоит из молекул). Для сравнения запишем (таблица 1):

Как видно из сравнений, молярная масса веществ по своей единице отличается от относительной молекулярной массы. То есть молярная масса – измеряемая величина.
Как видно из вышесказанного, понятие молярная масса применяется как к химическим элементам, так и к простым и сложным веществам с молекулярным и немолекулярным строением.
На основе количества вещества (моль) можно производить следующие вычисления. Если известно мольное количество вещества:
Закон Авогадро и молярный объём газов
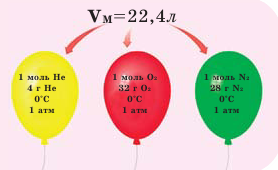
Обратите внимание на рисунки. Почему, несмотря на разные массы газов, они занимают одинаковый объём?
В начале XIX века итальянский ученый Авогадро, проведя наблюдения над свойствами газов в различных условиях и проанализировав открытые прежде законы о газах (Бойля-Мариотта, Гей-Люссака и др.) в 1811 году сформулировал новый закон о газах. Закон Авогадро звучит следующим образом: в равных объемах различных газов при одинаковых условиях (одинаковых температуре и давлении) содержится одинаковое число молекул.

Итальянский ученый. В 1811 году им был открыт закон о газах, который впоследствии был назван его именем.
Мы уже знаем, что 1 моль любого вещества содержит  молекул. Согласно закону Авогадро, можно утверждать, что одинаковое число молекул в 2 г водорода, 32 г кислорода, 28 г азота, 44 г углекислого газа занимает одинаковый объём.
молекул. Согласно закону Авогадро, можно утверждать, что одинаковое число молекул в 2 г водорода, 32 г кислорода, 28 г азота, 44 г углекислого газа занимает одинаковый объём.
Было вычислено, что при нормальных условиях объем 1 моля любого газа или смеси газов составляет примерно 22,4 л. Объем 1 моля газа при нормальных условиях (н.у.) называют молярным объемом данного газа, выраженным знаком 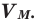 . При измерении объема газа в литрах молярный объём составит
. При измерении объема газа в литрах молярный объём составит 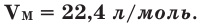 Зависимость между количеством вещества и молярным объёмом газа можно выразить следующей формулой:
Зависимость между количеством вещества и молярным объёмом газа можно выразить следующей формулой:
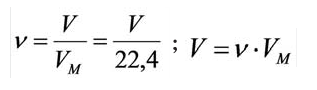
Здесь 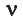 – количество вещества,
– количество вещества, 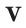 – объём газа,
– объём газа, 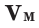 – молярный объем.
– молярный объем.
На основе закона Авогадро и молярного объёма газов можно вычислить плотность газов при нормальных условиях и относительную плотность одного газа по отношению к другому газу. Плотность обозначается буквой 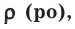 её единица
её единица
измерения – 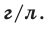
Нормальные условия означают: температура 0°С, 1 атм давления 1атм — 101,3 кПа
Для вычисления плотности какого-либо газа X в нормальных условиях (н.у.), следует его молярную массу разделить на молярный объем:
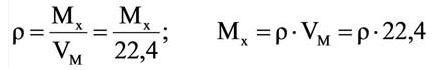
Например, вычислим плотности кислорода и углекислого газа при нормальных условиях:
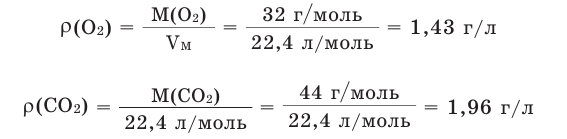
Плотность твёрдых и жидких веществ при н.у. вычисляется по формуле 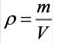 .
.
Для того, чтобы определить, масса какого из газов с одинаковыми объемами и при одинаковых условиях бывает тяжелее, пользуются понятием относительной плотности. Отношение плотностей различных газов при одинаковых условиях равно отношению их молярных масс. Относительная плотность обозначается буквой D и не имеет единицы измерения. Формула относительной плотности следующая:
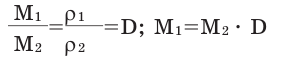
Относительную плотность газов в большинстве случаев вычисляют по самому легкому газу – водороду и воздуху:
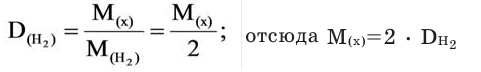
В таком случае, относительная плотность углекислого газа по водороду вычисляется следующим образом:
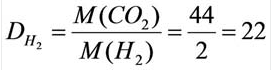
Так как средняя молярная масса воздуха, состоящего из смеси газов, примерно равна 29 г/моль, то формула его относительной плотности следующая:
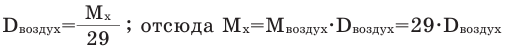
Способы вычисления средней молярной массы газовой смеси

Здесь: 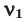 и
и 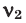 количество молей газов,
количество молей газов, 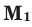 и
и 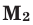 – молярные массы газов,
– молярные массы газов,  и
и 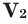 – объем газов в н.у., (
– объем газов в н.у., (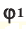 и
и 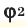 – доля газов в объеме газовой смеси.
– доля газов в объеме газовой смеси.
Среднюю молярную массу 1 моля смеси из двух различных газов можно вычислить по следующей формуле: 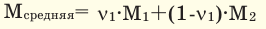 .
.
При смешивании газов с одинаковыми молярными массами, которые при одинаковом давлении не вступают друг с другом в реакцию, плотность газовой смеси (при н.у.), а также их средняя молярная масса остаются неизменными. Например, при смешивании  и
и 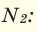
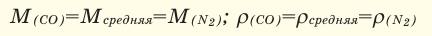
При смешивании газов с различными молярными массами, при одинаковом давлении, средняя молярная масса (при н.у.) и плотность полученной газовой смеси приобретают значение между молярными массами и плотностями смешиваемых газов. Например, при смешивании  и
и 
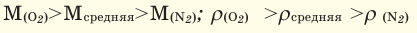
При добавлении газа с большей молярной массой в тот или иной газ при постоянном давлении плотность газовой смеси увеличивается, а при добавлении газа с меньшей молярной массой — уменьшается.
Закон объемных отношений
В химических реакциях соотношение объемов, вступающих в реакцию, и полученных газов равно соотношению их коэффициентов. Например:
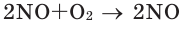 (объёмное соотношение 2:1:2)
(объёмное соотношение 2:1:2)
Численное соотношение объемов, молей и молекул газов равно друг другу.
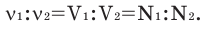
Можно производить следующие вычисления по смесям:
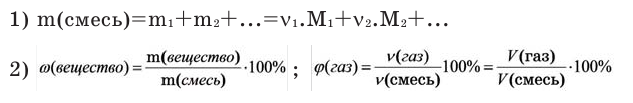
3) Массовое соотношение двух газов: 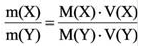
- Физические и химические явления
- Растворы в химии
- Периодический закон Д. И. Менделеева
- Химические связи
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
- Химическая формула
- Относительная атомная и относительная молекулярная масса
В этой статье мы собираемся проанализировать, как найти массу из молей и молярной массы.
Найти массу из молей и молярной массы очень просто. Это можно сделать, используя приведенное ниже соотношение:
Где,

n = количество молей (моль)
m = масса в граммах (г)
M = молярная масса (г/моль)
Мы можем лучше понять это, решив несколько примеров:
Как найти массу из молей и молярной массы Примеры:
1. Рассчитайте массу О2, если молярная масса равна 10.2 моль.
Решение:
Молярная масса = O2 = 16×2 = 32 г/моль
n = 10.2 моль
m = n × M = 10.2 моль × 32 г/моль = 326.4 г
2. На пляже XYZ в песке много минералов. SiO2 был одним из них, который был оценен, и у него было 12.5 молей, так какова масса SiO2 ?
Решение:
Молярная масса = SiO2 = 28 + 16×2 = 60 г.
n = 12.5 моль
m = n × M = 12.5 моль × 60 г/моль = 750 г
3. Рассчитайте массу 7.86 моль Хлорид кальция?
Решение:
Мы знаем, что формула хлорида кальция CaCl2.
Молярная масса = CaCl2 = 40 + 35.45×2 = 110.90 г/моль
n = 7.86 моль
m = n × M = 7.86 моль × 110.90 г/моль = 871.674 г
4. Студент в лаборатории приготовил 6.8 моль KNO3 и использовал его для титрования, поэтому для проведения расчетов какова будет его масса?
Решение:
Молярная масса = KNO3 = 39 + 14 + 3×16 = 110 г/моль
n = 6.8 моль
m = n×M = 6.8 моль × 110 г/моль = 748 г
5. Рассчитайте массу FeCl3 с числом молей, равным 5.7 моля.
Решение:
Молярная масса = FeCl3 = 55.845 +35.453×3 = 162.204 г/моль
n = 5.7 моль
m = n × M = 5.7 × 162.204 = 924.562 г
6. Рассчитайте массу 2.7 молей сульфата бария.
Решение:
Молярная масса = BaSO4 = 137.33 + 32.06 + 64 = 233.39 г/моль
n = 2.7 моль
м = п × М = 2.7 × 233.39 = 630.153 г
7. Рассчитайте массу 3.98 моль хлорида стронция.
Решение:
Молярная масса = SrCl2 = 87.62 + 35.453 + 35.453 = 158.52 г/моль.
n = 3.98 моль
м = п × М = 3.98 × 158.52 = 630.90 г
8. Рассчитайте массу 4.32 моля фосфата аммония.
Решение:
Молярная масса = (NH4)3PO4 = 14.01 × 3 + 12 + 30.97 + 16 = 149.12 г/моль.
n = 4.32 моль
м = п × М = 4.32 × 149.12 = 644.198 г
9. Рассчитайте массу 3.7 молей нитрата магния.
Решение:
Молярная масса = Mg(NO3)2 = 24 + 2×14 + 6×16 = 148 г/моль
n = 3.7 моль
м = п × М = 3.7 × 148 = 547.6 г
10.Рассчитайте массу 4.24 моль гидроксида алюминия.
Решение:
Молярная масса = Al(OH)3 = 27 + 16×3 + 3 = 78 г/моль
n = 4.24 моль
m = n × M = 4.24 × 78 = 330.72 г
11. Рассчитайте массу 1.49 моль йодида свинца (II).
Решение:
Молярная масса = PbI2 = 207.2 + 253.80 = 461 г/моль
n = 1.49 моль
m = n × M = 1.49 × 461 = 686.89 г
12. Рассчитайте массу 5.34 молей карбоната магния.
Решение:
Молярная масса = МгСО3 = 24 +12 + 16×3 =84 г/моль
n = 5.34 моль
m = n×M = 5.34 + 84 = 448.56 г
13.Рассчитайте массу 6.136 молей мышьяковой кислоты.
Решение:
Молярная масса = H3AsO4 = 3 + 74.9 + 3×16 = 141.9 г/моль
n = 6.136 моль
m = n × M = 6.136 × 141.9 = 870.69 г
14. Рассчитайте массу 4.59 моль карбоната лития.
Молярная масса = Li2CO3 = 13.88 + 12 + 3×16 = 73.89 г/моль
n = 4.59 моль
m = n × M = 4.59 × 73.89 = 339.15 г
15. Рассчитайте массу 4.999 молей бытового отбеливателя.
Решение:
Молярная масса = NaOCl = 23 + 16 + 35.4 = 74.4 г/моль
n = 4.999 моль
m = n × M = 4.99 × 74.4 = 371.92 г
16. Рассчитайте массу 2.156 моль дихромата калия.
Решение:
Молярная масса = K2Cr2O7 = 78 + 104 + 112 = 294 г/моль
n = 2.156 моль
m = n × M = 2.156 × 294 = 633.96 г
Узнайте больше о: Как Чтобы найти молярную массу из молярности: подробное объяснение
Как рассчитать молярную массу без массы ?
Обычно наиболее распространенным методом нахождения молярной массы является использование формулы M = m/n, которая подробно обсуждалась в предыдущем разделе.
Используя метод коллигативных свойств, мы можем вычислить молярную массу, не вдаваясь в картину. Давайте проанализируем, как в следующем разделе:
Бензол используется для растворения вещества (неизвестного вещества, молярная масса которого должна быть оценена) и доводится до 1.55 % (% массы неизвестной смеси к бензолу). Температура кипения бензола повышается примерно на 2.3%.
Учитывая коллигативные свойства:
Фактическая температура кипения бензола = 80 градусов по Цельсию.
ΔT = изменение температура кипения (1.84 градуса) 80×0.023
I = Вант-Гофф (коэффициент), для бензола считается быть одним, поскольку это не электролит.
m = моляльность
K = константа для бензола (точка кипения) составляет около 2.53.
Теперь,

= 1.84/1× 2.53
m = 0.728 моль (неизвестно)/кг бензола
Мы взяли смесь 1.55%.
Таким образом, на 1.55 г раствора приходится 1.55% массы, что означает 100 г неизвестного вещества.
Следовательно, неизвестная молярная масса будет отношением:
Молярная масса = рассчитанная из бензольного метода/ 0.728 моль
Вам понадобится:
- молярная масса
- масса молекулы
- уравнение Менделеева-Клапейрона
- таблица Менделеева
#1
Если в сосуде находится смесь газов, то рассчитать объем этой смеси и давление не составит труда. Объем газа равен объему сосуда, так как газы имеют свойство заполнять всю предоставленную им емкость. Давление измеряют манометром. А вот как найти массу смеси газов? Задача легко решается, если известно процентное содержание газов в данной смеси. Например, пусть в сосуде находится 20% углекислого газа и 80% кислорода. Большинство заданий требует нахождение молярной массы вещества. Поэтому, для расчета молярной массы смеси понадобятся еще и относительные молекулярные массы присутствующих газов, найденные по таблице Менделеева. Для углекислого газа это число составляет 44, а для кислорода 32.
#2
Молярная масса смеси находится следующим образом, 44*0,2+32*0,8. Рассчитав таким образом молярную массу, можно решить задачу, как определить массу молекулы. Для ее нахождения нужно молярную массу газа разделить на постоянную Авогадро, численное значение которой Nа=6.3 моль-1. Чтобы рассчитать массу газа проделываем следующее математическое действие: массу одной молекулы умножаем на число молекул. Правда, надо еще уметь найти количество молекул каждого газа в сосуде. Можно поступить по-другому. Для того, как рассчитать массу газа, надо вспомнить уравнение Менделеева-Клапейрона PV = mRT/M.
#3
Преобразуя уравнение, можно получить расчетную формулу для нахождения массы газа m= PVM / RT, где М- молярная масса газа; R- универсальная газовая постоянная R=8,1 Дж/моль. К; Р – давление газа; Т – абсолютная температура; V – объем газа. В химии существует некоторая аналогия между смесью газов и раствором веществ. Ведь раствор – это такая же смесь, например воды и соли. Задаваясь вопросом, как найти массу раствора, приходим к следующему выводу. Нужно складывать массу воды и массу растворенной в ней соли. Точно так же, чтобы найти массу газовой смеси, нужно суммировать массы входящих в нее газов.
#4
На молекулярном уровне действует тот же принцип. Как найти относительную молекулярную массу какого-либо вещества? Необходимо складывать массы всех атомов, из которых строится молекула этого вещества. Относительные атомные массы всех химических элементов приведены в той же знаменитой таблице Менделеева. Их табличные значения надо округлять. Например, относительная атомная масса кислорода 16. Таким образом, для газов, жидкостей, и даже молекул нахождение общей массы сводится к суммированию масс компонентов, составляющих смесь или раствор. Этот принцип сложения получил название аддитивности масс.
Как определить молярную массу смеси газов?
Определите
молярную массу M смеси газов, образовавшуюся в результате смешения газа массой m1 и молярной массой M1 и газа массой m2 и молярной массой M2 .
Решение.
Давление
смеси по закону Дальтона равно сумме парциальных давлений.
Для
нахождения парциальных давления компонентов и давления смеси воспользуемся
уравнением Клапейрона-Менделеева. Учитывая, что после смешения газы находятся
при одинаковой температуре и занимают одинаковый объем имеем следующее.
Где
m = m1 + m2 – масса смеси.
Подставляя значения p1 , p2 и p в исходное уравнение, получаем.
